Method Article
Eine flexible Kammer für die Zeitraffer-Bildgebung lebender Zellen mit stimulierter Raman-Streumikroskopie
In diesem Artikel
Zusammenfassung
Wir berichten über eine flexible Klimakammer mit Tischaufsatz für die Zeitraffer-Bildgebung lebender Zellen mittels aufrecht stimulierter Raman-Streumikroskopie mit Transitsignaldetektion. Lipidtröpfchen wurden in SKOV3-Zellen, die mit Ölsäure behandelt wurden, für bis zu 24 h in einem Zeitintervall von 3 Minuten abgebildet.
Zusammenfassung
Die stimulierte Raman-Streumikroskopie (SRS) ist eine markierungsfreie chemische Bildgebungstechnologie. Die Lebendzellbildgebung mit SRS wurde für viele biologische und biomedizinische Anwendungen demonstriert. Die Langzeit-Zeitraffer-SRS-Bildgebung von lebenden Zellen ist jedoch noch nicht weit verbreitet. Die SRS-Mikroskopie verwendet häufig ein Wasserimmersionsobjektiv mit hoher numerischer Apertur (NA) und einen Ölimmersionskondensator mit hoher NA, um eine hochauflösende Bildgebung zu erzielen. In diesem Fall beträgt der Abstand zwischen Objektiv und Kondensor nur wenige Millimeter. Daher können die meisten kommerziellen Stage-Top-Klimakammern aufgrund ihrer großen Dicke mit einer starren Glasabdeckung nicht für die SRS-Bildgebung verwendet werden. Dieser Artikel beschreibt das Design und die Herstellung einer flexiblen Kammer, die für die Zeitraffer-Bildgebung lebender Zellen mit transmittierter SRS-Signaldetektion auf einem aufrechten Mikroskoprahmen verwendet werden kann. Die Flexibilität der Kammer wird durch die Verwendung eines weichen Materials - einer dünnen Naturkautschukfolie - erreicht. Das neue Gehäuse- und Kammerdesign kann problemlos in ein bestehendes SRS-Bildgebungssystem integriert werden. Die Tests und vorläufigen Ergebnisse zeigen, dass das flexible Kammersystem eine stabile, langfristige Zeitraffer-SRS-Bildgebung von lebenden Zellen ermöglicht, die in Zukunft für verschiedene Bioimaging-Anwendungen verwendet werden kann.
Einleitung
Die optische Mikroskopie dient der Beobachtung der Mikrostrukturen von Proben. Die optische Bildgebung ist schnell, weniger invasiv und weniger zerstörerisch als andere Technologien1. Die Bildgebung lebender Zellen mit optischer Mikroskopie wurde entwickelt, um die Dynamik kultivierter lebender Zellen über einen langen Zeitraum zu erfassen2. Verschiedene Arten von optischen Kontrasten liefern unterschiedliche Informationen über biologische Proben. Zum Beispiel zeigt die optische Phasenmikroskopie den feinen Unterschied in den Brechungsindizes in der Probe3. Die Fluoreszenzmikroskopie wird häufig verwendet, um bestimmte Biomoleküle oder Zellorganellen abzubilden. Die breitbandigen Anregungs- und Emissionsspektren der Fluoreszenz führen jedoch in der Regel zu spektralen Überlappungen, wenn eine Mehrfarbenbildgebung durchgeführt wird4. Fluoreszierende Moleküle sind lichtempfindlich und können nach längerer, periodischer Lichtexposition gebleicht werden. Darüber hinaus kann die Fluoreszenzmarkierung die Bioverteilung der Moleküle in Zellen verändern5. Die SRS-Mikroskopie ist eine markierungsfreie chemische Bildgebungstechnologie6. Der Kontrast von SRS beruht auf dem Schwingungsübergang spezifischer chemischer Bindungen. Die Schwingungsfrequenz einer chemischen Bindung weist oft eine schmale spektrale Bandbreite auf, so dass es möglich ist, mehrere Raman-Banden in denselben Proben abzubilden7. Die SRS-Mikroskopie ist ein einzigartiges Werkzeug für die Bildgebung lebender Zellen, das mehrere chemische Kontraste auf markierungsfreie Weise liefert8.
Während die SRS-Bildgebung von ungefärbten Zellen für viele Studien verwendet wurde, ist die Langzeit-Zeitraffer-SRS-Bildgebung von lebenden Zellen noch nicht weit verbreitet. Ein Grund dafür ist, dass kommerzielle offene Kammern aufgrund ihrer großen Dicke nicht direkt für die SRS-Bildgebung verwendet werden können 9,10,11,12. Diese Kammern mit Glasdeckel sind meist für die Hellfeld- oder Fluoreszenzbildgebung mit einem einzigen Objektiv mit hoher NA und einem Rückwärtsdetektionsschema ausgelegt. Die SRS-Bildgebung bevorzugt jedoch die transmittierte Detektion sowohl mit einem Objektiv mit hoher NA als auch mit einem Kondensator mit hoher NA, wodurch nur ein sehr kurzer Abstand (typischerweise einige Millimeter) zwischen dem Objektiv und dem Kondensator verbleibt. Um dieses Problem zu lösen, haben wir eine flexible Kammer aus weichem Material entwickelt, die eine Zeitraffer-SRS-Bildgebung von lebenden Zellen mit einem aufrechten Mikroskoprahmen ermöglicht. Bei dieser Konstruktion wurde das Wassertauchobjektiv in der weichen Kammer eingeschlossen und kann sich zu Fokussier- und Abbildungszwecken frei dreidimensional bewegen.
Die optimale Temperatur für die Kultivierung der meisten Säugetierzellen liegt bei 37 °C, während die Raumtemperatur immer 10° niedriger ist. Eine Temperatur von mehr oder weniger als 37 °C hat einen dramatischen Einfluss auf die Zellwachstumsrate13. Daher ist eine Temperaturkontrolle der Zellkulturumgebung in einem Lebendzell-Bildgebungssystem erforderlich. Es ist bekannt, dass Temperaturinstabilität während der Langzeitbildgebung zu Defokussierungsproblemen führt14. Um eine stabile Umgebung bei 37 °C zu erreichen, haben wir eine große Gehäusekammer gebaut, die den gesamten Mikroskoprahmen abdeckt, einschließlich einer Wärmedämmschicht unter dem Mikroskop (Abbildung 1). Innerhalb der großen Temperaturregelkammer trägt die kleine flexible Kammer dazu bei, die physiologische Luftfeuchtigkeit und den pH-Wert durch den regulierten Luftstrom, der mit 5 % CO 2 ergänzt wird, genau aufrechtzuerhalten (Abbildung 2). Die Temperatur und Luftfeuchtigkeit der Kammern wurden gemessen, um zu bestätigen, dass das Doppelkammerdesign die optimalen Zellkulturbedingungen für das Zellwachstum unter langfristiger, periodischer SRS-Bildgebung bot (Abbildung 3). Anschließend demonstrierten wir die Anwendung des Systems zur Zeitraffer-Bildgebung und Verfolgung von Lipidtröpfchen (LDs) in SKOV3-Krebszellen (Abbildung 4, Abbildung 5 und Abbildung 6).
Protokoll
1. Bauen Sie die Umgebungseinhausung des Mikroskops
Anmerkungen: Dieses große Mikroskopgehäuse wird verwendet, um die Temperatur des Mikroskopgehäuses und der zu stabilisierenden Bildgebungsumgebung bei 37 °C zu steuern (Abbildung 1A).
- Markieren Sie die Positionen der Füße des SRS-Mikroskoprahmens und des motorisierten Tisches mit einem Markierungsstift auf dem optischen Tisch. Montieren Sie zwei Irisblenden vor dem Galvanometer-Scanner des Mikroskops und stellen Sie sie so ein, dass die Pump- und Stokes-Laserstrahlen durch die Mitte der Irisblenden geleitet werden.
- Entfernen Sie das Mikroskopgestell und den Tisch vom optischen Tisch.
- Legen Sie die Silikonkautschukplatte (Größe: 31 x 29 Zoll, Dicke: 1/8 Zoll) auf den optischen Tisch (Abbildung 1B).
- Schneiden Sie den Silikonkautschuk mit einem Messer entlang der Markierungen ab, entfernen Sie kleine Gummistücke und legen Sie die quadratischen MICA-Keramikplatten (Größe: 6 x 6 Zoll, Dicke: 1/4 Zoll) an die gleichen Stellen.
HINWEIS: MICA-Keramik ist ein leicht zu bearbeitendes Material15. Es ist so hart wie Aluminium, aber ein ausgezeichneter Wärmeisolator. MICA-Keramikplatten wurden verwendet, um die Wärmeübertragung vom Mikroskoprahmen und -tisch aus Metall auf den optischen Tisch aus Edelstahl zu verhindern. Es sollten einige Durchgangslöcher in die MICA-Platten gebohrt werden, um die Verwendung von 1/4-20 Schrauben für die Befestigung der Füße des Rahmens und der Bühne zu ermöglichen. - Bewegen Sie das Mikroskopgestell und den Tisch zurück zum optischen Tisch und richten Sie die Füße vorsichtig entlang der Markierungslinien auf den MICA-Keramikplatten aus. Verwenden Sie 1/4-20 Schrauben, um den Rahmen und die Bühne auf dem Tisch zu befestigen.
- Richten Sie den optischen SRS-Pfad neu aus. Stellen Sie die Spiegelhalterungen von Spiegel 1 und Spiegel 2 so ein, dass der Laserstrahl durch die Mitte der beiden vormontierten Irisblenden geht (Abbildung 2).
HINWEIS: Die technischen Details des im Labor gebauten SRS-Mikroskops, das für die aktuellen Lebendzell-Bildgebungsarbeiten verwendet wird, wurden zuvorbeschrieben 16. Die Pulsbreite der Pumpe und der Stokes-Strahlen beträgt ~3-4 ps mit Glasstabdispersion. Gesteuert wird das System mit der Software ScanImage17 . - Montieren Sie auf diesem Wärmedämmfundament das Umgebungsgehäuse so, dass es den gesamten Mikroskoprahmen mit fünf großen Polycarbonatplatten (Größe: 31 x 29 x 28 Zoll, Dicke: 0,25 Zoll) abdeckt.
HINWEIS: Die Größe des Gehäusekastens wird anhand der Abmessungen des Mikroskoprahmens und des Tisches bestimmt. Die Frontplatte des Mikroskopgehäuses muss vorübergehend entfernt werden, um die flexible Kammer zu installieren und die Zellkulturschale zu beladen.- Um das Gehäuse zusammenzubauen, führen Sie einfache Bearbeitungsarbeiten durch, einschließlich Schneiden, Bohren und Gewindebohren von Schraubenlöchern an jeder Kante der Polycarbonatplatten. Schneiden Sie zwei große Löcher mit einem Durchmesser von 2,6 Zoll auf die rechten und linken Bleche des Gehäuses, um den Einlass- bzw. Auslassschlauch anzupassen. Schneiden Sie ein kleines Loch mit einem Durchmesser von 5 mm in die Rückseite, damit die Laserstrahlen in das Gehäuse eindringen können.
- Versiegeln Sie die Kanten und Schnittstellen der Box mit Alufolienklebeband.
- Schließen Sie den flexiblen Kanalschlauch an die Einlass- und Auslassöffnungen des Gehäusekastens an, damit der zirkulierte Warmluftstrom vom Heizmodul gepumpt und gesteuert wird. Platzieren Sie den Thermosensor des Heizmoduls in der flexiblen Kammer, in der die Zellen kultiviert und abgebildet werden. Stellen Sie die Zieltemperatur auf 37 °C ein.
Anmerkungen: Ein Diffusor kann verwendet werden, um eine gleichmäßigere Luftstromverteilung im Umgebungsgehäuse zu erzielen.
2. Montieren Sie die flexible Kammer
- Montieren Sie das bearbeitete hohlzylindrische Aluminiumstück 1 (Material: Aluminium 6061) mit drei Stellschrauben am Objektivrevolver des Objektivs (Abbildung 2).
- Montieren Sie das bearbeitete hohlzylindrische Aluminiumstück 2 mit vier 1/4-20-Schrauben am Probenhalter (Abbildung 2).
Anmerkungen: Der Probenhalter muss so modifiziert werden, dass er die 50-mm-Deckelzellkulturschale mit Glasboden aufnehmen kann. Bohren Sie mit einer 1-7/8-Zoll-Lochsäge ein Durchgangsloch in die Mitte des Probenhalters. Bohren Sie das Loch mit einer 50-mm-Lochsäge ab und halten Sie die Tiefe der Durchgangsbohrung bei ~1 mm. - Montieren Sie den Probenhalter mit dem Aluminiumstück 2 auf dem Motortisch und befestigen Sie ihn mit Schrauben.
- Legen Sie die Naturkautschuk-Folienhülle (Dicke: 0,01 Zoll; mit Cyanacrylat-Kleber verklebt) zwischen die beiden bearbeiteten Aluminiumteile und montieren Sie sie mit Gummibändern an jedem Ende.
- Verbinden Sie die komprimierte CO2 -Flasche mit den richtigen Schläuchen und Anschlüssen mit dem Gasmischermodul. Stellen Sie den CO2 -Eingangsdruck auf 20-25 psi ein. Verwenden Sie einen eingebauten CO 2 -Sensor und einen Regler, um sicherzustellen, dass das Luftmischermodul 5 % CO2 regulieren und in den Luftstrom mischen kann. Verwenden Sie Inline-Filter, um den Luftstrom zu reinigen.
- Leiten Sie die Mischluft (mit 5 % CO2) mit geeigneten Schläuchen und Anschlüssen zu der vorsterilisierten Wasserflasche, die sich auf der Heizplatte befindet, und leiten Sie dann die befeuchtete Luft in die flexible Kammer. Stellen Sie die Kochplatte auf 37 °C ein. Blasen Sie den Luftstrom im warmen Wasser, um die Luftfeuchtigkeit des Luftstroms zu erhöhen.
3. Vorbereitung für Zeitraffer-Live-Cell-SRS-Bildgebungsexperimente
- Wischen Sie alle Teile der flexiblen Kammer mit 70%igem Ethanol ab, einschließlich des Objektivrevolvers, des Wassertauchobjektivs und des Probenhalters.
- Dekontaminieren Sie das gesamte Gehäusesystem mit einer UV-Lampe, die 20 bis 30 Minuten lang im Gehäuse platziert wird.
Anmerkungen: Halten Sie sich aus Sicherheitsgründen während des UV-Desinfektionsprozesses nicht im Laborraum auf. - Kultivieren Sie SKOV3-Zellen in einer 50-mm-Petrischale mit Glasboden für 12 h unter normalen physiologischen Bedingungen in einem normalen Inkubator.
HINWEIS: Starten Sie die SKOV3-Zellkultur18 in einer Standard-Biosicherheitswerkbank. - Trennen Sie das bearbeitete Aluminiumteil 2 vom Probenhalter, indem Sie die Schrauben entfernen.
Anmerkungen: Auf diese Weise wird die flexible Kammer geöffnet, um die Zellkulturschale zu beladen. - Legen Sie die Zellkulturschale ein. Denken Sie daran, Immersionsöl auf die Oberseite des Kondensators zu geben, bevor Sie die Zellkulturschale aufstellen. Entfernen Sie den Deckel der Schüssel und fixieren Sie die Schüssel mit den Klammern.
Anmerkungen: Um eine Kontamination zu vermeiden, sollten alle Vorgänge mit Handschuhen durchgeführt werden. - Senken Sie das Objektiv in das Zellkulturmedium, um eine grobe Fokussierung zu erzielen. Senken Sie das Aluminiumstück 2 ab, um die flexible Kammer zu umschließen, und befestigen Sie es mit Schrauben am Probenhalter.
Anmerkungen: Eine 2 mm dicke Silikongummi-Polsterauflage ist an der Unterseite des Aluminiumstücks 2 angebracht, um den Spalt dicht abzudichten. - Stellen Sie die Luftzufuhr auf 5 % CO2 und 19 %O2 für normale Zellkulturen mit einem Luftdurchsatz von 200 cc/min ein.
Anmerkungen: Es kann ein geringerer Luftdurchsatz verwendet werden. Es kommt darauf an, wie gut die flexible Kammer abgedichtet ist.
4. Führen Sie Zeitraffer-SRS-Bildgebungsexperimente mit lebenden Zellen durch
- Stimmen Sie die Laserwellenlänge auf 805 nm ab, um die Raman-Verschiebung von 2854 cm-1 zu erreichen, die auf die Schwingung chemischerCH2-Bindungen zurückzuführen ist. Verwenden Sie eine niedrige Laserleistung, um Lichtschäden an den Zellen zu reduzieren. Um diesem Protokoll zu folgen, verwenden Sie ~15 mW durchschnittliche Leistung des Pumplasers und ~7,5 mW des Stokes-Lasers (fixiert auf 1.045 nm) für die Langzeitbildgebung lebender Zellen.
HINWEIS: Eine höhere Laserleistung führt zu einer besseren SRS-Bildqualität. Eine zu hohe Laserleistung führt jedoch zu einer Lichtschädigung lebender Zellen. Es gibt einen Kompromiss zwischen Bildqualität und Lichtschäden. - Passen Sie das Objektiv an und fokussieren Sie es, um eine gute SRS-Bildgebung der Zellen zu erzielen, indem Sie die FOCUS-Taste auf dem Bedienfeld MAIN CONTROLS der Software verwenden. Um eine schnelle Fokussierung durchzuführen, stellen Sie die Pixelzahl auf 512 × 512 Pixel mit einer Pixelverweildauer von 4,8 μs im Bedienfeld KONFIGURATION ein.
- Stellen Sie den Eingangsbereich des Lock-in-Verstärkers (typischerweise 5 mV) auf das Doppelte der maximalen Signalspannung ein. Stellen Sie den Tiefpassfilter so ein, dass er mit der Pixelverweildauer (4,8 μs) übereinstimmt.
HINWEIS: Verschiedene im Labor gebaute SRS-Systeme können unterschiedliche Datenerfassungseinstellungen verwenden. - Nachdem Sie eine gute Fokussierung erreicht haben, stellen Sie die Bildauflösung auf 2.048 × 2.048 Pixel für ein Sichtfeld von 175μm2 für die Aufnahme hochwertiger Bilder ein. Aktivieren Sie die SAVE-Funktion im Bedienfeld " HAUPTEINSTELLUNGEN " und überprüfen Sie den SRS-Kanal im Bedienfeld "KANÄLE ". Stellen Sie die Intervallzeit zwischen zwei Bildern auf 180 s (3 min) auf dem MAIN CONTROLS-Kanal ein. Stellen Sie die Erfassungszahl auf 480 ein, um Zeitrafferaufnahmen über 24 Stunden zu machen.
HINWEIS: Je nach Zweck der Experimente kann eine niedrigere Bildauflösung verwendet werden. - Starten Sie die automatische Bildaufnahme mit der LOOP-Funktion auf dem Bedienfeld MAIN CONTROLS .
HINWEIS: Prüfen Sie, ob in der ersten Stunde der Bildgebung eine Fokusdrift aufgrund von Temperaturinstabilität vorliegt. Die Bildgebung in der ersten Stunde ist möglicherweise nicht stabil. Überprüfen Sie die Fokussierung alle 2-3 Stunden während der Zeitrafferaufnahme. - Bearbeiten Sie die gesammelten Bilder mit ImageJ19. Verwenden Sie die folgenden zwei Methoden für die LD-Quantifizierung: (i) das LD/Zellkörperflächen-Verhältnis und (ii) die mittlere SRS-Intensität der gesamten LDs. Messen Sie die Zellkörperfläche, indem Sie die nicht-zellulären Pixel in den SRS-Bildern bei 2.854 cm-1 auf Null setzen. Messen Sie den LD-Bereich und die Intensität, indem Sie die Nicht-LD-Pixel in den SRS-Bildern mit einem Schwellenwert versehen und auf Null setzen.
HINWEIS: Weitere Details zur SRS-Bildverarbeitung wurden bereits16 gemeldet.
Ergebnisse
Wir haben das flexible Kammersystem für die Zeitraffer-SRS-Bildgebung hergestellt und montiert (Abbildung 1 und Abbildung 2) und dann die Leistung des Systems bewertet. Die Temperatur im Inneren des Mikroskopgehäuses erreichte innerhalb von 1 h die erwarteten 37 °C, was die Raumtemperatur nicht wesentlich beeinflusste (Abbildung 3A). Die Temperatur in der flexiblen Kammer erreichte in 1,5 h 37 °C und wurde mindestens 24 h lang stabil bei 37 °C gehalten (Abbildung 3B). Die relative Luftfeuchtigkeit in der flexiblen Kammer konnte in 1 h 85 % erreichen und dann mindestens 24 h lang aufrechterhalten werden (Abbildung 3C). Die gemessenen Temperatur- und Feuchtedaten bestätigen, dass dieses System eine optimale Umgebung für ein langfristiges Zellwachstum bieten kann.
Die Lebendzellbildgebung mit SRS wurde in vielen biologischen und biomedizinischen Studien eingesetzt 20,21,22,23,24. Insbesondere die SRS-Bildgebung von markierungsfreien LDs in lebenden Zellen zum Verständnis des Lipidstoffwechsels bei Krebs hat viel Aufmerksamkeit erregt16,25,26. Mit dem entworfenen flexiblen Kammersystem führten wir zunächst eine Zeitraffer-SRS-Bildgebung von lebenden SKOV3-Zellen für 24 h mit einem Zeitintervall von 3 min durch (Abbildung 4). Die Videodaten zeigten die schnelle und aktive Bewegung intrazellulärer LDs mit einer zeitlichen Auflösung von 3 min. Am Ende der 24-stündigen Bildgebungssitzung zeigten die Zellen immer noch eine normale Morphologie und Dichte, was darauf hindeutet, dass die Zellen gesund waren. Anschließend bildeten wir SKOV3-Zellen ab, die mit Ölsäure (OA) behandelt wurden, und verfolgten den dynamischen Prozess der LD-Akkumulation innerhalb von 10 h (Abbildung 5A).
Die LD-Mengen wurden in den OA-behandelten SKOV3-Zellen auf zwei Arten (LD-zu-Zellkörper-Flächen-Verhältnis und Gesamt-SRS-Intensität der LDs) mit Hilfe von BildJ19 quantifiziert. Die Ergebnisse deuten darauf hin, dass die Anzahl der LDs (in Größe und Anzahl) über 10 h kontinuierlich zunahm (Abbildung 5B). Wir demonstrierten auch die simultane Vorwärts-SRS-Bildgebung von LDs (Pseudofarbe Grün) und die Rückwärts-Zwei-Photonen-Fluoreszenz-Bildgebung (TPF) von Lysosomen (Pseudofarbe Rot), die mit einem Fluoreszenzfarbstoff DND-189 markiert waren (Abbildung 6). Es wird darauf hingewiesen, dass die dual-modale SRS/TPF-Bildgebung verwendet werden kann, um die Kolokalisation zweier zellulärer Kompartimente zu analysieren. In diesem Experiment wurde ein sehr geringer Grad an Kolokalisation von LDs und Lysosomen beobachtet, was durch die kleinen gelben Bereiche angezeigt wurde. Zusammengenommen zeigen diese Ergebnisse, dass das flexible Kammersystem eine stabile, langfristige Zeitraffer-SRS-Bildgebung von lebenden Zellen ermöglicht, die in Zukunft für verschiedene Bildgebungsanwendungen verwendet werden kann.

Abbildung 1: Das flexible Kammersystem für die Zeitraffer-SRS-Bildgebung lebender Zellen. (A) Schematische Darstellung des flexiblen Kammersystems für die Zeitraffer-SRS-Bildgebung lebender Zellen. (B) Das Bild auf der linken Seite zeigt die Wärmedämmschicht mit einer Silikonkautschukplatte und MICA-Keramikpads unter dem Mikroskoprahmen und dem Tisch. Das Bild rechts zeigt das Gehäuse des Umweltmikroskops und die flexible Kammer. Abkürzungen: SRS = stimulierte Raman-Streuung; CCM = Kubikzentimeter pro Minute. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Schematische Darstellung und Bilder der flexiblen Kammer mit dem optischen Pfad des SRS, der eine dreidimensionale freie Bewegung des Wassertauchobjektivs zum Fokussieren und Abbilden ermöglicht. Die linken Bilder zeigen die beiden bearbeiteten Aluminiummodule, die mit einem handelsüblichen Objektivrevolver und einem modifizierten Probenhalter verbunden sind. Die unteren Bilder zeigen das flexible Kammersystem der Montage. Abkürzung: SRS = stimulierte Raman-Streuung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
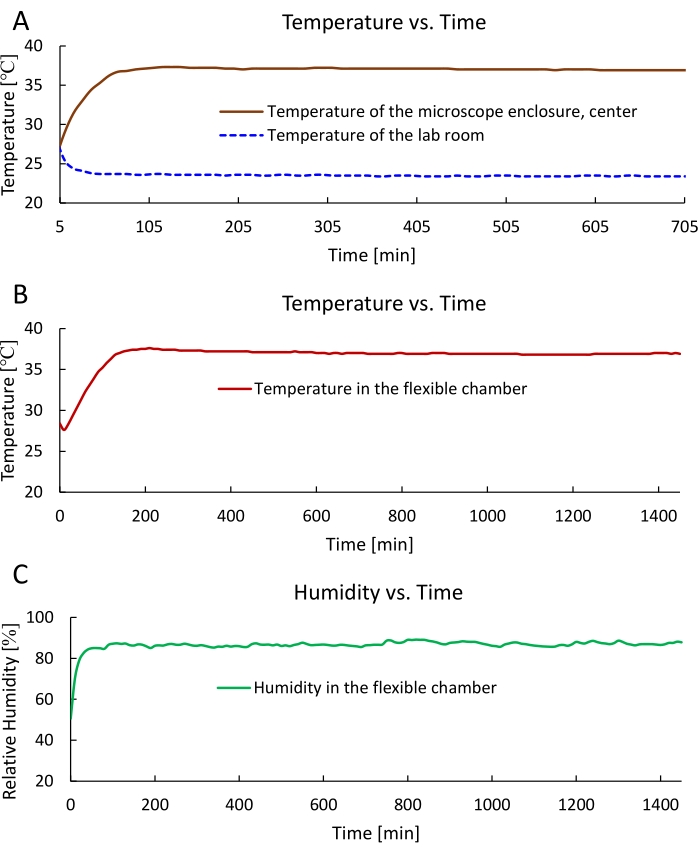
Abbildung 3: Temperatur- und Feuchtedaten des Mikroskopgehäuses und der flexiblen Kammer. (A) Die gemessenen Temperaturdaten des Mikroskopgehäuses und die Laborraumtemperatur bis zu 12 h. (B) Die gemessenen Temperaturdaten (Mittelwert bei 37 °C) innerhalb der flexiblen Kammer, bis zu 24 h. (C) Die gemessenen Daten der relativen Feuchte (Mittelwert bei 85 %) innerhalb der flexiblen Kammer, bis zu 24 h. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Repräsentative 24 Bilder von Zeitraffer-SRS-Aufnahmen. Zeitraffer-SRS-Bildgebung (bei 2.854 cm-1) von lebenden SKOV3-Zellen unter Verwendung der flexiblen Kammer, bis zu 24 h. In diesem Experiment wurden 480 Bilder mit einem festen Zeitintervall von 3 min aufgenommen. Die Zellen wurden unter normalen Bedingungen kultiviert. Maßstabsbalken = 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
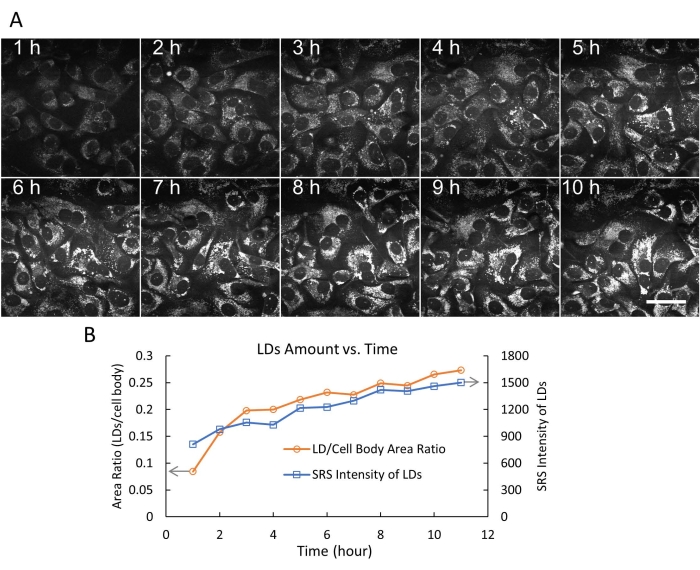
Abbildung 5: Zeitraffer-SRS-Bildgebung und Lipidtröpfchenquantifizierung. (A) Repräsentative 10 Bilder der Zeitraffer-SRS-Bildgebung (bei 2.854 cm-1) von lebenden SKOV3-Zellen, die mit 500 μM OA behandelt wurden, bis zu 10 h, unter Verwendung der flexiblen Kammer. In diesem Experiment wurden 200 Bilder mit einem festen Zeitintervall von 3 min aufgenommen. Maßstabsbalken = 50 μm. (B) Die Menge der LDs über der Zeit (0-10 h) wurde auf zwei Arten quantifiziert (LD/Zellkörperflächenverhältnis und Gesamt-SRS-Intensität der LDs), wobei die Schwellenwertfunktion und die Partikelanalysefunktionen in ImageJ verwendet wurden. Abkürzungen: SRS = stimulierte Raman-Spektroskopie; OA = Ölsäure; LDs = Lipidtröpfchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 6: Zeitraffer, simultane SRS- und Zwei-Photonen-Fluoreszenzbildgebung für LDs und Lysosomen. Zeitraffer, simultane SRS (bei 2.854 cm-1) und Zwei-Photonen-Fluoreszenzbildgebung für LDs (Pseudofarbe grün) und Lysosomen (rot), bis zu 2 h. Die Zellen wurden vor der Bildgebung 1 h lang mit einem Fluoreszenzfarbstoff (LysoSensor DND-189, 1 μM) behandelt. Die Bilder wurden alle 3 Minuten aufgenommen. Maßstabsbalken = 50 μm. Es wurde ein geringer Grad an Kolokalisation von LDs und Lysosomen beobachtet, was durch die gelbe Farbe angezeigt wird. Abkürzungen: SRS = stimulierte Raman-Spektroskopie; LDs = Lipidtröpfchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Diskussion
Die Zeitraffer-Lebendzell-SRS-Mikroskopie ist ein alternatives bildgebendes Verfahren zur markierungsfreien Molekülverfolgung. Im Vergleich zur Fluoreszenzmarkierung ist die SRS-Bildgebung frei von Photobleichung, was eine Langzeitüberwachung von Molekülen ermöglicht. Bisher ist das Lebendzell-Bildgebungssystem auf einer aufrechten SRS-Mikroskopie jedoch nicht kommerziell erhältlich. In dieser Arbeit wurde ein Lebendzell-Bildgebungssystem mit einer stabilen, thermisch isolierten Mikroskopgehäusebox und einer flexiblen inneren weichen Kammer entwickelt, um transmittierte SRS-Zeitrafferaufnahmen zu ermöglichen. In diesem Aufbau hält der große Gehäusekasten die Temperaturstabilität bei 37 °C, während die interne weiche Kammer befeuchtete Luft liefert, um eine optimale Zellkulturumgebung zu schaffen. Die flexible offene Kammer, die in dieser Arbeit demonstriert wurde, ermöglicht einen einfachen Arbeitsablauf für die Langzeit-SRS-Bildgebung von lebenden Zellen. Zellen, die in einer Glasbodenschale ausgesät wurden, können zunächst in einem normalen Inkubator vorbereitet und kultiviert werden, bevor sie zur Bildgebung in die flexible Kammer auf dem Tisch übertragen werden. Eine alternative Lösung zur Durchführung der Lebendzell-SRS-Bildgebung ist die Verwendung einer geschlossenen Durchflusszelle, einschließlich der mikrofluidischen und durchflusszytometrischen Plattformen27,28,29,30. Es ist möglich, eine Durchflusszelle mit geringerer Dicke zu konstruieren. Die Kultivierung von Zellen in einer Perfusionskammer kann jedoch eine technische Herausforderung darstellen31.
Fokale Drift ist ein häufiges Problem bei der Bildgebung lebender Zellen32. Da es sich um einen Multiphotonenprozess handelt, erfordert die Erzeugung von SRS-Signalen eine enge Fokussierung der Laserstrahlen, weshalb die SRS-Mikroskopie sehr empfindlich auf fokale Drift reagiert. Temperaturinstabilität ist ein wesentlicher Faktor bei der Induktion von Fokusdrift. Um die thermische Stabilität zu verbessern, wurde das gesamte Mikroskop mit wärmeisolierenden Materialien umschlossen. In einigen Bildgebungssitzungen kam es jedoch nach 2-3 Stunden Bildgebung immer noch zu einer fokalen Drift. Die mikroskopische SRS-Bildgebung ist auch empfindlich gegenüber Vibrationen, die die Fokussierung zerstören können. Ein vibrationsdämpfender optischer Tisch hilft, Vibrationen zu reduzieren, um eine stabile Bildgebung zu erreichen. Um das Problem der fokalen Drift zu lösen, könnten in zukünftigen Experimenten Autofokus-Technologien eingesetzt werden33.
Das Desinfektionsverfahren des Bildgebungssystems ist entscheidend, um eine Kontamination der Zellen zu vermeiden, insbesondere für das Wasserimmersionsobjektiv, das direkt mit den Zellkulturmedien in Kontakt kommt. Es sollte sicher sein, 70 % Ethanol für die Reinigung der Linsenoberseite zu verwenden. Da UV-Licht nur die Oberfläche der Objekte effektiv desinfizieren kann, wurden in diesen Experimenten vier UV-Lampen an verschiedenen Stellen im Gehäusekasten montiert, um die Desinfektion durchzuführen. Das UV-Licht kann jedoch die Kunststoffkomponenten im Bildgebungssystem zersetzen. In diesem Fall kann man Aluminiumfolie verwenden, um die Kunststoffteile einzuwickeln und abzudecken. Für die Bildgebung lebender Zellen werden Antibiotika (in der Regel 100 Einheiten/ml Penicillin und 100 μg/ml Streptomycin in den Nährmedien) dringend empfohlen.
In diesen Experimenten haben wir die LDs in lebenden Krebszellen abgebildet und quantifiziert. Für diese Experimente war ein Zeitintervall von 3 Minuten angemessen. Es wird darauf hingewiesen, dass das Zeitintervall der Bildgebung je nach den Anforderungen des Forschungsprojekts geändert werden kann. Um z. B. eine einzelne LD in einer lebenden Zelle zu verfolgen, kann ein Zeitintervall von weniger als 1 Minute erforderlich sein. Im Gegensatz dazu reicht ein längeres Zeitintervall von wenigen Minuten aus, um langsame biologische Prozesse zu verfolgen34.
Die SRS-Bildgebung verwendet eine höhere Laserleistung zur Anregung als viele andere optische Bildgebungstechnologien, was für die langfristige Zeitraffer-SRS-Bildgebung lebender Zellen eine Herausforderung darstellen kann. Die SRS-Bildgebung der nativen Biomoleküle ist aufgrund des winzigen Raman-Querschnitts der chemischen Bindungen noch schwieriger35. In diesen Experimenten wurden ein 15 mW Pumplaser bei 805 nm und ein 7,5 mW Stokes-Laser bei 1.045 nm verwendet, und in 24 h mit einem Zeitintervall von 3 Minuten wurde keine signifikante Photoschädigung beobachtet. Durch die Verwendung empfindlicher Raman-Tags kann die Laserleistung weiter reduziertwerden 36.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir möchten dem Undergraduate Senior Design Team 2019 (Suk Chul Yoon, Ian Foxton, Louis Mazza und James Walsh) an der Binghamton University für das Design, die Herstellung und das Testen der Mikroskopgehäusebox danken. Wir danken Scott Hancock, Olga Petrova und Fabiola Moreno Olivas von der Binghamton University für die hilfreichen Gespräche. Diese Forschung wurde von den National Institutes of Health unter der Fördernummer R15GM140444 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| A lab-built SRS microscope | https://rdcu.be/cP6ve | ||
| HF2LI 50 MHz lock-in amplifer | Zurich Instruments | HF2LI | |
| Iris diaphragm | Thorlabs Inc | SM1D12 | |
| Kinematic mirror mount | Thorlabs Inc | KM100 | |
| Microscope frame | Nikon Inc | FN-1 | |
| Motorized microscopy stage | Prior Scientific | Z-Deck | |
| Oil-immersion condenser (C-AA Achromat/Aplanat, NA 1.4) | Nikon Inc | MBL71405 | |
| Water-immersion objective (CFI75 Apo 25XC W 1300) | Nikon Inc | MRD77225 | |
| Materials and parts for the microscope enclosure (31'' x 29'' x 28'' L x W x H) | |||
| Airtherm heater module | World Precision Instruments (WPI) | AIRTHERM-SAT-1W | |
| Airtherm heater controller, CO2 and humidity monitor | World Precision Instruments (WPI) | AIRTHERM-SMT-1W | |
| Air/CO2 mixer module | World Precision Instruments (WPI) | ECU-HOC-W | |
| Flexible duct hose (2-1/2'' ID, 2-3/4'' OD) | McMaster-Carr | 56675K71 | |
| High-temperature glass-mica ceramic, easy-to-machine (6'' x 6'', 1/4'' thickness) | McMaster-Carr | 8489K62 | |
| Polycarbonate sheets (thickness 0.25'') | McMaster-Carr | 8574K286 | |
| Silicone rubber sheets (36'' x 36'', thickness 1/8'') | McMaster-Carr | 5827T43 | |
| Materials and parts for the Flexible chamber | |||
| Hot plate | McMaster-Carr | 31745K11 | |
| High-purity inline filter, 1/4 NPT | McMaster-Carr | 6645T18 | |
| Hole saw (cutting diameter 1-7/8 inch) | McMaster-Carr | 4066A34 | |
| Hole saw (cutting diameter 50 mm) | McMaster-Carr | 4556A19 | |
| High-temperature silicone rubber tubing, soft, 2 mm ID, 5 mm OD | McMaster-Carr | 5054K313 | |
| Inline filter (1/4 NPT, 40 micron) | McMaster-Carr | 98385K843 | |
| Multipurpose 6061 Aluminum round tube (1/8'' wall thickness, 4'' OD) | McMaster-Carr | 9056K42 | |
| Multipurpose 6061 Aluminum round tube (3/4'' wall thickness, 3-3/4'' OD) | McMaster-Carr | 9056K47 | |
| Multipurpose 6061 Aluminum bar (12'' x 12'', thickness 1/4'') | McMaster-Carr | 8975K142 | |
| Multipurpose 6061 Aluminum bar (8'' x 8'', thickness 3/8'') | McMaster-Carr | 9246K21 | |
| Objective nosepiece (single) | Nikon Inc | FN-MN-H | |
| Sample holder (modified) | Prior Scientific | HZ202 | |
| Ultra-thin natural rubber film (thickness 0.01'') | McMaster-Carr | 8611K13 | |
| Vacuum-sealable glass jar | McMaster-Carr | 3231T44 | |
| Software | |||
| MATLAB | MathWorks | ||
| ImageJ (Fiji) | imagej.net | ||
| ScanImage | Vidrio Technologies, LLC | SRS imaging software | |
| Materials for live-cell imaging | |||
| Cover glass bottom sterile culture dishes (Dia.x H, 50 x 7 mm) | Electron Microscopy Sciences (EMS) | 70674-02 | |
| DMEM cell culture medium | ThermoFisher Scientific | 11965092 | |
| Fetal bovine serum (FBS) | ThermoFisher Scientific | 26140079 | |
| LysoSensor fluorescent dye DND-189 | ThermoFisher Scientific | L7535 (Invitrogen) | |
| Oleic acid | MilliporeSigma | 364525 | |
| SKOV3 cell line | ATCC | HTB-77 |
Referenzen
- Mertz, J. . Introduction to Optical Microscopy. , (2019).
- Ettinger, A., Wittmann, T. Fluorescence live cell imaging. Methods in Cell Biology. 123, 77-94 (2014).
- Park, Y., Depeursinge, C., Popescu, G. Quantitative phase imaging in biomedicine. Nature Photonics. 12 (10), 578-589 (2018).
- Hu, C. D., Kerppola, T. K. Simultaneous visualization of multiple protein interactions in living cells using multicolor fluorescence complementation analysis. Nature Biotechnology. 21 (5), 539-545 (2003).
- lamo, P., et al. Fluorescent dye labeling changes the biodistribution of tumor-targeted nanoparticles. Pharmaceutics. 12 (11), 1004 (2020).
- Cheng, J. X., Xie, X. S. Vibrational spectroscopic imaging of living systems: An emerging platform for biology and medicine. Science. 350 (6264), aaa870 (2015).
- Lu, F. K., et al. Label-free DNA imaging in vivo with stimulated Raman scattering microscopy. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 11624-11629 (2015).
- Hill, A. H., Fu, D. Cellular imaging using stimulated Raman scattering microscopy. Analytical Chemistry. 91 (15), 9333-9342 (2019).
- Buđa, R., Vukušić, K., Tolić, I. . Methods in Cell Biology. (139), 81-101 (2017).
- Chiarelli, T. J., Grieshaber, N. A., Grieshaber, S. S. Live-cell forward genetic approach to identify and isolate developmental mutants in Chlamydia trachomatis. Journal of Visualized Experiments. (160), e61365 (2020).
- Lemon, W. C., McDole, K. Live-cell imaging in the era of too many microscopes. Current Opinion in Cell Biology. 66, 34-42 (2020).
- Birk, S. E., et al. Management of oral biofilms by nisin delivery in adhesive microdevices. European Journal of Pharmaceutics and Biopharmaceutics. 167, 83-88 (2021).
- Watanabe, I., Okada, S. Effects of temperature on growth rate of cultured mammalian cells (L5178Y). Journal of Cell Biology. 32 (2), 309-323 (1967).
- Lac, A., Lam, A. L., Heit, B. . Fluorescent Microscopy. , 57-73 (2022).
- Grossman, D. G. Machinable glass-ceramics based on tetrasilicic mica. Journal of the American Ceramic Society. 55 (9), 446-449 (1972).
- Yuan, Y., Shah, N., Almohaisin, M. I., Saha, S., Lu, F. Assessing fatty acid-induced lipotoxicity and its therapeutic potential in glioblastoma using stimulated Raman microscopy. Scientific Reports. 11 (1), 1-14 (2021).
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomedical Engineering Online. 2 (1), 1-9 (2003).
- Sun, M. W., Yuan, Y. H., Lu, F. K., Di Pasqua, A. J. Physicochemical factors that influence the biocompatibility of cationic liposomes and their ability to deliver DNA to the nuclei of ovarian cancer SK-OV-3 cells. Materials. 14 (2), 416 (2021).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Ozeki, Y., Itoh, K. Stimulated Raman scattering microscopy for live-cell imaging with high contrast and high sensitivity. Laser Physics. 20 (5), 1114-1118 (2010).
- Zhang, X., et al. Label-free live-cell imaging of nucleic acids using stimulated Raman scattering microscopy. ChemPhysChem. 13 (4), 1054-1059 (2012).
- Stiebing, C., et al. Real-time Raman and SRS imaging of living human macrophages reveals cell-to-cell heterogeneity and dynamics of lipid uptake. Journal of Biophotonics. 10 (9), 1217-1226 (2017).
- Miao, K., Wei, L. Live-cell imaging and quantification of PolyQ aggregates by stimulated Raman scattering of selective deuterium labeling. ACS Central Science. 6 (4), 478-486 (2020).
- Brzozowski, K., et al. Stimulated Raman scattering microscopy in chemistry and life science -Development, innovation, perspectives. Biotechnology Advances. 60, 108003 (2022).
- Hislop, E. W., Tipping, W. J., Faulds, K., Graham, D. Label-free imaging of lipid droplets in prostate cells using stimulated Raman scattering microscopy and multivariate analysis. Analytical Chemistry. 94 (25), 8899-8908 (2022).
- Chen, T., Yavuz, A., Wang, M. C. Dissecting lipid droplet biology with coherent Raman scattering microscopy. Journal of Cell Science. 135 (5), jcs252353 (2022).
- Cao, C., Zhou, D., Chen, T., Streets, A. M., Huang, Y. Label-Free digital quantification of lipid droplets in single cells by stimulated Raman microscopy on a microfluidic platform. Analytical Chemistry. 88 (9), 4931-4939 (2016).
- Zhang, C., et al. Stimulated Raman scattering flow cytometry for label-free single-particle analysis. Optica. 4 (1), 103-109 (2017).
- Suzuki, Y., et al. Label-free chemical imaging flow cytometry by high-speed multicolor stimulated Raman scattering. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15842-15848 (2019).
- Gala de Pablo, J., Lindley, M., Hiramatsu, K., Goda, K. High-throughput Raman flow cytometry and beyond. Accounts of Chemical Research. 54 (9), 2132-2143 (2021).
- Cole, R. Live-cell imaging: the cell's perspective. Cell Adhesion & Migration. 8 (5), 452-459 (2014).
- Kreft, M., Stenovec, M., Zorec, R. Focus-drift correction in time-lapse confocal imaging. Annals of the New York Academy of Sciences. 1048 (1), 321-330 (2005).
- Firestone, L., Cook, K., Culp, K., Talsania, N., Preston Jr, K. Comparison of autofocus methods for automated microscopy. Cytometry: The Journal of the International Society for Analytical Cytology. 12 (3), 195-206 (1991).
- Van Helvert, S., Storm, C., Friedl, P. Mechanoreciprocity in cell migration. Nature Cell Biology. 20 (1), 8-20 (2018).
- Zong, C., et al. Plasmon-enhanced stimulated Raman scattering microscopy with single-molecule detection sensitivity. Nature Communications. 10 (1), 1-11 (2019).
- Wei, L., et al. Super-multiplex vibrational imaging. Nature. 544 (7651), 465-470 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten