Method Article
Spotvariations-Fluoreszenz-Korrelationsspektroskopie zur Analyse der molekularen Diffusion an der Plasmamembran lebender Zellen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel zielt darauf ab, ein Protokoll zum Aufbau eines Fluoreszenz-Korrelationsspektroskopie-Mikroskops (svFCS) zur Messung der molekularen Diffusion an der Plasmamembran lebender Zellen vorzustellen.
Zusammenfassung
Dynamische biologische Prozesse in lebenden Zellen, einschließlich derjenigen, die mit der Organisation der Plasmamembran verbunden sind, finden auf verschiedenen räumlichen und zeitlichen Skalen statt, die von Nanometern bis Mikrometern bzw. Mikrosekunden bis Minuten reichen. Ein so breites Spektrum biologischer Prozesse stellt herkömmliche mikroskopische Ansätze in Frage. Hier beschreiben wir das Verfahren zur Durchführung von Messungen der Fluoreszenzkorrelationsspektroskopie (svFCS) mit einem klassischen Fluoreszenzmikroskop, das angepasst wurde. Das Protokoll beinhaltet eine spezifische Leistungsüberprüfung des svFCS-Aufbaus und die Richtlinien für molekulare Diffusionsmessungen von svFCS an der Plasmamembran lebender Zellen unter physiologischen Bedingungen. Darüber hinaus bieten wir ein Verfahren zur Störung von Plasmamembran-Floß-Nanodomänen durch Cholesterinoxidase-Behandlung und zeigen, wie diese Veränderungen in der lateralen Organisation der Plasmamembran durch svFCS-Analyse aufgedeckt werden können. Zusammenfassend lässt sich sagen, dass diese fluoreszenzbasierte Methode beispiellose Details über die laterale Organisation der Plasmamembran mit der entsprechenden räumlichen und zeitlichen Auflösung liefern kann.
Einleitung
Die Komplexität der Plasmamembranorganisation
Das aktuelle Verständnis der Zellmembranorganisation muss mehrere Aspekte berücksichtigen1. Erstens variiert eine komplexe Lipidzusammensetzung nicht nur zwischen den Zelltypen, sondern auch innerhalb einer einzelnen Zelle (Membranorganellen/Plasmamembran). Außerdem sind assoziierte oder intrinsische Membranproteine meist in dynamischen multimeren Komplexen organisiert, wobei sich große Domänen außerhalb der Membran erstrecken und eine deutlich größere Fläche ausmachen als die der Transmembrandomänen allein. Darüber hinaus weisen membranassoziierte Proteine spezifische lipidbindende oder lipidwechselwirkende Fähigkeiten auf, die bei der Regulierung der Proteinfunktion eine Rolle spielen. Diese hängen direkt von der lokalen Zusammensetzung und Zugänglichkeit der Lipideab 2.
Schließlich wird ein signifikantes Maß an Asymmetrie zwischen zwei Membranblättchen aufgrund der intrinsischen asymmetrischen Struktur von Membranproteinen und der Verteilung von Lipiden beobachtet. Tatsächlich erzeugt ein lipidmetabolisches Gleichgewicht zwischen Synthese und Hydrolyse, kombiniert mit einem Lipid-Flip-Flop zwischen den Blättchen, eine solche asymmetrische Verteilung. Da jeder Transport über die Doppelschicht durch die freie Energie eingeschränkt wird, die benötigt wird, um die polare Kopfgruppe durch das hydrophobe Innere der Membranen zu bewegen, wird er normalerweise von selektiven Transportern unterstützt. Für jeden Zelltyp wird die Asymmetrie tendenziell fest aufrechterhalten. Insgesamt tragen diese Faktoren zur lateralen Inhomogenität oder Kompartimentierung der Plasmamembranbei 3,4.
Wir bereichern diese Darstellung der Plasmamembran unter Berücksichtigung der intrinsischen molekularen Diffusion innerhalb und über die Doppelschicht, die zur dynamischen lateralen Heterogenität auf einer Skala von Zehnteln bis Hunderten von Nanometern und Mikrosekunden bis Sekunden beiträgt. Zum Beispiel tragen lipidabhängige Membran-Nanodomänen – die sogenannten Lipid-Flöße, definiert als Cholesterin, und Sphingolipid-reiche Signalplattformen – zur Kompartimentierung der Plasmamembranbei 5,6. Die derzeitige Sicht der Membranorganisation ist jedoch nicht nur auf Lipidflöße beschränkt. Membran-Nanodomänen sind komplexer und heterogener in Zusammensetzung, Ursprung und Funktion. Dennoch muss ihre Anwesenheit an der Plasmamembran eng koordiniert werden, und dynamische Wechselwirkungen zwischen Proteinen und Lipiden scheinen für die räumliche Verteilung und chemische Modifikation von Membran-Nanodomänenwichtig zu sein 1,3,7,8.
Das svFCS-Prinzip und seine Anwendung zur Untersuchung der Organisation der Plasmamembran
Obwohl bei der Analyse von Membrandomänen, hauptsächlich durch biophysikalische Techniken, große Fortschritte erzielt wurden, müssen die Determinanten, die die lokale Organisation der Plasmamembran bestimmen, mit angemessener räumlicher und zeitlicher Auflösung verfeinert werden. Determinanten, die auf der Verfolgung einzelner Moleküle basieren, bieten eine ausgezeichnete räumliche Präzision und ermöglichen die Charakterisierung verschiedener Bewegungsmodi 9,10,11,12, haben jedoch eine begrenzte zeitliche Auflösung mit klassisch niedrigen Kamerabildraten und erfordern mehr experimentellen Aufwand, um eine signifikante Anzahl von Trajektorien aufzuzeichnen. Alternativ kann der Diffusionskoeffizient von Membrankomponenten durch Fluoreszenzrückgewinnung nach Photobleichen (FRAP)13 oder Fluoreszenzkorrelationsspektroskopie (FCS)14 bewertet werden. Letzteres hat mehr Aufmerksamkeit erhalten, vor allem wegen seiner hohen Empfindlichkeit und Selektivität, seines mikroskopischen Detektionsvolumens, seiner geringen Invasivität und seines großen Dynamikbereichs15.
Die konzeptionelle Grundlage von FCS wurde von Magde und Kollegen vor etwa 50 Jahren 16,17 eingeführt. Es basiert auf der Erfassung der Fluktuation der Fluoreszenzemission mit einer hohen zeitlichen Auflösung (von μs bis s)18. In seiner modernen Version werden Messungen in lebenden Zellen durch ein kleines konfokales Anregungsvolumen (~ 0,3 Femtoliter) durchgeführt, das in einem interessierenden Bereich (z. B. an der Plasmamembran) positioniert ist. Das Fluoreszenzsignal, das durch die Diffusion fluoreszierender Moleküle erzeugt wird, die in das Beobachtungsvolumen ein- und ausgehen, wird mit sehr hoher zeitlicher Auflösung (d.h. der Ankunftszeit jedes Photons auf dem Detektor) gesammelt. Dann wird das Signal berechnet, um die Autokorrelationsfunktion (ACF) zu erzeugen, aus der die durchschnittliche Zeit td (Diffusionszeit), für die ein Molekül innerhalb des Fokusvolumens bleibt, zusammen mit der mittleren Anzahl von Teilchen (N) extrahiert wird, die im Beobachtungsvolumen vorhanden sind, das umgekehrt proportional zur Amplitude des ACF ist. Dieser letzte Parameter könnte eine nützliche Information über die Molekülkonzentration innerhalb des Beobachtungsvolumens sein.
Seitdem wurde eine wachsende Anzahl von FCS-Modalitäten dank der sich schnell entwickelnden Instrumentierung in der Biophotonik implementiert, die die Beschreibung dynamischer Phänomene in lebenden Systemen ermöglicht. Dennoch würde eine molekulare Spezies eine überlappendere Verteilung der Diffusionskoeffizientenwerte erfahren, was sich normalerweise in einer anomalen Diffusionseigenschaft widerspiegelt, in der Moleküle mit einer nichtlinearen Beziehung in der Zeit19 diffundieren, und Schwierigkeiten, die biologische Bedeutung dieser anomalen Subdiffusion zu identifizieren. In der Vergangenheit wurde diese Schwierigkeit etwas überwunden, indem die molekulare Diffusion durch FRAP aus Gebieten unterschiedlicher Größe und nicht nur aus einem Bereich aufgezeichnet wurde, wodurch zusätzliche räumliche Informationen bereitgestellt wurden. Dies ermöglichte beispielsweise die Konzeptualisierung von Membranmikrodomänen20,21,22.
Eine Übersetzung dieser Strategie auf FCS-Messungen (d.h. die sogenannte Spotvariation Fluorescence Correlation Spectroscopy (svFCS)) wurde durch Variation der Größe des Fokusvolumens der Beobachtung etabliert, so dass die Fluktuation der Fluoreszenz auf verschiedenen räumlichen Skalen aufgezeichnet werdenkann 23. Somit liefert der svFCS-Ansatz indirekte räumliche Informationen, die die Identifizierung und Bestimmung molekularer Diffusionsmoden und der Art der Membranpartitionierung (isolierte versus zusammenhängende Domänen24) von untersuchten Molekülen ermöglichen. Durch die Darstellung der Diffusionszeit td als Funktion der verschiedenen räumlichen Skalen, die durch den Taillenwert (ω) definiert sind, der der Größe des Detektionsstrahlradius in diesem Fall23,25 entspricht, kann man das Diffusionsgesetz eines gegebenen Moleküls in einem gegebenen physiologischen Zustand charakterisieren. Das svFCS ist daher ein perfektes Analogon zur Einzelpartikelverfolgung im Zeitbereich26. Unter der Brownschen Diffusionsbeschränkung sollte man eine streng lineare Beziehung zwischen der Diffusionszeit td und der Taille ω erwarten (Abbildung 1)23,25. Der Ursprung der Abweichung des Diffusionsgesetzes von diesem Schema kann auf nicht-exklusive Gründe wie Zytoskelettgeflecht, molekulares Crowding, dynamische Partitionierung in Nanodomänen oder eine Kombination dieser und anderer Effekte zurückgeführt werden (Abbildung 1) und muss experimentell getestetwerden 25.
Hier bieten wir alle notwendigen Kontrollpunkte für den täglichen Gebrauch eines maßgeschneiderten optischen Systems svFCS, das von Grund auf neu entwickelt wurde und unsere bisherigen Protokollüberprüfungen27,28 zu diesem experimentellen Ansatz ergänzt. Darüber hinaus geben wir als Machbarkeitsnachweis Richtlinien für die Kalibrierung des Aufbaus, die Vorbereitung von Zellen, die Datenerfassung und die Analyse zur Etablierung des svFCS-Diffusionsgesetzes (DL) für Thy1-GFP, ein Plasmamembran-Glykosylphosphatidylinositol-verankertes Protein, von dem bekannt ist, dass es in Lipid-Floß-Nanodomänen lokalisiert ist29. Schließlich zeigen wir, wie sich die partielle Destabilisierung von Lipid-Floß-Nanodomänen durch Cholesterinoxidase-Behandlung auf die Diffusionseigenschaften von Thy1-GFP auswirkt. Darüber hinaus finden Sie eine detaillierte Beschreibung des Erstellens eines svFCS-Setups von Grund auf im Ergänzungsmaterial.
Protokoll
1. Festlegen der Spezifikation für die Zusammenstellung eines maßgeschneiderten svFCS-Setups
HINWEIS: Die Einfachheit des vorgeschlagenen svFCS-Setups ermöglicht eine einfache Installation, Bedienung und Wartung zu niedrigen Kosten und gewährleistet gleichzeitig eine effiziente Photonenrückgewinnung. Weitere Informationen finden Sie unter Ergänzungsmaterial.
- Experimentierraum und Sicherheit
- Installieren Sie das System in einem Raum, der bei etwa 21 °C stabilisiert ist.
- Vermeiden Sie einen direkten Luftstrom auf dem passiven (oder aktiven) optischen Tisch und befolgen Sie die Lasersicherheitsregeln für die optische Ausrichtung.
- Hard- und Software
HINWEIS: Ergänzendes Material beschreibt die in Abbildung 2 dargestellten Installationsschritte.- Die Haupterfassungs- und Steuerungssoftware in LabVIEW wird mithilfe einer Zustandsautomaten- und Ereignisstrukturarchitektur geschrieben, bei der eine Multifunktionserfassungskarte die meisten Controller steuert.
HINWEIS: Der Korrelator, der Laser und der Leistungsmesser werden von einer eigenen Software gesteuert oder überwacht. - Passen Sie die Hardware- und Software-Installationsverfahren entsprechend der verwendeten Hardware an.
- Die Haupterfassungs- und Steuerungssoftware in LabVIEW wird mithilfe einer Zustandsautomaten- und Ereignisstrukturarchitektur geschrieben, bei der eine Multifunktionserfassungskarte die meisten Controller steuert.
- Optischer Aufbau
HINWEIS: Abbildung 3 zeigt die optischen Tischmodule, die in den folgenden Abschnitten verwendet werden, um die Qualität der optischen Ausrichtungen zu steuern. Alle Spezifikationen der optischen Elemente sind in der Materialtabelle aufgeführt. Die Vorgehensweise zum Erstellen des Setups wird im Ergänzungsmaterial ausführlich beschrieben. Dieses System besteht aus einem Dauerstrichlaser, einem motorisierten invertierten Mikroskop mit Tauchwasserobjektiv, einem Lawinenphotodiodendetektor, der mit einem einzelnen Photonenzählmodul gekoppelt ist, und einem Hardware-Korrelator. Eine mikroskopische Inkubationskammer mit vibrationsfreien Heizungen wurde speziell zur Temperaturregelung für Experimente an lebenden Zellen entwickelt. Gemäß der Konvention entspricht die XY-Achse der senkrechten Ebene des optischen Pfads und die Z-Achse dem optischen Pfad.
2. Täglicher Checkpoint vor dem Ausführen des Experiments
- Steuern Sie den Anregungspfad (Abbildung 3,
 &
&  ).
).- Öffnen Sie alle Irisdiaphragmen.
- Messen Sie die Laserleistung mit dem Leistungsmesser und halten Sie die erste Iris vollständig offen.
- Drehen Sie die Halbwellenplatte (HWP), um die maximale Leistung zu ermitteln.
- Überprüfen Sie die Ausrichtung mit der Iris, wenn die Laserleistung niedriger als üblich ist, und bewegen Sie L1 und M1 bei Bedarf abwechselnd.
- Notieren Sie sich den Leistungswert im Experimentlabor-Notizbuch.
- Steuern Sie den Erkennungspfad (Abbildung 3,
 &
&  ).
).- Legen Sie das Wasser, ein Deckglas und einen Tropfen einer 2 nM Rhodamin 6G (Rh6G) -Lösung auf das Objektiv.
- Wenn das Fluoreszenzsignal (Zählnummer auf dem APD, aufgezeichnet mit der LabVIEW-Software) niedriger als üblich ist, erstellen Sie die Rh6G-Lösung neu, überprüfen Sie die Positionierung und die Nummer des Deckglases auf der Objektivlinse oder beseitigen Sie gegebenenfalls Blasen.
- Wenn das Fluoreszenzsignal immer noch niedriger als gewöhnlich ist, platzieren Sie den Leistungsmesser innerhalb des optischen Pfades, um den Strahl zu blockieren.
- Schalten Sie den APD aus (im Folgenden bezieht sich APD auf den APD und das Einzelphotonenzählmodul).
- Entfernen Sie das Beispiel.
- Reinigen und ersetzen Sie die Objektivlinse durch ein reflektierendes Ziel.
- Überprüfen Sie den Laserstrahl auf dem reflektierenden Ziel, indem Sie den Leistungsmesser aus dem Lichtweg entfernen. Stellen Sie sicher, dass der Strahl des Ziels zentriert ist und die Rückreflexion die erste Blende auf der Linie
 erreicht (Abbildung 3).
erreicht (Abbildung 3). - Wenn nicht, passen Sie die mittlere Positionierung mit M2 oder die Rückreflexion mit dem dichroitischen Spiegel an.
- Wenn die Mikroskopkopplung korrekt ist, drücken Sie die Objektivlinse zurück, fügen Sie einen Tropfen Wasser, ein Deckglas und einen Tropfen einer konzentrierteren Rh6G-Lösung (dh 200 nM) hinzu und stellen Sie eine geringere Laserleistung als bei den klassischen Messungen ein (wenige μW).
- Schalten Sie den APD ein und optimieren Sie die APD- und Lochausrichtung abwechselnd mit den jeweiligen XYZ-Einstellschrauben bei gleichzeitiger Überwachung des Intensitätssignals (LabVIEW-Software).
- Wechseln Sie das Deckglas und fügen Sie eine niedrigere Konzentration von Rh6G (2 nM) hinzu. Bewegen Sie das Loch entlang der Z-Achse, um eine Position zu finden, an der das molekulare Helligkeitsverhältnis zunimmt und die Taille minimal ist.
- Schließen Sie die Iris, bis das Signal nach unten fällt: Die Laserstrahlgröße erreicht die hintere Blendengröße des Objektivs (d. h. die minimale Taillengröße, siehe Ergänzungsmaterial).
- Starten Sie die Korrelator-Software und zeichnen Sie Daten auf (siehe Abschnitt 7 zur Datenaufzeichnung).
- Überprüfen Sie den ACF, der ein geringes Rauschen aufweisen, eine kleine Taillengröße und eine hohe Zählrate pro Molekül und Sekunde ergeben sollte (siehe Abschnitt 7 für die Datenanalyse und die Bewertung der Taillengröße).
3. Allgemeine Überlegungen zur svFCS-Datenerfassung und -analyse
- Zeichnen und analysieren Sie die Fluoreszenzdaten nach diesem allgemeinen Schema (siehe Abschnitte 7, 8 und 9): (1) Fluoreszenzaufzeichnung und ACF-Erzeugung (Korrelationssoftware), (2) unerwartetes Verwerfen von Daten, ein Durchschnitt der gespeicherten Daten, Anpassung an das entsprechende Modell (mit hausgemachter Igor Pro-Software), (3) Diffusionsgesetzdiagramm (hausgemachte MATLAB-Software 1) und (4) optionaler Diffusionsgesetzvergleich (hausgemachte MATLAB-Software 2). Die verschiedenen Softwareprogramme sind auf Anfrage erhältlich.
HINWEIS: Der Hardware-Korrelator hat eine minimale Abtastzeit von 12,5 ns (d.h. eine Abtastfrequenz von 80 MHz). Es bietet eine zeitliche Auflösung, die mindestens 1.000 niedriger ist als die typische residente Zeit eines frei diffundierenden kleinen Moleküls in Lösung und 10bis 6 kleiner als die Diffusionszeit von Membranproteinen innerhalb eines konfokalen Beobachtungsvolumens.
4. Zellkultur und Transfektion
- Samen Sie die Cos7-Zellen in 8-Well-Kammer-Deckglas mit # 1.0 Borosilikatglasboden bei einer Dichte von 10.000 Zellen / Well mit vollständigem Dulbeccos Modified Eagle Medium (DMEM), ergänzt mit 5% fetalem Rinderserum, Penicillin (100 U / ml), Streptomycin (100 U / ml) und L-Glutamin (1 mM).
- Die Zellen bei 37 °C in einer befeuchteten Atmosphäre mit 5% CO2 für 24 h kultivieren.
- Entfernen Sie das Medium, fügen Sie 300 μL des frischen vollständigen Kulturmediums pro Vertiefung hinzu und inkubieren Sie die Zellen für 30 min bei 37 ° C.
- Verdünnen Sie 0,5 μg der Plasmid-DNA, die für das Thy-1-Protein kodiert, das mit eGFP25 in 50 μL serumfreiem DMEM verschmolzen ist. Vortex kurz zum Mischen.
- Verdünnen Sie 1,5 μL des DNA-Transfektionsreagenzes in 50 μL serumfreiem DMEM und mischen Sie die Lösung gut.
- Fügen Sie das verdünnte Transfektionsreagenz direkt in die vorbereitete DNA-Lösung hinzu und mischen Sie die Verbindungen sofort.
- Die vorbereitete Mischung für 10 bis 15 min bei Raumtemperatur inkubieren.
- Fügen Sie 10 μL der kombinierten DNA/Transfektionsreagenz-Komplexe tropfenweise auf das Medium in jeder Vertiefung hinzu und homogenisieren Sie, indem Sie die Platte vorsichtig verwirbeln.
- Inkubieren Sie die Zellen bei 37 °C mit 5% CO2 für 3 h.
- Ersetzen Sie nach der Inkubation das Medium, das DNA/Transfektionsreagenzienkomplexe enthält, durch 400 μL frisches vollständiges DMEM und kultivieren Sie die Zellen 16 Stunden lang vor dem svFCS-Experiment.
5. Vorbereitung der Zellen für svFCS-Messungen
- Entfernen Sie das Kulturmedium.
- Waschen Sie die Zellen vorsichtig zwei- bis dreimal mit dem serumfreien Hank's Balanced Salt Solution (HBSS) Puffer, der Ca 2+ und Mg2+ enthält, ergänzt mit 10 mM (4-(2-hydroxyethyl)-1-piperazineethansulfonsäure) (HEPES), pH 7,4 (HBSS/HEPES).
- Pflegen Sie die Zellen während aller svFCS-Akquisitionen im HBSS/HEPES-Puffer.
6. Pharmakologische Behandlung
- Entfernen Sie das Kulturmedium und waschen Sie die Zellen zwei- bis dreimal mit serumfreiem HBSS, ergänzt mit 10 mM HEPES, pH 7,4 (HBSS / HEPES).
- Inkubieren Sie die Zellen mit 1 HE/ml Cholesterinoxidase (COase)-Lösung in HBSS/HEPES-Puffer für 1 h bei 37 °C.
- Entfernen Sie die Lösung und halten Sie die Zellen in Gegenwart von 0,1 U / ml COase im HBSS / HEPES-Puffer, während Sie die svFCS-Messungen durchführen.
7. Kalibrierung der Spotgröße
- Die Mikroskopkammer bei 37 °C vorwärmen.
- Bereiten Sie eine Standard-2-nM-Lösung von Rh6G durch serielle Verdünnung vor.
- Lassen Sie 200 μL 2 nM Rh6G-Lösung auf ein Glasdeckglas fallen, das auf dem Wassertauchobjektiv platziert ist.
- Starten Sie die gesamte Hardware und Software.
- Messen und justieren Sie die 488 nm Laserstrahlleistung auf 300 μW. Passen Sie diese Leistung je nach Helligkeit und Photostabilität der verwendeten Fluoreszenzsonde entsprechend (1) der Fluoreszenzintensität (auf der LabVIEW-Software) an, die stabil sein sollte, (2) der ACF-Form (auf der Korrelatorsoftware), die im Laufe der Zeit eine konstante Form haben sollte, und (3) die passenden Parameter, die eine kleine Taillengröße und eine hohe Zählrate pro Molekül ergeben (Photonen pro Molekül pro Sekunde, typischerweise einige zehn bis Hunderte von Photonen pro Molekül pro Sekunde).
HINWEIS: Die Amplitude der ACF (genannt G(0)) ist umgekehrt proportional zur Anzahl des Moleküls (d.h. der Konzentration der fluoreszierenden Sonde). Für die Taillengrößenkalibrierung ist dies ein guter Qualitätskontrollkandidatenparameter. Daher sollte G(0) für die gleiche Konzentration von Tag zu Tag ähnlich sein, da es die Taillengröße und -konzentration miteinander verbindet. Für Zellmessungen, da FCS bei niedriger Konzentration genauer ist, sollte G(0) für die richtige Parameteranpassungsextraktion hoch sein. - Stellen Sie den Anschluss des svFCS-Beleuchtungs-/Detektionsmikroskops mit der LabVIEW-Software ein.
- Schalten Sie den APD ein.
- Schließen Sie die Iris, bis das Signal nach unten fällt, um die minimale Taillengröße zu erhalten, oder schließen Sie sie für eine größere Taillengröße.
- Zeichnen Sie mehrere ACFs mit ausgewählter Dauer (nämlich einen Lauf) auf, um die statistische Reproduzierbarkeit zu verbessern, typischerweise 10 Durchläufe mit einer Dauer von jeweils 20 Sekunden mit der Korrelatorsoftware.
- Schalten Sie den APD aus.
- Verwenden Sie die Igor Pro-Software, um die Läufe mit starken Schwankungen aufgrund molekularer Aggregate zu überprüfen und zu verwerfen. Führen Sie diesen Schritt manuell aus – er sollte benutzerunabhängig sein, nachdem die Benutzer geschult wurden.
- Passen Sie den Durchschnitt der zurückgehaltenen ACFs mit einem 3D-Diffusionsmodell an.
- Extrahieren Sie aus den Anpassungsparametern die durchschnittliche Diffusionszeit
 und speichern Sie sie in einer ".txt" -Datei (das Dateiformat wird von der Igor Pro-Software vorgegeben).
und speichern Sie sie in einer ".txt" -Datei (das Dateiformat wird von der Igor Pro-Software vorgegeben). - Überprüfen Sie die Zählrate pro Molekül pro Sekunde (ein guter Leistungsindikator), indem Sie die durchschnittliche Intensität (extrahiert aus der Fluoreszenzspur) durch die Anzahl der Moleküle (extrahiert aus dem ACF) dividieren.
HINWEIS: Stellen Sie sicher, dass dieser Wert von Tag zu Tag für dieselben Erfassungsparameter hoch und stabil ist. - Unter Kenntnis des Diffusionskoeffizienten von Rh6G in wässriger Lösung bei 37 °C (D) und (siehe 7.13) berechnet
 man die experimentelle Taillengröße ω nach:
man die experimentelle Taillengröße ω nach: 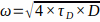 .
. - Wenden Sie das Verfahren für jede Taillengrößenänderung an, die erforderlich ist, um das FCS-Diffusionsgesetz zu plotten, und vor jeder neuen experimentellen Reihe von svFCS-Datenerfassung.
8. svFCS-Datenerfassung an Zellen
- Messen und justieren Sie die 488 nm Strahlleistung zwischen 2 und 4 μW. Abhängig von der Helligkeit und der Photostabilität der verwendeten Fluoreszenzsonde ist diese Leistung anzupassen, um eine hohe Zählrate pro Molekül (typischerweise mehrere tausend Photonen pro Molekül pro Sekunde) zu ermöglichen und gleichzeitig die Photobleiche niedrig zu halten (d. h. eine stabile Intensitätsspur auf der LabVIEW-Software).
- Die Proben für 10 min bei 37 °C ausgleichen, bevor mit den Messungen begonnen wird.
- Stellen Sie das Epifluoreszenz-Beleuchtungsmikroskop mit der LabVIEW-Software ein.
- Wählen Sie eine Zelle mit einem geeigneten Standort der Fluoreszenzsonde und einer (niedrigen) Fluoreszenzsignalintensität.
HINWEIS: Je niedriger die Fluoreszenz ist, desto besser sind die FCS-Messungen (siehe Schritt 8.1). - Stellen Sie den Anschluss des svFCS-Beleuchtungs-/Detektionsmikroskops mit der LabVIEW-Software ein.
- Schalten Sie den APD ein.
- Führen Sie mit der LabVIEW-Software einen XY-Scan der ausgewählten Zelle durch.
- Führen Sie einen Z-Scan durch und lokalisieren Sie den konfokalen Punkt mit der maximalen Fluoreszenzintensität, indem Sie die Plasmamembran oben auswählen und die Datenerfassung starten. Um die Trennung zwischen den beiden Membranen zu maximieren, führen Sie den Scan vorzugsweise im Kernbereich der Zelle durch.
- Zeichnen Sie mit der Correlator-Software eine Serie von 20 Durchläufen mit einer Dauer von jeweils 5 s auf.
HINWEIS: Stellen Sie sicher, dass die Dauer jedes Laufs lang genug ist, um ACFs mit reduziertem Rauschen zu erhalten. Lange Akquisitionen sind anfällig für Photobleaching oder unerwartete erhebliche Schwankungen (z. B. Zuschlagstoffe). Passen Sie die Anzahl der Durchläufe, ihre Dauer und die Anzahl der Reihen an die Stichproben an, aber stellen Sie sicher, dass sie innerhalb der gleichen Masse von Experimenten konstant bleiben, um die Reproduzierbarkeit zu gewährleisten. - Schalten Sie den APD aus.
- Verwerfen Sie unerwartete Läufe mit der Igor Pro-Software.
- Passen Sie den durchschnittlichen ACF mit einem 2D-Diffusionsmodell mit 2 Spezies an. Passen Sie dieses Modell an die Art des Diffusionsverhaltens des Zielmoleküls an.
- Speichern Sie die Formstückparameter in der vorherigen Datei (siehe Schritt 7.13).
- Führen Sie 10 bis 15 Aufzeichnungsreihen an mindestens 10 verschiedenen Zellen durch und wiederholen Sie die Schritte 8.3 bis 8.13. Überprüfen Sie, ob die einzelne erhaltene Datei die Taillengrößeninformationen und die Passformparameter der 10-15 Aufnahmen enthält.
- Um ein einzelnes Diffusionsgesetz festzulegen, analysieren Sie mindestens vier Taillengrößen zwischen 200 und 400 nm. Dieser Bereich wird durch die optische Beugungsgrenze definiert, ist aber objektiv- (numerische Apertur) und Laser- (Wellenlänge) abhängig.
HINWEIS: Da die Taillengrößenkalibrierung nicht absolut ist und ein gewisses Maß an Unsicherheit aufweist, wurde eine spezielle MATLAB-Software28 entwickelt, die den x- und y-Fehler (nämlich ω 2 und td) berücksichtigt, um dem Diffusionsgesetz zu entsprechen. - Starten Sie die MATLAB-Software 1 und wählen Sie einen Ordner aus, der alle ".txt" -Dateien enthält, die mindestens vier Taillengrößenexperimenten entsprechen.
- Plot <td> versus <ω2>, nämlich das Diffusionsgesetz. Zwei Hauptparameter können extrahiert werden: der y-Achsenschnitt (t0) und der effektive Diffusionskoeffizient (Deff, umgekehrt proportional zur Steigung).
9. Diffusionsgesetze verschiedener experimenteller Zustandsvergleich
HINWEIS: Falls erforderlich, reproduzieren Sie die Abschnitte 7 und 8 für verschiedene Versuchsbedingungen. Eine dedizierte Software (MATLAB-Software 2) wurde entwickelt, um festzustellen, ob diese Diffusionsgesetze gemäß den t-0- und D-eff-Werten28 ähnlich sind oder nicht. Es testet zwei Hypothesen: Die beiden Werte sind unterschiedlich, oder die beiden Werte unterscheiden sich nicht bei einem Schwellenwert, der über einer Wahrscheinlichkeit eines Fehlalarms (PFA) liegt. Ein beliebiger PFA-Wert von 5% (T = 3,8) gilt als Obergrenze der Signifikanz zwischen zwei Parametern (t 0 oder Deff), was darauf hinweist, dass es nur eine Wahrscheinlichkeit von 5% gibt, dass die beiden Werte identisch sind.
- Erstellen Sie eine ".xls"-Datei, die die charakteristischen Diffusionsgesetzwerte jeder zu vergleichenden Bedingung enthält (d. h. eine Datei, die den Fehler t 0, t0, D eff und Deff für die nicht behandelten (NT) und behandelten (COase) Bedingungen als Tabelle enthält).
- Starten Sie die MATLAB-Software 2.
- Wählen Sie die Datei ".xls" aus.
- Analysieren Sie das generierte farbcodierte 2D-Diagramm, wobei die statistischen Tests t0 und Deff auf der x- bzw. y-Achse dargestellt werden sollen (Abbildung 4). Je höher T ist, desto größer ist die Differenz zwischen den verglichenen Werten.
10. Cholesterinkonzentrationsmessungen
- Zellbehandlung und Lyse
- Samen Sie die Cos7-Zellen dreifach in 6-Well-Platten bei 4 × 10 5 Zellen / Well und inkubieren Sie in 2 ml vollständigem DMEM bei 37 ° C mit5 % CO 2 über Nacht, damit sich die Zellen an die Platte anheften können.
- Entfernen Sie das Kulturmedium und waschen Sie die Zellen dreimal mit phosphatgepufferter Kochsalzlösung (PBS).
- 1 ml HBSS/HEPES-Puffer mit (oder auch nicht, für Kontrollen) 1 HE/ml Coase hinzufügen und 1 h bei 37 °C mit 5 % CO2 inkubieren.
- Ersetzen Sie das Medium durch 1 ml HBSS/HEPES, das 0,1 HE/ml Coase enthält, und inkubieren Sie für 1 h bei 37 °C mit 5% CO2.
- Entfernen Sie die Lösung und ernten Sie die Zellen.
- Waschen Sie die Zellen dreimal mit PBS und zentrifugieren Sie bei 400 × g für 5 Minuten bei Raumtemperatur.
- Lyse der Zellen mit Radioimmunpräzipitations-Assay-Puffer (25 mM HEPES, pH 7,4, 150 mM NaCl, 1% NP40, 10 mM, MgCl 2, 1 mM Ethylendiamintetraessigsäure,2% Glycerin, Protease und Phosphatase-Hemmer-Cocktail) für 30 min auf Eis.
- Die Lysate bei 10000 × g für 10 min bei 4 °C zentrifugieren und den Überstand sammeln.
- Quantifizieren Sie die Gesamtproteinkonzentration für jede Probe durch modifizierten Bradford-Proteinassay unter Verwendung der Arbeitslösung gemäß den Empfehlungen des Herstellers.
- Messung der Cholesterinkonzentration
- Um den gesamten zellulären Cholesterinspiegel enzymatisch zu bestimmen, verwenden Sie das entsprechende Kit (z. B. Amplex Red Cholesterol Assay Kit) gemäß den Empfehlungen des Herstellers.
- Für jede Reaktion mischen Sie die Probe, die 5 μg Protein enthält, mit Amplex Red Reagenz/Meerrettichperoxidase/Cholesterinoxidase/Cholesterinesterase-Arbeitslösung und inkubieren Sie sie 30 min bei 37 °C im Dunkeln.
- Messen Sie die Fluoreszenz mit einer Anregung von 520 nm und detektieren Sie die Emission bei 560–590 nm mit einem Mikroplattenleser.
- Subtrahieren Sie den Hintergrund vom Endwert und bestimmen Sie die Cholesterinkonzentration anhand einer Standardkurve.
- Berechnen Sie den endgültigen Cholesteringehalt in ng Cholesterin pro μg Protein.
Ergebnisse
Wir erzeugten eine DL für Thy1-GFP, ausgedrückt in Cos-7-Zellen (Abbildung 4, schwarze Quadrate). Das Diffusionsgesetz hat einen positiven t 0-Wert (19,47 ms ± 2 ms), was darauf hinweist, dass Thy1-GFP in Nanodomänenstrukturen der Plasmamembran eingeschlossen ist. Die Cholesterinoxidase-Behandlung der Zellen, die Thy1-GFP exprimieren, führte zur Verschiebung des DL t0-Wertes auf 7,36 ± 1,34 ms (Abbildung 4, graue Quadrate). Diese Beobachtung bestätigt, dass die Art des Thy1-GFP-Einschlusses vom Cholesteringehalt abhängt und mit Lipid-Floß-Nanodomänen assoziiert ist. Diese beiden Diffusionsgesetze unterscheiden sich gemäß dem oben beschriebenen statistischen Test (siehe Schritt 9.1.3) in Bezug auf t 0- und D-eff-Werte. Darüber hinaus bewerteten wir die Konzentration des gesamten zellulären Cholesterins in nicht behandelten Cos-7-Zellen im Vergleich zu den mit COase behandelten Zellen. Eine kleine, aber signifikante Abnahme des Gesamtcholesteringehalts wird bei der Behandlung mit COase beobachtet (Abbildung 5). Da dieses Enzym nur auf den Cholesterinpool wirkt, der am äußeren Blatt der Plasmamembran zugänglich ist, gehen wir davon aus, dass die beobachtete Abnahme des Cholesterinspiegels nur mit der Plasmamembran assoziiert ist und zur Destabilisierung von Lipid-Floß-Nanodomänen führt.

Abbildung 1: Simulierte Fluoreszenzkorrelationsspektroskopie (FCS) Diffusionsgesetze, die durch Spot-Variations-FCS für verschiedene Formen der Membranorganisation festgelegt wurden. (Obere Tafeln) Schematische Darstellung der Membranorganisation - (A) freie Diffusion, (B) Netzbarrieren und (C) Fallen- / Domänengrenzen - mit der für ein einzelnes Molekül gezeichneten Flugbahn (rot). Blaue Kreise bezeichnen den Schnittpunkt der Membran und des Laserstrahls der Taille ω. (Untere Panels) FCS-Diffusionsgesetze, dargestellt durch Darstellung der Diffusionszeit td als Funktion des quadratischen Radius ω2. Die Diffusionsgesetzprojektion (grün gestrichelte Linie) durchschneidet die Zeitachse bei (A) dem Ursprung (t 0 = 0) im Falle der freien Diffusion; (B) in negativer Achse (t 0 < 0), wenn maschenartige Barrieren vorhanden sind, oder (C) in positiver Achse (t 0 > 0), wenn Fallen und Domänen (Lipidflöße) vorhanden sind. D ist der laterale Diffusionskoeffizient für die Brownsche Bewegung; Deff, der effektive Diffusionskoeffizient; Dmicro, der mikroskopische Diffusionskoeffizient innerhalb der Maschendrahtfallen; Din, der Diffusionskoeffizient innerhalb von Domänen; Dout, der Diffusionskoeffizient außerhalb von Domänen; L, die Größe der Seite einer quadratischen Domäne; und rD, der Radius einer kreisförmigen Domäne. Diese Figur wurde von He und Marguet6 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Schematische Ansicht der svFCS-Hardwaresteuerung. Der Computer steuert alle Geräte über verschiedene Kommunikationsprotokolle: seriell (Mikroskop, externer Verschluss), USB (XYZ-piezoelektrischer Tisch, Korrelator) und PCI (Erfassungsplatine). DAQ: Datenerfassungsplatine, APD: Lawinenphotodiode, SPCM: Einzelphotonenzählmodul, DO: digitaler Ausgang. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Schematische Darstellung der optischen Anregungs- und Emissionspfade des svFCS-Aufbaus. Der svFCS-Aufbau besteht aus vier Modulen: (1) der Ausgang eines faserigen 488-nm-Lasers wird kollimiert, (2) eine Kombination aus einer Halbwellenplatte und einem polarisierenden Strahlteiler stellt die optische Leistung ein, (3) der Laserstrahl, der auf die Probe fokussiert ist, nachdem er sich durch ein röhrenlinsenfreies motorisiertes Mikroskop bewegt hat, und (4) die Fluoreszenz wird durch einen konfokalartigen Detektionspfad auf eine Lawinenphotodiode detektiert, die mit einem einzelnen Photonenzählmodul gekoppelt ist, die ein Signal an einen Hardware-Korrelator liefert. Einfachheit verleiht dem System seine Empfindlichkeit, Robustheit und Benutzerfreundlichkeit (ausführlich kommentiert in Ergänzendes Material). Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Die svFCS-Diffusionsgesetze, die aus der Diffusionsanalyse von Thy1-GFP erzeugt werden, ausgedrückt in Cos-7. svFCS-Diffusionsgesetze von Cos-7-Zellen ohne Behandlung (NT, schwarze Quadrate) und nach Cholesterinoxidase-Behandlung (COase, graue Kreise). Die Einfügung in der Grafik stellt statistische Tests eines signifikanten Unterschieds zwischen den beiden vorgestellten svFCS-Diffusionsgesetzen dar (nach Mailfert et al.28). Der Prüfwert (T) sollte über dem auf 3,8 festgelegten Schwellenwert liegen, wenn beide Diffusionsgesetze unterschiedlich sind. Je höher es ist, desto größer ist der Unterschied zwischen den Diffusionsgesetzen. Der Wert von T ist farbcodiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
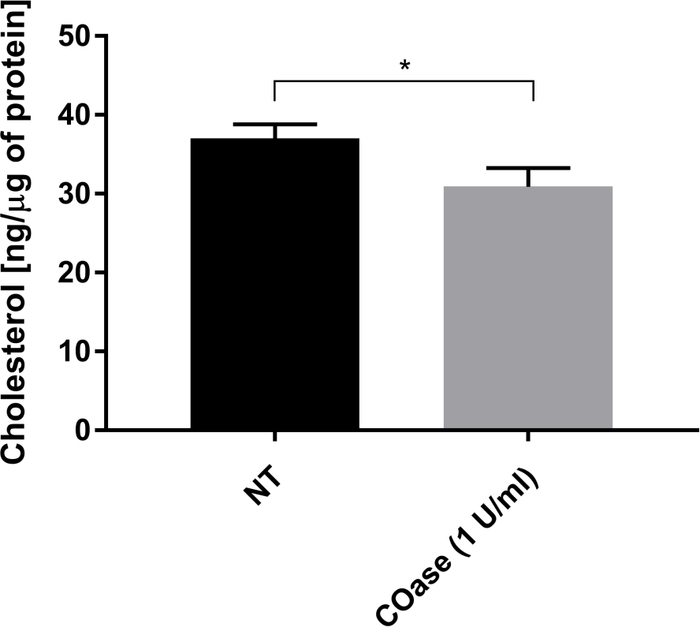
Abbildung 5: Vergleich des Gesamtcholesteringehalts in Cos-7-Zellen. Cos-7-Zellen wurden entweder nicht behandelt (NT) oder 1 Stunde lang mit 1 E/ml Cholesterinoxidase (COase) behandelt. Die Daten stellen ein Beispiel für ein Experiment in dreifacher Ausfertigung dar. Zur Beurteilung der statistischen Differenz (α=0,05) wurde ein zweiseitiger, ungepaarter t-Test verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Materialtabelle: Die Liste der optischen Elemente, die für das svFCS-Setup erforderlich sind.
Ergänzendes Material: Dieses Dokument beschreibt das Erstellen eines svFCS-Setups von Grund auf. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Hier haben wir die Implementierung des svFCS-Moduls auf einem Standard-Fluoreszenzmikroskop beschrieben, einem leistungsstarken experimentellen Ansatz zur Entschlüsselung der Dynamik der Plasmamembranorganisation in lebenden Zellen dank der FCS-Diffusionsgesetzanalyse. Konzeptionell basiert das svFCS auf einem einfachen Prinzip: Korrelationsmessungen der Fluoreszenz im Zeitbereich bei gleichzeitiger Variation der Größe der Beleuchtungsfläche23. Diese Strategie war maßgeblich an der Ableitung nanoskopischer Informationen aus mikroskopischen Messungen beteiligt, die dazu beitragen, die wichtigsten physikalisch-chemischen Elemente, die zur Plasmamembranorganisation im stationären Zustand25 und physiologischen Prozessen30,31,32,33 beitragen, zu entschlüsseln. Insgesamt zeigen diese svFCS-Analysen eindeutig die Existenz lipidabhängiger Nanodomänen in verschiedenen Zelltypen und deren direkte Auswirkungen auf die Abstimmung verschiedener Signalereignisse.
In diesem Rahmen gibt es einige optische Aspekte, die beim Aufbau des svFCS-Setups berücksichtigt werden müssen, um das Photonenbudget zu optimieren und optische Aberrationen zu minimieren. Daher empfehlen wir, ein Mikroskop zu verwenden, aus dem die Röhrchenlinse entfernt werden kann, wenn die svFCS-Messung durchgeführt wird. Darüber hinaus spielt eine einzelne Blende eine Schlüsselrolle im svFCS-Aufbau: Sie verändert die Strahlgröße an der hinteren Blende des Objektivs und variiert so direkt die effektive Taillengröße (d.h. das effektive Anregungsvolumen). Der Strahldurchmesser sollte zur objektiven Rückenpupille passen, um die kleinste Taillengröße34 zu erhalten. Diese Option, die hilft, die Taillengröße abzustimmen, sorgt für eine Optimierung des Photonenbudgets und ist einfach zu implementieren. Schließlich wird eine minimale Anzahl von optischen Teilen entlang des Lichtweges verwendet; Je weniger komplex das System, desto weniger Photonen gehen verloren. All diese Optionen verbessern die Robustheit von svFCS-Experimenten erheblich.
In Bezug auf das Protokoll selbst müssen einige kritische Schritte beachtet werden. Am wichtigsten ist eine angemessene Ausrichtung der optischen Pfade, die für erfolgreiche svFCS-Messungen entscheidend ist (Protokoll, Abschnitt 2). Dies ist leicht zu überprüfen, indem das Fluoreszenzsignal einer 2 nM Rh6G-Lösung analysiert wird, die unter 300 μW Laserbeleuchtung ~ 200 kHz betragen sollte. Alle Iris sollten geöffnet werden, und die ACFs sollten eine wichtige Amplitude haben (typischerweise G0 ~ 1,5-2,0). Ein weiterer kritischer Punkt betrifft die Zellen und ihre Vorbereitung für die svFCS-Analyse (Protokoll, Abschnitte 4–8). Ihre Dichte muss angepasst werden, damit isolierte Zellen, die beobachtet werden sollen, für die Analyse zur Verfügung stehen. Nicht adhärente Zellen müssen auf einem gekammerten Deckglas unter Verwendung von Poly-L-Lysin-Lösung immobilisiert werden. Das Fluoreszenzsignal der Zellmarkierung sollte nicht zu stark sein, da dies sonst zu sehr flachen ACFs führt, die schwer zu montieren sind, und die Anpassungsparameter sind mit einem wichtigen Fehler belastet. Darüber hinaus machen inhomogene Markierungs- und Fluoreszenzaggregate in Zellen die Interpretation der svFCS-Messungen extrem schwierig. Schließlich beeinflusst die Behandlung mit Cholesterinoxidase die Zelllebensfähigkeit, und die svFCS-Analyse sollte eine Stunde nach der Behandlung nicht überschreiten. Es ist auch besser, die Fluoreszenzschwankungen von der oberen Plasmamembran aufzuzeichnen, da sie nicht an den Träger gebunden ist und aufgrund der physikalischen Wechselwirkungen mit dem Träger keine Gefahr einer gehinderten Diffusion von Molekülen besteht.
Es gab genügend Fortschritte in der svFCS-Technik für ihre Verwendung in verschiedenen Ansätzen aufgrund der Vielfalt der Modalitäten zur Anpassung des Nachweisvolumens, die es ermöglichen, verschiedene biologische Prozesse in lebenden Zellen zu untersuchen. Eine Alternative zur Einstellung der Größe des Anregungsvolumens ist die Verwendung eines variablen Strahlexpanders35. Es ist auch möglich, die Größe der Beleuchtungsfläche einfach zu modulieren, indem das Fluoreszenzsignal vom Abfang der Plasmamembran entlang der z-Richtung36 aufgezeichnet wird. Dies kann an einem Standard-Konfokalmikroskop erfolgen, für das ein theoretischer Rahmen entwickelt wurde, um das Diffusionsgesetz37,38 abzuleiten.
Obwohl die svFCS-Methode eine räumlich-zeitliche Auflösung bietet, die für die Charakterisierung der inhomogenen lateralen Organisation der Plasmamembran notwendig ist, schließen sich die geometrischen Einschlussmodi nicht gegenseitig aus. Eine Abweichung von t0 in die eine oder andere Richtung offenbart ausschließlich eine dominante Einschließungsart25. Darüber hinaus ergibt sich eine weitere wichtige Einschränkung der vorliegenden svFCS-Methode aus der klassischen optischen Beugungsgrenze (~200 nm). Dies ist zweifellos größer als die Domänen, die die Moleküle in der Zellplasmamembran einschließen. Daher wird die Analyse des Einschlusses aus dem t 0-Wert abgeleitet, extrapoliert aus dem Diffusionsgesetz.
Dieser Nachteil wurde durch die Implementierung alternativer Methoden überwunden. Zunächst bot die Verwendung von Metallfilmen, die mit Nanoaperturen gebohrt wurden, die Möglichkeit, einen sehr kleinen Membranbereich (d. h. unterhalb der optischen Beugungsgrenze einzelner nanometrischer Aperturen mit Radien zwischen 75 und 250 nm) zu beleuchten39. Das aus dem theoretischen Diffusionsgesetz für isolierte Domänenorganisation vorhergesagte Übergangsregime wurde somit berichtet und ermöglichte eine Verfeinerung der charakteristischen Größe der nanometrischen Membranheterogenitäten und eine quantitative Schätzung der Oberfläche lipidabhängiger Nanodomänen39. Alternativ wurde die nanometrische Beleuchtung auch mit Hilfe der optischen Nahfeld-Rastermikroskopie40 oder der planaren optischen Nanoantennen41 entwickelt. In jüngerer Zeit hat die Kombination von stimulierter Emissionsverarmung (STED) und FCS ein leistungsfähiges und empfindliches Werkzeug zur Dokumentation des Diffusionsgesetzes mit sehr hoher räumlicher Auflösung bereitgestellt. Dieses STED-FCS ermöglicht den Zugang zu molekularen Diffusionseigenschaften auf einer Nanoskala, die innerhalb kurzer Zeit auftreten, und ermöglicht die Untersuchung der dynamischen Organisation von Lipidsonden an der Plasmamembran42,43. Die unvollständige Unterdrückung der Fluoreszenz im STED-Prozess stellt jedoch die Analyse der Autokorrelationskurven in FCS in Frage.
Um diese Schwierigkeit zu überwinden, wurde ein neues Anpassungsmodell entwickelt, das die Genauigkeit der Diffusionszeiten und der durchschnittlichen Molekülzahlenmessungenverbessert 44. Für die langsame molekulare Diffusion an der Plasmamembran schließlich kann das svFCS-Prinzip auf Daten angewendet werden, die mittels Bildkorrelationsspektroskopie45 aufgezeichnet wurden. Kürzlich wurde gezeigt, dass die Kombination der Rasterkraftmikroskopie (AFM) mit der Abbildung von Total Internal Reflection-FCS (ITIR-FCS) zur Verfeinerung der Art des Mechanismus beiträgt, der die molekulare Diffusion an der Plasmamembran behindert, insbesondere in der Nähe der Perkolationsschwellenmembrankonfiguration aufgrund einer hohen Dichte von Nanodomänen46.
Zusammenfassend lässt sich sagen, dass die Etablierung des Diffusionsgesetzes durch svFCS den experimentellen Beweis erbracht hat, um auf lokale Heterogenität zu schließen, die durch dynamische kollektive Lipide und die Assoziationen von Membranproteinen erzeugt wird. Wie Wohland und seine Mitarbeiter46 feststellten, "bleibt die FCS-Diffusionsrechtsanalyse ein wertvolles Werkzeug, um strukturelle und organisatorische Merkmale unterhalb der Lösungsgrenze aus dynamischen Informationen abzuleiten". Dennoch müssen wir neue Modelle entwickeln, um die Interpretation des Diffusionsgesetzes zu verfeinern, die ein besseres Verständnis der Dynamik der molekularen Ereignisse an der Plasmamembran ermöglichen sollten.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
SB, SM und DM wurden durch institutionelle Mittel des CNRS, des Inserm und der Universität Aix-Marseille sowie durch Programmzuschüsse der französischen Nationalen Forschungsagentur (ANR-17-CE15-0032-01 und ANR-18-CE15-0021-02) und des französischen "Investissement d'Avenir" (ANR-10-INBS-04 France-BioImaging, ANR-11-LABX-054 labex INFORM) unterstützt. Die KW würdigen "BioTechNan", ein Programm interdisziplinärer Umweltdoktoranden KNOW im Bereich Biotechnologie und Nanotechnologie. EB würdigt die finanzielle Unterstützung des Nationalen Wissenschaftszentrums Polens (NCN) im Rahmen des Projekts Nr. 2016/21/D/NZ1/00285 sowie der französischen Regierung und der französischen Botschaft in Polen. MŁ würdigt die finanzielle Unterstützung des polnischen Entwicklungsministeriums (CBR POIR.02.01.00-00-0159/15-00/19) und des Nationalen Zentrums für Forschung und Entwicklung (Innochem POIR.01.02.00-00-0064/17). TT würdigt die finanzielle Unterstützung des Nationalen Wissenschaftszentrums Polens (NCN) im Rahmen des Projekts Nr. 2016/21/B/NZ3/00343 und des Breslauer Biotechnologiezentrums (KNOW).
Materialien
| Name | Company | Catalog Number | Comments |
| Aligment tool | Spanner Wrench for SM1-Threaded Retaining Rings | Thorlabs | SPW602 |
| Avalanche Photodiode and Single Photon Counting Module (SPCM) | Single-Photon Counting Module, Avalanche Photodiode | Excelitas | SPCM-AQRH-15 |
| BNC 50 Ω plug to 50 Ω plug lead 2 m | RS Components | 742-4315 | |
| Coaxial cable 415 Cinch Connectors, RG-316, 50 Ω With connector, 1.22 m, RoHS2 | RS Components | 885-8172 | |
| Tee 50Ω RF Adapter BNC Plug to BNC Socket 0 → 1GHz | RS Components | 546-4948 | |
| Brennenstuhl 2.5 m, 8 Socket Type E – French Extension Lead, 230 V | RS Components | 768-5500 | |
| Mascot, 6W Plug In Power Supply 5V dc, 1.2A, 1 Output Switched Mode Power Supply, Type C | RS Components | 452-8394 | |
| Crystek CCSMACL-MC-24 Reference Oscillator Power Cable RF Adapter | RS Components | 792-4079 | |
| Fluorescence filtering | 535/70 ET Bandpass, AOI 0° Chroma Diameter 25 mm | AHF filter | F47-539 |
| Laser Beamsplitter zt488 RDC, AOI 45° Chroma 25.5 x 36 x 1 mm | AHF filter | F43-088 | |
| 496/LP BrightLine HC Longpass Filter, AOI 0° Chroma Diameter 25 | AHF filter | F37-496 | |
| Hardware correlator | 80 MHz Digital Correlator | Correlator.com | Flex02-12D |
| Laser | LASER LASOS LDM-XT fiber coupled, 488 nm, 65 mW | Lasos | BLD-XT 488100 |
| Laser safety | High-Performance Black Masking Tape, 1" x 180' (25 mm x 55 m) Roll | Thorlabs | T743-2.0 |
| Lens Tissues, 25 Sheets per Booklet, 5 Booklets | Thorlabs | MC-5 | |
| Laser Safety Glasses, Light Orange Lenses, 48% Visible Light Transmission | Thorlabs | LG3B | |
| Microscope | Zeiss Axiovert 200M Motorized Inverted Fluorescence Microscope Fine and coarse focusing, reflector turret rotation, objective nosepiece rotation, switching camera ports, and internal light shutters | Carl Zeiss | |
| C-Apochromat 40x/1,2 W Korr.selected for FCS (D=0.14-0.19 mm) (WD=0.28 mm at D=0.17 mm), UV-VIS-IR | Carl Zeiss | 421767-9971-711 | |
| Adapter W0.8 / M27x0.75 H "5" | Carl Zeiss | 000000-1698-345 | |
| Middle ring W0.8 - W0.8 H "5" | Carl Zeiss | 000000-1698-347 | |
| Optical path | D25.4mm Mirror, Protected Silver | Thorlabs | PF10-03-P01 |
| D25.4mm, F=60.0.mm, Visible Achromat | Thorlabs | AC254-060-A | |
| D25.4mm, F=35.0.mm, Visible Achromat | Thorlabs | AC254-035-A | |
| 25 µm mounted pinhole | Thorlabs | P25S I | |
| 25.4mm Mounted Zero, Order 1/2 Waveplate 488 nm | Thorlabs | WPH10M-488 (HWP) | |
| 20mm Polarizing Beamsplitter Cube 420-680 nm | Thorlabs | PBS201 | |
| Rotation Stage 56 mm x 26 mm Threaded ID | Thorlabs | RSP1/M | |
| 52 mm x 52 mm Kinematic Platform Mount | Thorlabs | KM100B/M | |
| Adjustable Prism Clamp | Thorlabs | PM3/M | |
| Beam block - active area 19 mm x 38 mm | Thorlabs | LB1/M | |
| Iris Diaphragm 1 mm to 25 mm Aperture | Thorlabs | ID25/M | |
| Left-Handed Kinematic Cylindrical Lens Mount | Thorlabs | KM100CL | |
| 1" Optic Holder, M4 Tap | Thorlabs | MFF101/M | |
| 1" Stackable Lens Tube | Thorlabs | SM1L03 | |
| Stackable Lens Mount for 1" optic-usable depth ½ | Thorlabs | SM1L05 | |
| Stackable Lens Mount For 1"Optic-usable Depth 2" | Thorlabs | SM1L20 | |
| Small Optical Rails 600mm, metric | Thorlabs | RLA600/M | |
| Small Optical Rails 75mm, metric | Thorlabs | RLA075/M | |
| Small Optical Rails 150mm, metric | Thorlabs | RLA150/M | |
| Rail Carrier, Counterbored Hole 1"x 1" | Thorlabs | RC1 | |
| Rail Carrier, Perpendicular Dovetail | Thorlabs | RC3 | |
| High Precision Translating Lens Mount for 1 inch | Thorlabs | LM1XY/M | |
| ½ " (12mm) Dovetail Translation Stage | Thorlabs | DT12/M | |
| Rail Clamps | Thorlabs | CL6 | |
| Metric XYZ Translation Stage (Includes PT102) | Thorlabs | PT3/M | |
| Black Rubberized Fabric | Thorlabs | BK5 | |
| Ball Driver kit/ 6 tools | Thorlabs | BD-KIT/M | |
| Adapter with External M6 x 1.0 Threads and External M4 x 0.7 Threads | Thorlabs | AP6M4M | |
| Mounting Base, 25 mm x 58 mm x 10 mm, 5 Pack | Thorlabs | BA1S/M-P5 | |
| Lens Mount for 25.4mm optic | Thorlabs | LMR1/M | |
| SM1 FC/APC Adapter | Thorlabs | SM1FCA | |
| Kinematic Mirror Mount For 1 inch Optics | Thorlabs | KM100 | |
| Silicon Power Head, 400-1100nm, 50mW | Thorlabs | S120C | |
| 12.7 mm Post Holders, Spring-Loaded Hex-Locking Thumbscrew, L=50 mm, 5 Pack | Thorlabs | PH50/M-P5 | |
| Post Holder with Spring-Loaded Hex-Locking Thumbscrew, L=20 mm | Thorlabs | PH20/M | |
| 12.7 mm x 50 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR50/M-P5 | |
| 12.7 mm x 75 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole, 5 Pack | Thorlabs | TR75/M-P5 | |
| USB Power and Energy Meter Interface | Thorlabs | PM100USB | |
| 12.7 mm x 30 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR30/M | |
| 12.7 mm x 20 mm Stainless Steel Optical Post, M4 Stud, M6-Tapped Hole | Thorlabs | TR20/M | |
| 750 mm long Structural Rail (detection box) | Thorlabs | XE25L750/M | |
| 350 mm long Structural Rail (detection box) | Thorlabs | XE25L350/M | |
| Quick Corner Cube for 25 mm Rails | Thorlabs | XE25W3 | |
| Right-Angle Bracket for 25 mm Rails | Thorlabs | XE25A90 | |
| Black posterboard 20" x 30" (508 mm x 762 mm), 1/16" (1.6 mm) Thick, 5 Sheets | Thorlabs | TB5 | |
| Hinge for 25 mm Rail Enclosures | Thorlabs | XE25H | |
| Lid Stop for 25 mm Rail Enclosures | Thorlabs | XE25LS | |
| M4 Cap Screw Kit | Thorlabs | HW-KIT1/M | |
| M6 Cap Screw Kit and Hardware kit | Thorlabs | HW-KIT2/M | |
| Table Clamp, L-Shape, 5 Pack | Thorlabs | CL5-P5 | |
| SM1 Ring-Actuated Iris Diaphragm (Ø0.8 - Ø12 mm) | Thorlabs | SM1D12D | |
| Ø1" SM1-Mounted Frosted Glass Alignment Disk w/Ø1 mm Hole | Thorlabs | DG10-1500-H1-MD | |
| Honeycomb Optical Table Top, Standa | Standa | 1HB10-15-12 | |
| Optical Table support, Standa | Standa | 1TS05-12-06-AR | |
| Sample nano-positionning | Precision XYZ Nanopositioning | Physik Instrumente | PI P527-3.CD |
| Digital Multi-Channel Piezo Co, 3 Channels, -30 to 130 V Sub- D Connector(s), Capacitive Sensors, | Physik Instrumente | PI E727-3.CD | |
| Temperature chamber | Zeiss 200M Inverted Microscope Incubator System MATT BLK | Digital Pixel | |
| Dual Channel Microprocessor Temperature Controller | Digital Pixel | DP_MTC_2000_DUO | |
| Two Vibration Free Heater Modules | Digital Pixel | DP_150_VF | |
| PT100 Temperature Sensor | Digital Pixel | DP_P100_TS | |
| Biological Reagents and Materials | |||
| Cell culture and transfection | Cos7 cells | ATCC® | CRL-1651™ |
| 8- well Lab-Tek chambers | Thermo Fisher Scientific | 155411PK | |
| Dulbecco's Modified Eagle Medium (DMEM) | Thermo Fisher Scientific | 11965092 | |
| Fetal bovine serum | Thermo Fisher Scientific | 16000044 | |
| L-glutamine | Thermo Fisher Scientific | 25030081 | |
| PBS buffer | Thermo Fisher Scientific | 14190144 | |
| PenStrep | Thermo Fisher Scientific | 15140122 | |
| PolyJet Transfection Reagent | SignaGen Laboratories | SL100688 | |
| Cholesterol content measurement | Amplex Red Cholesterol Assay Kit | Thermo Fisher Scientific | A12216 |
| Protease Inhibitor Cocktail | Thermo Fisher Scientific | 87786 | |
| Phosphatase Inhibitor Cocktail | Thermo Fisher Scientific | 78420 | |
| ROTI Nanoquant Working Solution | Roth | K880 | |
| GloMax Discover Microplate Reader | Promega | GM3000 | |
| svFCS measurements | HBSS buffer | Thermo Fisher Scientific | 14025092 |
| Hepes buffer | Thermo Fisher Scientific | 15630080 | |
| Cholesterol oxidase | Sigma-Aldrich | C8868 | |
| Rhodamine 6G | Sigma-Aldrich | 83697-1G |
Referenzen
- Engelman, D. M. Membranes are more mosaic than fluid. Nature. 438 (7068), 578-580 (2005).
- Newton, A. C. Regulation of the ABC kinases by phosphorylation: protein kinase C as a paradigm. The Biochemical Journal. 370, 361-371 (2003).
- Marguet, D., Lenne, P. F., Rigneault, H., He, H. T. Dynamics in the plasma membrane: how to combine fluidity and order. The EMBO Journal. 25 (15), 3446-3457 (2006).
- Edidin, M. The state of lipid rafts: From model membranes to cells. Annual Review of Biophysics and Biomolecular Structure. , (2003).
- Lingwood, D., Simons, K. Lipid rafts as a membrane-organizing principle. Science. , (2010).
- He, H. T., Marguet, D. Detecting nanodomains in living cell membrane by fluorescence correlation spectroscopy. Annual Reviews of Physical Chemistry. 62, 417-436 (2011).
- Rossy, J., Ma, Y., Gaus, K. The organisation of the cell membrane: Do proteins rule lipids. Current Opinion in Chemical Biology. 20 (1), 54-59 (2014).
- Nicolson, G. L. The Fluid - Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40 years. Biochimica et Biophysica Acta - Biomembranes. 1838 (6), 1451-1466 (2014).
- Fujiwara, T., Ritchie, K., Murakoshi, H., Jacobson, K., Kusumi, A. Phospholipids undergo hop diffusion in compartmentalized cell membrane. The Journal of Cell Biology. 157 (6), 1071-1081 (2002).
- Kusumi, A., et al. Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annual Review of Biophysics and Biomolecular Structure. 34, 351-378 (2005).
- Destainville, N., Salomé, L. Quantification and correction of systematic errors due to detector time-averaging in single-molecule tracking experiments. Biophysical Journal. 90 (2), 17-19 (2006).
- Wieser, S., Moertelmaier, M., Fuertbauer, E., Stockinger, H., Schütz, G. J. Un)confined diffusion of CD59 in the plasma membrane determined by high-resolution single molecule microscopy. Biophysical Journal. 92 (10), 3719-3728 (2007).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophysical Journal. , (1976).
- Petrášek, Z., Schwille, P. Precise measurement of diffusion coefficients using scanning fluorescence correlation spectroscopy. Biophysical Journal. , (2008).
- Elson, E. L. 40 Years of FCS: How it all began. Methods in Enzymology. , (2013).
- Elson, E. L., Magde, D. Fluorescence correlation spectroscopy. I. Conceptual basis and theory. Biopolymers. , (1974).
- Magde, D., Elson, E. L., Webb, W. W. Fluorescence correlation spectroscopy. II. An experimental realization. Biopolymers. , (1974).
- Schwille, P., Haupts, U., Maiti, S., Webb, W. W. Molecular dynamics in living cells observed by fluorescence correlation spectroscopy with one- and two-photon excitation. Biophysical Journal. , (1999).
- Bouchaud, J. P., Georges, A. Anomalous diffusion in disordered media: Statistical mechanisms, models and physical applications. Physics Reports. , (1990).
- Yechiel, E., Edidin, M. Micrometer-scale domains in fibroblast plasma membranes. Journal of Cell Biology. 105 (2), 755-760 (1987).
- Salomé, L., Cazeils, J. L., Lopez, A., Tocanne, J. F. Characterization of membrane domains by FRAP experiments at variable observation areas. European Biophysics Journal. 27 (4), 391-402 (1998).
- Niv, H., Gutman, O., Kloog, Y., Henis, Y. I. Activated K-Ras and H-Ras display different interactions with saturable nonraft sites at the surface of live cells. The Journal of Cell Biology. 157 (5), 865-872 (2002).
- Wawrezinieck, L., Rigneault, H., Marguet, D., Lenne, P. F. Fluorescence correlation spectroscopy diffusion laws to probe the submicron cell membrane organization. Biophysical Journal. 89 (6), 4029-4042 (2005).
- Saxton, M. J. Fluorescence corralation spectroscopy. Biophysical Journal. , (2005).
- Lenne, P. F., et al. Dynamic molecular confinement in the plasma membrane by microdomains and the cytoskeleton meshwork. EMBO Journal. 25 (14), 3245-3256 (2006).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. , (2015).
- Billaudeau, C., et al. Probing the plasma membrane organization in living cells by spot variation fluorescence correlation spectroscopy. Methods in Enzymology. 519, 277-302 (2013).
- Mailfert, S., Hamon, Y., Bertaux, N., He, H. T., Marguet, D. A user's guide for characterizing plasma membrane subdomains in living cells by spot variation fluorescence correlation spectroscopy. Methods in Cell Biology. 139, 1-22 (2017).
- Rege, T. A., Hagood, J. S. Thy-1, a versatile modulator of signaling affecting cellular adhesion, proliferation, survival, and cytokine/growth factor responses. Biochimica et Biophysica Acta - Molecular Cell Research. , (2006).
- Cahuzac, N., et al. Fas ligand is localized to membrane rafts, where it displays increased cell death-inducing activity. Blood. , (2006).
- Guia, S., et al. Confinement of activating receptors at the plasma membrane controls natural killer cell tolerance. Science Signaling. 4 (167), 21 (2011).
- Blouin, C. M., et al. Glycosylation-dependent IFN-γR partitioning in lipid and actin nanodomains is critical for JAK activation. Cell. 166 (4), 920-934 (2016).
- Chouaki-Benmansour, N., et al. Phosphoinositides regulate the TCR/CD3 complex membrane dynamics and activation. Scientific Reports. , (2018).
- Wawrezinieck, L., Lenne, P. F., Marguet, D., Rigneault, H. Fluorescence correlation spectroscopy to determine diffusion laws: application to live cell membranes. Biophotonics Micro- and Nano-Imaging. , (2004).
- Masuda, A., Ushida, K., Okamoto, T. New fluorescence correlation spectroscopy enabling direct observation of spatiotemporal dependence of diffusion constants as an evidence of anomalous transport in extracellular matrices. Biophysical Journal. , (2005).
- Humpolíčková, J., et al. Probing diffusion laws within cellular membranes by Z-scan fluorescence correlation spectroscopy. Biophysical Journal. , (2006).
- Benda, A., et al. How to determine diffusion coefficients in planar phospholipid systems by confocal fluorescence correlation spectroscopy. Langmuir. , (2003).
- Ganguly, S., Chattopadhyay, A. Cholesterol depletion mimics the effect of cytoskeletal destabilization on membrane dynamics of the serotonin1A receptor: A zFCS study. Biophysical Journal. , (2010).
- Wenger, J., et al. Diffusion analysis within single nanometric apertures reveals the ultrafine cell membrane organization. Biophysical Journal. 92 (3), 913-919 (2007).
- Manzo, C., Van Zanten, T. S., Garcia-Parajo, M. F. Nanoscale fluorescence correlation spectroscopy on intact living cell membranes with NSOM probes. Biophysical Journal. , (2011).
- Regmi, R., et al. Planar optical nanoantennas resolve cholesterol-dependent nanoscale heterogeneities in the plasma membrane of living cells. Nano Letters. , (2017).
- Mueller, V., et al. FCS in STED microscopy: Studying the nanoscale of lipid membrane dynamics. Methods in Enzymology. , (2013).
- Sezgin, E., et al. Measuring nanoscale diffusion dynamics in cellular membranes with super-resolution STED-FCS. Nature Protocols. , (2019).
- Wang, R., et al. A straightforward STED-background corrected fitting model for unbiased STED-FCS analyses. Methods. , (2018).
- Veerapathiran, S., Wohland, T. The imaging FCS diffusion law in the presence of multiple diffusive modes. Methods. , (2018).
- Gupta, A., Phang, I. Y., Wohland, T. To hop or not to hop: exceptions in the FCS diffusion law. Biophysical Journal. , (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten