Method Article
Dissektion von Pelvic Autonomic Ganglia und assoziierten Nerven bei männlichen und weiblichen Ratten
In diesem Artikel
Zusammenfassung
Die wichtigsten Beckenganglien enthalten parasympathische und sympathische Neuronen, die Beckenorgane innervieren. Hier beschreiben wir eine Seziermethode und stellen Schaltpläne zur Identifizierung dieser Ganglien und ihrer damit verbundenen Nerven zur Verfügung. Diese Methoden können auf die experimentelle Manipulation dieser Ganglien in vivo oder Entfernung post-mortem für weitere Studien angewendet werden.
Zusammenfassung
Die bilateralen Hauptbeckenganglien (MPG; Synonym, Beckenganglien) sind die primäre Quelle postganglionischer sympathischer und parasympathischer Neuronen, die Beckenorgane von Nagetieren innervieren; die funktionell gleichwertige Struktur beim Menschen ist der minderwertige hypogastrische Plexus. Die wichtigsten Beckenganglien bieten auch den Weg, über den Lenden- und sakrale sensorische Axone die Beckenorgane erreichen. Diese komplexen, gemischten Ganglien können sich als schwierig erweisen, um weitere experimentelle Untersuchungen normaler autonomer Mechanismen zu identifizieren und zu sezieren oder präklinische Modelle von Krankheiten, Verletzungen oder viszeralen Schmerzen zu etablieren. Hier beschreiben wir ein Protokoll, um auf diese Ganglien und die damit verbundenen Nervenbahnen zuzugreifen und sie zu visualisieren. Wir stellen dieses Protokoll mit Schaltplänen für männliche und weibliche Ratten zur Verfügung, da die Gangliengröße und die Orientierungspunkte zur Identifizierung zwischen den Geschlechtern unterschiedlich sind. Das Protokoll beschreibt die Entfernung des Ganglials für In-vitro-Studien, aber diese Methode kann in ein chirurgisches Rückgewinnungsprotokoll für experimentelle Eingriffe (z. B. Nervenquetschung, Nervenresektion) oder zur Kartierung neuronaler Schaltkreise (z. B. durch Mikroinjektion) integriert werden. neuronalen Tracern). Wir zeigen auch die primären Strukturen des Ganglials und der damit verbundenen Nerven unmittelbar nach der Zerlegung und nach immunohistochemischer Färbung.
Einleitung
Die Ratte ist eine der am besten charakterisierten Arten, die bei der Untersuchung der Beckenorganphysiologie und Anatomie verwendet werden. Zwar gibt es hervorragende Ressourcen für Beschreibungen dieser Organe1,2, sie liefern in der Regel keine Informationen über die zugehörigen neuronalen Strukturen oder tun dies bei unzureichender Auflösung, um eine experimentelle Studie zu leiten. Wie weiter unten beschrieben, unterscheidet sich die Organisation der autonomen Ganglien, die die Beckenorganfunktion regulieren, deutlich vom Rest des autonomen Nervensystems, was es schwierig macht, beckeninnervierende Merkmale aus neuroanatomischen Informationen, die für andere autonome Ganglien verfügbar sind, genau abzuleiten. Dieser Mangel an Ressourcen, um Forscher in diesen Bereich zu führen, könnte die Forschung über die neuronale Regulation von Beckenorganen verlangsamt haben. Hier beschreiben wir Protokolle für den Zugang zu dieser Region des Nervensystems für weitere In-vitro-Studien oder experimentelle Interventionen.
Die bilaterale Hauptbeckenganglien (MPG; Synonyme: Beckenganglien; parazervikale Ganglien [weiblich]; Frankenhäusers Ganglien [weiblich]) sind die primäre Quelle postganglionischer sympathischer und parasympathischer Neuronen, die Beckenorgane von Nagetieren innervierend sind; der minderwertige hypogastrische Plexus umfasst die äquivalente neuronale Struktur beim Menschen3,4,5,6. Sensorische Projektionen von Lenden- und Sakral-Dorsal-Wurzelganglien wandern auch über das MPG, um die Beckenorgane zu erreichen. Daher ist das Verständnis der neuronalen Schaltkreise und Biologie des MPG für präklinische Studien über eine Vielzahl klinischer Bedingungen im Zusammenhang mit der Entwicklung und der Erwachsenenfunktion von Beckenorganen von entscheidender Bedeutung. Mehrere ausgezeichnete Beschreibungen von Nagetier MPG wurden veröffentlicht7,8, aber unsere Erfahrung ist, dass im Allgemeinen diese Beschreibungen nicht immer genügend Anleitung bieten, um praktisch eine experimentelle Zerlegung oder Manipulation dieser Strukturen zu informieren, wenn die Erholung des Tieres erforderlich ist. Darüber hinaus konzentriert sich die Mehrheit der MPG-Studien auf männliche Ratten. Bei weiblichen Ratten sind die MPG kleiner9 und haben unterschiedliche anatomische Landmarken und erfordern daher einen deutlich zugeschnittenen Leitfaden zur Visualisierung und Zerlegung.
Sympathische und parasympathische Bahnen zeichnen sich durch ihre Anatomie aus, insbesondere durch die Lage ihrer präganglionischen Neuronen, mit sympathischen Bahnen mit präganglionischen Neuronen im Thorako-Lumbar-Rückenmark und den parasympathischen präganglionischen Neuronen im Hirnstamm (Kranialnervenprojektionen) und dem sakralen Rückenmark. In den meisten anderen Regionen des autonomen Systems befinden sich ihre Zielganglionneuronen in ausgeprägten sympathischen oder parasympathischen Ganglien. Die MPG sind jedoch ungewöhnlich, wenn sie mit sympathisierend-parasympathische Ganglien sind, und daher sind in makroskopischer Skala Konvergenzstellen von präganglionischen Axonen sowohl von thorako-lenden- als auch von sakralen Wirbelsäulenregionen. Wir haben daher in unsere Protokolle den Ort und die Beschreibung dieser primären Nervenbahnen aufgenommen, die jede Wirbelsäulenregion mit dem MPG verbinden, was die experimentelle Analyse oder separate Manipulation dieser neuronalen Komponenten erleichtert. Wir beachten auch für Leser, die diese Ganglien artübergreifend vergleichen, dass bei Nagetieren die spinalen präganglionischen Neuronen, die "funktionell sakral" sind, z.B. während der Micturition, Defäkation und Peniserektion aktiv sind und erforderlich sind, sich auf den Wirbelsäulenstufen L6-S1 befinden und nicht ausschließlich in den sakralen Segmenten10; ebenso L6 und S1 dorsale Wurzelganglien bieten den wichtigsten "sakralen" sensorischen Input für Beckenorgane. Bei Nagetieren konzentriert sich der sensorische und präganglionische Input aus mehr rostralen neuronalen Schaltkreisen auf die Wirbelsäulenstufen L1 und L210.
Hier beschreiben wir ein Protokoll für den Zugriff auf das MPG und die zugehörigen Nervenbahnen bei männlichen und weiblichen Ratten und unterstützen dies mit Schaltplänen, um bestimmte Landmarken zu veranschaulichen. Dieses Protokoll leitet den chirurgischen Zugang zu diesen Strukturen in einem experimentellen Kontext der Entfernung des Gewebes für In-vitro-Studien, z. B. die Isolierung von MPG-Neuronen für die molekulare Charakterisierung oder Primärkultur. Es kann auch an DIE MPG-Entfernung nach intrakardialer Perfusion mit fixativer Entwicklung angepasst werden, obwohl dies eine schwierigere Dissektion ist, da das neuronale Gewebe schwieriger zu visualisieren wird, wenn die angrenzenden Gewebe frei von Blut sind. Dieses Protokoll kann auch in eine chirurgische Umgebung für experimentelle Intervention dieser Nervenbahnen (z. B. Nervenresektion, Mikroinjektion von neuronalen Tracern) integriert werden. Diese Arten von Dissektionen werden für das wachsende Feld der bioelektronischen Medizin immer wichtiger, wo neue Ziele und Ansätze für die Neuromodulation zur Behandlung klinischer Bedingungen der Beckenviszer entwickelt werden11. Wir präsentieren das komplette Protokoll zuerst für männliche Ratten, dann eine Wiederholung des Protokolls speziell für weibliche Ratten zugeschnitten.
Protokoll
Alle Verfahren sind nach den institutionellen und förderswirtschaftlichen Anforderungen für Tierversuche durchzuführen. Die Verwendung von Tieren für diese Zerlegung und das Protokoll für Sterbehilfe wurden von der Tierethikkommission der Universität Melbourne genehmigt (Protokollnummer 1814639).
HINWEIS: Die hier dargestellten Abschnitte wurden an männlichen und weiblichen Sprague-Dawley-Ratten (Biomedical Sciences Animal Facility, University of Melbourne) mit einem Gewicht von 280 g (weiblich) und 350 g (männlich) durchgeführt. Vor diesen Abschnitten wurden die Ratten in einerCO2-Kammer für 4-5 min eingeschläfert. Unmittelbar nach dem Tod wurden MPG seziert. Wenn Sie Gewebe von einem Tier, das eine transkardiale Perfusion mit Fixierung durchlaufen hat, sezieren, treffen Sie Vorsichtsmaßnahmen, um den Bediener vor der Exposition gegenüber fixativen, d. h. Durchführung der Sezierung in Rauchschrank oder Downdraft-Schrank zu schützen und tragen geeignete persönliche Schutzausrüstung. Ein Protokoll für die transkardiale Perfusion wurde ausführlich veröffentlicht12.
1. Hauptbecken Ganglion und angrenzende Nerven: Zugang und Resektion in einer männlichen Ratte
HINWEIS: Abbildung 1 zeigt anatomische Landmarken für die MPG-Visualisierung bei einer männlichen Ratte.
- Zugang zur Bauchhöhle und zum Becken
- Legen Sie die Ratte in eine Supine-Position und greifen Sie durch einen ventralen Mittellinienschnitt auf den Bauch und das Becken zu, wobei Sie darauf achten, eine Kontamination des Operationsfeldes mit Fell zu vermeiden.
- Bewegen Sie die Bauchorgane vorsichtig zur Seite mit Zangen oder baumwollgekippten Applikatoren. Beachten Sie die Lage der ventralen Lappen der Prostata und der Harnblase.
- Bewegen Sie das Samenbläschen auf die kontralaterale Seite.
- Schneiden Sie die Vas deferens, um einen besseren Zugang zu dem Bereich über dem Ganglion zu bieten.
HINWEIS: Ab diesem Punkt der Zerlegung darf das Gewebe nicht austrocknen; halten Sie das Gewebe feucht mit physiologischer Salzin (für frische Gewebesektion) oder fixativ (für Perfusion-fixiertes Tier). Das Gewebe feucht mit Derinlin zu halten, begünstigt nicht nur die Gewebestruktur, sondern erleichtert auch die Zerlegung, da trockene Nerven zerbrechlicher sind und bei der Handhabung leichter reißen. - Identifizieren Sie den dorsolateralen Lappen der Prostata, auf deren dorsaler Oberfläche die Lage des Gangliens ist; dies wird noch nicht sichtbar sein.
- Um das Ganglion zu visualisieren, entfernen Sie sorgfältig Gewebe in der Nähe und über dem Ganglion. Verwenden Sie ggf. einen Retraktor, um das Sezierfeld frei zu halten.
- Entfernen Sie ein nahe gelegenes Aggregat von Fettgewebe und öffnen Sie die seitliche Faszien des Beckens.
- Zerlegung des MPG und der damit verbundenen Nerven
- Identifizieren Sie die folgenden Orte, die Sehenswürdigkeiten für die nächsten Schritte der Zerlegung bieten: der dorsolaterale Lappen der Prostata (das Ganglion befindet sich auf der Oberfläche dieses Lappens, etwas kaudaler als die Kreuzung zwischen Samenbläschen und Prostata) und die Samenbläschen (wo sie an der Mittellinie konvergieren, zeigt die Ganglienposition auf der rostrocaudalen Achse des Tieres an).
- Wie von diesem Punkt gefordert, entfernen Sie sorgfältig jedes Gewebe, das die vollständige Sicht auf die neuronalen Strukturen behindert, vermeidung von Schäden an der dünnen Kapsel der Prostata oder großen Gefäßen.
- Identifizieren Sie den Beckennerv, indem Sie die folgenden Merkmale und Merkmale visualisieren.
- Finden Sie die innere iliac Vene und seine feine Zweig in Richtung der MPG und die Blase projiziert. Dieser Gefäßzweig verläuft parallel zum Beckennerv und wird manchmal in den Beckennerv eingebettet, dann durchquert er das Ganglien.
- Legen Sie fein gekippte Winkelzangen vorsichtig unter den Beckennerv und schieben Sie die Zange entlang, um sie von umgebendem Gewebe zu befreien.
HINWEIS: Es kann auch möglich sein, den Beckennerv von dem kleinen Gefäß zu isolieren, das parallel dazu verläuft, aber für die meisten Arten von Experimenten ist dies nicht unbedingt erforderlich. Bestätigen Sie, dass die Struktur der Beckennerv ist, indem Sie unter hoher Vergrößerung betrachten, um festzustellen, dass der Nerv mehrere lose aggregierte Faszikel enthält, die leicht unter dem Sezierendes Mikroskop unterschieden werden können und charakteristisch für den Beckenspiegel sind. Nerven, wie keiner der anderen großen Nerven mit dem Ganglion verbunden zeigen diese klare Fasziulation.
- Identifizieren Sie den kavernennerven Nerv, indem Sie die folgenden Sehenswürdigkeiten und Merkmale visualisieren.
- Nachdem Sie dem Beckennerv bis zu seiner Verbindung mit dem Ganglion folgen, folgen Sie dem kavernenen Nerv, während er über die Prostata und dann kauarisch in Richtung der kavernenden Körper des Penis wandert.
- Wenn die Mikroskopvergrößerung es zulässt, beachten Sie, dass aus dem Ganglien zwischen Becken und Kavernennerven eine kleine Gruppe empfindlicher Nerven auftaucht; dies sind die rektalen Nerven, die in den unteren Darm reisen.
- Identifizieren Sie den hypogastrischen Nerv, indem Sie die folgenden Merkmale und Merkmale visualisieren.
- Identifizieren Sie, wo sich der hypogastrische Nerv an seinem Schädelrand anschließt, nachdem er neben dem Harnleiter gefahren ist.
- Bestätigen Sie, dass der hypogastrische Nerv viel dünner ist als der Becken- oder der Höhlennerv und nicht von großen Gefäßen begleitet wird.
- Identifizieren Sie das MPG, indem Sie die folgenden Funktionen visualisieren.
- Visualisieren Sie die ventralen, dorsalen und schädelförmigen Kanten des Ganglions und bilden Sie eine dreieckige Form.
- Bestätigen Sie die Lage der einzelnen hauptigen Nerven: die Beckennerven, die aus dem Rückendesrand des Gangliens hervorgehen, der kavernische Nerv an der kaudalsten Ecke des Ganglions, der hypogastrische Nerv von seiner Schädelkante und die Zubehörnerven, die aus dem Ganglion hervorgehen. ventrale Kante.
- Identifizieren Sie die Zubehörnerven, indem Sie die folgenden Merkmale und Features visualisieren.
- Nach dem Löschen von Gewebe, um die Visualisierung der ventralen Kante des Ganglials zu ermöglichen, identifizieren Sie einen Cluster von Nerven, die in Richtung des Harn- und Fortpflanzungstraktes projizieren.
- Wenn die Mikroskopvergrößerung es zulässt, identifizieren Sie eine kaudale Gruppe von Nerven, die zwischen den Prostatalappen und einer rostralen Gruppe zwischen dem Samenbläschen und der Blase eindringen.
- Entfernung des MPG mit den zugehörigen Nerven
- Schieben Sie vorsichtig Zangen zwischen dem Ganglien und der darunter liegenden Prostata, wobei Sie darauf achten, die dünne Kapsel der Prostata nicht zu durchstechen. Unterbrechen Sie alle Verbindungen zwischen dem Ganglion und der Prostata.
- Löschen Sie alle endgültigen Verbindungen mit umgebenden Geweben für die Für das Experiment erforderlichen Nervenlängen, und schneiden Sie dann jeden Nerv.
- Mit feinen Zangen, bewegen Sie das Ganglien mit seinen Nerven auf die geeignete Lösung für das Experiment und bestätigen, dass jeder der Hauptnerven intakt sind.
2. Großes Beckenganglion und angrenzende Nerven: Zugang und Resektion bei einer weiblichen Ratte
ANMERKUNG: Abbildung 2 zeigt anatomische Kennpunkte für die MPG-Visualisierung bei einer weiblichen Ratte.
- Zugang zur Bauchhöhle und zum Becken
- Legen Sie die Ratte in eine Supine-Position und greifen Sie durch einen ventralen Mittellinienschnitt auf den Bauch und das Becken zu, wobei Sie darauf achten, eine Kontamination des Operationsfeldes mit Fell zu vermeiden.
HINWEIS: Ab diesem Punkt der Zerlegung darf das Gewebe nicht austrocknen; halten Sie das Gewebe feucht mit physiologischer Salzin (für frische Gewebesektion) oder fixativ (für Perfusion-fixiertes Tier). - Bewegen Sie die Bauchorgane vorsichtig zur Seite mit Zangen oder baumwollgekippten Applikatoren. Beachten Sie die Lage des Gebärmutterhorns, der Harnblase und des Rektums.
- Schneiden Sie die Ovarial- und Gebärmuttergefäße und ziehen Sie das Gebärmutterhorn zurück.
- Betreten Sie den peritonealen Raum und räumen Sie sanft ein Aggregat von Fettgewebe in der Nähe des Gebärmutterhalses entfernt.
- Legen Sie die Ratte in eine Supine-Position und greifen Sie durch einen ventralen Mittellinienschnitt auf den Bauch und das Becken zu, wobei Sie darauf achten, eine Kontamination des Operationsfeldes mit Fell zu vermeiden.
- Zerlegung des MPG und der damit verbundenen Nerven
- Identifizieren Sie die seitliche Wand des Gebärmutterhalses, nur kaudal zu seiner Kreuzung mit den Gebärmutterhörnern; diese Region ist der primäre Meilenstein für die Definition des MPG-Standorts auf der rostrocaudalen Achse des Tieres.
- Wie von diesem Punkt gefordert, entfernen Sie sorgfältig jedes Gewebe, das die vollständige Sicht auf die neuronalen Strukturen behindert, um Schäden an wichtigen Gefäßen zu vermeiden.
- Identifizieren Sie den Beckennerv, indem Sie die folgenden Merkmale und Merkmale visualisieren.
- Finden Sie die innere iliac Vene und seine feine Zweig in Richtung der MPG und die Blase projiziert. Dieser Zweig verläuft parallel zum Beckennerv und ist manchmal in den Beckennerv eingebettet und durchquert dann das Ganglien.
- Bestätigen Sie, dass die Struktur der Beckennerv ist, indem Sie unter hoher Vergrößerung betrachten, um festzustellen, dass der Nerv mehrere lose aggregierte Faszikel enthält, die leicht unter dem Sezierendes Mikroskop unterschieden werden können und charakteristisch für den Beckenspiegel sind. Nerven, wie keiner der anderen großen Nerven mit dem Ganglion verbunden zeigen diese klare Fasziulation.
- Identifizieren Sie den hypogastrischen Nerv, indem Sie die folgenden Merkmale und Merkmale visualisieren.
- Identifizieren Sie, wo sich der hypogastrische Nerv an seinem Schädelrand anschließt, nachdem er neben dem Harnleiter gefahren ist.
- Bestätigen Sie, dass der hypogastrische Nerv viel dünner ist als der Becken- oder der Höhlennerv und nicht von großen Gefäßen begleitet wird.
- Identifizieren Sie den kavernennerven Nerv, indem Sie die folgenden Sehenswürdigkeiten und Merkmale visualisieren.
- Nachdem Sie dem Beckennerv bis zur Kreuzung mit dem Ganglion folgen, folgen Sie dem kavernenen Nerv, während er kauarisch entlang der Seitenwand des Gebärmutterhalses in Richtung der Vagina reist.
- Wenn die Mikroskopvergrößerung es zulässt, beachten Sie, dass aus dem Ganglien zwischen Becken und Kavernennerven eine kleine Gruppe empfindlicher Nerven auftaucht; dies sind die rektalen Nerven, die in den unteren Darm reisen.
- Identifizieren Sie die Zubehörnerven, indem Sie die folgenden Merkmale und Features visualisieren.
HINWEIS: Die Zubehörnerven sind schwer zu erkennen, aber projektieren aus dem medialen Aspekt des MPG. Nach dem Löschen von Gewebe, um die Visualisierung der ventralen Kante des Ganglials zu ermöglichen, identifizieren Sie einen Cluster von sehr empfindlichen Nerven, die in Richtung des Harn- und Fortpflanzungstraktes projizieren. - Identifizieren Sie das MPG, indem Sie die folgenden Funktionen visualisieren.
- Visualisieren Sie die ventralen, dorsalen und Schädelkanten des Ganglions, die eine dreieckige Form bilden.
- Bestätigen Sie die Lage der einzelnen hauptigen Nerven: die Beckennerven, die aus dem Rückendesrand des Gangliens hervorgehen, der kavernische Nerv an der kaudalsten Ecke des Ganglions, der hypogastrische Nerv von seiner Schädelkante und die Zubehörnerven, die aus dem Ganglion hervorgehen. ventrale Kante.
- Entfernung des MPG mit den zugehörigen Nerven
- Legen Sie fein gekippte Winkelzangen vorsichtig unter den Beckennerv und schieben Sie die Zange entlang, um sie vom darunter liegenden Gebärmutterhals und dem umgebenden Gewebe zu befreien.
HINWEIS: Es kann auch möglich sein, den Beckennerv von dem kleinen Gefäß zu isolieren, das parallel dazu verläuft, aber für die meisten Arten von Experimenten ist dies nicht unbedingt erforderlich. Wenn Sie die Zerlegung demonstrieren, legen Sie eine Naht unter den Beckennerv, um ihre Visualisierung zu erleichtern. - Wiederholen Sie den Vorgang für den kavernenen Nerv, dann den hypogastrischen Nerv und schließlich die Zubehörnerven.
- Schieben Sie vorsichtig Dies zwischen dem Ganglien und dem darunter liegenden Gebärmutterhals. Unterbrechen Sie alle Verbindungen zwischen dem Ganglien und dem Gebärmutterhals.
- Löschen Sie alle endgültigen Verbindungen mit umgebenden Geweben für die Für das Experiment erforderlichen Nervenlängen, und schneiden Sie dann jeden Nerv.
- Mit feinen Zangen, bewegen Sie das Ganglien mit seinen Nerven auf die geeignete Lösung für das Experiment und bestätigen, dass jeder der Hauptnerven intakt sind.
- Legen Sie fein gekippte Winkelzangen vorsichtig unter den Beckennerv und schieben Sie die Zange entlang, um sie vom darunter liegenden Gebärmutterhals und dem umgebenden Gewebe zu befreien.
3. Bestätigung von Ganglienkomponenten (optional)
- Nach Entfernung des Ganglials Ganglien gangse Ganglion in ein herkömmliches histologisches Fixativ (z.B. 4% gepuffertes Formalin) für mindestens 1 h, fixierend mit 0,1 M Phosphatpuffer und Prozessgewebe für Kryosektion und Fluoreszenzimmunhistochemie auswaschen, wie zuvor beschrieben13.
HINWEIS: Viele hochwertige Antikörper, die diese drei neuronalen Marker spezifisch erkennen, sind im Handel erhältlich. Siehe Tabelle der Werkstoffe für die Reagenzien, die für die Etikettierung verwendet werden, siehe Abbildung 3. - Alternativ, Prozessganglien intakt (Wholemounts) für die Immunhistochemie mit einer ähnlichen Methode wie oben, aber Erhöhung der Inkubationszeiten für die Antikörper auf 4 Tage (primärer Antikörper) und 2 Tage (sekundärer Antikörper).
- Um eine große Population von sensorischen Axonen zu demonstrieren, verwenden Sie Antikörper gegen Calcitonin-Gen-bezogenes Peptid (CGRP).
HINWEIS: Die empfohlene Verdünnung des in dieser Studie verwendeten Antikörpers beträgt 1:5.000. - Um noradrenerge sympathische Neuronen zu demonstrieren, verwenden Sie Antikörper gegen Tyrosinhydroxylase (TH).
HINWEIS: Die empfohlene Verdünnung des in dieser Studie verwendeten Antikörpers beträgt 1:5.000. - Um eine große Population von cholinergen Neuronen zu demonstrieren, verwenden Sie Antikörper gegen neuronale Stickstoffmonoxid-Synthase (NOS).
HINWEIS: Die empfohlene Verdünnung des in dieser Studie verwendeten Antikörpers beträgt 1:500.
Ergebnisse
Eine erfolgreiche Zerlegung wird nicht nur den gesamten Körper des MPG intakt entfernen, sondern auch das erste Segment jedes der noch befestigten Hauptnerven behalten. Diese Nerven sind wertvolle Indikatoren für die Ganglienorientierung in vivo und liefern daher wesentliche Informationen für viele Arten von anatomischen Studien (z. B. Kartierung von Expressionsmustern oder zellulären Veränderungen nach einer experimentellen Störung). Obwohl die Erhaltung der zugehörigen Nerven für einige Versuchstypen von geringerer Bedeutung sein kann (z. B. Gangliendissoziation für die Kultur isolierter Neuronen), bietet das Vorhandensein von Nerven auch eine Möglichkeit, das Ganglien ohne Berührung (und potenziell schädigend) die neuronalen Zellkörper.
Eine erfolglose Sezierung hat ein unvollständiges oder beschädigtes Ganglion oder wenn die primären Nerven nicht mehr befestigt sind. Es ist auch möglich, dass Ganglien oder Nerven unwissentlich während der Zerlegung geschädigt werden, entweder weil der physische Schaden zu subtil ist, um unter dem Sezierendes Mikroskop zu erkennen, oder weil der Schaden nur bei bestimmten Arten von Assays sichtbar wird. Wenn das Gangliengewebe z. B. während der Zerlegung trocken wird, kann das Gewebe bei der späteren Handhabung normal erscheinen, zeigt aber eine hohe unspezifische Fluoreszenz auf der Oberfläche.
Beispiele für seziertes MPG sind in Abbildung 3dargestellt, die Beispiele für das gesamte MPG enthält, das als gesamtdickes vollständiges Ganglion visualisiert ist (Abbildung 3A) und ein MPG, das für die Durchführung der Immunfluoreszenz kryokentiert wurde, um noradrergen und cholinergen Neuronen zu demonstrieren (Abbildung 3B,C).
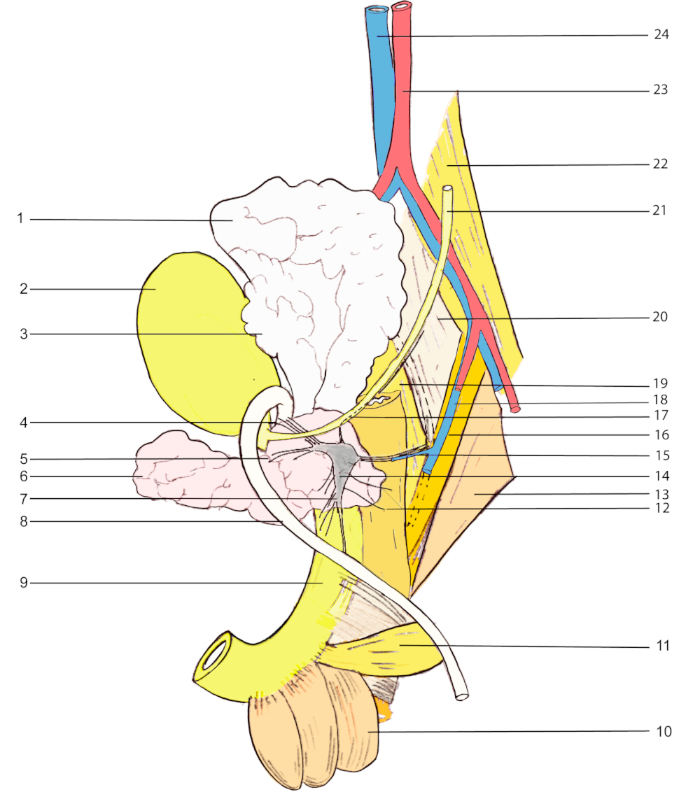
Abbildung 1: Anatomische Meilensteine für die MPG-Visualisierung bei einer männlichen Ratte. 1, Samenbläschen; 2, Harnblase; 3, Gerinnungsdrüse; 4 & 5, Zubehörnerven; 6, Prostata (ventraler Lappen); 7, kavernender Nerv; 8, vas deferens; 9, Harnröhre; 10, bulbocavernosus Muskel; 11, ischiocavernosus Muskel; 12, rektale Nerven; 13, Entführer caudae externus; 14, große Becken Ganglion; 15, Beckennerv; 16, Entführer caudae internus; 17, hypogastrischen Nerv; 18, innere iliac Vene; 19, flexor caudae brevis; 20, flexor caudae longus; 21, Harnleiter; 22, psoas major; 23, Bauchaorta; 24, minderwertige vena cava. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Anatomische Meilensteine für die MPG-Visualisierung bei einer weiblichen Ratte. 1, distaler Dickdarm; 2, Harnblase; 3, Gebärmutterkörper; 4, hypogastrischen Nerv; 5, Zubehör nerven; 6, große Becken Ganglion; 7, kavernender Nerv; 8, Vagina; 9, Harnröhre; 10, Rektum; 11, Entführer caudae externus; 12, rektale Nerven; 13, flexor caudae brevis; 14, Beckennerv; 15, innere iliac Vene; 16, Entführer caudae internus; 17, flexor caudae longus; 18, äußere Iliac Arterie; 19, Harnleiter; 20, psoas major; 21, Gebärmutterhorn; 22, Bauchaorta. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Immunohistochemisch gekennzeichnetes MPG von erwachsenen männlichen Ratten. Alle Präparate wurden mit einem herkömmlichen Weitfeldfluoreszenzmikroskop visualisiert, das mit einer monochromen Kamera ausgestattet und dann digital koloriert wurde. (A) Wholemount (vollständige Dicke), festes MPG mit zugehörigen Nerven, immunhistochemisch für die Sinnesnerven gekennzeichnet, die Calcitonin-Gen-bezogenes Peptid (CGRP) exprimieren; 1, Beckennerv (zeigt die multiplen Faszikel); 2, kavernender Nerv; 3, hypogastrischen Nerv; 4, Zubehör Nerven; 5, rektale Nerven; 6, HauptbeckenGanglion (MPG). (B,C) Kryosections (14 m) des festen MPG, immunohistochemisch gekennzeichnet, um die gemischte noradrenergen-cholinerge Natur des Ganglions zu demonstrieren; (B) noradrenge Neuronen, die durch Antikörper für Tyrosinhydroxylase und (C) eine Hauptpopulation von cholinergen Neuronen durch Antikörper für neuronale Stickstoffmonoxid-Synthase nachgewiesen werden. Die Kalibrierleiste steht für (A) 1.000 m, (B,C) 200 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die neuronale Steuerung der Beckenorgane wird durch komplexe Bahnen vermittelt, einschließlich somatischer, parasympathischer, sympathischer und viszeraler sensorischer Komponenten14,15,16,17. Die meisten dieser Wege stammen aus oder durchlaufen das MPG. Die hier skizzierten Dissektionsprotokolle bieten eine Einführung in die MPG-Anatomie, die damit verbundenen Nerven und nahe gelegene makroskopische anatomische Landmarken; Letztere werden durch anatomische Schaltpläne veranschaulicht. Andere Ansätze zur MPG-Sektion können ebenfalls erfolgreich sein, aber wir finden den hier beschriebenen als robust und für einen Forscher geeignet, der neu in diesem Bereich des Nervensystems ist.
Die kritischsten Aspekte des Protokolls sind die korrekte Identifizierung jedes hauptnervs und die vollständige Entfernung von MPG-Gewebe. Bei sorgfältiger Betrachtung und Handhabung der Gewebe können MPG-Gewebe für anatomische, molekulare und elektrophysiologische In-vitro-Studien18,19,20,21,22entfernt werden. Das Protokoll kann auch für in vivo experimentelle Manipulation23,24,25angepasst werden, wobei darauf hingewiesen werden muss, dass in diesem Fall sehr darauf geachtet werden muss, den Kontakt mit den primären Nerven, die mit dem Ganglion verbunden sind, zu minimieren oder die nahegelegene Vaskulatur zu beschädigen. Wenn das Experiment eine selektive Denervation durch Unterbrechung eines oder mehrerer Nerven erfordert, wird empfohlen, den abgetrennten Nerv zu ligisieren, um Reinnervation und Verwechslungen von Analysen zu verhindern. Dieses Sezierprotokoll könnte auch für die Maus verwendet werden, wo es auch ein MPG mit vergleichbarer Funktion26,27,28gibt.
Für neuroanatomische Studien wird die beste Konservierung von Antigenen und Gewebestruktur durch Sezieren des MPG von einem anästhesierten Tier erreicht, das transkardial mit histologischem Fixativ, das dem Experiment angemessen ist, durchdrungen wurde29; Die Identifizierung der Ganglien- und Nervenstrukturen ist nach diesem Prozess jedoch schwieriger, da die Gewebefärbung verloren geht. Es wird empfohlen, sich bei der Identifizierung und Sezieren des Gangliens von nicht durchsetzten Tieren zu bekennen, bevor sie diese Sezierung nach perfusionieren. Ebenso wird empfohlen, zuerst in der Zerlegung bei Männern kompetent zu werden, weil bei Tieren mit gleichwertigem Alter und Körpergröße die MPG und die damit verbundenen Nerven bei Frauen viel kleiner sind.
Um zu überprüfen, dass das entfernte Gewebe tatsächlich das MPG ist, wird dem Forscher zunächst empfohlen, die Position und die Eigenschaften jedes Primärnervs zu überprüfen. Viele Dissektoren finden den Beckennerv und den Kavernnerv am einfachsten in situ zu identifizieren; die hypogastrischen und Zubehörnerven sind empfindlicher und schwieriger vom umgebenden Gewebe zu unterscheiden. Wenn diese Nerven aufgrund von Problemen während der Zerlegung nicht mehr verfügbar sind, oder wenn es Unsicherheiten in Bezug auf ihre Struktur gibt, wird empfohlen, dass anfängliche MPG-Sektionen durch konventionelle Histologie charakterisiert sind (zur Bestätigung der Anwesenheit von neuronalen Zellkörpern8) und zweitens mit Derhistochemie (um festzustellen, dass sowohl cholinerge als auch noradrenergen Neuronen vorhanden sind30,31) (Abbildung 3). Um die korrekte Identifizierung der Hauptnerven zu validieren, werden die kavernenden Nerven leicht durch ihre hohe Dichte an neuronalen Zellkörpern in ihrem anfangsen Teil in der Nähe des MPG identifiziert; die meisten dieser Neuronen drücken Marker von cholinergen, nitrergen Neuronen32,33. Die Becken-, Hypogast- und Zubehörnerven haben nur sehr wenige neuronale Zellkörper34.
Es gibt mehrere häufige Fallstricke bei der Durchführung dieser Sezierung. Wenn Unerfahrene Probleme haben, einen der hauptigen Nerven oder die MPG zu finden, werden sie ermutigt, zu den Schritten zurückzukehren, die die wichtigsten Meilensteine beschreiben. Es ist sehr üblich, sich so auf die Suche nach den Mikrostrukturen zu konzentrieren, dass man den Überblick über den makroskopischen Kontext verliert. In der Regel bewegen sich unerfahrene Dissektoren entweder zu weit rostral in ihrer Sezierstelle oder bleiben zu "oberflächlich" - d.h. zu nah an der ventralen Öffnung des Bauches, anstatt tiefere (d.h. dorsalere) Strukturen zu untersuchen. Ein häufiges Problem während der Zerlegung ist die Schädigung der Gefäße während der Zerlegung. Wenn die Blutung beginnt, halten Sie vorsichtig einen mit Baumwolle umgaben Applikator über die Quelle, bis die Blutung aufhört, und spülen Sie den Bereich dann großzügig mit Derinlinie, bevor Sie die Dissektion wieder aufnehmen. Es ist möglich, dass das MPG nicht für Experimente verwendet werden kann, wenn es mit zu viel Blut kontaminiert ist oder wenn die Sezieren zu lange verzögert wird, während die Blutung auf ein Ende wartet. Ein weiterer häufiger Sezierfehler ist eine Beschädigung der Kapsel der Prostata, die die MPG-Visualisierung und -Entfernung erheblich beeinträchtigt. Diese Kapsel ist eine sehr empfindliche Struktur, die leicht punktiert werden kann, während das Fett von der Seitenwand der Prostata entfernt wird, auch wenn sie nur einen baumwollgekippten Applikator verwendet. Schließlich sind die Hauptnerven, die mit dem MPG verbunden sind, leicht beschädigt, während des Prozesses der Identifizierung jedes einzelnen und dann während der Entfernung des MPG. Die Sektoren werden ermutigt, eine Routine zu entwickeln, bei der jeder Nerv nacheinander in einer bestimmten Reihenfolge isoliert wird, so dass es weniger Möglichkeiten für Verwirrung während der letzten Schritte der Ganglienentfernung gibt.
Diese Zerlegung zielte nicht darauf ab, jede der Bestandteile der Zubehörnerven zu bestimmten Organen zu verfolgen oder jede der vielen Mikroganglien zu identifizieren, die an verschiedenen Stellen zwischen den Beckenganglien und den Beckenorganen liegen8. Diese sind ziemlich schwierig, in vivo ohne verwendung bestimmter Flecken zu visualisieren; jedoch können sie entfernt werden, indem sie jedem der Nervenbahnen in Richtung der Organe folgen und spezifische neuronale Flecken nach hoc verwenden, um ganglion Position zu bestimmen. Diese Mikroganglien, obwohl sie im Vergleich zum MPG nur einen kleinen Bruchteil der neuronalen Population ausmachen, können spezifische Arten von Input für die Organe liefern, an denen sie sich am nächsten befinden. Wir stellen hier eine Einschränkung auf dem Gebiet fest, dass weder diese Mikroganglien noch viele der kleinen Nervenbahnen, die das MPG verlassen, um zu Beckenorganen zu reisen, aber weitgehend akzeptierte Namen haben. Darüber hinaus wurde eine ähnlich detaillierte Studie mit Mikroganglien noch nicht an weiblichen Ratten durchgeführt.
Zusammenfassend lassen sich sagen, dass die hier bereitgestellten Protokolle und Schaltpläne den Forschern Werkzeuge zur Verfügung stellen, um die primären Strukturen zu untersuchen, die die autonome Nervenversorgung der Beckenorgane bereitstellen, sowie die wichtigsten peripheren Schläuche von Sinnesnerven aus lumbosakralen dorsalen Wurzeln. Ganglien, die über das MPG zu Beckenorganen reisen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die in dieser Veröffentlichung berichteten Forschungsergebnisse wurden vom Office of the Director, National Institutes of Health, Stimulating Peripheral Activity to Relieve Conditions (SPARC) Program, Award Number OT2OD023872, unterstützt. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die offizielle Meinung der National Institutes of Health dar. Dr. Bertrands Stipendium im Labor von Dr. Keast wurde finanziert von: Universitätsspital von Nemes, die Fakultät für Medizin von Montpellier-Némes, Die Vereinigung Franéaise de Chirurgie (AFC), Die Société Interdisciplinaire Francophone d "UroDynamique et de Pelvipérinéologie (SIFUD-PP) und das People-Programm (Marie-Curie-Aktionen) des Siebten Rahmenprogramms der Europäischen Union (RP7/2007-2013) im Rahmen der REA-Zuschussvereinbarung Nr. PCOFUND-GA-2013-609102 im Rahmen des vom Campus koordinierten PRESTIGE-Programms Frankreich.
Materialien
| Name | Company | Catalog Number | Comments |
| Anti-calcitonin gene-related peptide; RRID AB_259091 | Merck | C8198 | |
| Anti-nitric oxide synthase, RRID AB_2533937 | Invitrogen | 61-7000 | |
| Anti-rabbit IgG, Cy3 tag, RRID AB_2307443 | Jackson | 711-165-152 | |
| Anti-tyrosine hydroxylase, RRID AB_390204 | Millipore | AB152 | |
| Dissecting microscope | Olympus | SZ40, SC | |
| Dumont AA epoxy coated forceps | Fine Science Tools | 11210-10 | |
| Dumont #5 forceps | Fine Science Tools | 11255-20 | |
| Dumont #5/45 curved forceps | Fine Science Tools | 11251-35 | |
| LED light source | Schott | KL 1600 | |
| Micro-Adson forceps | Fine Science Tools | 11019-12 | |
| Student Vannas spring scissors | Fine Science Tools | 91500-09 | |
| Surgical scissors | Fine Science Tools | 14054-13 |
Referenzen
- Greene, E. C. . Anatomy of the Rat. , (1935).
- Krinke, G. J. . The Laboratory Rat. , (2000).
- Keast, J. R., McLachlan, E. M. Pelvic ganglia. Autonomic Ganglia. , 445-480 (1995).
- Keast, J. R. Unusual autonomic ganglia: connections, chemistry, and plasticity of pelvic ganglia. International Review of Cytology. 193, 1-69 (1999).
- Alsaid, B., et al. Coexistence of adrenergic and cholinergic nerves in the inferior hypogastric plexus: anatomical and immunohistochemical study with 3D reconstruction in human male fetus. Journal of Anatomy. 214 (5), 645-654 (2009).
- Keast, J. R., Smith-Anttila, C. J., Osborne, P. B. Developing a functional urinary bladder: a neuronal context. Frontiers in Cell and Developmental Biology. 3, 53 (2015).
- Purinton, P. T., Fletcher, T. F., Bradley, W. E. Gross and light microscopic features of the pelvic plexus in the rat. Anatomical Record. 175 (4), 697-705 (1973).
- Arellano, J., Xelhuantzi, N., Mirto, N., Hernández, M. E., Cruz, Y. Neural interrelationships of autonomic ganglia from the pelvic region of male rats. Autonomic Neuroscience. 217, 26-34 (2019).
- Greenwood, D., Coggeshall, R. E., Hulsebosch, C. E. Sexual dimorphism in the numbers of neurons in the pelvic ganglia of adult rats. Brain Research. 340 (1), 160-162 (1985).
- Nadelhaft, I., Booth, A. M. The location and morphology of preganglionic neurons and the distribution of visceral afferents from the rat pelvic nerve: a horseradish peroxidase study. Journal of Comparative Neurology. 226 (2), 238-245 (1984).
- Kessler, T. M., Birder, L. A., Gomery, P. Neuromodulation of urinary tract function. New England Journal of Medicine. 380 (21), 2067-2069 (2019).
- . Intracardiac perfusion with fixative for anatomical studies [keast-001-stage02] Available from: https://www.protocols.io/view/intracardiac-perfusion-with-fixative-for-anatomica-w3ffgjn (2019)
- . Immunohistochemical analysis of ganglion neurons innervating the lower urinary tract [keast-001-stage03] Available from: https://www.protocols.io/view/immunohistochemical-analysis-of-ganglion-neurons-i-w3efgje (2019)
- Fowler, C. J., Griffiths, D., de Groat, W. C. The neural control of micturition. Nature Reviews Neuroscience. 9 (6), 453-466 (2008).
- Keast, J. R., Booth, A., de Groat, W. C. Distribution of neurons in the major pelvic ganglion of the rat which supply the bladder, colon or penis. Cell and Tissue Research. 256 (1), 105-112 (1989).
- Dail, W. G., Minorsky, N. Composition of the pelvic nerve. Experimental Neurology. 92 (1), 278-283 (1986).
- Dail, W. G. The pelvic plexus: innervation of pelvic and extrapelvic visceral tissues. Microscopy Research and Technique. 35 (2), 95-106 (1996).
- Purves-Tyson, T. D., Arshi, M. S., Handelsman, D. J., Cheng, Y., Keast, J. R. Androgen and estrogen receptor-mediated mechanisms of testosterone action in male rat pelvic autonomic ganglia. Neuroscience. 148 (1), 92-104 (2007).
- Nangle, M. R., Keast, J. R. Semaphorin 3A inhibits growth of adult sympathetic and parasympathetic neurones via distinct cyclic nucleotide signalling pathways. British Journal of Pharmacology. 162 (5), 1083-1095 (2011).
- Tan, H., Mawe, G. M., Vizzard, M. A. Electrical properties of neurons in the intact rat major pelvic ganglion. Autonomic Neuroscience. 134 (1-2), 26-37 (2007).
- Park, K. S., et al. An alpha3beta4 subunit combination acts as a major functional nicotinic acetylcholine receptor in male rat pelvic ganglion neurons. Pflügers Archiv - European Journal of Physiology. 452 (6), 775-783 (2006).
- Park, K. S., et al. Modulation of N-type Ca2+ currents by A1-adenosine receptor activation in male rat pelvic ganglion neurons. Journal of Pharmacology and Experimental Therapeutics. 299 (2), 501-508 (2001).
- Payne, S. C., Belleville, P. J., Keast, J. R. Regeneration of sensory but not motor axons following visceral nerve injury. Experimental Neurology. 266, 127-142 (2015).
- Nangle, M. R., Proietto, J., Keast, J. R. Impaired cavernous reinnervation after penile nerve injury in rats with features of the metabolic syndrome. Journal of Sexual Medicine. 6 (11), 3032-3044 (2009).
- Kepper, M. E., Keast, J. R. Specific targeting of ganglion cell sprouts provides an additional mechanism for restoring peripheral motor circuits in pelvic ganglia after spinal nerve damage. Journal of Neuroscience. 18 (19), 7987-7995 (1998).
- Yan, H., Keast, J. R. Neurturin regulates postnatal differentiation of parasympathetic pelvic ganglion neurons, initial axonal projections, and maintenance of terminal fields in male urogenital organs. Journal of Comparative Neurology. 507 (2), 1169-1183 (2008).
- Ritter, K. E., Wang, Z., Vezina, C. M., Bjorling, D. E., Southard-Smith, E. M. Serotonin receptor 5-HT3A affects development of bladder innervation and urinary bladder function. Frontiers in Neuroscience. 11, 690 (2017).
- Tompkins, J. D., Girard, B. M., Vizzard, M. A., Parsons, R. L. VIP and PACAP effects on mouse major pelvic ganglia neurons. Journal of Molecular Neuroscience. 42 (3), 390-396 (2010).
- Forrest, S. L., Payne, S. C., Keast, J. R., Osborne, P. B. Peripheral injury of pelvic visceral sensory nerves alters GFRα (GDNF family receptor alpha) localization in sensory and autonomic pathways of the sacral spinal cord. Frontiers in Neuroanatomy. 9, 43 (2015).
- Keast, J. R., Luckensmeyer, G. B., Schemann, M. All pelvic neurons in male rats contain immunoreactivity for the synthetic enzymes of either noradrenaline or acetylcholine. Neuroscience Letters. 196 (3), 209-212 (1995).
- Keast, J. R., de Groat, W. C. Immunohistochemical characterization of pelvic neurons which project to the bladder, colon, or penis in rats. Journal of Comparative Neurology. 288 (3), 387-400 (1989).
- Dail, W. G., Moll, M. A., Weber, K. Localization of vasoactive intestinal polypeptide in penile erectile tissue and in the major pelvic ganglion of the rat. Neuroscience. 10 (4), 1379-1386 (1983).
- Keast, J. R. A possible neural source of nitric oxide in the rat penis. Neuroscience Letters. 143 (1-2), 69-73 (1992).
- Kepper, M. E., Keast, J. R. Transmitter profile and spinal inputs of pelvic ganglion cells projecting with preganglionic axons along the hypogastric and pelvic nerves of the male rat. Neuroscience Letters. 280 (2), 123-126 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten