Method Article
Dissektion und Lipid Tröpfchen Färbung von Oenocytes in Drosophila Larven
In diesem Artikel
Zusammenfassung
Hier werden detaillierte Methoden zur Zerlegung und Lipidtröpfchenfärbung von Önozyten in Drosophila-Larven mit BODIPY 493/503, einem Lipidtropfen-spezifischen fluoreszierenden Farbstoff, vorgestellt.
Zusammenfassung
Lipide sind wichtig für die Entwicklung der Tiere und physiologische Homöostase. Dysregulation des Fettstoffwechsels führt zu verschiedenen Entwicklungsfehlern und Krankheiten, wie Fettleibigkeit und Fettleber. In der Regel werden Lipide in Lipidtröpfchen gespeichert, die die multifunktionalen Lipidspeicherorganellen in Zellen sind. Lipidtröpfchen variieren in Größe und Anzahl in verschiedenen Geweben und unter verschiedenen Bedingungen. Es wurde berichtet, dass Lipidtröpfchen durch Regulierung seiner Biogenese und Abbau streng kontrolliert werden. Bei Drosophila melanogasterist das Onozyten ein wichtiges Gewebe für den Fettstoffwechsel und wurde vor kurzem als menschliches Leberanalogon in Bezug auf die Lipidmobilisierung als Reaktion auf Stress identifiziert. Die Mechanismen, die der Regulierung des Lipidtröpfchenstoffwechsels in Oenozyten zugrunde liegen, bleiben jedoch schwer fassbar. Um dieses Problem zu lösen, ist es von größter Bedeutung, eine zuverlässige und empfindliche Methode zu entwickeln, um dynamische Veränderungen des Lipidtröpfchens in Oenozyten während der Entwicklung und unter stressigen Bedingungen direkt zu visualisieren. Unter Ausnutzung der lipophilen BODIPY 493/503, einem lipidtropfenspezifischen Fluoreszenzfarbstoff, wird hier ein detailliertes Protokoll für die Zerlegung und anschließende Lipidtröpfchenfärbung in den Önozyten von Drosophila-Larven als Reaktion auf Hunger beschrieben. Dies ermöglicht eine qualitative Analyse der Lipidtröpfchendynamik unter verschiedenen Bedingungen durch konfokale Mikroskopie. Darüber hinaus kann diese schnelle und hochreproduzierbare Methode auch in genetischen Screens zur Indentifizierung neuartiger genetischer Faktoren verwendet werden, die den Fetttropfenstoffwechsel in Oenozyten und anderen Geweben beinhalten.
Einleitung
Lipide sind für das Überleben der Zelle unerlässlich. Neben ihrer traditionellen Rolle als integrale Bestandteile zellulärer Membransysteme spielen Lipide auch entscheidende Funktionen in der Energieversorgung und Signaltransduktion über die Lebenszyklen einzelner Tiere1. Daher muss der Fettstoffwechsel strengen Vorschriften entsprechen, um die physiologische Hämostase in den Zellen aufrechtzuerhalten. Es ist bekannt, dass die Dysregulation des Fettstoffwechsels zu verschiedenen Krankheiten führt, wie Diabetes und Fettleber. Trotz der großen Bedeutung des Fettstoffwechsels für die Tiergesundheit bleiben die Mechanismen, die der Lipidstoffwechselregulation zugrunde liegen, weitgehend unbekannt.
Drosophila wird seit Jahren ausgiebig verwendet, seit Professor Thomas H. Morgan begann, sie in Studien mit Genetik und anderen grundlegenden biologischen Fragen zu verwenden2. In den letzten Jahrzehnten hat sich gezeigt, dass Drosophila ein ausgezeichneter Modellorganismus in der Studie vieler Lipidstoffwechsel-assoziierten Krankheiten ist, wie Fettleibigkeit1,3. Insbesondere teilt Drosophila hochkonservierte stoffwechselgene mit Menschen und besitzt ähnliche relevante Gewebe/Organe und Zelltypen für den Fettstoffwechsel.
Zum Beispiel, der Fettkörper von Drosophila, die für Triacylglycerid Lagerung verantwortlich ist, funktionen analog zum menschlichen Fettgewebe. Kürzlich hat sich gezeigt, dass ein Cluster spezialisierter Hepatozyten-ähnlicher Zellen (d. h. Oenozyten), die nachweislich ein funktionelles Analogon zur menschlichen Leber sind, am Fettsäure- und Kohlenwasserstoffstoffwechsel in Fruchtfliegen beteiligt ist4,5. Ähnlich wie bei Säugetierlebern reagieren Onozyten auf Hunger, indem sie die Lipidtröpfchenbildung sowohl bei Larven als auch bei erwachsenen Drosophilaaktivieren, was zu einer Fetttröpfchenakkumulation in den Önozyten4,6,7,8führt. Anatomisch sind Oenozyten in Clustern von etwa sechs Zellen pro Bauchhalbteil eng an der basalen Innenfläche der lateralen Epidermis befestigt, was es undurchführbar macht, Oenozytencluster von der Epidermis zu isolieren. Daher müssen Oenozyten während der Zerlegung und Färbung an der Epidermis befestigt werden.
Lipide werden in Form von Lipidtröpfchen gelagert, die Organellen mit einschichtigen Membranen in Zellen9sind. Lipidtröpfchen gibt es in fast allen Zelltypen verschiedener Arten10. Lipid-Tröpfchen-Dynamik, einschließlich seiner Größe und Anzahl, ändern sich als Reaktion auf Umweltstressoren. Dies wird als Spiegelbild des metabolischen Zustands als Reaktion auf Stress, wie Alterung und Hunger7,8betrachtet. Daher ist es von großer Bedeutung, eine praktikable und zuverlässige Methode zur qualitativen Bestimmung der Lipidtröpfchendynamik in Oenozyten während der Entwicklung und unter stressigen Bedingungen zu entwickeln. Insbesondere in der dritten Instar-Larven enthalten Oenozyten unter gefütterten Bedingungen nur wenige oder keine nachweisbaren Lipidtröpfchen, aber sie enthalten zahlreiche große Lipidtröpfchen nach Ernährungsentzug4. Um die Wirksamkeit dieser Methode zu überprüfen, Es wird vorgeschlagen, Lipid Tröpfchen Färbung in den Oenozyten unter verhungerten Bedingungen durchzuführen.
Derzeit sind mehrere lipophile Farbstoffe für Lipidtröpfchen färbung verfügbar, wie die nichtfluoreszierenden Farbstoffe Sudan Black und Oil Red O und fluoreszierende Farbstoffe Nile Red und BODIPY 493/50311. Sudan Schwarz und Öl Rot O werden häufig für Gewebe-Cholesterylester und Triacylglycerole verwendet und können leicht durch Lichtmikroskopie erkannt werden. Relativ hohe Hintergrundfärbung und relativ geringe Auflösung sind jedoch zwei einschränkende Faktoren für seine Anwendungen in der qualitativen Analyse der Lipidtröpfchendynamik. Um die Grenzen von nichtfluoreszierenden Farbstoffen zu überwinden, werden Nile Red und BODIPY 493/503 als ideale Ersatzstoffe für Lipidtröpfchenfärbung eingesetzt. Es wurde berichtet, dass Nile Red auch einige unesterifizierte Cholesterin erkennen kann, was BODIPY 493/503 zu einem spezifischeren Farbstoff für zelluläre Lipidtröpfchen macht, bis zu einem gewissen Grad12,13,14.
Um vor allem den Bedarf an einer schnellen und sensiblen Analyse von Lipidtröpfchen in Oenozyten zu erfüllen, stellt dieses Protokoll eine praktikable und hochreproduzierbare Methode der fixativen Lipidtröpfchen-spezifischen Färbung mit BODIPY 493/503 als Fleckenfarbstoff dar. In diesem Bericht werden Oenozyten seziert, und BODIPY 493/503 wird für Lipidtröpfchenfärbung in den Oenozyten verwendet, bei denen Lipidtröpfchen durch konfokale Mikroskopie nachgewiesen werden. Die Leichtigkeit und Erschwinglichkeit dieses Verfahrens machen es ideal für Modifikationen und den weiteren Einsatz in anderen Anwendungen, wie z. B. Durchflusszytometrie.
Protokoll
1. Eilegen
- Bereiten Sie die Standard-Maismehl-Lebensmittel für die Eiablage vor.
HINWEIS: Das Rezept- und Kochverfahren für Standard-Maismehl-Lebensmittel, die hier verwendet werden, finden Sie in den zuvor veröffentlichten Details15. - Bereiten Sie frische Hefepaste vor, indem Sie 6 ml destilliertes Wasser zu 4 g aktiver getrockneter Hefe in einem 50 ml Zentrifugalrohr hinzufügen. Verwenden Sie einen Spachtel, um zu mischen und eine Paste zu machen.
- Eierlegende Flaschen machen, indem Sie das Maismehl-Essen in die Flaschen füllen und ca. 1 g Hefepaste mit einem Spachtel auf die Oberfläche des Maismehlfutters verteilen.
- Legen Sie die Fliegen der gewünschten Genotypen in eine Eierlegende Flasche und legen Sie sie in einen Inkubator mit einer konstanten Temperatur von 25 °C und einer Luftfeuchtigkeit von 60%.
HINWEIS: Ideale Kreuze bestehen in der Regel aus 150 Jungfliegen und mindestens 75 Männchen. Fliegen im Dunkeln zu halten, indem man eine lichtdichte Box über die EierlegendenFlaschen legt, erhöht die Reproduktionsrate. - Vor der Ei-Sammlung lassen Sie Fliegen Eier für 1 h legen, um die Entfernung aller alten Eier zu ermöglichen, die in den weiblichen Eileitern gelagert bleiben.
- Lassen Sie Fliegen Eier in eine neue Eierlegende Flasche für 1 h legen und die Erwachsenen aus der Flasche entfernen.
HINWEIS: Kontrollieren Sie die Eiablagezeit, um den Entwicklungsbereich zu minimieren, um Larven in einem genau kontrollierten Entwicklungsstadium zu erhalten. - Lassen Sie die Eier für 84 h zu den dritten Instar-Larven im Inkubator bei 25 °C mit einem 12 h/12 h Licht/Dunkel-Zyklus entwickeln.
2. Hungerbehandlung für die Larven
HINWEIS: Wie bereits erwähnt, gibt es in der dritten Insternlarven unter normalen Fütterungsbedingungen nur wenige oder keine nachweisbaren Lipidtröpfchen in den Önozyten, aber zahlreiche große Lipidtröpfchen können in den Önozyten unter Stressbedingungen wie Hunger induziert werden. Um diese Methode weiter zu verifizieren, ist es notwendig, diese Larven zu prezipieren, um Lipidtröpfchenbiogenese in Oenozyten zu induzieren. Hier wurde ein Hungerzeitverlauf von 12 h, 24 h und 36 h als Paradigma gewählt. Insbesondere reicht eine kurze Hungerperiode (z.B. 3 h) aus, um nachweisbare Lipidtröpfchen in Oenozyten zu induzieren. Die Hungerdauer kann je nach bestimmten experimentellen Zielen und Einstellungen variieren.
- Machen Sie Kammern für Hunger- und Kontrollbehandlungen.
- Für Hungerbehandlungskammern: Legen Sie ein Filterpapier der entsprechenden Größe in eine 6 cm Petrischale und Pipette 1 ml PBS auf das Filterpapier.
- Zur Kontrolle Behandlungskammern: Legen Sie 5 ml Bloomington Standard Maismehl-Lebensmittel in die Petrischale.
- Verwenden Sie einen Spachtel, um die obere Schicht von Lebensmitteln, die Larven enthalten, die noch in der Nahrung graben, sanft auszugraben und sie in eine Petrischale zu geben, die mit 5 ml PBS gefüllt ist. Rühren Sie die Larven in PBS vorsichtig um, um jegliche Lebensmittelkontamination von den Larven zu entfernen und sie so sauber wie möglich zu machen.
- Verwenden Sie einen kleinen Pinsel, um 40 Drittel inStar Larven der gleichen ungefähren Größe zu sammeln. Sortieren Sie sie nach dem Zufallsprinzip in eine Hunger- oder Kontrollkammer mit jeweils 20 Larven.
- Legen Sie die Kammern im Inkubator bei 25 °C bei 60% Luftfeuchtigkeit und ermöglichen Die Entwicklung für 12 h, 24 h und 36 h Behandlung.
HINWEIS: Für die Larven in der Hungerkammer 1 ml PBS alle 12 h hinzufügen, um Larvenaustaustrocknung zu vermeiden.
3. Zerlegung von Oenocytes
- Verwenden Sie einen kleinen Pinsel, um Larven des entsprechenden Alters (12 h, 24 h oder 36 h nach der Behandlung) zu pflücken, dann in eine neue Petrischale mit 5 ml eiskaltem PBS zum Waschen zu übertragen.
HINWEIS: Wiederholen Sie Schritt 2.2, wenn Sie mit Larven in einer Kontrollkammer umgehen, um jegliche Lebensmittelkontamination zu entfernen. - Füllen Sie eine Sezierplatte mit eiskaltem PBS und tragen Sie Zangen, um Larven sanft in die Sezierplatte zu übertragen. Legen Sie die Sezierplatte für den folgenden Sezierschritt unter ein Stereomikroskop.
HINWEIS: Die eiskalte Temperatur wird helfen, die Bewegungen der Larven zu verlangsamen und die Zerlegung zu erleichtern. - Drehen Sie die Larven ventrale Seite nach oben und dorsale Seite nach unten und halten Sie sanft an Ort und Stelle mit Zangen. Sichern Sie die Larven an der Sezierplatte, indem Sie einen Sezierstift durch den Rachen am vorderen Ende und einen weiteren Stift durch das Spirakel am hinteren Ende platzieren.
HINWEIS: Die dorsale Seite ist am leichtesten durch das Vorhandensein der dorsalen Stämme der Luftröhre zu erkennen. - Verwenden Sie Vannas Federschere, um (längs) durch die Epidermis vom vorderen bis zum hinteren Ende zu schneiden.
- Entfernen Sie das innere Gewebe der Epidermis mit Zangen.
HINWEIS: Beim Entfernen der Trachealzweige ist Vorsicht geboten, um Schäden an den Oenozyten zu vermeiden, die in der inneren Oberfläche der Epidermis lokalisiert sind. - Mit Zangen die Sezierstifte abrufen und die Epidermis in ein 1,5 ml Mikrozentrifugenrohr übertragen, das mit PBS auf Eis gefüllt ist.
- Weitere Sezieren Sie andere Larven nach dem oben beschriebenen Verfahren.
4. Lipid Droplet Färbung
- Inkubieren Sie die sezierte Epidermis im Fixationspuffer für 30 min bei Raumtemperatur (RT) auf einem Rotator.
HINWEIS: Der Fixationspuffer enthält 4% Paraformaldehyd (PFA) in PBS. - Entfernen Sie den Fixierungspuffer, gefolgt von einer schnellen Wäsche. Um eine schnelle Wäsche durchzuführen, fügen Sie 1 ml PBS bei RT nach dem Entfernen von PFA in das Rohr, setzen Sie das Gewebe vorsichtig wieder auf und entsorgen Sie das PBS.
ACHTUNG: Der Fixierungspuffer enthält PFA, das für die menschliche Gesundheit schädlich ist. Es ist wichtig, den Fixierungspuffer ordnungsgemäß als Sondermüll zu entsorgen. - Waschen Sie die Proben 3x für jeweils 5 min mit PBS, um alle möglichen PFA-Rückstände auszuwaschen.
- Inkubieren Sie die Epidermis mit BODIPY 493/503 (1 g/ml; siehe Materialtabelle) 30 min bei RT auf einem Rotator.
HINWEIS: Wickeln Sie ab diesem Schritt das Mikrozentrifugenrohr mit einem Stück Aluminiumfolie, um Proben vor Licht zu schützen und die mögliche Photobleichung zu minimieren. - Entfernen Sie die Beinenlösung BODIPY 493/503 und waschen Sie die Proben jeweils 3x für 10 min mit PBS, um Restfarbstoffe vollständig zu entfernen.
5. Montage und Bildgebung
- Legen Sie 6 l Montagemedium auf einem sauberen Mikroskopschlitten.
HINWEIS: Das Montagemedium wird für eine längere Erkennungszeit basierend auf seinen Antifade-Eigenschaften verwendet. - Verwenden Sie Zangen, um eine Epidermis aufzunehmen und vorsichtig die Rest-PBS mit einem Wisch zu entfernen.
- Legen Sie die Epidermis in das Montagemedium und passen Sie ihre Ausrichtung so an, dass sich die innere Oberfläche, die die Oenozyten enthält, auf der Unterseite und ihre Außenfläche auf der Oberseite befindet.
- Legen Sie vorsichtig einen Deckelrutsch auf die Epidermis.
HINWEIS: Entfernen Sie ggf. ein zusätzliches Montagemedium, das unter dem Deckelauslauf austritt, mit einem Wisch. Um die Bildgebung zu erleichtern, drücken Sie vorsichtig mit Zangen auf den Deckelnach unten, sodass der Oenozytencluster bei der Beobachtung des Dias durch das Mikroskop einfach in einer einzigen Ebene abgebildet werden kann. Alternativ ist es praktikabel, die Epidermis durch die Mittellinie in zwei Halbepidermis zu schneiden, um ein Aufrollen der gesamten Epidermis bei der Montage der Gewebe zu vermeiden. - Tragen Sie klaren Nagellack um die Ränder des Deckels auf, um zu versiegeln.
- Legen Sie die Dias in eine lichtdichte Musterbox und lassen Sie den Nagellack bei RT trocknen, was 5-10 min dauern kann.
- Fahren Sie mit der mikroskopischen Analyse fort. Nehmen Sie Bilder mit einem konfokalen Mikroskop auf (Vergrößerung von 63x mit optimierten GFP- oder FITC-Filtereinstellungen, Anregung = 488 nm, Emission = 503 nm), um saubere und empfindliche Signale mit minimiertem Hintergrund zu erfassen.
Ergebnisse
Die erfolgreiche Durchführung dieses Verfahrens sollte zu einer klaren Lipidtröpfchenfärbung führen, die die Anzahl und Größe der Lipidtröpfchen in den Oenozyten offenbart. Abbildung 1A,A',A'' zeigt, dass es in den Oenozyten normaler Fütterungslarven in verschiedenen Entwicklungsstadien nur wenige nachweisbare Lipidtröpfchen (grüne Punkte) gibt. Abbildung 1B,B',B'' zeigt erhöhte Lipidtröpfchen (grüne Punkte) in den Oenozyten als Reaktion auf 12 h (B), 24 h (B') und 36 h (B'') Hungerperioden. Es sollte beachtet werden, dass nach 96 h die gefütterten Larven (A) eine gewisse Lipidtröpfchenakkumung in den Oenozyten zu zeigen schienen, die möglicherweise auf ihre schnellen Wachstumsraten zurückzuführen waren. Forscher sollten beim Umgang mit den Larven in dieser Phase mehr Aufmerksamkeit schenken.
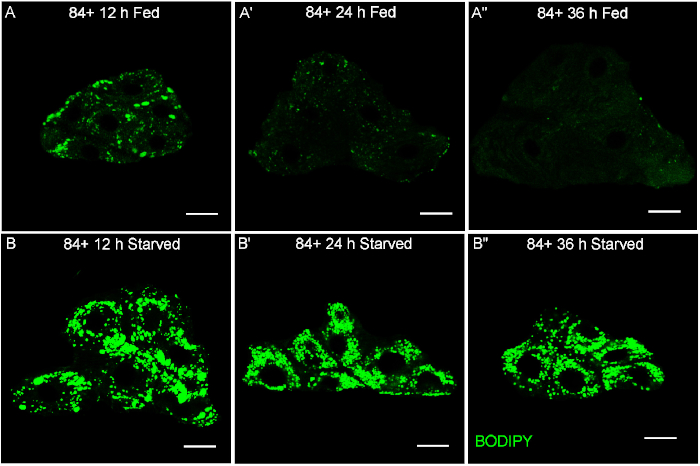
Abbildung 1: Repräsentative Bilder der Lipidtröpfchenfärbung. Bilder werden im Laufe der Entwicklung und des Hungers in den Önozyten der Drosophila Larven mit BODIPY 493/503 gezeigt. (A,A',A'') Lipid-Tröpfchenfärbung (grüne Punkte) von repräsentativen Bildern von Oenocytes Cluster in gefütterten Larven. (B,B',B'') Lipidtröpfchenfärbung (grüne Punkte) in repräsentativen Bildern von Oenocytes-Clustern nach 12 h (B), 24 h (B') und 36 h (B'') Hungerperioden, beginnend mit Larven im Alter von 84 h. Alle Bilder wurden in der gleichen Vergrößerung aufgenommen. Maßstabsleiste = 20 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Unter den oben beschriebenen gibt es mehrere kritische Schritte in diesem Protokoll, wobei der Zeitraum der Eiablage einer davon ist. Als Lipid-mobilisierendes Gewebe ist die Onozyten hochempfindlich gegenüber dem Ernährungsstatus6,8. Längere Eislegerzeiten können zu krähigen Larven und einem verstärkten Lebensmittelwettbewerb führen, was zu ungenauen Ergebnissen führen kann. Die in diesem Protokoll verwendete 1 h Eilegezeit erlaubt es den Larven, sich ohne Ernährungswettbewerb zu entwickeln. Eine viel größere Anzahl von Larven, die aus längeren Legehennenzeiten resultieren können, kann sich auch auf die Lipidtröpfchenmengen und -muster (z. B. Größe, Anzahl und Morphologie) in Oenozyten auswirken.
Darüber hinaus führt längere Eislegerzeit auch zu einer Larvenpopulation mit einer großen Variation der Entwicklungsstadien. In diesem Zusammenhang sollten Forscher vorsichtig sein, wenn sie Mutanten verwenden, die die embryonale oder Larvenentwicklung beeinflussen, da ihr Einfluss auf Lipidtröpfchenmuster durch sekundäre Auswirkungen von Entwicklungsfehlern beeinflusst werden kann. Das Zeitverlaufsverfahren legt nahe, dass Lipidtröpfchen in den gefütterten Onozyten während der Entwicklung von frühen dritten Insternlarven (84 h) bis zum späten dritten Instarlarven (120 h) selten nachweisbar sind. Darüber hinaus sind Larvenönozyten im Gegensatz zur Bernsteinpigmentierung von Oenozyten bei Erwachsenen farblos5. Daher sollte bei der Oenozytensektion erhöhte Aufmerksamkeit geschenkt werden, um mögliche Schäden an Oenozyten zu vermeiden, insbesondere beim Entfernen der umgebenden Gewebe (d. h. Trachealzweige). Darüber hinaus sind Lipidtröpfchen einschichtige Membranorganellen, die empfindlich auf Reinigungsmittel wie Triton X-1009reagieren. Daher ist es wichtig, sicherzustellen, dass die in diesem Protokoll verwendeten Puffer keine Detergenzien enthalten.
Wie oben erwähnt, Gibt es mehrere Farbstoffe verwendet, um die Lipid Tröpfchen Menge und Musteränderungen in Drosophila und anderen Arten zu bestimmen. Unter diesen kann BODIPY 493/503 für Lipidtropfen-spezifische Färbung im Vergleich zu anderen fluoreszierenden (z. B. Nilrot) oder nicht fluoreszierenden Farbstoffen (z. B. Oil Red O) am besten geeignet sein; obwohl, mehr neue und fortgeschrittene Farbstoffe entwickelt werden. Zum Beispiel, LipidSpot 488 und seine Derivate sind eine Reihe von neu entwickelten fluoreszierenden Farbstoffen mit minimaler Hintergrundfärbung von Zellmembranen und anderen Organellen. Sie ermöglichen eine schnelle Färbung von Lipidtröpfchen in lebenden und festen Zellen, ohne Waschschritterforderlich 16,17. Eine Einschränkung dieses Lipidtröpfchen-Färbeprotokolls ist, dass es nicht optimal für die quantitative Messung von Fettreserven in Zellen ist, obwohl es gut für die qualitative Bewertung von Lipidtröpfchengröße, -zahl und -morphologie funktioniert.
Zusätzlich zu den Lipidtröpfchenfärbung in Oenozyten, Kann diese Methode auch auf andere Gewebe in Larven (d.h. Muskel, Fettkörper, und Darmgewebe) mit geringfügigen Modifikationen während der Gewebesektion und Schnitt7angewendet werden. Darüber hinaus funktioniert diese Methode auch gut für Lipid Tröpfchen Färbung von erwachsenen Geweben7. Eine modifizierte Version dieser Methode kann in Kombination mit immunhistochemischen Färbungen mit Antikörpern auf breitere Anwendungen ausgedehnt werden. In diesem Fall sollten feste Gewebe mit Saponin (0,1% für 30 min bei RT) anstelle von herkömmlichen Reinigungsmitteln durchdrungen werden, bevor es mit Antikörpern inkubiert wird, was das Überqueren von Antikörpern über Plasmamembranen und die Aufrechterhaltung der Integrität der Lipidtröpfchenmembran8erleichtert.
Zusammenfassend bietet dieses Protokoll eine praktikable Methode für Forscher, um zu untersuchen, ob bestimmte genetische oder Umweltmanipulationen qualitative Veränderungen der Lipidtröpfchenmengen und -muster (d. h. Größe, Anzahl und Morphologie) verursachen, ohne dass schwierige Betriebsabläufe und teure Ausrüstung und Materialien.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde durch Stipendien der National Natural Science Foundation of China (31671422, 31529004 und 31601112), das 111 Project (D18010), das Local Innovative and Research Teams Project of Guangdong Perl River Talents Program (2017BT01S155) und das China Postdoctoral Science Foundation (2018M640767).
Materialien
| Name | Company | Catalog Number | Comments |
| 50 mL centrifuge tube | Corning | 430829 | 50 mL |
| 6 cm Petri dish | Thermo Fisher | 150326 | 6 cm |
| Agar | For fly food | ||
| Aluminum foil | N/A | N/A | Protect smaple from light |
| BODIPY 493/503 | Invitrogen | D3922 | Lipid droplet staining dye |
| Confocal microscope | Leica | Leica TSC SP5 | Confocal imaging |
| Corn syrup | For fly food | ||
| Cornmeal | For fly food | ||
| Coverslip | Citoglas | 10212424C | 20 × 20 mm, 0.13-0.17 thick |
| Dissection pin | N/A | N/A | |
| Dissection plate | N/A | N/A | |
| Filter paper | N/A | N/A | Diameter: 11 cm |
| Fixation buffer | N/A | N/A | 4% Paraformaldehyde (PFA) in 1x PBS |
| Forcep | Dumont | 11252-30 | #5 |
| Incubator | Jiangnan | SPX-380 | For fly culture |
| Microcentrifuge tube | Axygen | MCT-150-C | 1.5 mL |
| Microscopy slide | Citoglas | 10127105P-G | |
| Mounting medium | VECTASHIELDAntifade Mounting Medium | H-1000 | Antifade mounting medium |
| Nail polish | PanEra | AAPR419 | Seal the coverslip |
| Paintbrush | N/A | N/A | |
| PBS | N/A | N/A | 1x PBS (137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4,1.8 mM KH2PO4, pH 7.4) |
| Rotator | Kylin-Bell Lab Instruments | WH-986 | |
| Scissor | Smartdata Medical | SR81 | Vannas spring scissor |
| Soy flour | For fly food | ||
| Spatula | N/A | N/A | |
| Standard cornmeal food | N/A | N/A | Accoding to Bloomington standard cornmeal food recipe |
| Stereo microscope | Leica | Leica S6E | For tissue dissection |
| Wipe paper | N/A | N/A | |
| Yeast | For fly food | ||
| yw | Kept as lab stock | N/A | Drosophila |
Referenzen
- Liu, Z., Huang, X. Lipid metabolism in Drosophila: development and disease. Acta Biochimica et Biophysica Sinica (Shanghai). 45 (1), 44-50 (2013).
- Cheng, Y., Chen, D. Fruit fly research in China. Journal of Genetics and Genomics. 45 (11), 583-592 (2018).
- Warr, C. G., Shaw, K. H., Azim, A., Piper, M. D. W., Parsons, L. M. Using mouse and Drosophila models to investigate the mechanistic links between diet, obesity, type II diabetes, and cancer. International Journal of Molecular Science. 19 (12), (2018).
- Gutierrez, E., Wiggins, D., Fielding, B., Gould, A. P. Specialized hepatocyte-like cells regulate Drosophila lipid metabolism. Nature. 445 (7125), 275-280 (2007).
- Makki, R., Cinnamon, E., Gould, A. P. The development and functions of oenocytes. Annual Review of Entomology. 59, 405-425 (2014).
- Chatterjee, D., et al. Control of metabolic adaptation to fasting by dILP6-induced insulin signaling in Drosophila oenocytes. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 17959-17964 (2014).
- Yan, Y., et al. HDAC6 suppresses age-dependent ectopic fat accumulation by maintaining the proteostasis of PLIN2 in Drosophila. Developmental Cell. 43 (1), 99-111 (2017).
- Yan, Y., et al. HDAC6 regulates lipid droplet turnover in response to nutrient deprivation via p62-mediated selective autophagy. Journal of Genetics and Genomics. 46 (4), 221-229 (2019).
- Farese, R. V., Walther, T. C. Lipid droplets finally get a little R-E-S-P-E-C-T. Cell. 139 (5), 855-860 (2009).
- Murphy, D. J. The dynamic roles of intracellular lipid droplets: from archaea to mammals. Protoplasma. 249 (3), 541-585 (2012).
- Tennessen, J. M., Barry, W. E., Cox, J., Thummel, C. S. Methods for studying metabolism in Drosophila. Methods. 68 (1), 105-115 (2014).
- Fowler, S. D., Greenspan, P. Application of Nile red, a fluorescent hydrophobic probe, for the detection of neutral lipid deposits in tissue sections: comparison with oil red O. Journal of Histochemistry & Cytochemistry. 33 (8), 833-836 (1985).
- Gocze, P. M., Freeman, D. A. Factors underlying the variability of lipid droplet fluorescence in MA-10 Leydig tumor cells. Cytometry. 17 (2), 151-158 (1994).
- Fam, T. K., Klymchenko, A. S., Collot, M. Recent advances in fluorescent probes for lipid droplets. Materials (Basel). 11 (9), (2018).
- BDSC Standard Cornmeal Medium. Bloomington Drosophila Stock Center Available from: https://bdsc.indiana.edu/information/recipes/bloomfood.html (2019)
- Milon, A., et al. Do estrogens regulate lipid status in testicular steroidogenic Leydig cell?. Acta Histochemica. 121 (5), 611-618 (2019).
- Farmer, B. C., Kluemper, J., Johnson, L. A. Apolipoprotein E4 alters astrocyte fatty acid metabolism and lipid droplet formation. Cells. 8 (2), (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten