Method Article
Probenvorbereitung für Probe Elektrospray-Ionen-Massenspektrometrie
In diesem Artikel
Zusammenfassung
In diesem Artikel werden Beispielvorbereitungsmethoden für eine einzigartige Echtzeitanalysemethode auf der Grundlage der Umgebungsmassenspektrometrie vorgestellt. Mit dieser Methode können wir die biologischen Moleküle in vivo in echtzeit ohne spezielle Vorbehandlungen analysieren.
Zusammenfassung
Die Massenspektrometrie (MS) ist ein leistungsfähiges Werkzeug in der analytischen Chemie, da es sehr genaue Informationen über Moleküle liefert, wie Z. B. Massen-Zu-Ladungs-Verhältnisse (m/z), die nützlich sind, um Molekulargewichte und -strukturen abzuleiten. Obwohl es sich im Wesentlichen um eine destruktive Analysemethode handelt, haben uns die jüngsten Fortschritte in der Umgebungsionisationstechnik ermöglicht, Daten zu erfassen, während wir Gewebe in einem relativ intakten Zustand in Bezug auf Integrität zurücklassen. Die Probeelektrospray-Ionisation (PESI) ist eine sogenannte direkte Methode, da sie keine komplexe und zeitaufwändige Vorbehandlung von Proben erfordert. Eine feine Nadel dient als Probenpflücker sowie als Ionisationsemitter. Basierend auf der sehr scharfen und feinen Eigenschaft der Sondenspitze ist die Zerstörung der Proben minimal, so dass wir die molekularen Echtzeitinformationen aus Lebewesen vor Ort erfassen können. Hierin stellen wir drei Anwendungen der PESI-MS-Technik vor, die für die biomedizinische Forschung und Entwicklung nützlich sein werden. Zum einen geht es um die Anwendung auf Festgewebe, die die grundlegende Anwendung dieser Technik für die medizinische Diagnose ist. Da diese Technik erfordert nur 10 mg der Probe, Es kann sehr nützlich in der Routine klinischen Einstellungen sein. Die zweite Anwendung betrifft die in vitro medizinische Diagnostik, bei der menschliches Blutserum gemessen wird. Die Fähigkeit, Flüssigkeitsproben zu messen, ist auch in verschiedenen biologischen Experimenten wertvoll, bei denen ein ausreichendes Probenvolumen für herkömmliche Analysetechniken nicht vorgesehen werden kann. Die dritte Anwendung neigt zur direkten Anwendung von Sondennadeln bei lebenden Tieren, wo wir Echtzeit-Dynamik von Metaboliten oder Medikamenten in bestimmten Organen erhalten können. In jeder Anwendung können wir die Moleküle ableiten, die von MS nachgewiesen wurden, oder künstliche Intelligenz verwenden, um eine medizinische Diagnose zu erhalten.
Einleitung
Massenspektrometrie (MS) ist eine technologische Erkenntnis des Reduktionismus; es reduziert das Analyseobjekt auf eine Einheit, die auf der Grundlage molekularer Arten oder Kaskaden interpretiert werden kann. Daher ist es eine repräsentative Methode der analytischen Chemie. Es besteht aus vier Prozessen: Ionisierung, Analyse, Detektion und spektrale Erfassung. Da die Ionisierung des Moleküls der erste Prozess in der Massenspektrometrie ist, schränkt es in der Regel die Form der zu verarbeitenden Analyten ein. Die meisten Ionisationsverfahren erfordern die Zerstörung der Struktur, Morphologie und echtzeitbiologischen Prozesse von organischen Proben. Beispielsweise erfordert die Elektrospray-Ionisation (ESI) MS, dass sich die Proben für eine effiziente Ionisierung in einem flüssigen Zustand befinden1. Proben müssen daher eine komplexe biochemische Zubereitung durchlaufen, die die Zusammensetzung von Molekülen verändert. Während die matrixgestützte Laserdesorptionsionisierung (MALDI) MS molekulare Karten von dünnem Schnittgeweberekonstruieren kann,istdieIonisationseffizienz zu gering, um alle Moleküle in den Proben zu erkennen, und es ist besonders schlecht bei der Analyse von Fettsäuren. Unter Berücksichtigung dieser Einschränkungen kann die Sondenelektrospray-Ionisation (PESI)4 verwendet werden, um die Echtzeit-Änderungen in biologischen Systemen in situ zu beobachten, ohne die strukturelle Integrität zu zerstören5, während sich der beobachtete biologische Organismus technisch in einem lebendigen Zustand befindet. In diesem Fall wird eine sehr feine Nadel verwendet, die gleichzeitig als Probenpflücker und Ionenemitter dient. Dies bedeutet, dass die komplexen Probenvorbehandlungssequenzen umgangen werden können, um Massenspektren zu erhalten, die die molekularen Komponenten des lebenden Systems in situ widerspiegeln.
Es gibt mehrere andere Ionisationsmethoden, die PESI-MS Konkurrenz machen. Eine davon ist die schnelle Verdunstungsionisationsmassenspektrometrie (REIMS)6. Diese Technik funktioniert gut während der Operation, weil sie mit einem elektrischen Messer montiert wird und die Ionenfahne sammelt, die während des Schnittes erzeugt wird. Während REIMS sehr nützlich für die Operation ist, ist es im Wesentlichen eine destruktive Methode, die die elektrische Ablation des Gewebes erfordert. Daher ist es nicht nützlich für die detaillierte Analyse von Zellen und Geweben in einer präparativen Probe oder in Laboranalysen. Darüber hinaus, weil es eine große Menge an Pflaumen sammelt, die Gewebeablagerungen enthalten, erfordert es eine lange Wartung der Geräte nach jedem Gebrauch, wodurch die Verwendung dieser Maschine auf spezielle chirurgische Verfahren beschränkt wird. Eine ähnliche Methode, die laserdesorptionionistionionization mass spectrometry (LDI-MS)7genannt wird, ist eine andere Technik, die nicht invasiv und nützlich für die Oberflächenanalyse ist. Da diese Technik gut beim Scannen der Oberfläche einer Probe ist, erreicht sie eine umfassende zweidimensionale Analyse wie die MALDI-Bildmassenspektrometrie8,9. Da LDI-MS jedoch nur auf die Oberflächenanalyse anwendbar ist, ist PESI-MS vorteilhaft für die Analyse der Proben z.B. innerhalb des Gewebes. Eine andere Technik, der MasSpec Pen10, wurde berichtet, um eine hohe Spezifität und Empfindlichkeit bei der Diagnose von Schilddrüsenkrebs zu erreichen, aber der Durchmesser der Sonde ist in der Größenordnung von mm und es ist spezifisch für die Oberflächenanalyse, was bedeutet, dass es nicht erkennen kann, kleine Knötchen von Krebs oder tief lokalisierte Läsionen. Da bei dieser Methode ein im Sondenstift eingebetteter Mikrokapillar-Durchflusskanal verwendet wird, muss die Kreuzkontamination, ähnlich wie Beil-MS, berücksichtigt werden. Es gibt andere Techniken, die auf klinische Umgebungen angewendet wurden, wie die Durchflusssonde und die Ionisationsform Tupfer11, aber sie sind nicht weit verbreitet.
PESI ist die extreme Miniaturisierung von ESI, wobei die Kapillare des Nanoelektrosprays auf einer festen Nadel mit einem Spitzenkrümmungsradius von mehreren hundert nm konvergiert. Die Ionisation erfolgt im extrem eingeschränkten Bereich der Nadelspitze durch Bildung eines Taylor-Kegels, auf dem Proben verbleiben, bis die Ionisierung der gesamten Flüssigkeit auf der Spitze abgeschlossen ist12. Bleibt der Analyt an der Spitze der Metallnadel, wird an der Schnittstelle zwischen metallener Nadel und den Analyten kontinuierlich eine Überladung erzeugt. Daher erfolgt die sequentielle Ionisierung von Molekülen in Abhängigkeit von ihrer Oberflächenaktivität. Diese Eigenschaft macht die Nadelspitze zu einer Art Chromatogramm, das die Analyten je nach Oberflächenaktivität trennt. Technisch gesehen kommen Moleküle mit der stärkeren Oberflächenaktivität an die Oberfläche des Taylor-Kegels und werden früher ionisiert als Moleküle mit schwächerer Oberflächenaktivität, die bis zum Ende des Ionisationsprozesses an der Oberfläche der Nadel haften. So wird eine vollständige Ionisierung aller Moleküle erreicht, die von der Nadel aufgenommen werden13. Da diese Technik nicht die Zugabe von überflüssigem Lösungsmittel in die Probe beinhaltet, reichen mehrere hundert Femtoliter aus, um Massenspektren stark genug für weitere Analysen zu erhalten14. Diese Eigenschaften sind vorteilhaft für die Analyse intakter biologischer Proben. Ein großer Nachteil von PESI-MS liegt jedoch in der Diskontinuität bei der Ionisierung aufgrund der Hubbewegung der Nadel entlang der vertikalen Achse, ähnlich einer Sägemaschine. Die Ionisierung findet nur statt, wenn die Spitze der Sonde den höchsten Punkt erreicht, wenn die Höhe der Ionenöffnung an der horizontalen Achse ausgerichtet ist. Die Ionisierung hört auf, während die Nadel Proben aufnimmt, und so ist die Stabilität der Ionisierung nicht gleich der des konventionellen ESI. Daher ist PESI-MS keine ideale Methode für Proteomik.
Bislang wurde PESI-MS hauptsächlich auf die Analyse biologischer Systeme angewandt, die ein breites Spektrum von Bereichen von der Grundlagenforschung bis hin zu klinischen Umgebungen abdecken. Zum Beispiel konnte die direkte Analyse des menschlichen Gewebes, das während der Operation vorbereitet wurde, die Ansammlung von Triacylglycerol sowohl bei Nierenzellkarzinom15 als auch bei Pharyngeal-Plattenkarzinom16aufdecken. Diese Methode kann auch flüssige Proben messen, wie Blut, um sich auf das Lipidprofil zu konzentrieren. Zum Beispiel wurden einige Moleküle während der Ernährungsumstellung bei Kaninchen abgegrenzt; Es wurde berichtet, dass einige dieser Moleküle in sehr frühen Stadien der Experimente abnahmen, was auf die hohe Empfindlichkeit und Nützlichkeit dieses Systems für die klinische Diagnose17hindeutet. Darüber hinaus ermöglichte die direkte Anwendung auf ein lebendes Tier den Nachweis biochemischer Veränderungen der Leber nach nur einer Fastennacht5. Zaitsu et al.18 besuchten dieses Experiment5 und analysierten die Stoffwechselprofile der Leber fast auf die gleiche Weise, mit Ergebnissen, die die Stabilität und Reproduzierbarkeit unserer ursprünglichen Methode verstärkten. Darüber hinaus konnten wir das Krebsgewebe aus der umgebenden nicht-kanzerösen Leber bei Mäusen mit dieser Technik unterscheiden19. Daher ist dies eine vielseitige Massenspektrometrie-Technik, die in verschiedenen Umgebungen nützlich ist, sowohl in vivo als auch in vitro. Aus einem anderen Blickwinkel kann das PESI-Modul durch Einstellen der Montagebefestigung für verschiedene Massenspektrometer geeignet werden. In diesem kurzen Artikel stellen wir die Grundlagen und Beispiele von Anwendungen vor (Abbildung 1), einschließlich Anwendungen mit lebenden Tieren5.
Gemäß den Vorschriften und Gesetzen in jedem Land müssen Teile dieses Protokolls überarbeitet werden, um die Kriterien der einzelnen Institutionen zu erfüllen. Die Anwendung auf den lebenden Organismus ist die interessanteste und herausforderndste, weil es biochemische oder metabolische Veränderungen in Geweben oder Organen bei lebenden Tieren in situ liefern kann. Während dieser Antrag vom institutionellen Ausschuss für Tierpflege an der Universität Yamanashi genehmigt wurde, wird 20135eine weitere Genehmigungsrunde notwendig sein, da die Vorschriften für die Tierversuche kürzlich geändert wurden. Daher sind mehrere Änderungen des Versuchsschemas ratsam. In Bezug auf die in Experimenten gewonnenen Massenspektren gibt es unter Berücksichtigung der Schwankungen der Massenspektren zwischen den einzelnen Messungen kein System für den Austausch spektraler Informationen, das der Nukleotid-Sequenzierungsgemeinschaft gemeinsam ist. Beim Umgang des Bedieners mit der Nadel ist vorsichtshalber, um Nadelstiche zu vermeiden, insbesondere beim Entfernen der Nadel aus dem Nadelhalter. Ein spezielles Gerät zum Lösen der Nadel ist sehr nützlich für diesen Zweck. Da es sich bei dem Fach des PESI-Moduls um eine luftdichte, geschlossene Kammer handelt, kommt es nicht zu Leckagen der Ionenfahne, wenn das Massenspektrometer gemäß den Anweisungen betrieben wird.
Protokoll
Der institutionelle Ausschuss für Tierpflege an der Universität Yamanashi genehmigte alle hier genannten Protokolle und die Verwendung von Versuchstieren. Die Verwendung menschlicher Proben wurde von der institutionellen Ethikkommission der Universität Yamanashi genehmigt.
1. Feststoffpräparation
HINWEIS: Proben müssen nach ihrer Entfernung aus dem tierischen oder menschlichen Körper auf Eis gehalten werden, um die Frische des Gewebes zu erhalten. Wenn die Messungen nicht sofort der Zerlegung folgen, wird empfohlen, Gewebe bei -80 °C zu lagern. Es ist nicht ratsam, das Gewebe in irgendeiner Art von Puffer oder Saline zu platzieren, weil sie bestimmte Inhalte aus dem Gewebe extrahieren können. Gewebe, das mit Aldehyden fixiert oder in Paraffin/Wachs oder Kryogel eingebettet wurde, ist für MS-Messungen nicht geeignet.
- Schneiden Sie die Gewebeprobe mit einem Skalpell oder Messer auf ca. 2 x 2 x 2 mm. Alternativ können Sie die Probe mit einem Trepan (ein Einweg-Biopsie-Punch, Bohrungsgröße 3 mm) für die Hautuntersuchung ausstechen. Trimmen Sie in diesem Fall die Länge der Säule auf 2 mm.
HINWEIS: Jedes Gewebe kann mit dieser Methode analysiert werden. In diesem Experiment wurden Leber15 und Niere19erfolgreich analysiert, um Massenspektren zu erhalten. Im Allgemeinen geben parenchymale Organe gute Massenspektren, während solche, die faserige Komponenten haben, dies nicht tun. - Wenn das Gewebe mit Blut kontaminiert ist, kurz mit eiskalter Phosphat-gepufferter Saline waschen.
HINWEIS: Um die postmortalen Gewebeschäden zu minimieren, führen Sie diesen Schritt so schnell wie möglich bei Raumtemperatur durch. Wenn die Messungen nicht sofort durchgeführt werden, fangen Sie das Gewebe in flüssigem Stickstoff ein und lagern Sie es bei -80 °C. - Die geschnittene oder ausgestanzte Probe (ca. 10 mg) in ein Kunststoff-Mikrorohr geben und 100 l 50% Ethanol hinzufügen.
HINWEIS: Das genaue Gewicht der Proben wird nicht bestimmt, da die in diesem System verwendete Massenspektrometrie keine quantitativen Daten liefert. Ungefähr 10 mg ist optimal für das parenchymale Gewebe. - Homogenisieren Sie die Probe mit einem Mikroschädling.
- Legen Sie 10 l des Homogenats in den Brunnen der Patrone(Abbildung 2).
- Legen Sie die Patrone in die Ionisationskammer des Massenspektrometers und installieren Sie die Nadelsonde aus Edelstahl, die für die Probenionisierung verwendet wird (Abbildung 2).
HINWEIS: Sondennadeln werden vom Hersteller geliefert. Sie sind aus Edelstahl gefertigt und haben einen Krümmungsradius von ca. 400 nm. - Schließen Sie den Kammerdeckel fest, um die Sicherheitsvorrichtung automatisch zu aktivieren.
- Starten Sie den Bordcomputer, indem Sie auf das Symbol Start klicken, um dies zu analysieren. Wenden Sie mit hilfe der Bildschirmpanels eine Spannung von 2,3 kV auf die Nadel an, um das Elektrospray zu erzeugen und sicherzustellen, dass die Nadelfrequenz 3 Hz beträgt.
- Warten Sie 30 s, bis die Messung abgeschlossen ist.
HINWEIS: Die Sitzung wird automatisch beendet, wenn die Datenerfassung abgeschlossen ist. Die Qualität der Analyse wird durch ein Gesamtionenchromatogramm (TIC) überwacht. Die Messzeit wird definiert, um die repräsentativen Massenspektren zu erhalten und kann verkürzt oder verlängert werden. - Entsorgen Sie die Patrone und die Nadel nach der Messung jeder Probe in einem Biogefährdungs-Entsorger.
HINWEIS: Es kann jeweils nur eine Probe gemessen werden. Es ist nicht notwendig, die Maschine vor jeder Messung zu kalibrieren; Die Kalibrierung hängt von der regelmäßigen Kontrolle durch den Lieferanten einmal alle sechs Monate ab. - Analysieren Sie die Massenspektren und exportieren Sie die Massenspektraltextdaten mithilfe der Software, die dem Massenspektrometer zugeordnet ist (siehe Materialtabelle), wie in den schritten unten angegeben (Abbildung 3).
- Klicken Sie auf die LCD-Datei im Browserfenster der Datendatei der Software.
- Wählen und klicken Sie auf eine einzelne Spitze im Massenspektrumfenster und stellen Sie automatisch ein extrahiertes Ionenchromatogramm (EIC) dar.
- Überprüfen Sie das TIC und EIC und klicken Sie auf das Symbol für das durchschnittliche Spektrum, um das Bereichsfenster für die Erzeugung des Massenspektrums auszuwählen.
ANMERKUNG: In dieser Analyse erscheinen die Zielmoleküle im Massen-Zu-Lade-Verhältnis (m/z)(Abbildung 3). Da die Dauer der Ionisation pro einzelnen Nadelstich sehr kurz ist, sind alle erhaltenen Massenspektren im Wesentlichen gemittelte Spektren über 10 s (300 Scans). - Generieren Sie eine Textdatei mit m/z- und Ionenintensität, indem Sie zur weiteren Analyse auf die Registerkarte Exportieren klicken. Diese Textdatei kann in jedem Ordner gespeichert werden.
HINWEIS: Alle RNA-Konservierungsstoffe wirken sich auf das native Spektralmuster von Proben aus. Darüber hinaus ist es ratsam, Gewebe ohne Flüssigkeit (z. B. phosphatgepufferte Kochsaline) zu handhaben und zu lagern, um die Ausscheidung molekularer Komponenten aus dem Gewebe in die Flüssigkeit während der Lagerung zu verhindern. Im Idealfall werden frische oder frisch gefrorene Proben ohne Jegliche Behandlung verwendet.
2. Körperflüssigkeiten (Serum) Vorbereitung
HINWEIS: Dieses ganze Verfahren ist fast identisch mit dem, das für Festgewebe verwendet wird. Die Patrone für die Flüssigkeitsprobe ist beim Hersteller erhältlich. Da die Kontamination durch rote Blutkörperchen (RBCs) die Effizienz der spektralen Erfassung der beabsichtigten Komponente (Plasma oder Serum) stark verringern kann, sollten Sie alle RBCs durch Zentrifugieren vor Messungen eliminieren.
- Nehmen Sie 10 l der Serumprobe und geben Sie sie in ein 1,5 ml Mikrorohr.
HINWEIS: Sowohl frisches als auch gespeichertes Serum kann verwendet werden. - Fügen Sie dem 1,5 ml-Rohr 190 l 50 % Ethanol hinzu, dann wirbeln Sie 2 min bei Raumtemperatur.
- Zentrifugieren Sie die Flüssigkeit bei 15.000 x g für 1-5 min bei 4 °C.
- Übertragen Sie 10 L Überstand in den Brunnen der Patrone.
- Legen Sie die Patrone in die Ionisationskammer der Maschine und installieren Sie die Edelstahl-Nadelsonde, die für die Probenionisierung verwendet wird (Abbildung 2).
- Schließen Sie den Kammerdeckel fest, um die Sicherheitsvorrichtung automatisch zu aktivieren.
- Starten Sie den Bordcomputer, indem Sie auf das Startsymbol klicken, um zu ionisieren.
- Entsorgen Sie die Probenpatrone und die Nadel, wie in 1.10 beschrieben, sobald die Messungen durchgeführt wurden.
- Analysieren Sie die erhaltenen EIC-Sätze, wie unten angegeben (Abbildung 3).
- Öffnen Sie die LCD-Datei im Datenbrowser.
- Klicken Sie auf eine einzelne Spitze, um das TIC und EIC anzuzeigen.
- Wählen Sie das Bereichsfenster zum Generieren von Massenspektren mithilfe des Symbols für das mittlere Spektrum aus.
- Exportieren Sie die generierte Datei, die sowohl die m/z- als auch die Ionenintensität eines entsprechenden Peaks enthält, indem Sie auf die Registerkarte Export auf dem Monitor klicken.
HINWEIS: Dieses Verfahren kann auch auf Speichel, Urin und andere Körperflüssigkeiten angewendet werden.
3. Vorbereitung auf in vivo PESI-MS in lebenden Organismen
HINWEIS: In diesem Abschnitt wird eine Anwendung zur Überwachung des metabolischen Profils von 5-Fluor-2'-Deoxyuridin (5-FdU) in einem lebenden Mausmodell eingeführt. Verwenden Sie aseptische Bedingungen durchgängig.
- 100 l von 100 mM 5-FdU-Lösung in die Schwanzvene einer 2 Monate alten Maus (ca. 20 g Gewicht) einfließen.
HINWEIS: Es gibt keine Präferenz für Geschlecht, Alter oder Maus-Stamm. Während dieses Protokoll zum Zeitpunkt der Durchführung des Experiments5genehmigt wurde, hängt die Durchführbarkeit dieses Experiments von den ethischen Beschränkungen des Landes ab, in dem es durchgeführt wird. - Anästhesisieren Sie die Maus nach Ihrem genehmigten Tierpflegeprotokoll. Beurteilen Sie die Tiefe der Anästhesie durch die fehlende Reaktion auf Schwanzkneifen.
HINWEIS: Wenn die Verwendung von Natriumpentobarbital von der Ethikkommission für Tierversuche nicht gestattet ist, können alternative Methoden wie Ketaminhydrochlorid verwendet werden. - Rasieren Sie die Bauchhöhle mit einem elektrischen Rasiermesser und wenden Sie Tierarzt Salbe auf die Augen.
- Setzen Sie die anästhesierte Maus in eine Supine-Position und fixieren Sie die Pfoten auf der Kunststoffplatte mit Mending Tape. Schrubben Sie die chirurgische Stelle mit Peelings von 70% Alkohol dreimal.
- Die Bauchhöhle mit einer Schere aufschneiden. Schneiden Sie zunächst die Haut seitlich (10 mm) von knapp über der Membran. Seitlich schneiden Sie den Muskel der Bauchkörperwand und Peritoneum (ca. 7 mm) und halten Sie die Wunde mit Edelstahldraht offen, um die Leberoberfläche freizulegen.
HINWEIS: Es besteht keine Notwendigkeit, die Oberfläche der Leber zu durchdringen. - Tragen Sie die Spitze der Sondennadel auf die Leberoberfläche auf. Stellen Sie die Nadeltiefe auf ca. 0,5 mm tiefe Position ein, um die Ionisierungseffizienz zu optimieren und das TIC- und Spektralmuster gleichzeitig zu überprüfen. Stellen Sie die Hochspannung auf 2,3 kV und die Frequenz auf 3 Hz auf dem Bildschirm des Bedienfelds ein.
- Entfernen Sie das Tier von der Kunststoffplatte.
- Besinnen Sie die Wunde mit einer chirurgischen Darmnaht und bringen Sie die Maus in den Käfig zurück. Lassen Sie die Maus nicht unbeaufsichtigt, bis sie das Bewusstsein wiedererlangt hat, um die Brustbesinnung aufrechtzuerhalten. Geben Sie die Maus nicht an die Gesellschaft anderer Tiere zurück, bis sie vollständig erholt ist.
- Führen Sie den Zeitlichen Kurs der Ionenintensität in EIC und das Verfahren der EIC-Darstellung wie in 1.11.1 bis 1.11.4 durch.
Ergebnisse
Wie in Abbildung 3dargestellt, sind die durch PESI-MS-Technik erhaltenen Daten die Massenspektren, deren m/z-Bereich in diesem System zwischen 10 und 1.200 liegt. Während man Moleküle bis zu m/z 2.000 erkennen kann, gab es mit dieser Technik nur wenige Spitzen über den Massenbereich von m/z 1.200. Daher haben wir Spitzen wertet von m/z 10 bis 1.200. Es gab auffällige Spitzengruppen um m/z 800 und 900; Erstere stellen Zellmembrankomponenten wie Phosphatidylcholin (PC) und letztere für Triacylglycerin (TAG) dar. Abbildung 4 zeigt die Massenspektren einer normalen menschlichen Niere und eines Nierenzellkarzinoms (RCC). Die Massenspektren wurden mit der im Protokoll 1 erläuterten direkten Gewebemethode gewonnen. Da der klare Zelltyp RCC TAG im Zytoplasma ansammelt, ist eine Gruppe von Spektren um m/z 900 sehr ausgeprägt. Das Ergebnis in Abbildung 4 wurde durch die in Abbildung 1 für feste Proben eingeführte Extraktionsmethode ermittelt.
Da sich der Fettstoffwechsel des hepatozellulären Karzinoms während des Krankheitsverlaufs20ändert, ist es möglich, die Stadien der Krankheit durch routinemäßige Biopsie in Kombination mit PESI-MS zu überwachen. Das Ergebnis in Abbildung 5 zeigt die Unterschiede im Spektralmuster zwischen normalem Lebergewebe und HCC. Insbesondere gibt es mehrere bemerkenswerte Spektren der TAG in HCC. Wenn die Auflösung des Massenspektrometers überlegen ist, ist es möglich, dass die molekulare Anmerkung jedes Spektrums die Aufklärung des molekularen Mechanismus von Krebs sowie der normalen zellulären Physiologie ermöglicht.
Die Echtzeitüberwachung des Arzneimittelstoffwechsels kann mit PESI durchgeführt werden. In unseren Experimenten wurde die Pharmakodynamik des Anti-Onkotiker-Mittels 5-FdU über 10 s überwacht, nachdem sie durch die Schwanzvene einer Maus injiziert worden war. Sehr schnelle Erkennung von Spektren wurde nur wenige Sekunden nach der Injektion des Medikaments beobachtet (Abbildung 6), was den schnellen Transport des Medikaments über den Blutkreislauf in die Leber impliziert. Die Intensität der Natriumaddukte von 5-FdU schwand mit einem kurzen Defekt des Ionensignals in der Aufzeichnung bei etwa 6-7 s nach Beginn der Messung. Dies war aufgrund der unterschiedlichen Tiefe der PESI-Nadel im Leberparenchym, die das Ergebnis von Körperbewegungen der anästhesierten Maus war. Daher ist darauf zu achten, dass die Tiefe der PESI-Nadel für die Echtzeitmessung lebender Tiere angepasst wird. Es gibt keinen empfohlenen Weg, um die optimale Tiefe der Nadel zu finden, aber es wird mit der Praxis offensichtlich.
Blutproben von drei Personen wurden von PESI-MS analysiert. In diesem Fall wurden 10 l Serum mit 190 l 50% Ethanol gemischt und dann für die PESI-MS-Analyse verwendet. Während die spektralen Gesamtmuster mehrere gemeinsame Spitzen zu teilen scheinen (Abbildung 7), gibt es viele winzige Unterschiede in den Spektren dieser drei Personen. Sie sind ein Fingerabdruck jeder Person in Bezug auf metabolische Aktivitäten. Für detaillierte Informationen über molekulare Identitäten ist es notwendig, eine High-End-Maschine zu verwenden. Das in den Experimenten verwendete Massenspektrometer lieferte keine ausreichende Auflösung, um die Moleküle zu identifizieren.
Bei kontaminationserweiser Kontamination durch Polymerverbindungen führen die ursprünglichen Spektren in Abbildung 4 zu überlagerten periodischen und auffälligen Spitzen, die die Spektren aus der ursprünglichen Probe verwischen (Abbildung 8). Um dies experimentell zu demonstrieren, haben wir Polypropylenglycerintriol (PPGT) zu 2,5% hinzugefügt, um einen Kontaminationsfall zu reproduzieren. Fast alle spezifischen Spektren, die in Abbildung 8 zu sehen sind, wurden durch die Hinzufügung von PPGT maskiert.

Abbildung 1: Schematische Übersicht über einen Probenvorbereitungsfluss. Für Proben eignet sich eine spezielle Probenpatrone ideal für eine stabile Datenerfassung. Die Analyse von Flüssigproben ist die einfachste Möglichkeit, PESI-MS durchzuführen, indem die Lösung einfach in die Patrone eingebracht wird. Es gibt zwei Methoden, um diese Methode auf Festgewebe anzuwenden. Die direkte Anwendung von PESI auf das Gewebe ist sehr einfach und schnell, während die Extraktionsmethode eine viel stabilere Erfassung von Spektren in Abhängigkeit von der Probenart ermöglicht. Bei diesem Verfahren wird ein kleines Stück der Gewebeprobe in ein Mikrorohr mit 100 l 50% Ethanol gelegt und mit einem Mikroschädling homogenisiert. 10 l des resultierenden Homogenats werden dann für die Massenspektrometrie verwendet. Bei der Analyse eines lebenden Tieres werden 30 l 50 % Ethanol auf die serosale Oberfläche des Zielorgans gelegt, gefolgt von der Messung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Übersicht und grundlegende Komponenten von PESI-MS. Ein Massenspektrometer mit einem PESI-Modul. Der Ionisationsteil wird in einer geschlossenen Kammer installiert, in der der Ioneneinlass, der Nadelhalter und der Probenhalter platziert sind. Die Nadel ist fertig, und die Einweg-Edelstahlnadel wird am Nadelhalter befestigt. Es wird im Massenspektrometer direkt nach dem Platzieren der Probenpatrone in der Kammer eingestellt. Der durchschnittliche Krümmungswinkel der Nadel beträgt 400 nm. Die Patrone zum Platzieren der Probe ist Einweg und besteht aus Kunststoffpolymeren. Es hat einen kleinen Brunnen für die Platzierung der flüssigen Probe (roter Pfeil). Nach dem Einlegen der festen Probe in den Brunnen wird die Kassette gefaltet, um die Probe zu kneifen und den Brunnen zu versiegeln. Für eine flüssige Probenpatrone wird eine andere verwendet, die kein Falten erfordert, und dies ist eine empfohlene Version, die festen Proben überlegen ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Grafische Benutzeroberfläche (GUI) für PESI-MS. Alle Verfahren zur Erzeugung von Massenspektren aus dem gesamten Ionenchromatogramm (TIC) können mit der zugehörigen Software durchgeführt werden. Nach dem Öffnen der LCD-Datei im Datenbrowser kann das TIC angezeigt und der Zeitbereich für die Erzeugung von Massenspektren ausgewählt werden. Die erzeugten Massenspektren können als Textdaten exportiert werden, die sowohl das Massen-Zu-Ladungs-Verhältnis (m/z) als auch die Ionenintensität enthalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
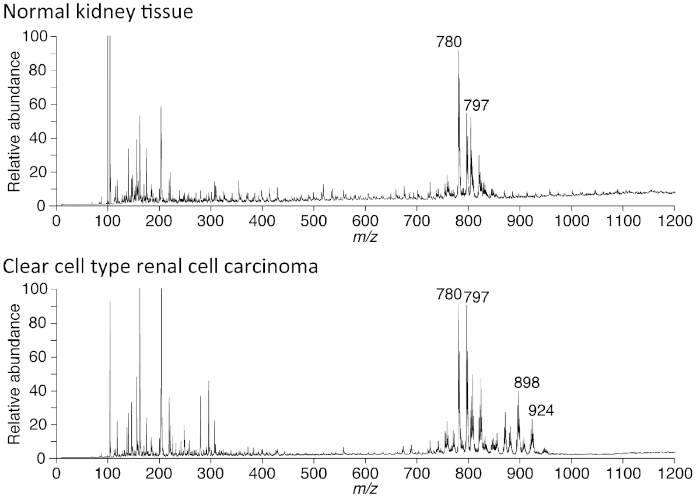
Abbildung 4: Das Karzinom der menschlichen Nierenzell zeigt charakteristische Spitzen neutraler Lipide. Es gab relativ starke Spitzen in den Spektren aus dem menschlichen Nierenzellkarzinomgewebe (RCC), die im umgebenden nicht-kanzerösen Gewebe nicht identifiziert wurden. Diese Spitzen stellen hauptsächlich Triacylglycerol (TAG) bei einem Massen-Zu-Ladungsverhältnis (m/z) 900 dar. Die Spektralerfassung wurde im positiven Ionenmodus durch direkte Analyse durchgeführt. Die Hochspannung wurde auf 2,3 kV eingestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Beispiel für Daten, die in normalen Lebergeweben und humanem hepatozellulärem Karzinom (HCC) erfasst werden. Das obere Panel zeigt die Spektren aus einem menschlichen Lebergewebe, in dem keine neoplastische Läsion vorhanden war, sondern von einem Patienten mit chronischer Hepatitis und Leberzirrhose. Das untere Panel zeigt die gemittelten Spektren von HCC vom selben Patienten. Auf einen Blick, während diese beiden sehr ähnliche Spektralmuster haben, gibt es viele kleine Unterschiede im Spektralmuster. Die Abszisse zeigt das Massen-Zu-Lade-Verhältnis (m/z) und die Ordinate stellt die relative Intensität jedes Spektrums dar. Die Erfassung von Spektren wurde mit dem positiven Ionenmodus nach der Extraktion des Gewebes durchgeführt, wie in Abbildung 2Cdargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Echtzeitmessungen des Arzneimittelstoffwechsels. Metabolische Veränderungen in 5-FdU intravenös in das Schwanzgefäß einer Maus injiziert. Sehr schneller und empfindlicher Nachweis von 5-FdU mit Natriumaddukt wurde in der Leber in situ erreicht. Aufgrund der instabilen Ionisierung während der Messung kann die Einstellung des Signals bei etwa 6-7 s festgestellt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Beispiele für Daten von drei Personen. Das menschliche Serum von drei Individuen wurde mit PESI-MS analysiert. Es gab deutliche Unterschiede in den Spektralmustern unter den Individuen. Die Daten wurden im positiven Ionenmodus ermittelt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Polymerverbindungen stören die präzise Datenerfassung. Aufgrund der periodischen Entstehung von Spektralspitzen, die auf der Originalprobe überlagert sind, wird es schwierig, die Daten genau zu interpretieren. In diesem Fall erscheinen die spektren aus Polypropylen-Triolglycerol (PPGT) als lautes Overlay. Diese Verbindungen, die in der Regel für die Kalibrierung verwendet werden, maskieren die ursprünglichen Spektren aus der Leber. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Obwohl PESI ein Derivat von ESI für die Massenspektrometrie4ist, ist es am vorteilhaftesten für die Überwachung von Echtzeit-Metabolomik, sowie für die Analyse biochemischer Reaktionen, ohne komplexe oder zeitaufwändige Vorbehandlungendurchzuführen 5,14,15,17. Es ist eine einfache und sofortige Massenspektrometrie-Technik, die auf den integrierten Zustand lebender Organismen angewendet werden kann. Da es keine komplexen Kaskaden von Probenvorbehandlungen erfordert, besteht eine viel größere Möglichkeit, die molekulare Zusammensetzung der gesamten Probe zu bewerten, da wir einen möglichen Probenverlust vermeiden, der in konventionellen ESI auftreten kann, was komplexe Schritte der Probenvorbehandlungen mit großen Mengen organischer Lösungsmittel erfordert. Daher ermöglicht es PESI uns, viel mehr Informationen von der Probe zu erhalten, wenn alle Bedingungen angemessen kontrolliert werden.
Zunächst müssen wir einige der technischen Aspekte erwähnen, die erforderlich sind, um gute Ergebnisse bei der PESI-MS-Analyse zu erzielen. Der wichtigste Faktor bei PESI ist die Aufrechterhaltung der Ionisationseffizienz während der Analyse. Um dies zu erreichen, ist es ratsam, den Abstand zwischen der Spitze der Nadel und der Probenoberfläche anzupassen und zu optimieren, um ein stabiles TIC zu erzeugen, indem man sich während der Analyse auf den Computermonitor bezieht. Um dies zu tun, ist es notwendig, die Tiefe der Nadel in einer schrittweisen Weise zu ändern, um maximale TIC zu erreichen. Da die Dauer der Ionisation im Vergleich zu ESI relativ kurz ist, ist PESI nicht ideal für Reproduzierbarkeit oder Quantifizierung. Zweitens, da die Form der Nadelspitze eine sehr wichtige Rolle bei der Ionisierung spielt, indem ein idealer Taylor-Kegel gebildet wird, der als Ionenquelle dient, muss darauf geachtet werden, die Nadelspitze nicht zu verformen. Eine Verformung der Spitze kann zu einer geringeren Ionisationseffizienz führen.
Während PESI vorteilhaft ist, weil es direkt auf frische Proben (z. B. Leber, Niere und Gehirn) und lebenden Organismus ohne besondere Behandlung angewendet werden kann, ist es relativ empfindlich gegenüber anderen exogenen Verunreinigungen, da es fast alle Komponenten in einer Flüssigkeit ionisieren kann21,22,23. Das heißt, der Nachteil des Überspringens der Probenvorbehandlung bedeutet, dass PESI-MS in mehreren Situationen, die häufig in biologischen Experimenten auftreten, benachteiligt ist. Wie im Protokollabschnitt erläutert, ist PESI empfindlich gegenüber Verunreinigungen durch RNA-Konservierungsstoffe, Aldehyde und Polymerverbindungen wie die Kryogel, die häufig für die histologische Zubereitung verwendet werden. Blutgerinnsel können an der PESI-Nadel haften und oft die vorgesehenen Spektren maskieren. Darüber hinaus befreit die Hämolyse von RBCs Hämoglobin, und das dissoziierte Eisenion führt zu viel stärkeren Spektren als die, die von den beabsichtigten Analyten abgeleitet sind. Polymerverbindungen geben auch periodische Spektralspitzen, die die spektren überlagern, die von den beabsichtigten Analyten abgeleitet werden, was es aufgrund des Rauschens viel schwieriger macht, die realen Daten zu interpretieren (Abbildung 8). Um Probleme beim Erwerb von Massenspektren zu vermeiden, ist es ratsam, unser Protokoll zu befolgen, wobei besondere Hinweise auf die Kontamination zu beachten sind. In dieser Hinsicht ist die Anwendung von PESI in einigen Fällen begrenzt.
Ein weiterer Nachteil von PESI liegt in seinem relativ instabilen Ionisationsprozess, der uns erfordert, die Tiefe der Sondennadel an die Analyten anzupassen. Darüber hinaus kann diese Technik einen sehr begrenzten Bereich in einer einzigen Analyse abdecken. Aufgrund der sehr geringen Größe der Nadelspitze, die direkt auf das Gewebe aufgetragen wird, ist die PESI-MS-Analyse nicht so umfassend wie die 2D-Analyse, die mit einer MALDI-TOF MS-basierten bildgebenden Massenspektrometrie oder DESI-basierten Bildgebung7,8erreicht werden kann. PESI kann jedoch ein Bild der Hippocampusbildung rekonstruieren, obwohl es mehrere Stunden23 dauert, da das 2D-Scannen einer Probe eine lange Zeit in Anspruch nimmt, vor allem wegen der instabilen Ionisationseffizienz dieser Technik. Unter Berücksichtigung dessen ist die Massenspektralbildgebung durch PESI-MS keine wertvolle Anwendung.
Hinsichtlich der elektrochemischen Eigenschaften von PESI ist das Volumen und die Konzentration der Probe, die an der Nadelspitze haftet, kritisch18, da der Unterdrückungseffekt durch Verkleinerung der Elektrospraygröße etwas abgeschwächt wird. Wenn man bedenkt, dass PESI eine Miniaturisierung von ESI ist, müssen Proben idealerweise verdünnt werden, um zu vermeiden, dass eine Gülle auf der Spitze entsteht. Daher ist die Zugabe von ca. 30 l 50 % Ethanol erforderlich, um eine effiziente Ionisation zu erreichen, wenn die direkte Gewebemethode angewendet wird (Abbildung 2B). Dies maximiert die Ionisationseffizienz und erreicht eine nahezu vollständige Ionisierung der Moleküle, die an der Spitze der Nadel befestigt sind.
Bei der Verwendung dieses Systems ist die Wahl der am besten geeigneten Methode der Datenverarbeitung sehr wichtig24. In Bezug auf die Umsetzung des maschinellen Lernens für jede Krankheitsdiagnose ist der Aufbau einer Datenbank notwendig, um eine Referenz für die Klassifizierung oder Kategorisierung von Krankheiten zu erstellen7. Zum Beispiel haben wir die Unterstützung Vektormaschine oder logistische Regression verwendet, um eine Diagnose der primären Leber malignancies25zu machen.
PESI-MS ist eine vielseitige und einfache Technik, die ein großes Potenzial für Arzneimittelscreening, Dopingtests, Lebensmittelsicherheitstests für landwirtschaftliche Produkte26und einige Umwelttests hat. Da diese Ionisationseinheit mit anderen Spektrometern kompatibel ist, indem eine Befestigung für jedes spezifische Instrument vorbereitet wird, kann PESI für verschiedene Zwecke eingesetzt werden.
Offenlegungen
Der entsprechende Autor wurde von Shimadzu, einem Hersteller und Lieferanten von PESI-MS-Instrumenten, finanziert.
Danksagungen
Wir danken Ayumi Iizuka für den Betrieb der PESI-MS und Kazuko Sawa-nobori für ihre Sekretariatsunterstützung. Wir danken Bronwen Gardner, Ph.D., von der Edanz Group (www.edanzediting.com/ac) für die Bearbeitung eines Entwurfs dieses Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 5-Fluoro-2'-deoxyuridine (5-FdU) | Sigma-Aldrich | F8791-25MG | 25mg |
| disposable biposy punch (Trepan) | kai Europa GmbH | BP-30F | bore size 3mm |
| ethanol | nacalai tesque | 14710-25 | extra pure reagent |
| LabSolutions | Shimadzu | ver. 5.96, Data analyzer | |
| micropestle | United Scientific Supplies | S13091 | |
| microtube | Treff | 982855 | 0.5 mL clear |
| PESI-MS (Direct Probe Ionization-MS) | Shimadzu | DPiMS-2020 | Mass spectrometer equipped with PESI |
| PPGT solition | Shimadzu | ND | Attached to DPiMS-2020 |
Referenzen
- Fenn, J. B., Mann, M., Meng, C. K., Wong, S. F., Whitehouse, C. M. Electrospray ionization for mass spectrometry of large biomolecules. Science. 246, 64-71 (1989).
- Karas, M., Bachman, D., Bahr, U., Hillenkamp, F. Matrix-Assisted Ultraviolet Laser Desorption of Non-Volatile Compounds. International Journal of Mass Spectrometry and Ion Processes. 78, 53-68 (1987).
- Tanaka, K., et al. Protein and polymer analyses up to m/z 100000 by laser ionization time-of flight mass spectrometry. Rapid Communications in Mass Spectrometry. 2, 151-153 (1988).
- Hiraoka, K., Nishidate, K., Mori, K., Asakawa, D., Suzuki, S. Development of probe electrospray using a solid needle. Rapid Communications in Mass Spectrometry. 21, 3139-3144 (2007).
- Yoshimura, K., Chen, L. C., Yu, Z., Hiraoka, K., Takeda, S. Real time analysis of living animals by electrospray ionization mass spectrometry. Analytical Biochemistry. 417, 195-201 (2011).
- Balog, J., et al. Intraoperative tissue identification using rapid evaporative ionization mass spectrometry. Science Translational Medicine. 5, 194ra93(2013).
- Boughton, B. A., Hamilton, B. Spatial metabolite profiling by matrix-assisted laser desorption ionization mass spectrometry imaging. Advances in Experimental Medicine and Biology. 965, 291-321 (2017).
- Shimma, S., Sugiura, Y., Hayasaka, T., Hoshikawa, Y., Noda, T., Setou, M. MALDI-based imaging mass spectrometry revealed abnormal distribution of phospholipids in colon cancer liver metastasis. Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences. 855, 98-103 (2017).
- Sugiyama, E., Setou, M. Visualization of brain gangliosides using MALDI imaging mass spectrometry. Methods in Molecular Biology. 1804, 223-229 (2018).
- Zhang, J., et al. Nondestructive tissue analysis for ex vivo and in vivo cancer diagnosis using a handheld mass spectrometry system. Science Translational Medicine. 9, 406(2017).
- Pirro, V., Jarmusch, A. K., Vincenti, M., Cooks, R. G. Direct drug analysis from oral fluid using swab touch spray mass spectrometry. Analytica Chimca Acta. 861, 47-54 (2015).
- Chen, L. C., et al. Characterization of probe electrospray generated from a solid needle. Journal of Physical Chemistry. B. 112, 11164-11170 (2008).
- Mandal, M. K., Chen, L. C., Hiraoka, K. Sequential and exhaustive ionization of analytes with different surface activity by probe electrospray ionization. Journal of the American Society for Mass Spectrometry. 22, 1493-1500 (2011).
- Yoshimura, K., Chen, C. L., Asakawa, D., Hiraoka, K., Takeda, S. Physical properties of the probe electrospray ionization (PESI) needle applied to the biological samples. Journal of Mass Spectrometry. 44, 978-985 (2009).
- Yoshimura, K., et al. Analysis of renal cell carcinoma as a first step for mass spectrometry-based diagnostics. Journal of the American Society for Mass Spectrometry. 23, 1741-1749 (2012).
- Ashizawa, K., et al. Construction of mass spectra database and diagnosis algorithm for head and neck squamous cell carcinoma. Oral Oncology. 75, 111-119 (2017).
- Johno, H., et al. Detection of potential new biomarkers of atherosclerosis by probe electrospray ionization mass spectrometry. Metabolomics. 14, 38(2018).
- Zaitsu, K., et al. Intact endogenous metabolite analysis of mice liver by probe electrospray ionization/triple quadrupole tandem mass spectrometry and its preliminary application to in vivo real-time analysis. Analytical Chemistry. 88, 3556-3561 (2016).
- Yoshimura, K., et al. Real time diagnosis of chemically induced hepatocellular carcinoma using a novel mass spectrometry-based technique. Analytical Biochemistry. 441, 32-37 (2013).
- Nakagawa, H., et al. Lipid metabolic reprogramming in hepatocellular carcinoma. Cancers. 10, 447-461 (2018).
- Mandal, M. K., Chen, L. C., Hashimoto, Y., Yu, Z., Hiraoka, K. Detection of biomolecules from solutions with high concentration of salts using probe electrospray and nano-electrospray ionization mass spectrometry. Analytical Methods. 2, 1905-1912 (2010).
- Yoshimura, K., Chen, L. C., Johno, H., Nakajima, M., Hiraoka, K., Takeda, S. Development of non-proximate probe electrospray ionization for real-time analysis of living animal. Mass Spectrometry. 3, S0048(2014).
- Chen, L. C., et al. Ambient imaging mass spectrometry by electrospray ionization using solid needle as sampling probe. Journal of Mass Spectrometry. 44, 1469-1477 (2009).
- Yoshimura, K., Chen, C. L., Asakawa, D., Hiraoka, K., Takeda, S. Physical properties of the probe electrospray ionization (PESI) needle applied to the biological samples. Journal of Mass Spectrometry. 44, 978-985 (2009).
- Takeda, S., Yoshimura, K., Hiraoka, K. Innovations in analytical oncology - Status quo of mass spectrometry-based diagnostics for malignant tumor. Journal of Analytical Oncology. 1, 74-80 (2012).
- Hiraoka, K., et al. Component profiling in agricultural applications using an adjustable acupuncture needle for sheath-flow probe electrospray ionization/mass spectrometry. Journal of Agricultural and Food Chemistry. 67, 3275-3283 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten