Method Article
Isolierung von Atrial Myozyten von erwachsenen Mäusen
In diesem Artikel
Zusammenfassung
Dieses Protokoll wird verwendet, um einzelne vorhofflische Kardiomyozyten aus dem erwachsenen Mausherz mit einem Chunk-Verdauungsansatz zu isolieren. Dieser Ansatz wird verwendet, um rechte oder linke Vorhoffleine myozyten zu isolieren, die verwendet werden können, um Vorhoffleine Myozytenelektrophysiologie in Patch-Clamp-Studien zu charakterisieren.
Zusammenfassung
Die elektrophysiologischen Eigenschaften von Vorhofmyozyten wirken sich vor allem auf die allgemeine Herzfunktion aus. Veränderungen in den zugrunde liegenden ionischen Strömen, die für das Aktionspotential verantwortlich sind, können proarrhythmische Substrate verursachen, die Arrhythmien zugrunde liegen, wie Vorhofflimmern, die in vielen Bedingungen und Krankheitszuständen weit verbreitet sind. Die Isolierung von vorehebrecherischer Vorhofkardiomyozyten für den Einsatz in Patch-Clamp-Experimenten hat unser Wissen und Verständnis der zellulären Elektrophysiologie im gesunden Vorhofmyokard und bei der Einstellung der vorhoffalen Pathophysiologie erheblich erweitert. Darüber hinaus haben Studien mit genetischen Mausmodellen die Rolle einer Vielzahl von Proteinen bei der Regulierung der Atrialelektrophysiologie aufgeklärt. Hier bieten wir ein detailliertes Protokoll zur Isolierung von Kardiomyozyten aus den Vorhofanhängchen erwachsener Mäuse unter Verwendung einer Kombination aus enzymatischer Verdauung und mechanischer Dissoziation dieser Gewebe. Dieser Ansatz liefert konsequent und zuverlässig isolierte vorgerichtliche Kardiomyozyten, die dann zur Charakterisierung der zellulären Elektrophysiologie verwendet werden können, indem Wirkungspotentiale und Ionische Ströme in Patch-Clamp-Experimenten im Rahmen einer Reihe von experimentellen Bedingungen.
Einleitung
Die Vorhöfe, die dünnwandigen Niederdruckkammern des Herzens, die Blut von der überlegenen und minderwertigen Venenhöhle sowie den Lungenvenen erhalten, sind integraler Bestandteil der normalen Herzphysiologie. Wie andere Regionen des Herzens, die Vorhöfe enthalten eine Reihe von Zelltypen, einschließlich Kardiomyozyten, Fibroblasten, Endothelzellen, vaskuläre glatte Muskelzellen, und andere. Vorhoffllässe Myozyten sind elektrisch erregbare Zellen, die eine wesentliche Rolle bei der Leitung elektrischer Signaledurch das Herz spielen und so eine ordnungsgemäße Vorhofkontraktion während jedes Herzschlags 1 gewährleisten. Elektrische Dysfunktion in den Vorhöfen kann zu einer Reihe von vorgericht spezifischen Arrhythmien wie Vorhofflimmern und Vorhofflimmern führen2,3. Diese sind sehr weit verbreitete, aber wenig verstandene Atrialarrhythmien, die zu einer signifikanten Morbidität und Mortalität führen. Vorhofflimmern kann in Verbindung mit genetischen Mutationen, in Verbindung mit dem Altern oder bei der Einstellung erworbener Formen von Herzerkrankungen auftreten, einschließlich Bluthochdruck, Herzinsuffizienz und Diabetes2,4,5 ,6. Diese Bedingungen können die elektrischen Eigenschaften von Vorhofmyozyten verändern, die ein Substrat erzeugen können, das die Prävalenz der Arrhythmogenese1,2erhöht.
Die normale elektrische Funktion in den Vorhöfen sowie die Atrialarrhythmogenese werden durch die Morphologie des in Vorhofmyozyten erzeugten Aktionspotentials (AP) wesentlich beeinflusst. Der vorhofische AP wird aus der Aktivität einer Reihe von Ionenströmen erzeugt, einschließlich des Natriumstroms (INa, getragen von NaV1.5 Kanälen), des L-Typ-Calciumstroms (ICa,L, getragen von Cav1.2 und CaV1.3 Kanälen). ), und mehrere Kaliumströme, einschließlich des ultraschnellen verzögerten Gleichrichters Kaliumstrom (IKur, getragen von KV1.5 Kanälen), der transiente außen Kaliumstrom (Izu, getragen von KV4.2 und KV4.3 kanäle), einen stationären Kaliumstrom (IKss, getragen von KV2.1 Kanälen) und den nach innen gerichteten Gleichrichter Kaliumstrom (IK1, getragen von Kir2.1 Kanälen)1,7, 8. Obwohl sie in den Mausvorhöfen keine große Rolle spielen, tragen die schnellen und langsamen Komponenten des verzögerten Gleichrichters K+ Strom (IKr und IKs) auch zur AP-Repolarisation bei einigen Artenbei 7bei. Veränderungen in einem oder mehreren dieser ionischen Ströme können die elektrischen Eigenschaften von Vorhofmyozyten erheblich verändern, was zu Vorhofarrhythmien führen kann. Zum Beispiel kann eine Reduzierung von INa die Leitungsgeschwindigkeit über die Vorhöfe verlangsamen, indem die AP-Aufschlaggeschwindigkeit reduziert wird. Andererseits kann eine Verringerung der repolarisierenden Kaliumströme oder eine Erhöhung entweder iCa,L oder der späten INa zur Entwicklung von Nachdepolarisationen führen, die spontane Aktivität in den Vorhöfen auslösen können1, 2,9.
Es ist wichtig zu erkennen, dass es Unterschiede in der AP-Morphologie in verschiedenen Teilen des vorhofen Myokards gibt, die wahrscheinlich auf Unterschiede in der Expression oder Regulierung dieser zugrunde liegenden Ionenkanäle zurückzuführen sind. Beispielsweise wurden Unterschiede in der AP-Dauer zwischen der rechten und linken Vorgeschichte in Verbindung mit Unterschieden in Iund stromdichte gut beschrieben10,11,12,13. Außerdem haben wir vor kurzem gezeigt, dass es verschiedene Muster des elektrischen Umbaus in der rechten und linken Vorhöfin von Mäusen mit chronischer Hypertoniegibt 6,14. Die rechte hintere Vorhofwand enthält auch den sinoatrialen Knoten, der seine eigenen Muster der AP-Morphologie und Feuermuster15hat. Die unterschiedlichen Eigenschaften von Myozyten in jedem dieser verschiedenen Teile der Vorhöfe können mit isolierten Myozyten aus jeder dieser Regionen im Detail untersucht werden.
Es gibt verschiedene Ansätze, die verwendet werden können, um vorbliche Myozyten für Patch-Clamp-Elektrophysiologie-Studien zu isolieren16. Eine Möglichkeit besteht darin, einen retrograden Perfusionsansatz zu verwenden, bei dem das Herz über die Aorta für die Abgabe von Enzymen kanüliert wird. Während dies ein praktikabler Ansatz ist, kann es Variabilität in der Atrial-Myozytenqualität aufgrund von Inkonsistenzen in der Durchblutung der Vorhöfe produzieren. Wir haben einen "Chunk"-Verdauungsansatz für die Isolierung von vorhofen Myozyten gewählt, der die Notwendigkeit einer retrograden Durchblutung des Herzens eliminiert. Unser Ansatz verwendet eine Kombination aus enzymatischer Verdauung und mechanischer Dissoziation von Vorhofgewebe, die konsequent und zuverlässig eine große Anzahl isolierter Vorhofmyozyten ergibt, die für Patch-Clamp-Studien geeignet sind. Während wir unseren Ansatz hier mit vorgerichtem Anhängselgewebe beschreiben, kann der Ansatz in jeder Region des vorgerichtlichen Myokards (d. h. rechte oder linke Vorhofanhängsel, freie Wände, hintere Wände) verwendet werden, die der Prüfer wählt. Dieser Ansatz ist ideal für Studien der Vorhoffyzelektrophysiologie bei genetisch veränderten Mäusen, in Mausmodellen von Herz-Kreislauf-Erkrankungen oder für die Untersuchung der Auswirkungen pharmakologischer Verbindungen5,6,17 , 18 , 19.
Protokoll
Alle Tierverfahren wurden vom Animal Care and Use Committee der University of Calgary genehmigt und in Übereinstimmung mit den Richtlinien des Canadian Council on Animal Care durchgeführt. Die nachstehend beschriebene Vorhofmyozytenisolation, Bilder und repräsentative Ergebnisse wurden von einer 15 Wochen alten männlichen Wildtyp-Maus C57Bl/6 erhalten. Wir verwenden routinemäßig dieses Protokoll, um Vorhoffleine myocyten von Wildtyp-Mäusen zu isolieren17,18, Mäuse mit genetischen Mutationen19,20 und Maus-Modelle von Krankheiten wie chronische Hypertonie6, 14. Das Protokoll kann ähnlich für männliche oder weibliche Mäuse verwendet werden. Wir haben auch eine ähnliche Version dieses Isolationsverfahrens verwendet, um sinoatriale Knotenmyozyten aus dem Mausherz17,21,22,23zu isolieren. Ein Flussdiagramm dieses experimentellen Protokolls befindet sich in Abbildung 1.
1. Vorbereitung von Lagerlösungen und Ausrüstung
- Bereiten Sie 1 Sezieren Schale durch Zugabe von Silikon-Elastomer nach den Anweisungen des Herstellers. Fügen Sie genügend Silikon-Elastomer-Verbindung, um den Boden einer 10 cm Petrischale bis zu einer Tiefe von 1 cm zu bedecken. Lassen Sie 6 Insektenstifte in die Schale einlegen.
HINWEIS: Diese Silikon-Sezschale kann monatelang wiederverwendet und bei Raumtemperatur gelagert werden. - Bereiten Sie 3 feuerpolierte Pasteur pipetten mit einer Öffnung von 1 mm (kleine Bohrung), 3 mm (mittlere Bohrung) oder 5 mm (große Bohrung) im Durchmesser vor, wie in Abbildung 2Adargestellt. Um diese Pipetten herzustellen, punkten Sie eine Pasteur-Pipette und schnappen Sie dann entlang der Score-Marke, um eine Öffnung zu erzeugen, die etwas größer als die gewünschte Bohrungsgröße ist. Verwenden Sie eine Metallfeile, um die Oberfläche zu glätten und dann diese Öffnung mit einer offenen Flamme zu polieren.
HINWEIS: Dadurch entsteht eine glatte, feuerpolierte Kante mit einer Öffnung des gewünschten Durchmessers. Es ist wichtig, dass die Öffnung frei von Rissen und rauen Oberflächen ist. Diese feuerpolierten Pipetten können bei Raumtemperatur gelagert und monatelang wiederverwendet werden. - Bereiten Sie Lagerlösungen für die pH 6.9-Lösung von Tyrode und die pH 7.4-Lösung von Tyrodes gemäß Tabelle 1vor. Bereiten Sie auch 10 ml von je 1 M MgCl2, 1 M CaCl2und 100 mM CaCl2vor. Verwenden Sie Reinstwasser für alle Lösungen und lagern Sie bis zu 2 Monate bei 4 °C.
- Bereiten Sie 1 L modifizierte Kraft-Brühe (KB) Lösung wie in Tabelle 2angegeben vor. Verwenden Sie Reinstwasser. Teilen Sie die Lösung in 20 ml Aliquots auf und lagern Sie sie bis zu 2 Monate bei -20 °C.
2. Vorbereitung von Lösungen und Isolations-Setup für atriale Myozyten-Isolation
- Bereiten Sie 50 ml einer modifizierten Tyrodes pH 7.4-Lösung, wie in Tabelle 3 beschrieben, in einem 125 ml Erlenmeyer Kolben mit 1 M CaCl2 und 1 M MgCl 2-Lagerlösungen vor. Legen Sie den Erlenmeyerkolben bis zur Verwendung in ein 35 °C-Wasserbad, wie in Abbildung 2Bdargestellt.
- Bereiten Sie die modifizierte Tyrodes pH 6.9-Lösung, wie in Tabelle 4 beschrieben, in einem 50 ml-Rohr mit der 100 mM CaCl 2-Lagerlösung vor. Aliquot 2,5 ml dieser Lösung in jeweils drei 5 ml runde Bodenrohre. Legen Sie diese Rohre in ein Drahtgestell, das in einem 35 °C-Wasserbad bis zur Verwendung platziert ist, wie in Abbildung 2Bdargestellt.
- Bereiten Sie die Enzymlösung wie in Tabelle 5 beschrieben in einem 14 ml runden Unterrohr vor. Um die Protease-Lösung zu machen, fügen Sie 1 mg Protease pro 100 l Reinstwasser hinzu. Legen Sie die Röhre mit dieser Enzymlösung in das Drahtgestell und in kubieren Sie in einem 35 °C Wasserbad, bis sie verwendet wird.
- Ein Aliquot modifizierter KB-Lösung in einem 35 °C-Wasserbad auftauen. Aliquot 2,5 ml KB-Lösung in jeweils drei 5 ml runde Bodenrohre und 2,5 ml in ein 14 ml rundes Unterrohr. Legen Sie diese Rohre in das Drahtgestell und inkubieren Sie in einem 35 °C Wasserbad bis zur Verwendung, wie in Abbildung 2Bdargestellt.
- Legen Sie die Sezierenderplatte, sezierende Werkzeuge, eine Pasteur Pipette und die feuerpolierten Pipetten, wie in Abbildung 2Bdargestellt.
3. Zerlegung von Mouse Atrial Appendage(s)
- Injizieren Sie die Maus mit 0,2 ml Heparin (10 000 USP U/10 ml) über intraperitoneale Injektion und warten Sie 5 min auf Absorption.
- Die Maus in eine Induktionskammer legen und durch Isofluran-Inhalation (3-4%) anieren. Isofluran und Sauerstoff werden mit einer Anästhesiemaschine geliefert und Anästhesiegas wird aufgeräumt. Sobald die Maus anästhesiert ist, und zeigt keinen Zehenkneifen reflex, euthanisieren Sie die Maus durch schnelle zervikale Dislokation. Legen Sie die Maus auf ein Papiertuch oder ein Korkbrett und kleben Sie die Pfoten nach unten, um die Maus an Ort und Stelle zu halten.
- Befeuchten Sie die Brust der Maus mit 70% Ethanol. Entfernen Sie das Fell und die Haut, die die Brust mit einer gebogenen Schere bedecken. Als nächstes verwenden Sie Rattenzahnzangen, um das Brustbein zu heben und dann schneiden Sie die Membran entlang der Kante der Rippen. Entfernen Sie den gesamten Rippenkäfig mit einer gekrümmten Schere, um das Herz freizulegen.
- Um das Vorhofanhängsbitinim (rechts oder links) zu entfernen, heben Sie das Anhängseln vorsichtig mit feinen Sezieren der Zange an und schneiden Sie es mit einer Federschere aus. Das Vorhofanhängsmaterial sofort auf eine silikonbeschichtete Sezierschale mit 20 ml der in Schritt 2.1 beschriebenen pH-Lösung von yrodes Tyrodes pH 7.4 übertragen.
- Platzieren Sie einen Sezierenden Stift an der Oberseite und einen Pin an der Unterseite der Öffnung des Vorhofanhängs. Mit einer Weidepipette die Vorhöfe mit der gewärmt modifizierten Tyrodes pH 7.4-Lösung zur Blutentfernung spülen. Öffnen Sie das Vorhofanhängsfeld, indem Sie den oberen und unteren Rand des Vorhofanhängs entlang schneiden. Als nächstes heften Sie die Ecken des Vorhofanhängs nach unten, um ein flaches, rechteckiges Stück Gewebe zu erstellen, wie in Abbildung 3Adargestellt.
4. Isolierung von Atrial-Myozyten
HINWEIS: Die Schritte in diesem Abschnitt werden alle bei 35 °C durchgeführt, wobei die Rohre in ein 35 °C-Wasserbad getaucht werden. Seien Sie vorsichtig, wenn Sie Gewebestreifen zwischen runden Bodenröhrchen übertragen, um sicherzustellen, dass nur das Gewebe (und nicht die Lösung) zwischen den Röhren übertragen wird.
- Schneiden Sie den Vorhofanhängskopf mit Federschere und feinen Zangen in ca. 8-10 gleich große Streifen (ca. 0,7 mm breite). Ein Beispiel für die Streifen des Vorhofgewebes ist in Abbildung 3Bdargestellt. Beachten Sie, dass die Streifen zusammenziehen, sobald sie frei vom Hauptstück des Gewebes geschnitten werden. Mit der kleinbohrten feuerpolierten Pipette die Gewebestreifen in das erste Rohr mit erwärmter modifizierter Tyrodes pH 6.9-Lösung in Schritt 2.2 zu übertragen. Warten Sie 5 min.
- Waschen Sie die Gewebestreifen, indem Sie sie auf das zweite und dann das dritte runde Unterrohr mit modifizierter Tyrodes pH 6.9-Lösung in Schritt 2.2 mit der mittelbohrungs-feuerpolierten Pipette übertragen.
- Um die Gewebestreifen zu waschen, kappen Sie das 5 ml runde Unterrohr und invertieren Sie das Rohr vorsichtig 3 Mal. Lassen Sie die Gewebestreifen an der Unterseite des Rohres absetzen, bevor Sie die Gewebestreifen mit der mittelbohrungsfeuerpolierten Pipette in das nächste Rohr übertragen.
- Übertragen Sie die Gewebestreifen in die in Schritt 2.3 beschriebene Enzymlösung mit einer mittelgroßen feuerpolierten Pipette und brüten Sie 30 min. Wirbeln Sie das Rohr alle 3-5 min, um zu verhindern, dass die Gewebestreifen zusammenhaften.
HINWEIS: Zu Beginn der enzymatischen Verdauung setzen sich Gewebestreifen nach dem Wirbeln schnell ab. Bei ca. 20 min der Verdauung beginnen die Gewebestreifen nach dem Wirbeln in der enzymatischen Lösung zu schweben. Während dieser Zeit ändern sich die Vorhofgewebestreifen auch im Aussehen von blassrosa zu weiß, wenn sie verdaut werden. - Führen Sie nach der enzymatischen Verdauung drei Wälvorgänge mit 2,5 ml KB-Lösung in den 5 ml runden Bodenrohren aus, die in Schritt 2.4 vorbereitet wurden. Für jede Wäsche, sanft invertieren das Rohr 3 mal vor dem Verschieben des Gewebes zum nächsten Rohr mit der mittleren Bohrung feuerpolierte Pipette. Nach der Endwäsche die Streifen in das 14 ml runde Unterrohr mit 2,5 ml KB-Lösung geben. Warten Sie 5 min.
- Das Gewebe mit der weitbohrungspolierten Pipette 7,5 min lang sanft trituieren. Dadurch werden die Gewebestreifen mechanisch getrennt und eine trübe Lösung mit individuellen Vorhofmyozyten gefüllt.
HINWEIS: Während der Trituration wird das Gewebe weiß und die Lösung wird trüb. Die Triturationskraft, die durch Veränderung sowohl der Frequenz als auch der Geschwindigkeit des Ausstoßens der Gewebestreifen aus der weitbohrungen feuerpolierten Pipette erreicht wird, sollte auf die individuelle Isolierung zugeschnitten werden. Wenn die Trituration zu sanft ist, wird die Zellausbeute niedrig sein, während eine zu harte Trituration viele abgestorbene Zellen ergibt. Vermeiden Sie Blasen beim Trituieren. - Füllen Sie das 14 ml runde Bodenrohr mit den trituierten Gewebestreifen mit KB-Lösung auf ein Endvolumen von 7-10 ml, abhängig von der gewünschten Dichte der Zellen für den experimentellen Einsatz. Legen Sie dieses Rohr bei Raumtemperatur für 1 h. Nach dieser Inkubationszeit können Zellen für eine Vielzahl von Experimenten bis zu 7 h verwendet werden. Zellen können auch bei 4 °C bis zu 7 h gelagert werden.
Ergebnisse
Die mit diesem Protokoll isolierten Vorhofmyozyten können verwendet werden, um die elektrophysiologischen Eigenschaften dieser Zellen mit der Patch-Clamp-Technik zu charakterisieren. Aliquots von Vorhoff-Myozyten in KB-Lösung können der Aufnahmekammer eines Standard-Patch-Clamp-Geräts hinzugefügt und mit Lösungen überlagert werden, die für die Art der Aufzeichnung geeignet sind, die der Experimentalist durchführen möchte. Atriale Myozyten, die mit diesem Protokoll isoliert werden, werden am besten für elektrophysiologische Studien innerhalb von 6-7 h Isolation verwendet. Repräsentative Patch-Clamp-Daten aus unserem Labor werden unten vorgestellt.
Abbildung 4 zeigt Beispiele für isolierte Vorhofmyozyten von normalen Mäusen, die mit dem obigen Protokoll hergestellt wurden. Isolierte Vorhofmyozyten sind in der Regel in der Größenordnung von 100 m lang und 10 m breit mit klaren Streifen. Die Kapazität isolierter Vorhofmyozyten beträgt typischerweise 40-70 pF.
Abbildung 5A zeigt ein Beispiel für einen vorgerichtlichen Myozyten-AP, der mit der perforierten Patch-Clamp-Technik im aktuellen Klemmmodus aufgezeichnet wurde, wie wir zuvor6,19,20beschrieben haben. Zusammenfassungsdaten zur Veranschaulichung typischer Atrial-Myozyten-AP-Parameter sind in Tabelle 6enthalten. Insbesondere präsentieren wir zusammenfassende Daten für Messungen des Ruhenden Membranpotentials (RMP), der maximalen Aufhubgeschwindigkeit (Vmax), des Überschießens (OS) und der AP-Dauer bei 50% (APD50), 70% (APD70) und 90% (APD90) Repolarisation Zeit (Tabelle 6). APs können auch in der gesamten Zellenkonfiguration14aufgezeichnet werden. Die Superfusions- und Pipettenlösungen für die Aufnahme von APs sind in Tabelle 7 und Tabelle 8verfügbar.
Abbildung 5B zeigt eine repräsentative Familie von Na+ Strömen (INa), die in der gesamten Zellkonfiguration der Patch-Clamp-Technik aufgezeichnet ist. Diese Ströme wurden mit 50 ms Spannungsklemmenschritten zwischen -100 und +10 mV aus einem Haltepotential von -120 mV aufgezeichnet. Wir haben Ansätze und Protokolle für die Aufzeichnung INa zuvor6,14,20beschrieben. Eine Zusammenfassung der Beziehung INa IV ist auch in Abbildung 5Bdargestellt. Lösungen zur Aufzeichnung von INa sind in Tabelle 7 und Tabelle 8dargestellt.
Abbildung 5C zeigt eine repräsentative Familie von Ca2+ Strömen (ICa,L), die in der gesamten Zellkonfiguration der Patch-Clamp-Technik aufgezeichnet sind. Diese Ströme wurden mit 250 ms Spannungsklemmenschritten zwischen -60 und +80 mV aus einem Haltepotential von -70 mV aufgezeichnet. Die experimentellen Bedingungen, die verwendet werden können, um ICa,L zu messen, wurden zuvor beschrieben17,18,20. Eine Zusammenfassung der Beziehung ICa,L IV ist auch in Abbildung 5Cdargestellt. Die Lösungen für die Aufzeichnung iCa,L sind in Tabelle 7 und Tabelle 8verfügbar.
Abbildung 5D zeigt eine repräsentative Familie von K+ Strömen (IK), die in der gesamten Zellkonfiguration der Patch-Clamp-Technik aufgezeichnet ist. Diese Ströme wurden von einem Haltepotential von -80 mV mit 500 ms Spannungsklemmenschritten zwischen -120 mV und +80 mV erfasst, wie wir zuvor6,14beschrieben haben. Die Zusammenfassung IV-Beziehung für die Gesamt-IK ist auch in Abbildung 5Ddargestellt. Die Lösungen für die Aufzeichnung von IK sind in Tabelle 7 und Tabelle 8verfügbar.
Mit diesen Ansätzen zur Aufzeichnung von APs und großen Familien von ionenischen Strömen, einschließlich Na+, Ca2+ und K+ Strömungen (wie oben dargestellt), erlaubt es dem Prüfer, die Vorhofflyz-Myozyten-Elektrophysiologie in einem Vielzahl von experimentellen Bedingungen. Unser Labor hat diese Techniken routinemäßig eingesetzt, um die Vorhoffleine Elektrophysiologie bei normalen Mäusen,in Mausmodellen von Herzerkrankungen und bei genetisch veränderten Mäusen 6,14,17,18 zu untersuchen. ,19,20.

Abbildung 1: Flussdiagramm für das Vorhofmyozytenisolationsprotokoll. Zusammenfassung der Schritte, die zum Isolieren von Vorhofmyozyten mithilfe dieses Protokolls verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
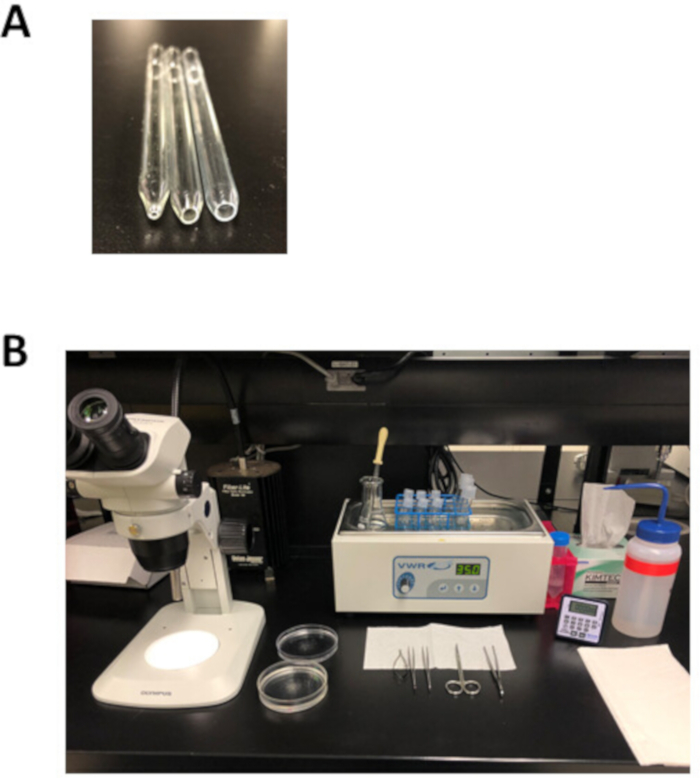
Abbildung 2: Experimentelle Einrichtungs- und Sezierwerkzeuge für die Myozytenisolation. (A). Eine kleine Bohrung feuerpolierte Pipette mit einem Öffnungsdurchmesser von 1 mm (links) wird für die Gewebeübertragung nach der Zerlegung verwendet, eine mittellange feuerpolierte Pipette mit einem Öffnungsdurchmesser von 3 mm (Mitte) wird verwendet, um Gewebestreifen während der und eine großbohrungsfeuerpolierte Pipette mit einem Öffnungsdurchmesser von 5 mm (rechts) wird zur Trituration des verdauten Vorhofgewebes verwendet. (B). Experimentelleeinrichtung für atriale Myozytenisolation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
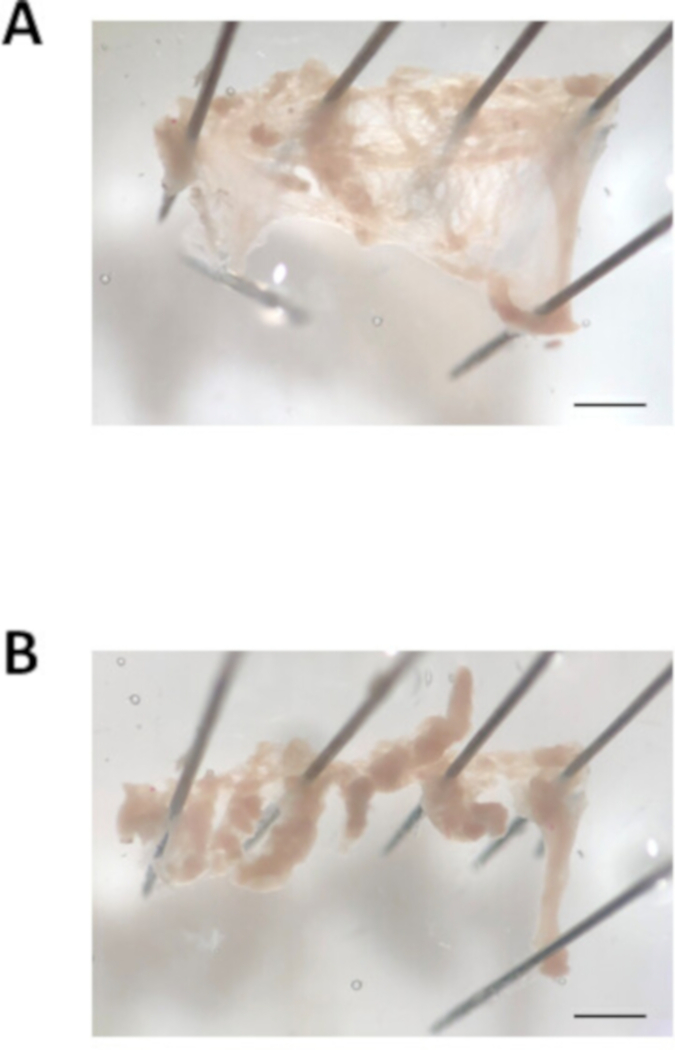
Abbildung 3: Bild der Vorhof-Anhängsungssektion. (A). Repräsentatives helles Feldbild eines ausgeschnittenen Vorhofanhängs, das aufgeschnitten und angeheftet wird. (B). Repräsentatives helles Feldbild des in Gewebestreifen geschnittenen Vorhofanhängs in eine Breite von ca. 0,7 mm. Maßstabsleiste = 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Bilder von isolierten Vorhofmyozyten. (A). Hellfeldbild von isolierten Vorhofmyozyten unmittelbar nach der Isolation. Skalenbalken = 50 m. (B). Hellfeldbild einer einzelnen isolierten Vorhofmyozyten. Skalenbalken = 100 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
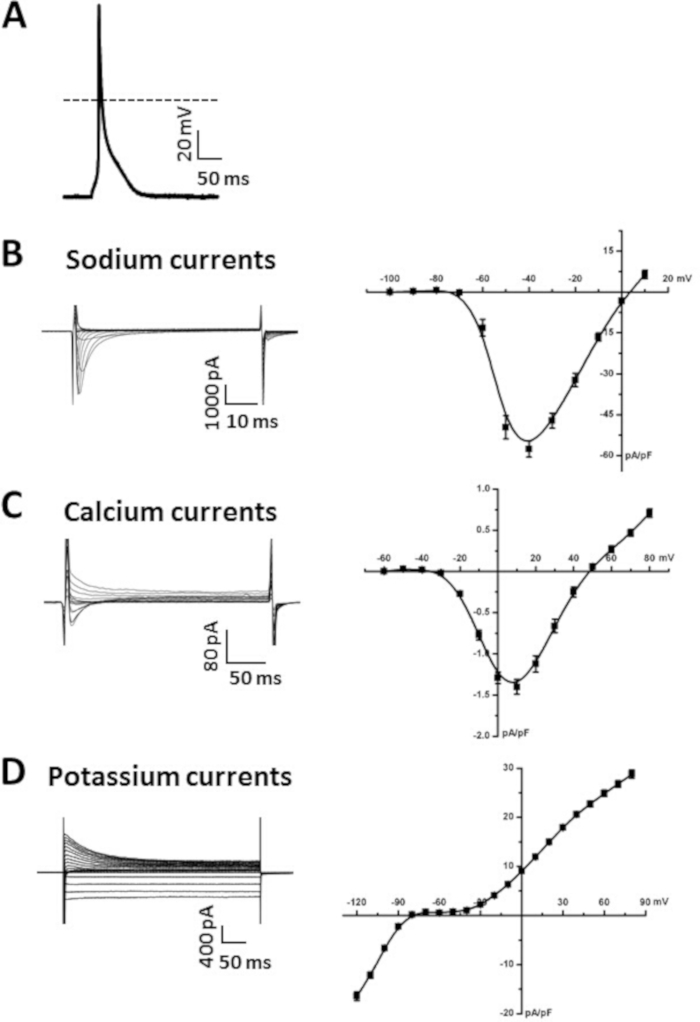
Abbildung 5: Repräsentative Patch-Clamp-Daten aus isolierten Vorhofmyozyten. (A). Der Vertreter stimulierte die AP-Aufnahme von einer isolierten Vorhofmyozyten. Die Zusammenfassung der AP-Parameter ist in Tabelle 6dargestellt. Amphotericin B (200 g/ml) wurde der Pipettenlösung zugesetzt, um die Zellmembran zu permeabilisieren. (B). Vertreter INa Aufnahmen (links) und Zusammenfassung INa IV Kurve (rechts) aus einem isolierten Vorhof Myozyten. Nifedipine (10 'M) wurde der modifizierten Tyrodes Lösung hinzugefügt, um ICa,L bei der Aufnahme von INazu blockieren. C. Vertreter ICa,L-Aufnahmen (links) und Zusammenfassung ICa,L IV-Kurve (rechts) aus einer isolierten Vorhofmyozyten. (D). Vertreter I K-Aufnahmen (links) und Zusammenfassung IK IV-Kurve (rechts) aus einer isolierten Vorhofmyozyten. Die Lösungen, die zum Aufzeichnen der einzelnen Ströme verwendet werden, sind in Tabelle 7 und Tabelle 8aufgeführt. Zusammenfassung IV-Kurven sind gemittelte Messungen von 10 Vorhofmyozyten, die von einer 15 Wochen alten männlichen Wildtyp-Maus C57Bl/6 isoliert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Stock Tyrodes pH 6,9 | Stock Tyrodes pH 7,4 | |
| chemisch | in mM | in mM |
| Nacl | 140 | 140 |
| Kcl | 5,4 | 5,4 |
| KH2PO4 | 1.2 | 1.2 |
| HEPES | 5 | 5 |
| Endvolumen | 500 ml | 1 L |
| Letzter pH-Wert mit NaOH | 6,9 | 7,4 |
Tabelle 1: PH-Wert von Tyrodes pH 7,4 und pH 6,9-Lösungen von Tyrodes. Zusammensetzung der Tyrodes Lösungen (pH 7.4 und pH 6.9), die im Voraus hergestellt und bei 4 °C für bis zu 2 Monate gelagert werden können.
| chemisch | in mM |
| K-Glutamat | 100 |
| K-Aspartat | 10 |
| Kcl | 25 |
| KH2PO4 | 10 |
| MgSO4 | 2 |
| Taurin | 20 |
| Kreatin | 5 |
| EGTA | 0,5 |
| glukose | 20 |
| HEPES | 5 |
| Bsa | 0,10% |
| Endvolumen | 1 L |
| Letzter pH-Wert mit KOH | 7,2 |
Tabelle 2: Geänderte KB-Lösung. Rezept für modifizierte KB-Lösung, die im Voraus hergestellt, aliquoted und bei -20 °C für bis zu 2 Monate gelagert werden kann.
| chemisch | betrag |
| glukose | 5,55 mM |
| MgCl2 | 1 mM |
| CaCl2 | 1,8 mM |
| Stock Tyrodes pH 7,4 | 50 ml |
| Heparin | 250 l |
Tabelle 3: Modifizierte pH-Lösung von Tyrodes 7,4 mit Glucose, Magnesium, Kalzium und Heparin. Zusammensetzung der modifizierten pH-Lösung von Tyrodes 7,4 für die Vorhofgewebesektion. Diese Lösung sollte frisch gemacht und bis zur Anwendung in einem 35 °C-Wasserbad aufbewahrt werden.
| chemisch | betrag |
| glukose | 18,5 mM |
| Taurin | 49,96 mM |
| Bsa | 15 mg |
| CaCl2 | 0,066 mM |
| Stock Tyrodes pH 6,9 | 15 ml |
Tabelle 4: Modifizierte pH-Lösung von Tyrodes 6,9, die Glukose, Taurin, BSA und wenig Kalzium enthält. Zusammensetzung der modifizierten pH 6.9-Lösung des modifizierten Tyrodes, die für die vorbliche Myozytenisolierung verwendet wird. Diese Lösung sollte frisch gemacht und bis zur Anwendung in einem 35 °C-Wasserbad aufbewahrt werden.
| chemisch | betrag |
| Kollagenase | 1.064 U |
| Elastase | 9 U |
| Protease-Lösung | 65,2 l |
| Geänderter pH-Wert von Tyrodes pH 6,9 | 5 mL |
Tabelle 5: Enzymatische Lösung. Zusammensetzung der enzymatischen Lösung zur enzymatischen Verdauung von Vorhofgewebestreifen. Diese Lösung sollte frisch gemacht und bis zur Anwendung in einem 35 °C-Wasserbad aufbewahrt werden.
| Parameter | durchschnitt |
| RMP (mV) | -74,2 € 0,7 |
| Vmax (V/s) | 144,6 € 5,8 |
| Betriebssystem (mV) | 71,9 € 3,0 |
| APD50 (ms) | 11,1 x 1,7 |
| APD70 (ms) | 23,0 x 4,6 |
| APD90 (ms) | 54,7 x 7,8 |
Tabelle 6: Zusammenfassung der AP-Parameter aus isolierten Vorhofmyozyten. Die Daten werden als Mittelwert dargestellt: SEM, n = 10 Vorhofmyozyten, isoliert von einer 15-wöchigen männlichen Wildtyp-Maus C57Bl/6.
| Kaliumströme und APs | Natriumströme | Calciumströme | |
| chemisch | in mM | in mM | in mM |
| Nacl | 140 | 5 | |
| Kcl | 5,4 | ||
| MgCl2 | 1 | 1 | 1 |
| CaCl2 | 1 | 1 | 2 |
| HEPES | 10 | 10 | 10 |
| glukose | 5,5 | 5,5 | 5,5 |
| Cscl | 130 | ||
| TEA-Cl | 5,4 | 145,5 | |
| Ph | 7.4 mit NaOH | 7.4 mit CsOH | 7.4 mit CsOH |
Tabelle 7: Zusammensetzung der Tyrodes Lösungen, die bei Patch-Clamp-Experimenten verwendet werden. Zusammensetzung der Tyrodes Lösungen verwendet, um APs, INa, ICa,Lund IK aus isolierten Vorhof Myozyten aufzunehmen.
| Kaliumströme und APs | Natriumströme | Calciumströme | |
| chemisch | in mM | in mM | in mM |
| Nacl | 5 | 5 | 5 |
| Kcl | 140 | ||
| MgCl2 | 1 | 1 | 1 |
| CaCl2 | 0,2 | 0,2 | 0,2 |
| HEPES | 10 | 10 | 10 |
| EGTA | 5 | 5 | |
| Mg-ATP | 4 | 5 | 4 |
| Na-GTP | 0,3 | 0,3 | 0,3 |
| Na-Phosphoktotin | 6.6 | 6.6 | |
| Cscl | 130 | 135 | |
| BAPTA | 5 | ||
| Ph | 7.2 mit KOH | 7.2 mit CsOH | 7.2 mit CsOH |
Tabelle 8: Zusammensetzung der internen Pipettenlösung, die bei Patch-Clamp-Experimenten verwendet wird. Zusammensetzung der Pipettenfülllösungen zur Aufnahme von APs, INa, ICa,Lund IK aus isolierten Vorhofmyozyten.
Diskussion
Unser Labor verwendet dieses Protokoll routinemäßig, um Maus-Vorhofmyozyten für den Einsatz in Patch-Clamp-Experimenten zu isolieren, um die Auswirkungen verschiedener Formen von Herz-Kreislauf-Erkrankungen, genetischen Mutationen oder pharmakologischen Verbindungen auf Atrialmyozyten zu untersuchen. Elektrophysiologie. Obwohl sehr reproduzierbar, hängt die Qualität der Daten, die aus den isolierten Vorhofmyozyten erhalten werden, von der Qualität der Isolierung ab. Darüber hinaus führt die Wiedereinführung von Kalzium nach der vorbäuflinösen Myozytenisolation zu einem Zelltod für eine Population isolierter Myozyten aufgrund des Calciumparadoxons16. Dementsprechend erfordert die Isolierung tragfähiger, hochwertiger Vorhofmyozyten mit diesem Ansatz Praxis und Optimierung an mehreren Stellen in der Isolation. Einmal optimiert, Wird geschätzt, dass zwischen 70-90% der gesamten vorgericht myozyten isoliert mit diesem Ansatz wird sowohl Kalzium-tolerant und Stab geformt sein. Die Schritte, die die meiste Übung und Optimierung erfordern, werden im Folgenden erläutert.
Die Geschwindigkeit und Effizienz der Sezierung wird sich nachgelagert auf die Qualität der isolierten Zellen auswirken. Es ist wichtig, sich Zeit zu nehmen, um sicherzustellen, dass das gesamte Blut aus dem Vorhofgewebe entfernt wird und dass Gewebestreifen auf eine ähnliche Größe geschnitten werden. Es sollte etwa 5 min dauern, um das Vorhofanhängschen zu entfernen, das Gewebe in Streifen zu schneiden und die Gewebestreifen in das erste Rohr der modifizierten Tyrodes pH 6.9-Lösung zu übertragen. Wenn dieser Schritt jedoch zu lange dauert, kann die Qualität des Gewebes beeinträchtigt werden.
Es ist auch wichtig, dass Gewebestreifen in einer Isolation und zwischen Herzen auf eine einheitliche Größe geschnitten werden. Wenn Gewebestreifen zu groß oder zu klein sind oder wenn sie innerhalb einer Isolierung nicht einheitlich sind, kann dies sowohl bei der enzymatischen Verdauung als auch bei der Trituration zu Problemen führen. Dies liegt daran, dass kleine Streifen gründlicher verdaut und große Streifen unterdgetaut werden. Ebenso wichtig ist es, den untersuchten Genotyp und die Krankheitseinstellung zu berücksichtigen, da die Größe des Vorhofanhängs von Ort zu Tier variieren kann. Zum Beispiel haben hypertrophe Herzen größere Vorhofanhängsel im Vergleich zu gesunden Herzen, und daher kann der Experimentator mehr Streifen in hypertrophen Herzen schneiden als normale Herzen. Dementsprechend wird die Optimierung der Größe der geschnittenen Gewebestreifen und die Anwendung dieser Abmessungen auf jedes einzelne Vorhofanhängsband die Reproduzierbarkeit von Myozytenisolationen zwischen experimentellen Bedingungen erheblich verbessern.
Das empfindliche Gleichgewicht zwischen enzymatischer Verdauung und mechanischer Dissoziation ist der Schlüssel zu einer erfolgreichen Myozytenisolation mit diesem Protokoll. Wenn Gewebe während der enzymatischen Verdauung nicht ausreichend gewirbelt wird, neigen die einzelnen Gewebestreifen dazu, sich zu verklumpen und zusammenzukleben, was die Wirksamkeit der enzymatischen Verdauung einschränkt. Wenn zu häufig oder kräftig aufgeregt, kann dies das Vorhofgewebe schädigen, was zur Isolierung von nicht lebensfähigen Zellen führen wird. Mechanische Dissoziation von isolierten Vorhofmyozyten von Gewebestreifen während der Trituration ist der kritischste Schritt, um zu üben und zu optimieren mit diesem Ansatz, um Vorhofmyozyten zu isolieren. Wenn die Trituration zu sanft ist, ist die Zellausbeute gering. Auf der anderen Seite, wenn Trituration zu hart ist, dann wird eine Fülle von nicht lebensfähigen Myozyten isoliert werden, und die Qualität der Daten, die während Patch-Clamp-Experimente erhalten werden, wird gefährdet. Darüber hinaus kann die Zusammensetzung der Vorhöfe die Isolierung beeinflussen. Wenn beispielsweise Gewebe fibrotisch ist, müssen die enzymatische Verdauung und die Triturationsschritte möglicherweise modifiziert werden. Es ist daher wichtig, sich die Zeit zu nehmen, die Fähigkeiten zu entwickeln, die erforderlich sind, um während der Trituration qualitativ hochwertige Zellen zu erhalten, die für Patch-Clamp-Experimente verwendet werden können.
Wie bei allen experimentellen Techniken gibt es Einschränkungen. Diese Technik erfordert Praxis, um lebensfähige, qualitativ hochwertige Myozyten reproduzierbar zu isolieren, was wiederum die Durchführbarkeit aller Experimente beeinflusst, die mit diesen Myozyten durchgeführt werden sollen. Dieser Ansatz ist auch terminal und Vorhof-Myozyten, die mit diesem Ansatz isoliert sind, können nur am Tag der Isolierung verwendet werden. Unser Labor verwendet die Zellen innerhalb von 6-7 h Isolation.
Dieser Ansatz der Isolierung von vorhofen Kardiomyozyten hat mehrere Anwendungen. Zum Beispiel kann dieser Ansatz modifiziert werden, um Vorhoffleine (sowie Herz-Fibroblasten) von anderen Arten, einschließlich menschlicher Vorhofgewebebiopsien, zu isolieren. Darüber hinaus ist ein Vorteil bei der Verwendung dieser Chunk-Methode für die vorhofflische Myozytenisolation (im Gegensatz zur retrograden Perfusion des Herzens), dass sie modifiziert werden kann, um Kardiomyozyten aus anderen Regionen des Herzens zu isolieren, wie z. B. dem sinoatrialen Knoten oder anderen spezifischen Regionen. des Vorhofmyokards oder umfassen die gesamte supraventrikuläre Region des Herzens. Unser Labor verwendet vorgerichtliche Kardiomyozyten für Patch-Clamp-Experimente, um Aktionspotentiale und Ionische Ströme zu messen, obwohl dieser Ansatz nicht auf diese Technik beschränkt sein muss. Zum Beispiel können isolierte Myozyten verwendet werden, um Veränderungen in Kalziumtransienten und Kontraktilität in einer Vielzahl von experimentellen Umgebungen zu untersuchen. Atriale Kardiomyozyten können auch in Immunfluoreszenzstudien verwendet werden, um die Lage von Proteinen oder Strukturen von Interesse zu untersuchen. Dementsprechend ist dieser Ansatz mit vielen Einsatzmöglichkeiten sehr vielseitig.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wird durch Betriebskostenstipendien der Canadian Institutes of Health Research (MOP 93718, 142486) und der Heart and Stroke Foundation of Canada an R.A. Rose unterstützt. H.J. Jansen ist Träger eines Killam Postdoktorandenstipendiums.
Materialien
| Name | Company | Catalog Number | Comments |
| 1, 2-Bis(2-Aminophenoxy)ethane-N, N, N', N'-tetraacetic acid 98% | Sigma | A4926-1G | |
| Adenosine 5'-triphosphate disodium salt hydrate BioXtra, > 99%, from microbial | Sigma | A7699-1G | |
| Adenosine 5'-triphosphate magnesium salt > 95%, bacterial | Sigma | A9187-1G | |
| Amphocetericin B from Streptomyces sp. ~80% (HPLC), powder | Sigma | A4888-500 MG | |
| Bovine serum albumin | Sigma | A3059-50G | |
| Calcium chloride dihydrate | Sigma | 223506-500G | |
| Cesium chloride ReagentPlus, 99.9% | Sigma | 289329-100G | |
| Cesium hydroxide monohydrate > 99.5% trace metals basis | Sigma | 562505-1KG | |
| Collagenase Type 2 | Worthington Biochemical Corporation | LS004176 | |
| Creatine anhydrous | Sigma | C0780 | |
| D-(+)-Glucose | Sigma | G7021-1KG | |
| DL-Aspartic acid potassium salt | Sigma | A2025-100G | |
| Elastase suspension | Worthington Biochemical Corporation | LS002279 | |
| Ethylene glycol-bis(2-amino-ethylether)-N,N,N',N'-tetraacetic acid >97.0% | Sigma | E4378-25G | |
| Guanosine 5'-triphosphate sodium salt hydrate > 95% (HPLC), powder | Sigma | G8877-250MG | |
| Heparin 10 000 USP U/10 mL | SANDOZ | 10750 | |
| HEPES > 99.5% (titration) | Sigma | H3375-500G | |
| L-Glutamic acid potassium salt monohydrate > 99% (HPLC), powder | Sigma | G1501-500G | |
| Magnesium sulfate | Sigma | M2643-500G | |
| Nifedipine > 98% (HPLC), powder | Sigma | N7634-1G | |
| Phosphocreatine disodium salt hydrate enzymatic, approx 98% | Sigma | P7936-5G | |
| Potassium chloride ACS reagent, 99.0-100.5% | Sigma | P3911-500G | |
| Potassium hydroxide | EM Science | PX1480-1 | |
| Potassium phosphate monobasic | EMD | PX1565-1 | |
| Protease from Streptomyces griseus, type XIV, >3.5 units/mg solid, powder | Sigma | P5147-1G | |
| Sodium chloride ACS reagent, > 99.0% | Sigma | S9888-2.5KG | |
| Sodium hydroxide, pellets, 97+%, A.C.S. reagent | Sigma | 221465-500G | |
| Sylgard 184 silicone elastomer kit | World Precision Instruments Inc | SYLG184 | |
| Taurine | Sigma | T0625-100G | |
| Tetraethylammonium chloride > 98% (titration) | Sigma | T2265-100G |
Referenzen
- Bartos, D. C., Grandi, E., Ripplinger, C. M. Ion Channels in the Heart. Comprehensive Physiology. 5 (3), 1423-1464 (2015).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circulation Research. 114 (9), 1483-1499 (2014).
- Jalife, J. Mechanisms of persistent atrial fibrillation. Current Opinion in Cardiology. 29 (1), 20-27 (2014).
- Nattel, S., Maguy, A., Le Bouter, S., Yeh, Y. H. Arrhythmogenic ion-channel remodeling in the heart: heart failure, myocardial infarction, and atrial fibrillation. Physiological Reviews. 87 (2), 425-456 (2007).
- Jansen, H. J., et al. Atrial structure, function and arrhythmogenesis in aged and frail mice. Scientific Reports. 7, 44336(2017).
- Jansen, H. J., et al. Distinct patterns of atrial electrical and structural remodeling in angiotensin II mediated atrial fibrillation. Journal of Molecular and Cellular Cardiology. 124, 12-25 (2018).
- Nerbonne, J. M., Kass, R. S. Molecular physiology of cardiac repolarization. Physiological Reviews. 85 (4), 1205-1253 (2005).
- Grant, A. O. Cardiac ion channels. Circulalation: Arrhythmia and Electrophysiology. 2 (2), 185-194 (2009).
- Schmitt, N., Grunnet, M., Olesen, S. P. Cardiac potassium channel subtypes: new roles in repolarization and arrhythmia. Physiological Reviews. 94 (2), 609-653 (2014).
- Lomax, A. E., Kondo, C. S., Giles, W. R. Comparison of time- and voltage-dependent K+ currents in myocytes from left and right atria of adult mice. American Journal of Physiology Heart and Circulatory Physiology. 285 (5), H1837-H1848 (2003).
- Li, D., Zhang, L., Kneller, J., Nattel, S. Potential ionic mechanism for repolarization differences between canine right and left atrium. Circ Res. 88 (11), 1168-1175 (2001).
- Wirth, K. J., Knobloch, K. Differential effects of dofetilide, amiodarone, and class lc drugs on left and right atrial refractoriness and left atrial vulnerability in pigs. Naunyn Schmiedebergs Archives of Pharmacology. 363 (2), 166-174 (2001).
- Qi, A., Yeung-Lai-Wah, J. A., Xiao, J., Kerr, C. R. Regional differences in rabbit atrial repolarization: importance of transient outward current. American Journal of Physiology. 266 (2 Pt 2), H643-H649 (1994).
- Jansen, H. J., et al. NPR-C (Natriuretic Peptide Receptor-C) Modulates the Progression of Angiotensin II-Mediated Atrial Fibrillation and Atrial Remodeling in Mice. Circulation: Arrhythmia and Electrophysiology. 12 (1), e006863(2019).
- Mangoni, M. E., Nargeot, J. Genesis and regulation of the heart automaticity. Physiological Reviews. 88 (3), 919-982 (2008).
- Voigt, N., Pearman, C. M., Dobrev, D., Dibb, K. M. Methods for isolating atrial cells from large mammals and humans. Journal of Molecular and Cellular Cardiology. 86, 187-198 (2015).
- Springer, J., et al. The natriuretic peptides BNP and CNP increase heart rate and electrical conduction by stimulating ionic currents in the sinoatrial node and atrial myocardium following activation of guanylyl cyclase-linked natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 52 (5), 1122-1134 (2012).
- Hua, R., Adamczyk, A., Robbins, C., Ray, G., Rose, R. A. Distinct patterns of constitutive phosphodiesterase activity in mouse sinoatrial node and atrial myocardium. PLoS One. 7 (10), e47652(2012).
- Egom, E. E., et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. Journal of Physiology. 593 (5), 1127-1146 (2015).
- Hua, R., et al. Effects of Wild-Type and Mutant Forms of Atrial Natriuretic Peptide on Atrial Electrophysiology and Arrhythmogenesis. Circulation: Arrhythmia and Electrophysiology. 8 (5), 1240-1254 (2015).
- Krishnaswamy, P. S., et al. Altered parasympathetic nervous system regulation of the sinoatrial node in Akita diabetic mice. Journal of Molecular and Cellular Cardiology. 82, 125-135 (2015).
- Mackasey, M., et al. Natriuretic peptide receptor C (NPR-C) protects against angiotensin II mediated sinoatrial disease in mice. JACC Basic to Translational Science. , (2018).
- Azer, J., Hua, R., Vella, K., Rose, R. A. Natriuretic peptides regulate heart rate and sinoatrial node function by activating multiple natriuretic peptide receptors. Journal of Molecular and Cellular Cardiology. 53 (5), 715-724 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten