Method Article
Analyse der Scherung strömungsinduzierte Migration der Murine Marginal Zone B-Zellen In Vitro
In diesem Artikel
Zusammenfassung
Randzone B Zellen (MZBs) reagieren auf die Kraft des Schubflusses Neuausrichtung ihrer Migrationspfad bis die Strömung. Dieses Protokoll zeigt, wie Sie erfassen und analysieren der Migration mit einem Fluidik-Einheit, Pumpe, Mikroskop-imaging-System und freie Software.
Zusammenfassung
Randzone B Zellen (MZBs) sind eine Population von B-Zellen, die in der Maus Milz Randzonen befinden, die Follikel zu umhüllen. Um die Follikel zu erreichen, muss die Schubkraft des Blutflusses MZBs wandern. Wir stellen Ihnen hier eine Methode für die Analyse dieser strömungsinduzierte MZB-Migration in-vitro. Erstens sind MZBs isoliert aus der Maus Milz. Zweitens sind MZBs ließ sich auf Integrin Liganden in Fluss Kammer Folien, Fluss Scherung ausgesetzt und abgebildet unter dem Mikroskop während der Migration. Drittens Bilder von der Migration von MZBs werden mit der MTrack2 automatische Zelle tracking-Plugin für ImageJ verarbeitet, und die daraus resultierenden Zelle Tracks mit dem Ibidi Chemotaxis Werkzeug quantifiziert. Die Migrationsdaten zeigen, wie schnell sich die Zellen bewegen, wie oft sie die Richtung ändern, ob der Scherung Fluss Vektor ihre Migration Richtung auswirkt und welche Integrin-Liganden beteiligt sind. Obwohl wir MZBs verwenden, kann die Methode leicht angepasst werden für die Analyse der Migration Leukozyten, die auf die Kraft des Schubflusses reagiert.
Einleitung
Immunzellen sind die meisten bewegliche Zellen im menschlichen Körper und müssen oft mit Querkraft von Blut und Lymphe Strömung kämpfen. Allerdings gibt es vergleichsweise wenige Studien auf Scherung Kraft-induzierte Migration von Leukozyten1,2,3,4,5. Wir stellen Ihnen hier eine zuverlässige und quantitative Protokoll um die Reaktion der einer Immunzelle auf in-vitro-Fluss zu analysieren. Durchführung des Tests erfordert keine Herstellung von Komponenten und alle Geräte und Verbrauchsmaterialien sind im Handel erhältlich. Das Protokoll, einschließlich Reinigung und Migration Zellanalyse, kann an einem einzigen Tag durchgeführt werden. Schließlich, obwohl wir die Migration der Randzone B-Zellen (MZBs) beschrieben wird, kann das Protokoll angepasst werden um Migration gegen andere Arten von Immunzellen zu analysieren. Daher ist es möglich, dieser Assay verwenden, um eine Vielzahl von Leukozyten mit einer umfangreichen Gruppe von Bedingungen systematisch zu analysieren.
MZBs sind eine Population von B-Zellen, die in der Maus, nur in der Milz und Shuttle gefunden werden, zwischen dem Innenraum der Follikel und die Randzonen6,7,8,9. Die Randzone ist eine Schicht von Immunzellen ca. 5 – 10 Zellen dick. Die Zellschicht die Follikel umhüllt und besteht hauptsächlich aus MZBs und Makrophagen, aber auch invariante natürlichen killer (iNKT) T-Zellen, dendritischen Zellen (DCs) und Neutrophilen, unter anderem10. Die Zellen in der Randzone sind unidirektional Blutfluss aus Milz Arterien, die marginale Sinus rund um die Follikel kündigen ausgesetzt. Das Blut wird fließt aus den Löchern in den marginalen Sinus durch die Randzone und dann in venösen Sinus in dem roten Fruchtfleisch gesammelt und restauriert im Umlauf-11. Der freie Fluss von Blut wäscht über den MZBs und setzt sie auf Antigene im Blut durchgeführt. Die MZBs tragen das Antigen in der Follikel transportiert automatisch zwischen der Randzone und innerhalb der Follikel, die nicht Blut ausgesetzt ist. So müssen sie als MZBs Shuttle in Richtung der Follikel, die Schubkraft der Blut fließen12 (Abbildung 1A) Wandern.
In diesem Protokoll wir beschreiben, wie quantitativ zu bestimmen, wie die Immunzellen wie keine Strömung oder high-Flow-in-vitro-MZBs reagieren, um aufzuzeigen, wie sie sind so programmiert, dass um in Vivozu migrieren. In einem ersten Schritt werden aus einer Maus Milz mit magnetischen Beads gekoppelt an Antikörper aus handelsüblichen Kits MZBs gereinigt. Frisch isolierte MZBs sind in den Brunnen einer Strömung Kammer Folie eingeführt, erlaubt, sich auf Integrin Liganden und den Fluss der Migration Puffer mit einem Pumpensystem (Abbildung 2A) ausgesetzt. Die Zellen werden mit einem Time-Lapse video-Mikroskopie-System abgebildet. Anschließend werden die Bilder zur Analyse mit einem kostenlosen ImageJ-Plugin, MTrack213,14, um die Zellen automatisch zu verfolgen. Spuren können dann mit dem kostenlosen Ibidi Chemotaxis Werkzeug15 verschiedene Parameter wie Geschwindigkeit, Geradheit und Migration Index bestimmen quantifiziert werden. Diese Werte können zu bestimmen, die Auswirkungen der Migration-Inhibitoren, Zelle Stimulatoren, Chemokine und andere Chemikalien Migration beeinflussen auf der Schubfluss induzierte Migration verwendet werden, um die Immunzelle Bewegungskontrolle in-vivo Kräfte zu verstehen.
Protokoll
Alle Experimente, die die Verwendung von Tieren wurden zuvor durch das Landesverwaltungsamt Halle (Sachsen-Anhalt), Deutschland, nach allen Richtlinien der medizinischen Fakultät der OVGU Universität Magdeburg genehmigt.
(1) MZB Zelle Reinigung
-
Leukozyten zu isolieren.
- Opfern Sie ein 8 bis 16 Wochen altes Baby Maus zu und entfernen Sie der Milz-16. Die Milz in 5 mL eiskaltes Zelle Puffer zu trennen [Phosphat-gepufferte Kochsalzlösung (PBS) + 0,5 % Fettsäure-freie Rinderserumalbumin (BSA)], entweder mit einem Gewebe Dissociator oder sanft Maischen die Milz durch ein 70 µm Zelle Sieb Gitter in einen Brunnen auf einem 6-Well-Platte mit den Kolben aus einer 5 mL Spritze.
- Übertragen Sie die Zellen in Zelle Puffer in eine 15 mL konische Rohr. Sammeln Sie weitere Zellen, indem das Gewebe Dissociator Rohr oder Nylon-Netzgewebe in den Brunnen ein weiteres 5 mL eiskaltes Zelle Puffer hinzufügen. Übertragen Sie die zusätzlichen 5 mL Zelle Puffer plus Zellen auf das konische Rohr. Zentrifugieren bei 300 X g für 10 min bei Raumtemperatur (RT, 20 ° C) und den Überstand verwerfen.
-
Führen Sie lyse der roten Blutkörperchen.
- Wieder aussetzen der Zelle Pellet in 1 mL der roten Blutzelle (RBC) Lysis Puffer (150 mM NH4Cl, 10 mM KHCO3, 0, 1 mM EDTA), vorgewärmten RT. Hinzufügen einer zusätzlichen 1,5 mL RBC Lyse Puffer und wirbeln um zu mischen. Inkubieren Sie bei RT (20 ° C) für eine Gesamtmenge von 2 min, einschließlich der Zeit benötigt, um das Diabolo wieder auszusetzen.
- Die Zellsuspension zu stoppen die Lyse fügen Sie 7,5 mL eiskaltes Zelle Puffer hinzu. Bei 300 x g und 4 ° C für 10 min Zentrifugieren und den Überstand verwerfen.
- Wieder aussetzen der Zelle Pellet in 1 mL der Zelle Puffer und eine zusätzliche 9 mL Zelle Puffer. Pipette 10 mL Zellsuspension durch einen 30 µm Vorabscheidung Filter in ein neues 15 mL konische Röhrchen, Zelle Ablagerungen zu entfernen.
- Zellen bei 300 x g und 4 ° C für 10 min zentrifugiert und den Überstand entsorgen. Wieder aussetzen der Zelle Pellet in 500 µL Puffer Zelle. Halten Sie Zellen kühl bei allen weitere Schritten des Verfahrens bis Inkubation in den Fluss Kammer Folien.
-
MZBs zu reinigen.
- Die Zellsuspension in einem konischen Rohr fügen Sie 50 µL der Biotin-gekoppelten Antikörper aus einem handelsüblichen Bausatz gegen alle unerwünschten Zellen, einschließlich CD43 (auf nicht-B-Zellen), CD4 (auf T-Zellen), CD93 (auf unreife B-Zellen) und Ter119 (auf Erythrozyten hinzu). Schütteln Sie oder wechseln Sie das Rohr vorsichtig, um zu mischen, aber tun nicht Wirbel der Zellen. Legen Sie das konische Rohr auf einem Bett aus Eis in einem fast flachen Winkel und Rock bei 25 u/min für 15 Minuten.
- Fügen Sie magnetische Beads gekoppelt an Anti-Biotin-Antikörper in einem Gesamtvolumen von 100 µL, die Zellsuspension hinzu. Weiterhin der Zellsuspension bei 25 u/min auf Eis für 20 min. Waschen der Zellen rock durch Zugabe von 5 mL Zelle Puffer, Zentrifugieren bei 300 X g und 4 ° C für 10 min, und den Überstand verworfen. Wieder aussetzen Sie Zellen in 1 mL der Zelle Puffer.
- Zum Abbau der Zellsuspension der magnetischen Wulst verbunden Zellen durch eine magnetische Spalte binden. Ablagestapel beschriftet Zellen (alle nicht-B-Zellen und unreifen B-Zellen). Sammeln Sie-markierten Zellen (Reife B-Zellen) in einem 15 mL konische Röhrchen, die vorbeschichtete mit einer Kurzbewerbung von 5 mL der Zelle Puffer, um unspezifische Adhäsion durch MZBs zu verhindern.
- Waschen Sie die Zellsuspension mit 5 mL der Zelle Puffer. Bei 300 x g und 4 ° C für 10 min Zentrifugieren und den Überstand verwerfen. Auszusetzen Sie Zellen in 90 µL Zelle Puffer wieder, und fügen Sie 10 µL Anti-CD23-gekoppelten Perlen. Rock-Zellsuspension sanft auf Eis für 20 min bei 25 Umdrehungen pro Minute.
- Waschen Sie die Zellsuspension mit 5 mL der Zelle Puffer. Bei 300 x g und 4 ° C für 10 min Zentrifugieren und den Überstand verwerfen. Wieder aussetzen Sie Zellen in 1 mL der Zelle Puffer.
- Zum Abbau der Zellsuspension der magnetischen Wulst verbunden Zellen durch eine magnetische Spalte binden. Entsorgen Sie die markierten Zellen (follikuläre B-Zellen). Sammeln Sie die nicht-markierten Zellen (MZBs), in einem 15 mL konische Röhrchen, die mit einer Kurzbewerbung von 5 mL der Zelle Puffer vorbeschichtet. Entfernen Sie 50 µL der Zellen für das zählen und Reinheit überprüft.
-
Färben die sortierten MZBs für Reinheit zu überprüfen.
- 10.000 Zellen in 50 µL 10 % Volumen (5 µL) des Fc Block hinzufügen und bei 4 ° C für 5 min. hinzufügen 50 µL der Zelle Puffer mit 0,3 µL der B220-FITC inkubieren (0,15 µg), CD21-PE (0,06 µg), und CD23-APC (0,06 µg) in einem Gesamtvolumen von 105 µL (jeder Antikörper verdünnt 1: 350) , oder jede andere Kombination von Fluorophore für die Unterscheidung zwischen follikulären B-Zellen und MZBs. Fleck der Zellen bei 4 ° C im Dunkeln für 15 Minuten.
- Waschen Sie die gefärbten Zellen einmal mit 1 mL der Zelle Puffer. Bei 300 x g und 4 ° C für 5 min Zentrifugieren und den Überstand verwerfen. In 300 µL Puffer Zelle Aufschwemmen und Proben mit einem Durchflusszytometer und Standardmethoden zu erwerben. Tor auf live Lymphozyten, dann auf B220+ -Zellen, und schließlich zum CD23niedrigen CD21hohe Zellen (Abbildung 1 b).
Hinweis: Das Verfahren liefert in der Regel 500.000 MZBs pro Milz von einer C57B/6-Maus.
-
Flow-Migration MZBs vorbereiten.
- Waschen gereinigt MZBs einmal in 1 – 2 mL kalte Migration Puffer [Hanks ausgewogen Salzlösung (HBSS) mit Kationen, 10 mM Hepes, 0,2 % Fettsäure-freie BSA] um sicherzustellen, dass die kationen-haltigen Migration Puffer nicht durch passives kation-freie PBS-Puffer verdünnt wird. Bei 300 x g und 4 ° C für 10 min Zentrifugieren und den Überstand verwerfen. Wieder aussetzen MZBs im kalten Migration Puffer zu einer Konzentration von 50.000 MZBs pro 30 µL (entspricht der Höhe in einen Brunnen einer Strömung Kammer Folie geladen).
Hinweis: Die frisch isolierte MZBs sollte so bald wie möglich verwendet werden. Sie sind jedoch noch in der Lage, für bis zu 8 h oder mehr nach dem Start des Experiments für Migration, solange sie auf Eis gehalten werden. Optimale Temperaturen sollte für andere Zelltypen getestet werden. Zum Beispiel kann es besser, kultivierte T-Zellen bei 37 ° C bis zum Beginn der Migration zu halten sein.
- Waschen gereinigt MZBs einmal in 1 – 2 mL kalte Migration Puffer [Hanks ausgewogen Salzlösung (HBSS) mit Kationen, 10 mM Hepes, 0,2 % Fettsäure-freie BSA] um sicherzustellen, dass die kationen-haltigen Migration Puffer nicht durch passives kation-freie PBS-Puffer verdünnt wird. Bei 300 x g und 4 ° C für 10 min Zentrifugieren und den Überstand verwerfen. Wieder aussetzen MZBs im kalten Migration Puffer zu einer Konzentration von 50.000 MZBs pro 30 µL (entspricht der Höhe in einen Brunnen einer Strömung Kammer Folie geladen).
(2) Flow Experiment
-
Beschichtung von Folien mit Integrin-Liganden.
- Am Tag vor dem Experiment, Tauwetter ein Aliquot der ICAM-1 (400 µg/mL). Verdünnen Sie ICAM-1 mit einem Faktor von 1: 80 mit PBS-Puffer, eine Endkonzentration von 5 µg/mL zu erreichen. Eine Kammer auf einer Fluss-Folie für jeden Migration Film benötigt fügen Sie 30 µL der ICAM-1 hinzu. Über Nacht inkubieren Sie Dia in einer feuchten Kammer bei 4 ° C.
Hinweis: Jede Folie enthält 6 Kammern und bis zu 8 Filme in einer Sitzung kann problemlos erfasst werden.
- Am Tag vor dem Experiment, Tauwetter ein Aliquot der ICAM-1 (400 µg/mL). Verdünnen Sie ICAM-1 mit einem Faktor von 1: 80 mit PBS-Puffer, eine Endkonzentration von 5 µg/mL zu erreichen. Eine Kammer auf einer Fluss-Folie für jeden Migration Film benötigt fügen Sie 30 µL der ICAM-1 hinzu. Über Nacht inkubieren Sie Dia in einer feuchten Kammer bei 4 ° C.
-
Die beschichteten Vertiefungen zu blockieren.
- Am Tag des Experiments waschen Sie die Kammer durch Hinzufügen von 100 µL PBS zu einem Brunnen und Brunnen der Kammer 100 µL entziehen. Hinzufügen einer Kammer 100 µL blocking-Puffer (2 % Fettsäure-freie BSA mit PBS-Puffer) und inkubieren Sie die Folie in einer feuchten Kammer bei RT für 1,5 h.
- Waschen Sie die Kammer, durch Zugabe von 100 µL PBS zu einem Brunnen, entziehen die anderen gut, dann hinzufügen 100 µL Puffer Migration an die Kammer. Speichern Sie die Folien in einer feuchten Kammer bei RT, bis das Experiment.
-
Vorbereiten der Fluidik-Einheit.
- Schließen Sie eine Flüssigkeitspumpe, der Fluidik Einheit und schalten Sie die Pumpe-Software. Waschen Sie den Schlauch einmal mit 5 – 10 mL Migration Puffer dann 11,7 mL Puffer Migration ebenso hinzu beiden Stauseen und entfernen Sie die Luftblasen zu.
- Klemmen Sie den Schlauch ca. 10 cm aus dem Anschlussstück. Stellen Sie das fluidische Gerät in der beheizten Inkubation Kammer am Mikroskop.
- Legen Sie die Folie Wahl, "µ-Folie VI 0,4" und den Schlauch zu "weiß" in der Software. Legen Sie die gewünschten Scherspannung (z. B. 4 dyn cm-2). Die Zeit der Bildgebung bis 30 min einstellen.
- Festlegen der Kalibrierfaktor Schläuche durch die Bestimmung des Durchfluss durch den Schlauch in mL/min Maßnahme den Zeitaufwand für 2 mL des Puffers fließen aus einem Reservoir des anderen und durch 2 Teilen. Machen Sie mindestens 4 Messungen für Genauigkeit. Verwenden Sie die tatsächliche Fördermenge einstellen durch Eingabe der Werte in der Pumpe-Software den gewünschten Durchfluss und Schubspannung.
-
Bereiten Sie die imaging-System.
- Vorwärmen der Mikroskop Inkubation Kammer, Fluidik-Einheit und Migration Puffer Aliquote auf 37 ° C (Abb. 2 b). Test die fluidische Pumpe indem sichergestellt wird, dass die Migration Puffer hin und her in den Stauseen fließt, gibt es keine Luft im System sprudelt.
-
Laden Sie die Zellen auf der Folie.
- Reinigen Sie die Unterseite des Objektträgers mit einem Ethanol-gedämpft Gewebe. Fügen Sie 30 µL Zellsuspension in einem Brunnen der Kammer und den anderen Brunnen entziehen Sie 30 µL. Inkubieren Sie die Folie mit einem Deckel auf Verdampfung bei 37 ° C für 30 min damit die Zellen legen zu verhindern.
- Langsam fügen Sie den vorgewärmten Migration Puffer in jede Vertiefung der Fluss Kammer Folie hinzu, bis ein positiver Meniskus aus dem Brunnen erhebt sich und entfernen Sie eventuell vorhandene Luftbläschen mit der Pipettenspitze.
-
Legen Sie die Folie auf Fluidik-Einheit.
- Klemmen Sie die Folie auf den Mikroskoptisch. Das Anschlussstück entfernen Sie die unmarkierte Seite des fluidischen Schläuche und am Ende mit Migration Puffer füllen Sie, bis ein positiver Meniskus ohne Luftblasen aus dem Ende steigt.
- Drehen Sie das Ende des Schlauchs über und legen Sie sie in den oberen Brunnen Strömungsraum, verschüttete Puffer mit einem Tuch aufwischen. Halten Sie den Schlauch geklemmt und wiederholen Sie den Vorgang für die markierte Ende des Schlauches.
-
Bild der Zellen.
- Wechseln Sie die imaging-System "Live" den Fokus auf die Zellen festlegen. Wählen Sie eine Sichtfeld in der Mitte der Folie. De-Fokus die Zellen etwas zu verbessern die schwarze Umrisse der Zelle und einem weißen inneren, die thresholded zu einem runden schwarzen Zellform auf einem weißen Hintergrund für die Verwendung mit einer automatischen Tracking-Programm zu produzieren.
- Starten der Sequenz Bildbearbeitungsprogramm und Datensatz 1 Bild alle 5 s für 30 min mit 10 x trocken Ziel. Entfernen Sie die Klammer aus der Schlauch und schalten Sie die Pumpe ein, dann nicht anhaftende Zellen abwaschen werden und adhärente Zellen beginnen zu migrieren. Bild für 30 min oder länger mit einer 10 x Ziel oder höher, wie gewünscht. Beschriften Sie und speichern Sie den Film.
-
Lösen Sie die fluidische Einheit von der Folie.
- Am Ende des Programms imaging, zurücksetzen die Pumpe für das nächste Experiment: die Klammer um den Schlauch wieder befestigen, entfernen Sie den Schlauch aus der Folie wieder befestigen das Anschlussstück, öffnen Sie die Halterung und die manuelle Steuerung der Pumpe zu verwenden, um mehrere mL Puffer aus einem Reserv schieben Oir, andererseits um die Luftblasen zu entfernen. Befestigen Sie die Klammer und legen Sie das eingespannte Rohr auf den Mikroskoptisch für den nächsten Film zu.
Hinweis: Das Protokoll kann hier auf unbestimmte Zeit pausiert werden. Wenn ein Inhibitor oder Modifikator der Zellwanderung, je nach ihrer Wirkungsweise, verwenden entweder die Zellsuspension bevor er sich in der Kammer der Migration oder der Migration-Puffer in der fluidische Einheit hinzufügen.
- Am Ende des Programms imaging, zurücksetzen die Pumpe für das nächste Experiment: die Klammer um den Schlauch wieder befestigen, entfernen Sie den Schlauch aus der Folie wieder befestigen das Anschlussstück, öffnen Sie die Halterung und die manuelle Steuerung der Pumpe zu verwenden, um mehrere mL Puffer aus einem Reserv schieben Oir, andererseits um die Luftblasen zu entfernen. Befestigen Sie die Klammer und legen Sie das eingespannte Rohr auf den Mikroskoptisch für den nächsten Film zu.
3. Migration-Track-Analyse
Hinweis: Zellen können nachverfolgt werden, automatisch mit dem MTrack2-Plugin oder von Hand mit der Tracking-Anleitung Plugin17. Automatisches tracking funktioniert gut mit MZBs weil diese Zellen vor allem Runde sind und auf diese Weise während der Migration bleiben erleichtert Schwelle das Bild der Zellen auf schwarze Objekte auf einem weißen Hintergrund. Automatische Verfolgung ist schwieriger, wenn andere Zelltypen dienen, wie kultiviert, CD8 + T-Zellen aktiviert, da diese Zellen während der Migration ausstrecken und etwas durchsichtig, macht es schwierig, die Kanten zu definieren. In diesem Fall können entweder (1) die Zellen befleckt werden, mit einer Intra vital Leuchtstofffärbung Bilder zu produzieren, die thresholded zeigen schwarze Objekte auf einem weißen Hintergrund oder (2) andere Programme, die Zellen zu skizzieren, wie Bilderkennung Segmentierung und/oder Rand kann verwendet. Manuelle Tracking ist eine nützliche Option, wenn ein kontrastreiches Bild der Zelle umrissen zu produzieren ist nicht möglich.
-
Führen Sie manuelle Tracking mit dem Plugin.
- Installieren Sie das Plugin "Tracking-Handbuch" in ImageJ und öffnen Sie den Film in ImageJ. "Tracking-Handbuch" klicken Sie im Menü "neue Spur hinzufügen". Klicken Sie auf die Mitte einer Zelle als Film Fortschritte automatisch Frame für Frame. Wenn die Zelle in jedem Frame ausgewählt wurde, wählen Sie "neue Spur hinzufügen" zu Folge eine neue Zelle.
- Nachdem die Tracks aufgezeichnet wurden, kopieren Sie die Ausgabeergebnisse in eine Daten-Tabelle. Ändern Sie das Format für die dezimale Darstellung für alle Tabellenzellen auf Null stellen nach dem Komma. Speichern Sie die Datei als "Registerkarte" Stop getrennt".txt-Datei für die spätere Analyse.
Hinweis: In der Regel werden 50 – 100 Zellen verfolgt, die dauert etwa 1 h für einen 20 min Film von ca. 240 Rahmen abgeschlossen.
-
Führen Sie automatische Verfolgung mit dem MTrack2-Plugin. Downloaden Sie und installieren Sie das MTrack2 kt Plugin gemäß den Anweisungen in der Datei (siehe zusätzliche Codierung Datei).
- Schwelle der Bilder aus dem Film Zelle Migration. Öffnen Sie den Bildstapel in ImageJ. Prozess der Bilder in ImageJ konvertieren Sie das Video aus, kontrastreiche Bilder zeigen die Zellen als schwarze Objekte auf einem weißen Hintergrund (Abbildung 3A) Farbe.
- Schärfen der Bilder doppelt, despeckle Bilder und Konvertieren der Bilder in 8 Bit. Wählen Sie das "Bild | passen Sie Helligkeit/Kontrast"Untermenü" und legte werden der Schieberegler Kontrast bei maximaler Kontrast, dann die Zellen als weiße Objekte auf einem schwarzen Hintergrund angezeigt. Wählen Sie das "Bild | Stellen Sie die Schwelle"Untermenü" um sicherzustellen, dass die Zellen als schwarze Objekte auf einem weißen Hintergrund angezeigt.
- Führen Sie die automatische Zelle tracking-Plugin "MTrack2 kt" (siehe Zusätzliche Codierung Datei). Legen Sie die folgenden Parameter auf dem Bildschirm.
- Legen Sie die Partikelgröße mindestens 1 Pixel und Partikelgröße maximale auf 30 Pixel für MZBs.
- Für Geschwindigkeit (max. Abstand zwischen 2 Teilchen auf aufeinander folgenden Frames des Films) wenn die Zelldichte auf der Folie hoch ist, dieser Wert niedrig eingestellt zu vermeiden, dass der Track "springen" von einer Zelle zur anderen. Für MZBs, legen Sie diesen Wert auf 10 Pixel erfassen Ausreißer, obwohl MZBs 2 Pixel auf aufeinander folgenden Frames in der Regel nicht überschritten werden, die 5 s auseinander.
- Für die minimale Anzahl der Frames, die ein Teilchen verfolgt werden, sein muss setzen Sie diesen Wert auf die Anzahl der Frames in dem Film für MZBs (z.B., 240) für einen 20 min Film mit 12 Frames/min. Jedoch wenn die Zellen schnell genug, um das Sichtfeld vor dem Ende der Bildgebung zu verlassen sind, legen Sie die minimale Anzahl von Frames auf weniger als die Dauer des Films. Beispielsweise mit schnellen T-Zellen, legen Sie die Mindestanzahl auf den Gegenwert von 5-10 min der Bildgebung.
Hinweis: Zeichnen Sie ein Makro folgendermaßen (Schwellwerte und MTrack2-kt), dieser Teil des Verfahrens zu automatisieren und Zeit sparen (siehe Zusätzliche Codierung Datei). Mit dem Makro automatisch einen Film in ImageJ verfolgen dauert weniger als eine Minute.
- Kopieren Sie die ausgegebenen Ergebnisse in einer Daten-Tabelle. Ändern Sie das Format für die dezimale Darstellung für alle Tabellenzellen auf Null stellen nach dem Komma. Fügen Sie eine leere Zeile am oberen Rand der Zelle Spuren in der Tabelle, und löschen Sie die Spalte "D". Speichern Sie die Datei als "Registerkarte" Stop getrennt".txt-Datei für die spätere Analyse im Ibidi Chemotaxis-Tool.
Hinweis: Das MTrack2-Plugin gibt die Zelle Spuren in Reihen von 75 parallelen Spalten. Für die Analyse im Ibidi-Chemotaxis-Tool muss die Zelle Tracks in einer einzigen Spalte. Um die Ausgabe zu konvertieren, das MTrack2-Plugin wurde modifiziert, um entweder Ausgabe im Originalformat oder als einzelne Spalte (Abb. 3 b) (siehe Zusätzliche Codierung Datei "MTrack2 kt", die in Java geschrieben ist). Kopieren Sie die Java-Datei auf ImageJ Plugins-Ordner. Wählen Sie in ImageJ "Plugins > kompilieren und ausführen". Neustart ImageJ und die geänderte Version der MTrack2 sollte im Menü Plugins angezeigt werden.
- Schwelle der Bilder aus dem Film Zelle Migration. Öffnen Sie den Bildstapel in ImageJ. Prozess der Bilder in ImageJ konvertieren Sie das Video aus, kontrastreiche Bilder zeigen die Zellen als schwarze Objekte auf einem weißen Hintergrund (Abbildung 3A) Farbe.
-
Um die Zelle Tracks mit dem Ibidi Chemotaxis-Tool analysieren, download Ibidi Chemotaxis und Migrations-Tool V2. 0 ("Stand alone") und öffnen Sie das Programm.
- Wählen Sie "Daten importieren" und navigieren Sie zu der .txt-Zelle-Track-Dateien. Mehrere Dateien können gleichzeitig ausgewählt werden. Importierte Dateien werden im Bereich "Datensätze" in rot angezeigt. Wählen Sie alle Objekte und geben Sie die korrekten Werte im Menü "Initialisierung" unten, um die folgenden Einstellungen gelten.
- Geben Sie entweder die genaue Zahl oder einen Bereich von der Anzahl der Scheiben (die Anzahl der Frames in dem Film).
- Im Menü "Kalibrierung" (X / Y-Kalibrierung), geben Sie die Größe eines Pixels. Suchen Sie diese Informationen in der Properties-Datei des Films. Für MZBs war ein 10 X-Objektiv verwendet, was eine Pixelgröße von 1.14 µm. In "Kalibrierungsmenü | Time Interval", geben Sie die Länge der Zeit zwischen den Bildern im Film.
- Übernehmen Sie die Einstellungen. Wählen Sie "Plot-Daten" die Spur Grundstücke anzeigen und bestätigen, dass der Track-Dateien öffnet. Ab diesem Zeitpunkt sind viele Optionen verfügbar, die in der Dokumentation für das Programm, einschließlich der Kennzeichnung die Tracks mit unterschiedlichen Farben basierend auf verschiedenen Eigenschaften beschrieben sind und Anzeigen der Einzel- oder durchschnittliche Werte für Geschwindigkeit, Migration weiterleiten Index, Direktheit und mehr (Abb. 3 b).
Hinweis: Die MZBs nehmen etwa 10 min zu erkennen und reagieren auf den Fluss, vermutlich durch ihre Integrin-komplexe auf den Fluss-Forward-Punkt der Zelle zu polarisieren. Ein Diagramm der Migration Index im Laufe der Zeit zeigen einen ersten Tropfen unter Null, entsprechend der ersten paar Minuten, die die Zelle ausgesetzt ist, fließen, gefolgt von einer allmählichen Aufstieg nach oben, bis der forward Migration-Index-Werte positiv sind. Somit kann es optimal, um diese ersten Minuten in der endgültigen Berechnungen ausgeschlossen sein, wenn dieser Prozess von Interesse ist.
Ergebnisse
Wir verwendet das Protokoll beschriebenen Migration von MZBs auf ICAM-1-beschichtete Folien ohne Strömung (0 dyn/cm2) vergleichen und Fluss (4 dyn/cm2) Scherung ausgesetzt. Zellen wurden automatisch mit MTrack2 und die daraus resultierende Spur, die Dateien überlagert wurden verfolgt, auf die Zelle Migration Filme Stromstille (0 dyn/cm2) und (4 dyn/cm2) zeigen die Verteilung und Form der Tracks (Abb. 4A). Zelle wurden dann in das Ibidi Chemotaxis-Tool (IKT) Track Grundstücke jedes Films (Abbildung 4 b) generieren importiert. Die durchschnittliche Migration Index (genannt "FMIy" in der IKT), Geschwindigkeit, Geradheit (genannt "Direktheit" in der IKT) und Luftlinie (genannt "Euklidische Entfernung" in der IKT) der Zelle Tracks aus 4 Filmen jeweils für beide Bedingungen wurden berechnet, in der Chemotaxis-Tool mit dem Befehl "Messwerte". Diese Durchschnittswerte wurden dann in GraphPad Prism kopiert, zur Erzeugung von Grafiken und Berechnung der statistischen Signifikanz (Abbildung 4).

Abbildung 1: MZB pendelt. (A) Modell der MZB pendeln zwischen der Randzone und der Follikel in der Milz. MZBs erfordern Internalisierung von S1PR1, ein Rezeptor für S1P und funktionelle CXCR5, einen Rezeptor für das Chemokin CXCL13, um den Follikel zu gelangen. Darüber hinaus müssen zur Erreichung des Follikels MZBs migrieren, gegen die Kraft des Blutflusses von Poren in den marginalen Sinus, der die Follikel umhüllt. Wenn ein MZB ICAM-1, die Liganden für LFA-1 Integrin Haftung verliert wird es geschoben in dem roten Fruchtfleisch durch die Kraft der Strömung, wo erhöhte Mengen an VCAM-1, die Liganden für VLA-4 nicht unterstützen würde, Migration. (B) Durchflusszytometrie Anspritzung Strategie um Reinheit testen sortiert MZBs mit Antikörpern gegen B220, CD23 und CD21. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Aufbau der Fluidik System, Pumpe, Mikroskop und Inkubation Kammer. (A) Bild des Pumpsystems (Ibidi18) bestehend aus einer Pumpe mit angeschlossenen Fluidik und Laptop läuft die Software um die Pumpe zu steuern. Höhere Vergrößerung Bild: der Fluss Kammer Folie mit 6 Kammern fließen, von denen die erste ist der Schlauch der Fluidik-Einheit an. (B) typische Einrichtung zur Messung der in-vitro-Migration von MZBs gegen Strömung. Ein Mikroskop, ausgestattet mit einer Heizkammer (Black Box) mit der Fluidics Einheit verbunden zu einer Pumpe (blaues Quadrat Objekt an der unteren rechten Ecke des Mikroskops) außerhalb des Mikroskops. Höhere Vergrößerung Bild: die Fluidics Einheit in das Mikroskop Heizung Kammer. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3: Quantifizierung der Bilddaten. (A) repräsentative Bilder eines Rahmens aus einem Film von Zugvögeln MZBs vor (links) und nach (rechts) Schnittstellenüberwachung das Bild, um die Zellen in schwarze Objekte auf einem weißen Hintergrund zu konvertieren. Bars in niedriger und hoher Vergrößerung Bilder skalieren = 100 µm. (B) linken Panel: Bild des typischen Ergebnisausgabe aus dem MTrack2 (einspaltigen Ausgabe) Plugin. Rechten Seite: Bild des Werkzeugs Ibidi Chemotaxis und Migration 2.0 nach der Eingabe des MTrack2 Ergebnisse zeigen eine Spur Grundstück von Migration MZBs und eine "Messwerte" Fenster zeigt die Mittelwerte der Parameter wie Geschwindigkeit, Migration Index und Direktheit (anzeigen grüne Felder), unter anderem. Kalibrierungseinstellungen gezeigt sind die Pixelauflösung von 1.14 µm pro Pixel und einem Zeitabstand von 5 s (0,083 min) pro Film-Frame. Bitte klicken Sie hier für eine größere Version dieser Figur.
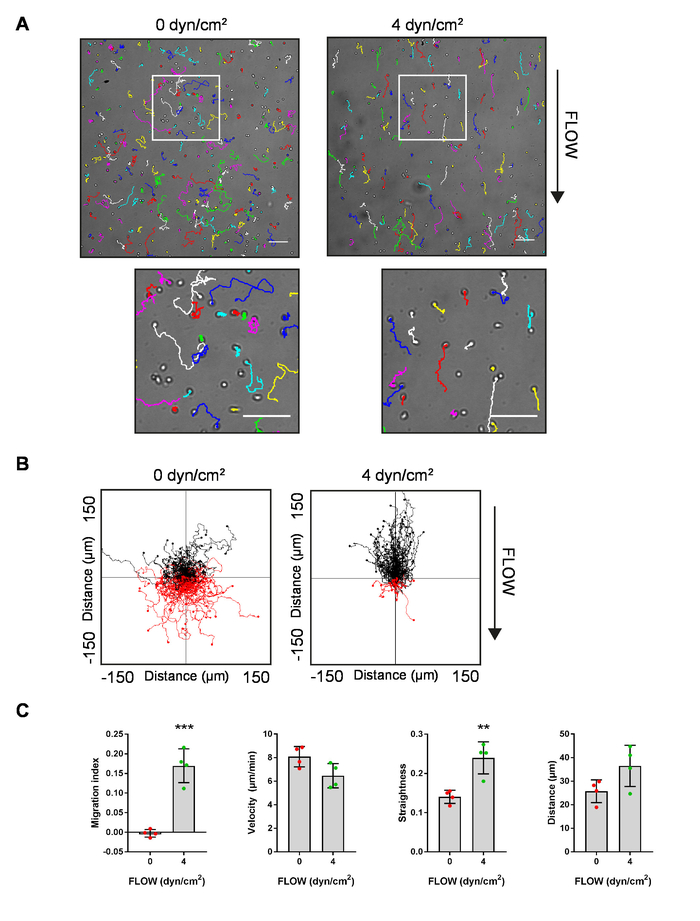
Abbildung 4: Beispiel für Ergebnisse, die mit dem Protokoll um zu messen, MZB pendelt. (A) Vertreter stills der Migration von MZBs mit einer Überlagerung von Tracks aus dem ImageJ-Plugin "MTrack2 kt". Hinweis: die Track-Farben wurden durch das "Handbuch Tracking" Plugin für ImageJ willkürlich festgelegt. Bars in beiden niedriger und hoher Vergrößerung-Einsätze zu skalieren = 100 µm. (B) repräsentativen Track Grundstücke Migration MZBs aus dem Ibidi Chemotaxis und Migration 2.0-Tool. Rote und schwarze Linien repräsentieren Zelle Tracks, die unterhalb oder oberhalb der horizontalen Achse, bzw. zu kündigen. In (A) und (B): links, MZBs Migration mit Stromstille (0 dyn/cm2); Recht, MZBs Migration zu einem 4 dyn/cm2 . (C) Index (FMIy), Geschwindigkeit, Geradheit (Direktheit) und Entfernung für MZBs ohne Migration Migration fließen (0 dyn/cm2) oder fließen (4 dyn/cm2) (n = 4 Mäuse in 4 separate Experimente). Fehlerbalken = Mittelwert ± SD; Der Student t -Test, ** p < 0,01 *** p < 0,001. Bitte klicken Sie hier für eine größere Version dieser Figur.
Ergänzende Datei 1: MTrack2_kt.java. Bitte klicken Sie hier, um diese Datei herunterladen.
Diskussion
Wir beschreiben hier eine Methode für die Analyse der Migration von Zellen, die die Kraft des Schubflusses zu erkennen und durch Veränderung ihrer Migration zu reagieren. Eine Analyse der MZBs zeigte, dass MZBs migrieren spontan auf ICAM-1 und im Beisein von fließen, werden migriert, bis die Strömung. In unserer bisherigen Arbeit haben wir gezeigt, dass MZBs nicht den Fluss von VCAM-1 migrieren aber stattdessen fixiert. Der murinen Milz Randzone enthält hauptsächlich ICAM-1, während das rote Fruchtfleisch ICAM-1 und VCAM-1 enthält. Aus diesen Daten könnte man ableiten, dass MZBs den Fluss und in der Randzone aber nicht in dem roten Fruchtfleisch wandern würde. Die Analyse wurde in Vivo mit MZBs mit defekten Haftung, die auf die Milz rote Pulpa durch die Kraft der Strömung12mislocalized wurden überprüft. Aus diesen Gründen stellen MZBs eine gute positive Kontrolle für die Prüfung der Flow-Migration-Systems hier beschrieben wird, auch wenn das System verwendet wird, um eine andere Zelle Art zu studieren.
Der wichtigste Aspekt des Verfahrens gewährleistet Konsistenz in Zelle handling auf der Folie. Weil die quantifizierbaren Aspekte der Zellwanderung hängt ab, die die Zellen zur Folie eingehalten, würde Ihnen Abnahme der zellulären Adhäsion reproduzierbare Ergebnisse erschweren. Verminderte zelluläre Adhäsion führen von Inkonsistenz in mehreren Faktoren ab, einschließlich Temperaturen des Puffers Migration oder die beheizte Inkubation (Kälte reduziert Haftung), Ebenen von kationen in der Zellsuspension (kationen beeinflusst Integrin-Bindung), Schieben Sie Handhabung (Tippen oder Beugung der Folie könnte Zellen verdrängen), und Zell-Dichte (Kollisionen zwischen den Zellen könnte Migrationsparameter beeinflussen). Andere sensible Punkte während des Verfahrens gehören nicht den Puffer in die Folie Vertiefungen mit zu viel Kraft vor dem Anbringen der Schläuche (wie dies Zelladhäsion reduzieren könnte) und halten Sie den Zeitaufwand für Protokoll Schritte konsequent in jedem Experiment (pipettieren Einschwingzeit Zelle könnte Klebkraft beeinträchtigen können). Zusammenfassend lässt sich sagen muss eine mögliche Beeinflussung der Zelladhäsion Wiederholungen, zuverlässige Migration Zellendaten produzieren einheitlich gehalten werden.
Diese Methode ist einfach einzurichten, da es kommerziell verfügbare Ausrüstung nutzt und Versorgungsmaterialien und keiner der Schritte erweiterte Anleitung erfordern. Für die Analyse der MZB sowie andere Zelltypen wie kultivierte CD8+ T Zellen, Beschichtung der Folien mit verschiedenen Integrin-Liganden ist ausreichend, um die Migration den Fluss zu beobachten. Studium strömungsinduzierte Migration als Reaktion auf verschiedene Integrin-Liganden führt zu direkten Identifizierung der aktiven Integrine auf der Zelloberfläche, möglicherweise enthüllt Mechanismen für in-vivo Funktionen als mit MZB Migration bis die Strömung auf ICAM-1, aber nicht VCAM-1. Es ist jedoch auch möglich, den Fluss Kammern eine endotheliale Zellschicht hinzufügen. Ein Beispiel der Immunzelle Migration, die von Schubfluss betroffen ist ist T-Zell-Extravasation durch Endothelzellen Layer3. Dieses Verfahren wurde verwendet, um die Aktivierung der T-Zell-Adhäsion über Integrine, Selectins und Chemokine und Modell Lymphozyten Migration durch die Blut - Hirn-Schranke zu entwirren. Die einzige Einschränkung, die Zellen, die mit dieser Methode analysiert werden kann ist, dass sie in der Lage, die Kraft der Strömung als ein Richtungssignal zu spüren sein müssen.
Obwohl die hier beschriebene Methode verwendet, um zellulare Verhalten wie Geschwindigkeit und drehen zu charakterisieren, kann es auch zur Analyse der molekularen Aspekte der Migration erweitert werden. Molekulare komplexe auf die strömungsinduzierte Migration, einschließlich Integrine wie LFA-1 und ihre Zellskelett Adapter wäre innerhalb 200 nM von der Oberfläche der Folie, Visualisierung mit TIRF-Mikroskopie zugänglich. Diese Ergänzung der Methode wäre ideal für das Studium Zellen von Mäusen mit Mutationen im Integrin - oder Zytoskelett-Proteine. Wie viele Immunzellen in verschiedenen Phasen ihrer Entwicklung durch Blut oder Lymphe fließt zu migrieren, kann die in-vitro-Migration beschrieben verwendet werden, um viele Arten von kultivierten oder primäre Leukozyten für Antwort zu fließen und zeigen, wie die Zellen sind systematisch zu testen programmiert, um in einer in-vivo Immunantwort zu migrieren. Abschließend bietet der hier beschriebenen Test eine zuverlässige und unkomplizierte Methode zur Analyse strömungsinduzierte Migration von MZBs, die auch auf andere Zelltypen ausgedehnt werden kann.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenlegen.
Danksagungen
Diese Arbeit wurde unterstützt durch Zuschüsse aus dem "Deutschen Forschungsgemeinschaft" SFB 854/TP11, K.-D.F
Materialien
| Name | Company | Catalog Number | Comments |
| VWR Cell Strainer, 70 µm | VWR | 10199-656 | |
| Pre-Separation Filters, 30 µm | Miltenyi | 130-095-823 | |
| MZB and FOB cell isolation kit | Miltenyi | 130-100-366 | |
| B220 CD45R, clone RA3-6B2, FITC | Biolegend | 103206 | |
| CD21 / CD 35, clone 7G6, APC | BD Biosciences | 558658 | |
| CD23, clone B3B4, PE | Biolegend | 101608 | |
| HBSS | Biochrom | L2035 | |
| D-PBS 1x | Gibco by Life Technologies | 14190-094 | |
| BSA albumin fraction V, fatty acid-free | Roth | "0052.3" | |
| ICAM-1 | R&D Systems | 796-IC-050 | |
| Ibidi µ-slides VI 0.4, hydrophobic, uncoated | Ibidi | 80601 | |
| Perfusion set, white, 50 cm, 0.8 mm | Ibidi | 10963 | |
| Ibidi Pump system | Ibidi | 10902 |
Referenzen
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinions in Cell Biology. 20 (5), 525-532 (2008).
- Dominguez, G. A., Anderson, N. R., Hammer, D. A. The direction of migration of T-lymphocytes under flow depends upon which adhesion receptors are engaged. Integrative Biology (Cambridge). 7 (3), 345-355 (2015).
- Steiner, O., et al. Differential roles for endothelial ICAM-1, ICAM-2, and VCAM-1 in shear-resistant T cell arrest, polarization, and directed crawling on blood-brain barrier endothelium. Journal of Immunology. 185 (8), 4846-4855 (2010).
- Valignat, M. P., Theodoly, O., Gucciardi, A., Hogg, N., Lellouch, A. C. T lymphocytes orient against the direction of fluid flow during LFA-1-mediated migration. Biophysical Journal. 104 (2), 322-331 (2013).
- Woolf, E., et al. Lymph node chemokines promote sustained T lymphocyte motility without triggering stable integrin adhesiveness in the absence of shear forces. Nature Immunology. 8 (10), 1076-1085 (2007).
- Cinamon, G., et al. Sphingosine 1-phosphate receptor 1 promotes B cell localization in the splenic marginal zone. Nature Immunology. 5 (7), 713-720 (2004).
- Cinamon, G., Zachariah, M. A., Lam, O. M., Foss, F. W., Cyster, J. G. Follicular shuttling of marginal zone B cells facilitates antigen transport. Nature Immunology. 9 (1), 54-62 (2008).
- Cyster, J. G., Schwab, S. R. Sphingosine-1-phosphate and lymphocyte egress from lymphoid organs. Annual Reviews in Immunology. 30, 69-94 (2012).
- Schwab, S. R., Cyster, J. G. Finding a way out: lymphocyte egress from lymphoid organs. Nature Immunology. 8 (12), 1295-1301 (2007).
- Cerutti, A., Cols, M., Puga, I. Marginal zone B cells: virtues of innate-like antibody-producing lymphocytes. Nature Reviews Immunology. 13 (2), 118-132 (2013).
- Mebius, R. E., Kraal, G. Structure and function of the spleen. Nature Reviews Immunology. 5 (8), 606-616 (2005).
- Tedford, K., et al. The opposing forces of shear flow and sphingosine-1-phosphate control marginal zone B cell shuttling. Nature Communications. 8 (1), 2261 (2017).
- ImageJ. MTrack2 Available from: https://imagej.net/MTrack2 (2018)
- . MTrack2 Available from: https://valelab4.ucsf.edu/~nstuurman/IJplugins/MTrack2.html (2018)
- . Chemotaxis and Migration Tool Available from: https://ibidi.com/chemotaxis-analysis/171-chemotaxis-and-migration-tool.html (2018)
- Reeves, J. P., Reeves, P. A. Removal of lymphoid organs. Current Protocols in Immunology. , (2001).
- . Manual Tracking Available from: https://imagej.nih.gov/ij/plugins/manual-tracking.html (2018)
- . ibidi Pump System Available from: https://ibidi.com/perfusion-system/112-ibidi-pump-system.html (2018)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten