Method Article
Proliferation und Differenzierung der murinen Myeloid Precursor 32D/G-CSF-R Zellen
In diesem Artikel
Zusammenfassung
Hier werden ausführliche Protokolle für die Kultivierung der murinen myeloid Precursor-32D/G-CSF-R Zell-Linie, Durchführung Virusinfektionen und Durchführung von Proliferation und Differenzierung Assays vorgestellt. Diese Zelllinie eignet sich für das Studium myeloische Zellentwicklung und die Rolle der Gene des Interesses an myeloischer Zellwachstum und Neutrophile Differenzierung.
Zusammenfassung
Verständnis der hämatopoetischen Stammzellen und Vorläuferzellen Zelle Biologie hat wichtige Implikationen für regenerative Medizin und die Behandlung von hämatologischen Erkrankungen. Trotz der wichtigsten Daten, die Verwendung von in-Vivo -Modelle oder Primärkulturen erworben werden können, schränkt die niedrigen Fülle von hämatopoetischen Stamm- und Vorläuferzellen deutlich am Pool geeigneter Techniken für ihre Untersuchung. Daher ermöglicht die Verwendung von Zelllinien ausreichende Produktion von biologischem Material für die Durchführung der Vorführungen oder Tests, die große Zelle Zahlen erfordern. Hier präsentieren wir eine detaillierte Beschreibung, Auslesen und Interpretation von Proliferation und Differenzierung Assays, die für die Untersuchung der Prozesse, die in Myelopoiesis und Neutrophile Differenzierung verwendet werden. Diese Experimente beschäftigen 32D/G-CSF-R Zytokin abhängigen murinen myeloische Zelllinie, die besitzt die Fähigkeit zu proliferieren in Anwesenheit von IL-3 und G-CSF zu unterscheiden. Wir bieten Protokolle für den Umgang mit 32D/G-CSF-R Zellen optimiert und besprechen wichtige Gefahren und Nachteile, die die beschriebenen Tests und erwarteten Ergebnisse gefährden könnte. Dieser Artikel enthält außerdem Protokolle für Lentivirale und retroviralen Produktion, Titration und Transduktion 32D/G-CSF-R-Zellen. Wir zeigen, dass genetische Manipulation dieser Zellen eingesetzt werden kann, um erfolgreich funktionelle und molekulare Studien durchzuführen, die Ergebnisse, die mit primären hämatopoetischen Stammzellen und Vorläuferzellen Zellen oder in Vivo Modellen ergänzen können.
Einleitung
Die hämatopoetische Stammzellen und Vorläuferzellen Bevölkerung versorgt den Organismus mit einer Vielzahl von reifen Zellen, einschließlich der Zellen von der myeloid Abstammung (Neutrophile, eosinophile, Basophils und Monozyten). Der Prozess, der die Produktion von myeloid Zellen aus hämatopoetischen Stammzellen antreibt ist bekannt als Myelopoiesis und ausreichende Produktion von Reifen myeloische Zellen als Reaktion auf wechselnde Anforderungen ist eine Voraussetzung für den ordnungsgemäßen Umgang des Organismus mit stress Krankheiten, wie Infektionen und Blutverlust. Unzureichende Produktion von Reifen myeloische Zellen führen zu Unfähigkeit, Krankheitserreger, reduzierten Blutgerinnung und anderen lebensbedrohlichen Bedingungen1,2zu beseitigen. Darüber hinaus können Veränderungen im myeloid Abstammung Entwicklung auch hämatologischen malignen Erkrankungen, wie akute myeloische Leukämie (AML)3zugeordnet werden. Veränderungen in der Myelopoiesis können aus verschiedenen Gründen auftreten, wie z. B. Defekte Zelle Oberfläche Rezeptoren4, veränderten Ausdrucksformen der Transkription Faktoren5, Signalisierung Bahnen6, was Bildung Mutationen beeinträchtigt / Aktivierung der Onkogene7oder Inaktivierung von Tumor-Suppressor-Gene-8.
Verschiedene Methoden wurden entwickelt, um myeloischen Entwicklung zu untersuchen und beurteilen die Wirkung von bestimmten genetischen Veränderungen, die in diesem Prozess. Gemeinsame Ansätze zur Myelopoiesis Untersuchung beinhalten Primärzellen und transgenen Mäusen. Obwohl diese Modelle Erwerb von biologisch relevante Daten erlauben, haben sie bestimmte Einschränkungen. Die Verwendung von Primärzellen begegnet eine begrenzte Anzahl von Zellen und eine Sperrfrist von Kultur, Einengung der Möglichkeiten um die Genexpression und anschließende biologische oder biochemische Analyse zu ändern. Transgene Mäuse sind teuer und erfordern ein vernünftiges Maß an biologische Begründung. Darüber hinaus fügt arbeiten mit in Vivo Modellen einen Grad an Komplexität zu verstehen, die Rolle eines Gens von Interesse in einem bestimmten Prozess. Daher werden alternative Ansätze, diese Einschränkungen zu umgehen benötigt. Zell-Linien haben unbestreitbare Vorteile: (1) sie besitzen unbegrenzte Verbreitung Kapazität, die ermöglicht die Generierung von genug Material für biochemische und biologische Studien, (2) sie sind anfällig für genetische Manipulationen (Zuschlag, Ko, Überexpression), (3) die Kosten sind relativ gering, und (4) sie erlauben eine gewisse biologische Vereinfachung in bestimmten experimentellen Ansätze erforderlich.
Die elterliche IL-3 (Interleukin-3) abhängige 32D Zelllinie wurde 1983 von Greenberger und Kollegen durch Infektion der Knochenmarkzellen von C3H/HeJ Mäuse mit Freund murine Leukämie-Virus9gegründet. Mehreren 32D Klone wurden in der Literatur beschrieben: cl-239, cl-310und cl-10-11. Die 32D cl-3 Zellen erwiesen sich vermehren sich in IL-3 und Neutrophile Differenzierung bei der Behandlung mit Granulozyten-Kolonie Stimulation Faktor (G-CSF)10zu unterziehen. Im Gegenteil, waren 32D cl-10 Zellen, während IL-3 abhängige Wesen ursprünglich nicht in Reaktion auf die Behandlung von G-CSF Differenzierung. Im Jahr 1995 ausgestrahlt der Gruppe von Dr. Ivo Touw retrovirally 32D cl-10 Zellen mit Wildtyp und mutierte Formen von G-CSF Rezeptor (G-CSF-R), um funktionell wichtige Regionen dieses Rezeptors11zu ermitteln. Diese Studie ergab Generation von den 32D/G-CSF-R-Zellen, die in ähnlicher Weise abhängig von IL-3 sind, aber innerhalb von 6 bis 10 Tage nach dem Austausch des IL-3 mit G-CSF, Zellen aufhören zu vermehren und irreversibel in Reife Neutrophile unterscheiden. Diese Eigenschaften machen 32D cl-3 und 32D/G-CSF-R Zellen vereinfachte Modelle der murinen Neutrophile Differenzierung, die durch zwei klar definierte Wachstums- und Differenzierungsfaktoren - IL-3 und G-CSF moduliert werden kann. In den letzten Jahrzehnten haben mehrere Gruppen 32D/G-CSF-R-Zellen verwendet, um die Rolle bestimmter Gene Proliferation und Differenzierung myeloischer Zellen in Kultur12,13,14,15 studieren , 16, und G-CSF Signalisierung17,18zu studieren. Wichtig ist, die erzielten Ergebnisse mit dieser Zelllinie mit Primärzellen mit transgenen Mäusen16,19,20,21gewonnenen Daten korreliert. Daher glauben wir, dass 32D/G-CSF-R-Zellen, eine verbreitete und etablierte Modell, stellen ein wertvolles System myeloische Differenzierung zu studieren, die parallel mit anderen Ansätzen dieser Frage verwendet werden können.
Hier ausführliche Protokolle, die Handhabung der Zelllinie 32D/G-CSF-R beschreiben, welche Abdeckung Erweiterung, Differenzierung und Bewertung der Proliferation und Differenzierung der Zellen wird vorgestellt. Detaillierte Informationen für die genetische Veränderung von 32D/G-CSF-R-Zellen sind entweder durch Retroviren oder Lentivirale Transduktion sowie Protokolle für die Virus-Titration zur Verfügung gestellt. Darüber hinaus sind mehrere repräsentative Ergebnisse, die Anwendungsmöglichkeiten der 32D/G-CSF-R Zellen zeigen zur Verfügung gestellt.
Protokoll
Hinweis: Schritte beschreiben Erweiterung, Differenzierung und Transduktion 32D/G-CSF-R-Zellen unter präsentieren.
1. Vorbereitung
- Medien-Vorbereitung
- 250 mL Kulturmedium vorbereiten: (Roswell Park Memorial Institute) RPMI 1640 Medium ergänzt mit 10 % Hitze inaktiviert FBS (fetale Rinderserum) und murinen IL-3 (10 ng/mL).
- Alternativ können Sie hausgemachte IL-3. Zu produzieren hausgemachte IL-3, transduzieren HEK293 Zellen mit IL-3 mit dem Ausdruck ihrer Vektor und IL-3 mit Überstand22zu sammeln.
Beachte: Antibiotika wie Penicillin G (100 IE/mL), Streptomycin (100 µg/mL) und Gentamicin (40 µg/mL), verwendbar für die Zelle Kultivierung bei jedem Schritt des Protokolls, sofern nicht anders angegeben.
- Alternativ können Sie hausgemachte IL-3. Zu produzieren hausgemachte IL-3, transduzieren HEK293 Zellen mit IL-3 mit dem Ausdruck ihrer Vektor und IL-3 mit Überstand22zu sammeln.
- 50 mL Differenzierung Medium vorbereiten: RPMI 1640 Medium ergänzt mit 10 % FBS und menschlichen G-CSF (100 ng/mL).
Hinweis: Nicht alle Serumchargen unterstützen Differenzierung von 32D/G-CSF-R-Zellen (wichtig). Vor dem Experiment starten Test verschiedene Chargen des Serums. Es wird empfohlen, mindestens 4 verschiedene Chargen zu testen und wählen die optimale basierend auf die Fähigkeit der 32D/G-CSF-R-Zellen zu differenzieren. 32D/G-CSF-R Differenzierung Protokoll unten zu sehen. - 10 mL Einfrieren Medium vorbereiten: RPMI 1640 Medium ergänzt mit 40 % FBS und 10 % DMSO (Dimethyl Sulfoxid).
- 250 mL Kulturmedium vorbereiten: (Roswell Park Memorial Institute) RPMI 1640 Medium ergänzt mit 10 % Hitze inaktiviert FBS (fetale Rinderserum) und murinen IL-3 (10 ng/mL).
- Produktion von Retroviren
- Eine einzelne Zelle Aussetzung der Bosc23 Zellen (6 × 106) in einer Petrischale 16 cm Platte und pflegen in 18 mL DMEM (Dulbeccos geändert Eagle Medium) mit 10 % FBS bis die Konfluenz der Kultur 80 % (24 h erreicht).
Hinweis: Zellen sollten in einem monomolekularen Film und nicht die Form Klumpen in Kultur wachsen. Zellzählung kann mit verschiedenen Methoden (gültig für den Rest der hier vorgestellten Protokolle) durchgeführt werden. Im Falle einer geringen Anzahl von Proben wird es empfohlen, die manuelle Zählung unter dem Mikroskop mit Bürker Kammer. In diesem Fall verwenden Sie Trypan blau für den Ausschluss von abgestorbenen Zellen. Zellen 1:1 mit 0,4 % mischen Trypan blau mit PBS-Puffer. Zur Zählung der großen Anzahl von Proben durchführen, kann ein automatische Zelle Zähler eingesetzt werden. - Kombinieren Sie 40 µg retrovirale Konstrukt (z. B. MSCV), 20 µg pCL-Eco (Verpackung Vektor)23, 80 µl PEI (Polyethylenimine) und 2 mL reduziert Serum Medium (z. B. Opti-MEM) Medium (ohne Antibiotika). Diese Mischung für 20 min bei Raumtemperatur (RT) inkubieren.
- Ersetzen Sie sorgfältig Bosc23 Zellen Medium mit 16 mL DMEM ergänzt mit 2 % FBS. Wärmen Sie Mittel-bis 37 ° C vor dem Gebrauch vor.
Hinweis: Verwenden Sie Antibiotika während Transfektion, da es Transfection Leistungsfähigkeit verringern kann. - Fügen Sie die Mischung in 1.2.2 vorbereitet. tropfenweise und sorgfältig die Bosc23 Kultur, und 4 h bei 37 ° c inkubieren Inkubation auf weniger als 6 h durch PEI Toxizität zu begrenzen.
- Nach der Inkubation ändern Bosc23 Medium bis 18 mL DMEM mit 10 % vorgewärmt FBS, und kultivieren Sie Zellen für 48 h bei 37 ° C. Legen Sie Speisen in einem Labor Biosafety Level 2, hier davon halten Sie ab, diesen Schritt auf und führen Sie standard-Sicherheits-Verfahren.
- Bosc23 Medium (enthaltenden Ecotropic retroviralen Partikel) mit einer serologischen 25-mL-Pipette in ein 50 mL konische Röhrchen zu sammeln, und bei 4 ° c lagern
Hinweis: (Wichtig) Transfection Leistungsfähigkeit sollte 90 % um einen hohen Titer-Virus produzieren erreichen. - Hinzugefügt 18 mL DMEM vorgewärmt 10 % FBS, Bosc23 Zellen und pflegen für 24 h.
- Wiederholen Sie Schritt 1.2.6.
Hinweis: Retroviren Überstände von 1.2.6 und 1.2.8 können zusammengefasst werden, sobald sie die gleiche Temperatur (4 ° C erreichen) um virale Integrität zu wahren. - Zur Vermeidung von Bosc23 Verunreinigungen in der viralen Überstände spin gesammelten Virus bei 1500 × g für 10 min bei 4 ° C. Aliquoten Virus snap mit Trockeneis oder flüssigem Stickstoff eingefroren und bei-80 ° c lagern Beachten Sie jedoch, dass frisch zubereitete Virus von höherer Qualität in Bezug auf die Effizienz der Infektion als gefrorene Aktien ist.
Hinweis: (Wichtig) vermeiden Sie wiederholte Einfrieren/Auftauen des Virus, da es zu einer viralen Verschlechterung führt.
- Eine einzelne Zelle Aussetzung der Bosc23 Zellen (6 × 106) in einer Petrischale 16 cm Platte und pflegen in 18 mL DMEM (Dulbeccos geändert Eagle Medium) mit 10 % FBS bis die Konfluenz der Kultur 80 % (24 h erreicht).
- Produktion von lentivirus
- Eine einzelne Zelle Aussetzung der HEK293T (menschliche embryonale 293T) Nierenzellen (6 × 106) in einer Petrischale 16 cm Platte und pflegen in 18 mL DMEM mit 10 % FBS bis die Konfluenz der Kultur 80 % (24 h erreicht).
Hinweis: Zellen sollten in einem monomolekularen Film und nicht die Form Klumpen in Kultur wachsen. - Kombinieren Sie 15 µg Lentivirale Konstrukt (z. B. pGhU6), Verpackung Plasmide pCMVdR8.74 (Codierung für Gag/Pol, 12 µg) und pMD2.VSVG (Codierung für VSV-G, 1,4 µg), 85,2 µL PEI und 2 mL reduziert Serum Medium (ohne Antibiotika). Diese Mischung für 20 min bei RT inkubieren
- Ersetzen Sie sorgfältig HEK293T Medium mit 16 mL DMEM ergänzt mit 2 % FBS. Wärmen Sie Mittel-bis 37 ° C vor dem Gebrauch vor. Verwenden Sie Antibiotika nicht während Transfection, da es Transfection Leistungsfähigkeit verringern kann.
- Sorgfältig Tropfen der Mischung in 1.3.2 für die Zellkultur HEK293T vorbereitet und 4 h bei 37 ° c inkubieren Dauer der Inkubation, innerhalb von 6 h PEI Toxizität zu verhindern zu begrenzen.
- Änderung Mittel-bis 18 mL DMEM vorgewärmt 10 % FBS und kultivieren Zellen für 48 h bei 37 ° C. Legen Sie Speisen in einem Labor Biosafety Level 2, hier davon halten Sie ab, diesen Schritt auf und führen Sie standard-Sicherheits-Verfahren.
- Sammeln Sie HEK293T Medium (enthaltenden Amphotropic Lentivirale Partikel) mit einer serologischen 25-mL-Pipette in ein 50 mL konische Röhrchen und speichern Sie es bei 4 ° C.
Hinweis: (Wichtig) Transfection Leistungsfähigkeit sollte 90 % um einen hohen Titer-Virus produzieren erreichen. - Fügen Sie sorgfältig 18 mL vorgewärmten DMEM 10 % FBS zu den HEK293T Zellen. Pflegen Sie für 24 h bei 37 ° C.
- Wiederholen Sie Schritt 1.3.6.
Hinweis: Lentivirale Überstände von 1.3.6 und 1.3.8 können gebündelt werden, sobald sie die gleiche Temperatur (4 ° C erreichen) um virale Integrität zu wahren. - Zur Vermeidung von Kontamination der viralen überstand mit HEK293T Zellen spin gesammelten Virus bei 1500 × g für 10 min bei 4 ° C. Aliquoten Virus snap mit Trockeneis oder flüssigem Stickstoff eingefroren und bei-80 ° c lagern Beachten Sie jedoch, dass frisch zubereitete Virus von höherer Qualität in Bezug auf die Effizienz der Infektion als gefrorene Aktien ist.
Hinweis: (Wichtig) vermeiden Sie wiederholte Einfrieren/Auftauen des Virus, da es zu einer viralen Verschlechterung führt.
- Eine einzelne Zelle Aussetzung der HEK293T (menschliche embryonale 293T) Nierenzellen (6 × 106) in einer Petrischale 16 cm Platte und pflegen in 18 mL DMEM mit 10 % FBS bis die Konfluenz der Kultur 80 % (24 h erreicht).
- Titration von Virus, enthält einen GLP-reporter
- Samen 1 × 105 NIH/3 t 3 Zellen in DMEM 300 µL 10 % FBS pro Bohrloch in einer 24-Well-Platte. 7 Brunnen werden zu einem Virus Titer eingesetzt werden.
- Virus bei 37 ° C Auftauen und NIH/3 t 3 Kulturen 1, 5, 10, 50, 100 und 500 µL Virus hinzufügen. Fügen Sie keine Viren in negative Kontrolle gut. Kultivieren Sie Zellen in Anwesenheit des Virus für 48 h bei 37 ° C.
- NIH/3 t 3 Zellen mittels Trypsin/EDTA (Ethylenediaminetetraacetic Säure) 30 µL zu ernten (0,25 % Trypsin, 0,01 % EDTA mit PBS-Puffer) und Zellen in 250 µL PBS in einer Röhre FACS (Fluoreszenz aktiviert Zellsortierung).
- Bestimmen Sie die Häufigkeit der GFP+ Zellen durch Durchflusszytometrie in jeder Probe24. Abgestorbene Zellen durch Zugabe eines Farbstoffs Lebensfähigkeit, wie Hoechst 33258 ausschließen.
- Berechnen Sie die Gesamtzahl der GFP+ Zellen (basierend auf der Anzahl der vergoldeten Zellen und Anteil der GFP+ Zellen) und zeichnen sie gegen das Volumen der Virus-Infektion verwendet.
Hinweis: (Wichtig) Effizienz der Infektion ein Plateau erreicht, wenn große virale Dosen angewendet werden. Daher ist es wichtig, schätzen die Titer basierend auf virale Konzentrationen an welche, die Infektion Effizienz in einem linearen Bereich (Beispiel siehe Tabelle 1) auftritt. Die Anzahl der GFP+ Zellen gibt die Anzahl der funktionellen Viruspartikel (TU - Umwandlung von Einheiten) in einem bestimmten Virus-Volumen. Berechnen Sie die Anzahl der TU pro mL.
- Titration von Virus, enthält einen Puromycin-reporter
- Samen 5 × 104 NIH/3 t 3 Zellen in 3 mL DMEM 10 % FBS pro Bohrloch in einer 6-Well-Platte; 6 Brunnen, ein Virus Titer zu beschäftigen. Kultur über Nacht bei 37 ° C.
- Verdünnen Sie nächsten Tag Virus, wie in Tabelle 2angegeben. Um den Virus zu verdünnen, verwenden Sie vorgewärmte DMEM 10 % FBS. Tun Sie nicht Wirbel.
- Entfernen Sie Kulturmedium von NIH/3 t 3 Zellen zu, und fügen Sie 1 mL der verdünnten Virus.
- Über Nacht bei 37 ° c inkubieren
- Ersetzen Sie sanft die Virus-haltigen Medium mit 2 mL vorgewärmten DMEM 10 % FBS, und über Nacht bei 37 ° c inkubieren
- Ersetzen Sie sanft NIH/3 t 3 Medium, mit 2 mL vorgewärmten DMEM 10 % FBS enthaltenden Puromycin (2 µg/mL).
- Kultur bei 37 ° C und sorgfältig Aktualisierung Medium mit Puromycin alle 3 Tage oder als Medium gelb wird.
- Aspirieren Sie bei 10 bis 12 Tage nach der Infektion Medium aus jedem Brunnen und waschen Sie vorsichtig mit PBS.
- Färben mit 1 mL Kristallviolett-Lösung (0,5 % Kristallviolett 20 % Ethanol und dH2O), 2 min bei RT, und zweimal sorgfältig mit PBS waschen.
- Anzahl blaue Kolonien in jede Vertiefung unter dem Mikroskop (Vergrößerung X4) vorhanden. Keine Kolonien sollte in der negativen Kontrolle gut beobachtet werden.
- Die Gesamtzahl der TU/mL in Anbetracht den Verdünnungsfaktor zu berechnen.
2. Ausbau und Wartung der 32D/G-CSF-R-Zellen
- 32D/G-CSF-R Zellen fixiert, eine aliquote nehmen und Auftauen der Zellen im Wasserbad 37 ° C für 1 min und gießen Sie Zellen aus dem Fläschchen direkt in 10 mL vorgewärmten RPMI 1640 Medium ergänzt mit 10 % FBS in eine 15-mL-Tube. Invert das Rohr 3 Mal und die Zellen nach unten drehen sich mit 400 × g. Überstand zu entfernen und Aufschwemmen Zellen in IL-3 mit Nährmedium in einer Konzentration von 0,3 × 106 Zellen/mL.
- Optimale Zelle Wachstum Konzentration beträgt 0,25-0,5 × 106 Zellen/mL. Teilen von Zellen alle 2 Tage bringt sie zu einer Konzentration von 0,1-0,2 × 106 Zellen/mL.
Hinweis: (Wichtig) 32D/G-CSF-R Zellen verlieren teilweise ihre Fähigkeit zu unterscheiden, wenn Konzentrationen höher als 1 × 106 Zellen/mL gewachsen. Daher ist es sehr wichtig, um rechtzeitig 32D/G-CSF-R Zellen aufgeteilt. - Je nach Bedarf, frieren Sie ein und lagern Sie Zelle Aliquote für längere Zeit bei-80 ° C oder in flüssigem Stickstoff. Spin-down 3 × 106 Zellen, überstand zu entfernen und in 1 mL Einfrieren Medium aufzuwirbeln. Legen Sie Rohr in einem eiskalten Container bei-80 ° C. Positionieren Sie für die langfristige Lagerung Zellen in flüssigem Stickstoff.
(3) Transduktion 32D/G-CSF-R-Zellen
- Platte 32D/G-CSF-R Zellen in 6-Well-Platte in einer Konzentration von 0,3 × 106 Zellen/mL.
- Fügen Sie die entsprechende Menge des Virus, ein MOI (Multiplizität der Infektion) zwischen 10 und 40 zu erreichen.
Hinweis: Höhere MOI führt zu erhöhten Anteil der GFP+ Zellen sowie höhere Expression des Gens von Interesse. Beispiel: 0,3 × 106 infizieren Zellen mit einer MOI von 10; 3 × 106 TU müssen die 32D/G-CSF-R-Zellen hinzugefügt werden. - Endkonzentration 8 µg/mL Polybrene hinzu und 6 h bei 37 ° c inkubieren Alternativ führen Sie einen Spin-Impfung: Zentrifugieren bei 1200 × g für 90 min. bei 30 ° C in einer Kultivierung Platte mit einem Swing-Eimer-Rotor und 3 h bei 37 ° c inkubieren
- Sammele Zellen übertragen auf eine 15-mL-Tube und drehen sich mit 450 × g für 5 min (4 ° C).
- Den Überstand verwerfen, Aufschwemmen gebeizte Zellen in 6 mL Kulturmedium, statt in ein T25 Zelle Kultur Kolben und Kultur bei 37 ° C.
- 48 h später, Zellen zu ernten und mit 450 × g für 5 min (4 ° C) drehen. Verwerfen Sie den überstand.
- Im Falle einer GLP-Reporter: Platzzellen in 500 µL PBS und Art GFP+ -Zellen mittels einen Flow Cytometry Sorter. Im Falle einer Puromycin-Reporter mit Vektor: Platzzellen in Kulturmedium mit 2 µg/mL von Puromycin.
- Bedarf für weitere Analysen und Experimente Zellen erweitert werden.
Hinweis: (Optional) Transduced Zellen können im eiskalten Medien in einem eiskalten Container bei-80 ° C eingefroren, und weiter in flüssigem Stickstoff gelagert.
(4) 32D/G-CSF-R Zell-Proliferation assay
- Zur Verbreitung Rate statt 0,2 × 106 Zellen in 1 mL Kulturmedium zu bewerten und über Nacht bei 37 ° c inkubieren
- Nächsten Tag die Anzahl der Zellen und verdünnen sie zurück zu einer Konzentration von 0,2 × 106 Zellen/mL Kulturmedium mit. Über Nacht bei 37 ° c inkubieren Aufzeichnungen Sie über Zelle Konzentrationen und Verdünnungen auf den täglichen Kulturen mit Tabelle 3angewendet.
- Wiederholen Sie Schritt 4.2 für so viele Tage wie Verbreitung muss beurteilt werden.
Hinweis: Die Länge des Assays Verbreitung hängt die Wirkung des Gens von Interesse. Bei einer starken Phänotyp kann 8-9 Tage ausreichen, um einen signifikanten Effekt (siehe Abbildung 3A) zu beobachten sein. Im Falle einer milden Phänotyp können jedoch längere Zeit erforderlich sein. - Bewerten Sie Zellwachstum durch eine Verbreitung Kurve zu machen, wie in Tabelle 3angegeben.
(5) 32D/G-CSF-R Zell-Differenzierung assay
- Waschen Sie 0,2 × 106 32D/G-CSF-R Zellen zweimal mit RPMI Medium ohne Zytokine.
Hinweis: Die Waschschritte vor Zugabe von G-CSF in der Kultur sind wichtig, da Anwesenheit des restlichen IL-3 Differenzierung hemmen kann. - Setzen Sie Zellen in 1 mL Differenzierung (-haltigem Medium 100 ng/mL G-CSF) in einer 24/Platte, was zu einer Zelle Konzentration von 0,2 × 106 Zellen/mL (Tag 0). Kultur über Nacht bei 37 ° C.
- Anzahl der Zellen/mL wie oben (Schritt 1.2.1) angegeben.
- Cytospin 2 bis 5 × 104 Zellen auf einem Objektträger (76 X 26 mm) mit Hilfe einer Zentrifuge mit erforderlichen Adaptern bei 20 × g.
- Aktualisieren Sie Differenzierung Mittel- und Platte Zellen in einer Konzentration von 0,2 × 105 Zellen/mL auf einen 24/Platte (Tag1). Entsorgen Sie die alte Platte, und fahren Sie nächsten Tag mit Schritt 5.6 mit der neuen Platte.
- Am Tag 2 bis 7 wiederholen Sie die Schritte 5,3 bis 5,5. Zellproliferation in Anwesenheit von G-CSF zu beurteilen, wie in Schritt 4 beschrieben.
Hinweis: (Wichtig) während der Differenzierung, Zellproliferation verlangsamt, also nach 3 bis 4 Tagen in Anwesenheit von G-CSF ist es ausreichend, Zellkulturen bei höheren Konzentrationen. - Bewerten Sie Differenzierung Bundesstaat 32D/G-CSF-R Zellen basierend auf Zellmorphologie.
- Zellen aus Schritt 5.4 in Methanol für 5 min bei RT zu beheben und Folien an der Luft trocknen lassen.
Hinweis: Dias von Tag 0 bis 7 können bei RT gelagert und gleichzeitig fixiert. Ebenso können sie auch bei RT für längere Zeit nach der Fixierung gehalten werden. - Zellen unter Verwendung des folgenden Herstellers Färbeprotokoll May-Grünwald-Giemsa Fleck.
- Gefärbte Zellen mit einem Mikroskop und Vergrößerung X40 zu visualisieren.
- Anzahl von Explosionen, Klosterturm differenzierte Zellen und Reife Granulozyten mit anschaulichen Bildern auf Abbildung 1 und Beschreibung in Tabelle 4zu quantifizieren.
- Zellen aus Schritt 5.4 in Methanol für 5 min bei RT zu beheben und Folien an der Luft trocknen lassen.
Ergebnisse
Proliferation und Differenzierung von Zellen 32D/G-CSF-R
Proliferation von Zellen 32D/G-CSF-R unter Pro-proliferative und pro-Differenzierung zu bewerten, wurden in Medien mit IL-3 und G-CSF, bzw. 32D/G-CSF-R Zellen kultiviert. Es wurde beobachtet, dass Zellen kultiviert in IL-3 enthaltenden Medium (10 ng/mL) etwa alle 24 h (Abbildung 2A) teilen. Auf Ersatz von IL-3 mit G-CSF (100 ng/mL) Verbreitung allmählich verlangsamt und nach 4 Tagen (Abbildung 2A) gestoppt. Darüber hinaus wurde der Differenzierung Zustand der Zellen in Anwesenheit von G-CSF mit May-Grünwald-Giemsa gefärbten Cytospun Zellen kultiviert bewertet. Es zeigte sich, dass am Tag 0 (vor Beginn der Behandlung von G-CSF) Zellen eine unreife Myeloblast-wie Morphologie, zeichnet sich durch einen großen Kern und eine dunkel Zytoplasma (Abb. 2 b) präsentieren. Im Laufe der Behandlung ist die nukleare verkleinert und die Form der Kern Änderungen an einen Mond-förmigen oder Donut-Form. Darüber hinaus das Zytoplasma wird vergrößert und verliert die dunkle violette Farbe. Nach 6 Tagen Behandlung mit G-CSF präsentieren Zellen Zeichen der vollen Neutrophile Differenzierung, gekennzeichnet durch einen lappenden Kern und einen leichten violetten Zytoplasma (Abb. 2 b). Die Differenzierung der Zellen 32D/G-CSF-R ist ein schrittweiser Prozess, wo nicht alle Zellen in Richtung Reife Neutrophile mit der exakt gleichen Geschwindigkeit entwickeln. Quantifizierung der Zellen in den verschiedenen Phasen im Laufe der Differenzierung (nämlich Explosion, Klosterturm differenzierte Zellen und Neutrophilen) ist in Abbildung 2 bdargestellt.
Murine Evi2b Zuschlag blockiert Neutrophile Differenzierung in 32D/G-CSF-R-Zellen
Für höhere EVI2B (virale Integrationsort Ecotropic 2 b) in 32D/G-CSF-R Zellen, 3 Evi2b-targeting (Sh2, Sh3, Sh4) und 1-targeting-silencing Kontrolle (NSC1) ShRNAs wurden entwickelt; Diese wurden in einen Lentivirale Vektor tragen eine GFP Reporter16geklont. 32D/G-CSF-R-Zellen wurden mit Kontroll- und Evi2bausgestrahlt-ShRNAs mit einer MOI von 10 zum Schweigen zu bringen. Zwei Tage nach Transduktion, wurden GFP+ (ausgestrahlt) Zellen sortiert und für den weiteren Experimenten erweitert. Für den Fall, dass der Sh3 und Sh4, EVI2B Erschöpfung 80 % erreicht, aber Sh2 konnte effizient Downregulate EVI2B Protein-Ebene, und diente daher als eine zusätzliche Kontrolle bezeichnet hier als nicht-silencing Control 2 (NSC2). Vier Tage nach Transduktion, Differenzierung und Proliferation Assays wurden in Anwesenheit von G-CSF durchgeführt und die Auswirkungen der Evi2b Herabregulation in diesen Prozessen wurden ausgewertet. Es wurde beobachtet, dass Evi2b-abgereicherte Zellen (Sh2, Sh3) nachhaltig Zellproliferation in Anwesenheit von GCSF, während der Kontrollzellen (NSC1 und NSC2) Verbreitung rund um Tag 4 (Abbildung 3A) reduziert. Weiter, Evi2b-schallgedämpfte 32D/G-CSF-R-Zellen produziert weniger zwischen- und Reife Neutrophile im Vergleich zu Kontrollzellen (Abb. 3 b). Bemerkenswert ist, zeigte Zellen ausgestrahlt mit NSC2, die Armen Evi2b Knockdown Effizienz unter Beweis gestellt, auch leichten Rückgang in der Anzahl der Reife Neutrophile (Abb. 3 b). Diese Daten wurden kürzlich erschienenen16.
BCR-ABL Schmelzverfahren Protein beeinträchtigt Neutrophile Differenzierung in 32D/G-CSF-R-Zellen
Es hat sich gezeigt, dass BCR-ABL Schmelzverfahren Protein myeloische Differenzierung beeinträchtigt, was zu einer umfangreichen Erweiterung der myeloischen Vorläuferzellen, die Ergebnisse in hämatopoetischen Ausfall während der akuten Phase von chronisch-myeloischer Leukämie25,26. Frühere Studien zeigten, dass erzwungene Ausdruck der BCR-ABL in 32D cl-3 Zellen in einem Block von Neutrophilen Differenzierung27,28geführt. Daher untersuchten wir, ob ähnliche mit der 32D/G-CSF-R Zell-Linie Ergebnisse konnten. 32D/G-CSF-R-Zellen wurden mit BCR-ABL oder Kontrolle MSCV retroviral Vektor tragen einen GLP-Reporter ausgestrahlt (MOI = 20). 2 Tage nach Transduktion, wurden GFP+ Zellen sortiert und für 2 Wochen im IL-3 enthaltenden Medium erweitert. Als nächstes wurden im Beisein von G-CSF Differenzierung Assays durchgeführt. Wir beobachteten, dass am Tag 0 (bevor die Zellen auf G-CSF enthaltenden Medium übertragen), MSCV kontrollieren und BCR-ABL mit dem Ausdruck 32D/G-CSF-R Zellen ähnliche Morphologie präsentiert, hauptsächlich aus unreifen myeloischen Blasten (Abbildung 4). Jedoch wir gezeigt, dass bei leerer Vektor ausgestrahlt Kontrollzellen Neutrophile Differenzierung nach 6 Tagen von G-CSF Behandlung unterzog (Herstellung von 11,5 % der Reifen Neutrophilen und 56,4 % der Klosterturm differenzierten Zellen), keine Reifen Neutrophilen entstanden aus BCR-ABL-ausgestrahlt 32D/G-CSF-R Zellen (Abbildung 4). Konsequent, blieb der Anteil der unreifen Explosion in BCR-ABL mit dem Ausdruck ihrer Zellen in G-CSF auf den Prozentsatz der Explosion in IL-3 Bedingungen auf ähnlichem Niveau.
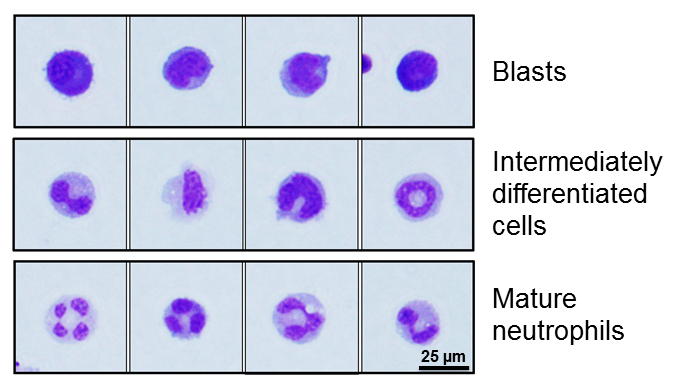
Abbildung 1: Repräsentative Bilder von unterschiedlichen 32D/G-CSF-R Zelle Morphologie. 32D/G-CSF-R Zellen morphologisch als Explosion eingestuft werden, Klosterturm differenzierte Zellen und Reife Neutrophile. Beschreibung finden Sie unter Tabelle 4 .

Abbildung 2: Proliferation und Differenzierung von Zellen 32D/G-CSF-R. (A) Verbreitung von 32D/GCSFR Zellen in 10 ng/mL IL-3 (schwarze Linie) oder 100 ng/mL G-CSF (blaue Linie) mit Medium. Die x-Achse repräsentiert Tagen der Behandlung. Die y-Achse zeigt sich in logarithmischen Skala (Log2) und gibt die Anzahl der Zellen × 105. Ergebnisse sind Mittelwerte von 3 unabhängigen Experimenten. Fehlerbalken zeigen Standardabweichung. (B) Differenzierung der Zellen 32D/G-CSF-R in G-CSF-haltigen Medium (100 ng/mL). Im oberen Bereich die Pie-Plots zeigen Prozentsatz der Blasten (schwarz), Klosterturm differenzierten Zellen (rosa) und Neutrophile (rot) in der Kultur nach 0, 2, 4 und 6 Tagen von G-CSF Behandlung. Der untere Bereich enthält repräsentative Bilder von Cytospun Zellen aus dem jeweiligen Zeitpunkten mit May-Grünwald-Giemsa gefärbt. Ein Minimum von 100 Zellen wurden für jeden Zeitpunkt ausgewertet.

Abbildung 3. Evi2b zum Schweigen zu bringen, sperrt Neutrophile Differenzierung in 32D-G-CSF-R-Zellen. (A) Verbreitung der Evi2b-zum Schweigen gebracht (orange Linie) und Kontrolle (schwarze Linien) 32D/G-CSF-R Zellen in 100 ng/mL G-CSF enthaltenden Medium. Die x-Achse repräsentiert Tagen der Behandlung. Die y-Achse zeigt sich in logarithmischen Skala (Log2) und gibt die Anzahl der Zellen × 105. Die Ergebnisse zeigen ein repräsentatives Ergebnis von 3 unabhängigen Experimenten. (B) Bewertung der Differenzierung der 32D/G-CSF-R Zellen ausgestrahlt mit Evi2b-Stummschaltung und Kontrolle ShRNAs in G-CSF-haltigen Medium (100 ng/mL) mit May-Grünwald-Giemsa Färbung der Cytospun Zellen. Im oberen Bereich die Pie-Plots zeigen Prozentsatz der Blasten (schwarz), Klosterturm differenzierte Zellen (rosa) und neutrophilen Granulozyten (rot) in Kultur. Die unteren Platten enthalten repräsentative Bilder von Cytospun Zellen. Differenzierung wurde am 7. Tag der Differenzierung beurteilt. Mindestens 100 Zellen wurden für jede Bedingung ausgewertet.
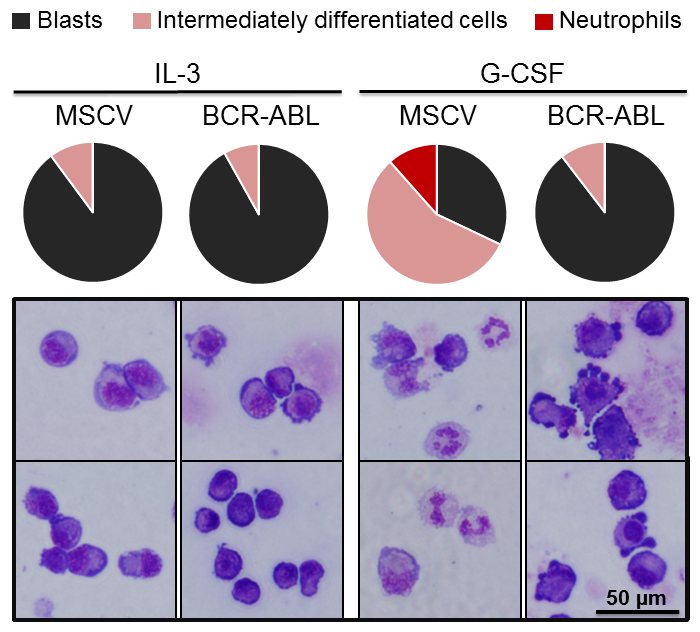
Abbildung 4. Überexpression des BCR-ABL Schmelzverfahren Protein beeinträchtigt Differenzierung von Zellen 32D/G-CSF-R. Bewertung der Differenzierung von Zellen 32D/G-CSF-R ausgestrahlt entweder mit MSCV oder BCR-ABL Fusionsgen in G-CSF-haltigen Medium (100 ng/mL). Obere Torte-Darstellungen zeigen Anteil der Blasten (schwarz), Klosterturm differenzierte Zellen (rosa) und Neutrophile (rot) am 6. Tag der Differenzierung. Die unteren Platten zeigen repräsentative Bilder von Cytospun Zellen mit May-Grünwald-Giemsa gefärbt. Mindestens 100 Zellen wurden für jeden Zeitpunkt ausgewertet.
| Virus V [µL] | Anzahl der vergoldeten Zellen | GFP+ % | Zellzahl GFP+ | Linear? | TU/mL | Durchschnitt (TU/mL) |
| 1 | 100 000 Einwohner | 1,83 | 1 830 | Ja | 1 830 000 | 2 350 000 |
| 5 | 100 000 Einwohner | 12.9 | 12 900 | Ja | 2 580 000 | |
| 10 | 100 000 Einwohner | 26.4 | 26 400 | Ja | 2 640 000 | |
| 50 | 100 000 Einwohner | 71,4 | 71 400 | Nein | ||
| 100 | 100 000 Einwohner | 85,1 | 85 100 | Nein | ||
| 500 | 100 000 Einwohner | 85,6 | 85 600 | Nein |
Tabelle 1. Virale Titer-Bestimmung für GLP-Reporter mit Vektoren. Beispiel für Daten, die mit dem MSCV Retrovirus und Berechnung durchgeführt, um die virale Titer zu schätzen. Virale Titer wurde basierend auf Anzahl der GFP+ Zellen erworben, wenn gewisse Virus angewendet wurde berechnet. Der Virusmenge zur Infektion sollte einer linearen Korrelation mit dem Prozentsatz der GFP+ Zellen gemessen. TU: Umwandlung Einheiten.
| Rohr | Rohr-Beschreibung | DMEM + 10 % FBS | Virus | Gesamtvolumen | Verdünnungsfaktor |
| (ΜL) | (ΜL) | (ΜL) | |||
| 1 | Verdünnung 1 | 1485 | 15 µL virale Lager | 1500 | 1 x 10-2 |
| 2 | Verdünnung 2 | 1350 | 150 µL Rohr 1 | 1500 | 1 x 10-3 |
| 3 | Verdünnung 3 | 1350 | 150 µL Rohr 2 | 1500 | 1 x 10-4 |
| 4 | Verdünnung 4 | 1350 | 150 µL Rohr 3 | 1500 | 1 x 105 |
| 5 | Verdünnung 5 | 1350 | 150 µL Rohr 4 | 1500 | 1 x 106 |
Tabelle 2: Virale Titer-Bestimmung für Puromycin Reporter mit Vektoren. Virale Verdünnung Strategie der viralen Titer in Puromycin mit Vektoren zu bestimmen. Tabelle 5 Rohre vorbereiten (1-5), eine serielle Verdünnung der viralen Aktie enthalten. Rohr 1 enthält 1485 µL DMEM + 10 % FBS und 15 µL des produzierten Virus, Bereitstellung von 1 × 102 verdünnt Virus. Rohr 2 enthält 1350 µL DMEM + 10 % FBS und 150 µL des 1 × 102 verdünnt Virus (u 1), Bereitstellung von 1 × 103 verdünnten Virus. Rohr 3 enthält 1350 µL DMEM + 10 % FBS und 150 µL des 1 × 103 verdünnt Virus (u 2), Bereitstellung von 1 × 104 verdünnten Virus. Schlauch 4 enthält 1350 µL DMEM + 10 % FBS und 150 µL des 1 × 104 verdünnt Virus (Röhre 3), Bereitstellung von 1 × 105 verdünnten Virus. Tube 5 enthält 1350 µL DMEM + 10 % FBS und 150 µL des 1 × 105 verdünnt Virus (Rohr 4), Bereitstellung von 1 × 106 verdünnten Virus. 1 ml aus Rohren 1-5 wird verwendet, um Titer das Virus.
| Zelle zählt (X = Anzahl der Zellen pro ml) | |||||||
| Tag 0 | Tag 1 | Tag 2 | Tag 3 | Tag 4 | Tag 5 | Tag 6 | |
| Beispiel 1 | x0 | x1 | x2 | x3 | x4 | x5 | x6 |
| Verdünnung (d) (y = Volumen der Zellen für replating [mL]; Z = Endvolumen [mL]) | |||||||
| Tag 0 | Tag 1 | Tag 2 | Tag 3 | Tag 4 | Tag 5 | Tag 6 | |
| Beispiel 1 | d0= 1 | d1= y1Standardfall1 | d2= y2Standardfall2 | d3= y3Sektorenanzahl3 | d4= y4Sektorenanzahl4 | d5= y5Standardfall5 | |
| Insgesamt Zellzahl | |||||||
| Tag 0 | Tag 1 | Tag 2 | Tag 3 | Tag 4 | Tag 5 | Tag 6 | |
| Beispiel 1 | x0 | x 1/d0 | x2/d1 | x3/d2/d1 | x4/d3/d2/d1 | x5/d4/d3/d2/d1 | x6/d5/d4/d3/d2/d1 |
Tabelle 3. Wachstum Kurve Generation. Die Tabelle beschreibt Gleichungen für Beurteilung der Proliferationsrate 32D/G-CSF-R-Zellen erforderlich.
| Kern | Zytoplasma | |
| Blasten | Dunkle, Runde | Dunkle, fast nisht zu unterscheidend von Kern |
| Halbfertigteile differenzierte Zellen | Änderungen im nuklearen Form, oft Donut-wie ausgesprochen oder mondähnliche geformt | Leichter, unterscheidbar Zytoplasma |
| Reife Neutrophile | Lappenden Kern; fast keine Verbindungen zwischen den Läppchen | Leichte Zytoplasma |
Tabelle 4. 32D/G-CSF-R Zellmorphologie während Neutrophile Differenzierung. Die Tabelle fasst die wichtigsten morphologischen Merkmale ermöglicht Unterscheidung von unreifen Blasten, Klosterturm differenzierte Zellen und Reife Neutrophile. Kern- und zytoplasmatischen Eigenschaften werden beschrieben. Siehe Abbildung 1 für repräsentative Bilder.
Diskussion
Die Wahl von einem experimentellen Modell ist eines der wichtigsten Themen in der Forschung. Obwohl primäre tierische und menschliche Zellen geglaubt werden, um die biologisch relevanten Daten zu produzieren, diese Modelle können beinhalten ethische Bedenken und sind oft teuer und/oder anspruchsvolle Isolierung/Kultivierung Verfahren zugeordnet. Primäre Zellen sind in Stückzahlen begrenzt und es ist schwer sie genetisch zu manipulieren. Darüber hinaus stellen primäre Zellen eine heterogene Bevölkerung setzt sich aus verschiedenen Zelltypen, die Daten Auslegung29erschweren können. Im Gegensatz dazu Zell-Linien bieten eine nahezu unbegrenzte Quelle von biologischem Material, sind kostengünstig und erlauben, um die ethischen Fragen zu umgehen. Allerdings ist es wichtig zu berücksichtigen, dass Zelle Linien gelten als ein künstliches experimentelle System werden die genetisch und phänotypisch unterscheiden sich von ihr Gewebe von Ursprung. Dennoch Zellinien in Kombination mit anderen experimentellen Ansätzen, ein wertvolles Modell zur Erzeugung von reproduzierbaren und biologisch relevante Daten liefern.
Die 32D/G-CSF-R Zell-Linie sowie 32D cl-3 Zellen sind etabliert und verbreitet Kultur Zellmodelle murinen Neutrophile Differenzierung14,15,24,30. Mehrere Forschergruppen haben diese Zellen verwendet, um die Rolle bestimmter Gene Myelopoiesis bewerten und erzielten Ergebnisse, die mit Daten in Vivo Modellen und Primärzellen16,31korreliert. Hier bieten wir ein Protokoll für den Umgang mit der 32D/G-CSF-R Zell-Linie, jedoch ähnliche Verfahren zur Kultivierung und Manipulation 32D cl-3 Zellen angewendet werden können. Es ist wichtig, darauf hinzuweisen, dass verschiedene Chargen der 32D cl-3 Zellen in verschiedenen Labors verwendet vorliegenden Unterschiede im Karyotyp, was darauf hindeutet, dass verschiedene Gruppen mit ihren eigenen Subclones32arbeiten könnte. Basierend auf dieser Beobachtung, vermuten wir, dass genetischer Variabilität könnte ebenso im 32D/G-CSF-R Zellen vorhanden sein, und dies muss berücksichtigt werden, beim Vergleich der Ergebnisse von verschiedenen Forschungsgruppen erhalten. Alternative Kultur Zellmodelle 32D/G-CSF-R-Zellen sind verewigt hämatopoetischen Vorläuferzellen Linien22,33,34,35,36. Dieser Ansatz ist sinnvoll, wenn große Vorläuferzellen Ausbau erforderlich, zum Beispiel zur ist Protein-Interaktionen22zu studieren. 32D/G-CSF-R Zellen von Vorteil ist, dass verewigt Stammväter aus gentechnisch veränderten Maus erzeugt werden können zwar die Zeit, um die Linie zu etablieren beträchtlich lange37. Darüber hinaus, Bearbeitung und Manipulation von Knochenmark verewigt Stammväter erfordert mehr Sachverstand als 32D/G-CSF-R-Zellen.
Um den Leser mit dem 32D/G-CSF-R-Modell in der ersten Jahreshälfte die repräsentativen Ergebnisse vertraut zu machen haben wir bewiesen, Proliferation und Differenzierung Kinetik der 32D/G-CSF-R-Zellen in Anwesenheit von IL-3 und G-CSF. Repräsentative Bilder zeigen die Morphologie der Zellen in IL-3 wuchernden Bedingungen sowie zu verschiedenen Zeitpunkten der GCSF-induzierte Differenzierung wurden vorgestellt. Wir bewertet Neutrophile Differenzierung durch morphologische Analyse, aber es wurde berichtet, dass 32D cl-3-Zell-Differenzierung von durchflusszytometrischen Analyse mit Hilfe der CD11b Zelle Oberfläche Marker27,31bestimmt werden kann, 38,39. Unser Wissen und Know-how ist CD11b nicht hochreguliert während Neutrophile Differenzierung von Zellen 32D/G-CSF-R. Für Standardisierung in die 32D/G-CSF-R Verbreitung Assays beschäftigten wir handelsübliche IL-3. Allerdings haben wir beobachtet, dass Zellen auch in selbst gebastelten IL-3, produziert wie von Bürgermeister und Kollegen22beschrieben zu vermehren. Um ein hohes Maß an G-CSF-induzierte Neutrophile Differenzierung zu erhalten, ist es wichtig zu bedenken, dass die Fähigkeit der Differenzierung der 32D/G-CSF-R Zellen beeinträchtigt sein kann, wenn Zellen ab einer Konzentration von 1 × 106 Zellen/mL kultiviert werden. Darüber hinaus können den Grad und die Geschwindigkeit der Differenzierung der Serum-Zusammensetzung betroffen sein. Daher empfiehlt es sich, die Fähigkeit der Differenzierung der 32D/G-CSF-R Zellen in mehreren FBS Chargen zu testen, und wählen diejenige, die die Entwicklung der Reifen Neutrophilen auf 6 bis 9 Tage der Kultur in Anwesenheit von G-CSF besser unterstützt.
Wir stellten zwei repräsentative Experimente zeigen Möglichkeiten zur Untersuchung der Rolle von bestimmten Proteinen in myeloische Differenzierung (Abbildung 3 und Abbildung 4). Wir haben gezeigt, dass Downregulation der EVI2B, ein transmembranen Protein in hämatopoetischen Zellen exprimiert führt auf einen Block der myeloischen Differenzierung in 32D/G-CSF-R-Zellen. Diese Daten wurden vor kurzem von unserer Fraktion, in Kombination mit Tests durchgeführt mit Primärzellen und Evi2b Knockout Mäuse16veröffentlicht. Zweitens haben wir den Effekt der BCR-ABL, ein Fusionsprotein aus der genetischen Translokation t(9,22) (q34; q11), auf Neutrophile Differenzierung der Zellen 32D/G-CSF-R. Diese Translokation wurde ursprünglich bei Patienten mit chronisch-myeloischer Leukämie40,41identifiziert. Es zeigte sich bisher diesen Ausdruck des BCR-ABL-Fusion-Oncoprotein 32D cl-3 Zellen führt zu einer myeloischen Differenzierung Verhaftung27,28. Hier haben wir bewiesen, dass BCR-ABL-Überexpression ähnliche Auswirkungen auf 32D/G-CSF-R-Zellen hat. In beiden Experimenten präsentiert hier (betreffend Evi2b Downregulation und BCR-ABL-Überexpression), genetische Modifikation von 32D/G-CSF-R Zellen erfolgte durch virale Transduktion, führt zu stabilen Genexpression. Die Wahl der retroviralen gegen Lentivirale Lieferung betrifft nicht die Proliferation und Differenzierung von Zellen 32D/G-CSF-R. Lentivirale Infektion ist jedoch effizienter als retrovirale Transduktion aufgrund des Vorhandenseins von endogenen Retroviren in 32D/G-CSF-R-Zellen. Unserer Erfahrung nach ist die Transfektion von diesen Zellen unter Verwendung von standard lipophilen Reagenzien nicht effizient. Allerdings, wenn vorübergehende Konstrukt Ausdruck benötigt wird, Transfektion durch Elektroporation ist ein geeigneter Ansatz42,43,44. Hier präsentierten wir Genmanipulation 32D/G-CSF-R-Zellen, gefolgt von GFP sortieren und bulk-Analyse der infizierten Zellen. Jedoch könnte gegebenenfalls einzelne Zelle sortieren eingesetzt werden, einzelne Zelle Klone als zuvor gemeldeten12,45zu generieren.
Neben der Proliferation und Differenzierung-Assays sind 32D/G-CSF-R-Zellen eingesetzt, um erfolgreich die Rolle bestimmter Proteine in der Zelle Migration und Apoptose13,46,47,48 bestimmen . Weiter, die Linie 32D/G-CSF-R wurde zur Zytokin unabhängiges Wachstum vermittelt durch Onkoproteine19,20bestimmen. Eine weitere ist häufig verwendete Zytokin Unabhängigkeit zu studieren Ba/F3 Zellen21,49. BA/F3 ist eine IL-3 abhängige murinen Zelllinie C3H Maus Stamm ähnlich 32D/G-CSF-R Zellen abgeleitet. Obwohl beide Systeme eingesetzt werden, können um unabhängige Verbreitung Zytokin studieren, unterscheiden Ba/F3 Zellen schlecht in Anwesenheit von G-CSF.
Insgesamt empfehlen wir, dass 32D/G-CSF-R Zellen, obwohl weniger bevorzugt als Primärzellen, bieten mehrere Vorteile einschließlich unbegrenzte Verbreitung Kapazität und einfache Handhabung. Wir glauben, dass für die Erzeugung von verlässlichen Daten, Experimente in 32D/G-CSF-R Zellen mit Daten, die durch alternative experimentelle Ansätze wie murinen Modellen und Primärkulturen ergänzt werden sollte.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren danken Prof. Ruud Delwel und Prof. Ivo Touw für die uns mit der 32D/G-CSF-R Zell-Linie und Prof. Daniel G. Tenen für die uns mit der Bosc23-Zell-Linie. Diese Arbeit wurde unterstützt durch Zuschüsse der Grant-Agentur der Tschechischen Republik (GACR 15-03796S und GACR 17-02177S), MA-J, unterstützt vom Institut für Molekulargenetik der Tschechischen Akademie der Wissenschaften (RVO 68378050), MA-J, ein GA-UK-Stipendium (Projekt Nr. 341015) Charles Universität in Prag zu MK und ein GA-UK-Stipendium (Projekt Nr. 1278217) von Charles Universität in Prag, PD.
Materialien
| Name | Company | Catalog Number | Comments |
| RPMI 1640 powder medium | Merck, Kenilworth, NJ, USA | T 121-10 | without NaHCO3, with L-glutamine |
| DMEM | Thermo Fisher Scientific, Waltham, MA, USA | 15028 | |
| Opti-MEM I Reduced Serum Medium | Thermo Fisher Scientific, Waltham, MA, USA | 31985-047 | L-Glutamine, Phenol Red |
| Fetal bovine serum (FBS) | PAA Laboratories (GE Healthcare,Chicago, IL, USA) | MT35011CV | For differentiation of 32D/G-CSF-R cells |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific, Waltham, MA, USA | 10270 | Used for culturing HEK293T, NIH3T3, BOSC23 cells |
| Penicillin | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | P3032 | |
| Streptomycin | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | S9137 | Streptomycin sulfate salt powder |
| Gentamicin | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | G1914 | |
| murine IL-3 | PeproTech, Rocky Hill, NJ, USA | 213-13 | |
| human G-CSF | PeproTech, Rocky Hill, NJ, USA | 300-23 | |
| Polyethylenimine | Polyscience, Warrington, PA, USA | 23966 | Linear, MW 25,000 (PEI 25000) |
| Polybrene | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | H9268 | |
| Trypsin | VWR Chemicals, Radnor, PA, USA | 0458 | |
| EDTA | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | E5134 | |
| Crystal violet | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | C0775 | |
| Trypan blue | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | T6146 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich (Merck, Kenilworth, NJ, USA) | D2650 | |
| May-Grünwald Giemsa | DiaPath, Martinengo, BG, Italy | 10802 |
Referenzen
- Bonilla, M. A., et al. Effects of recombinant human granulocyte colony-stimulating factor on neutropenia in patients with congenital agranulocytosis. N Engl J Med. 320 (24), 1574-1580 (1989).
- Bennett, C. L., Djulbegovic, B., Norris, L. B., Armitage, J. O. Colony-stimulating factors for febrile neutropenia during cancer therapy. N Engl J Med. 368 (12), 1131-1139 (2013).
- Lowenberg, B., Downing, J. R., Burnett, A. Acute myeloid leukemia. N Engl J Med. 341 (14), 1051-1062 (1999).
- Dong, F., et al. Identification of a nonsense mutation in the granulocyte-colony-stimulating factor receptor in severe congenital neutropenia. Proc Natl Acad Sci U S A. 91 (10), 4480-4484 (1994).
- Rosenbauer, F., Tenen, D. G. Transcription factors in myeloid development: balancing differentiation with transformation. Nat Rev Immunol. 7 (2), 105-117 (2007).
- Kota, J., Caceres, N., Constantinescu, S. N. Aberrant signal transduction pathways in myeloproliferative neoplasms. Leukemia. 22 (10), 1828-1840 (2008).
- Kvinlaug, B. T., et al. Common and overlapping oncogenic pathways contribute to the evolution of acute myeloid leukemias. Cancer Res. 71 (12), 4117-4129 (2011).
- Krug, U., Ganser, A., Koeffler, H. P. Tumor suppressor genes in normal and malignant hematopoiesis. Oncogene. 21 (21), 3475-3495 (2002).
- Greenberger, J. S., Sakakeeny, M. A., Humphries, R. K., Eaves, C. J., Eckner, R. J. Demonstration of permanent factor-dependent multipotential (erythroid/neutrophil/basophil) hematopoietic progenitor cell lines. Proc Natl Acad Sci U S A. 80 (10), 2931-2935 (1983).
- Valtieri, M., et al. Cytokine-dependent granulocytic differentiation. Regulation of proliferative and differentiative responses in a murine progenitor cell line. J Immunol. 138 (11), 3829-3835 (1987).
- Dong, F., et al. Mutations in the gene for the granulocyte colony-stimulating-factor receptor in patients with acute myeloid leukemia preceded by severe congenital neutropenia. N Engl J Med. 333 (8), 487-493 (1995).
- Jorda, M. A., Lowenberg, B., Delwel, R. The peripheral cannabinoid receptor Cb2, a novel oncoprotein, induces a reversible block in neutrophilic differentiation. Blood. 101 (4), 1336-1343 (2003).
- Jorda, M. A., et al. Hematopoietic cells expressing the peripheral cannabinoid receptor migrate in response to the endocannabinoid 2-arachidonoylglycerol. Blood. 99 (8), 2786-2793 (2002).
- Abbas, S., et al. Integrated genome-wide genotyping and gene expression profiling reveals BCL11B as a putative oncogene in acute myeloid leukemia with 14q32 aberrations. Haematologica. 99 (5), 848-857 (2014).
- Zhuang, D., Qiu, Y., Kogan, S. C., Dong, F. Increased CCAAT enhancer-binding protein epsilon (C/EBPepsilon) expression and premature apoptosis in myeloid cells expressing Gfi-1 N382S mutant associated with severe congenital neutropenia. J Biol Chem. 281 (16), 10745-10751 (2006).
- Zjablovskaja, P., et al. EVI2B is a C/EBPalpha target gene required for granulocytic differentiation and functionality of hematopoietic progenitors. Cell Death Differ. 24 (4), 705-716 (2017).
- Santini, V., et al. The carboxy-terminal region of the granulocyte colony-stimulating factor receptor transduces a phagocytic signal. Blood. 101 (11), 4615-4622 (2003).
- Liu, H., Qiu, Y., Xiao, L., Dong, F. Involvement of protein kinase Cepsilon in the negative regulation of Akt activation stimulated by granulocyte colony-stimulating factor. J Immunol. 176 (4), 2407-2413 (2006).
- Kelly, L. M., et al. FLT3 internal tandem duplication mutations associated with human acute myeloid leukemias induce myeloproliferative disease in a murine bone marrow transplant model. Blood. 99 (1), 310-318 (2002).
- Pikman, Y., et al. MPLW515L is a novel somatic activating mutation in myelofibrosis with myeloid metaplasia. PLoS Med. 3 (7), e270 (2006).
- Schwaller, J., et al. Transformation of hematopoietic cell lines to growth-factor independence and induction of a fatal myelo- and lymphoproliferative disease in mice by retrovirally transduced TEL/JAK2 fusion genes. EMBO J. 17 (18), 5321-5333 (1998).
- Drobek, A., et al. PSTPIP2, a Protein Associated with Autoinflammatory Disease, Interacts with Inhibitory Enzymes SHIP1 and Csk. J Immunol. 195 (7), 3416-3426 (2015).
- Naviaux, R. K., Costanzi, E., Haas, M., Verma, I. M. The pCL vector system: rapid production of helper-free, high-titer, recombinant retroviruses. J Virol. 70 (8), 5701-5705 (1996).
- Alberich-Jorda, M., et al. C/EBPgamma deregulation results in differentiation arrest in acute myeloid leukemia. J Clin Invest. 122 (12), 4490-4504 (2012).
- Calabretta, B., Perrotti, D. The biology of CML blast crisis. Blood. 103 (11), 4010-4022 (2004).
- Ren, R. Mechanisms of BCR-ABL in the pathogenesis of chronic myelogenous leukaemia. Nat Rev Cancer. 5 (3), 172-183 (2005).
- Schuster, C., et al. The effects of Bcr-Abl on C/EBP transcription-factor regulation and neutrophilic differentiation are reversed by the Abl kinase inhibitor imatinib mesylate. Blood. 101 (2), 655-663 (2003).
- Chang, J. S., et al. High levels of the BCR/ABL oncoprotein are required for the MAPK-hnRNP-E2 dependent suppression of C/EBPalpha-driven myeloid differentiation. Blood. 110 (3), 994-1003 (2007).
- Velten, L., et al. Human haematopoietic stem cell lineage commitment is a continuous process. Nat Cell Biol. 19 (4), 271-281 (2017).
- Jorda, M. A., Rayman, N., Valk, P., De Wee, E., Delwel, R. Identification, characterization, and function of a novel oncogene: the peripheral cannabinoid receptor Cb2. Ann N Y Acad Sci. 996, 10-16 (2003).
- Wurm, A. A., et al. Disruption of the C/EBPalpha-miR-182 balance impairs granulocytic differentiation. Nat Commun. 8 (1), 46 (2017).
- Agliano, A. M., et al. On chromosomal instability: what is the karyotype of your 32D CI3 cell line. Blood. 95 (11), 3636-3637 (2000).
- Wang, G. G., et al. Quantitative production of macrophages or neutrophils ex vivo using conditional Hoxb8. Nat Methods. 3 (4), 287-293 (2006).
- Houston, I. B., Huang, K. J., Jennings, S. R., DeKoter, R. P. PU.1 immortalizes hematopoietic progenitors in a GM-CSF-dependent manner. Exp Hematol. 35 (3), 374-384 (2007).
- Calvo, K. R., Sykes, D. B., Pasillas, M., Kamps, M. P. Hoxa9 immortalizes a granulocyte-macrophage colony-stimulating factor-dependent promyelocyte capable of biphenotypic differentiation to neutrophils or macrophages, independent of enforced meis expression. Mol Cell Biol. 20 (9), 3274-3285 (2000).
- Calvo, K. R., Sykes, D. B., Pasillas, M. P., Kamps, M. P. Nup98-HoxA9 immortalizes myeloid progenitors, enforces expression of Hoxa9, Hoxa7 and Meis1, and alters cytokine-specific responses in a manner similar to that induced by retroviral co-expression of Hoxa9 and Meis1. Oncogene. 21 (27), 4247-4256 (2002).
- Fossati-Jimack, L., et al. Phagocytosis is the main CR3-mediated function affected by the lupus-associated variant of CD11b in human myeloid cells. PLoS One. 8 (2), e57082 (2013).
- Schwable, J., et al. RGS2 is an important target gene of Flt3-ITD mutations in AML and functions in myeloid differentiation and leukemic transformation. Blood. 105 (5), 2107-2114 (2005).
- Worch, J., et al. The serine-threonine kinase MNK1 is post-translationally stabilized by PML-RARalpha and regulates differentiation of hematopoietic cells. Oncogene. 23 (57), 9162-9172 (2004).
- Rowley, J. D. Letter: A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining. Nature. 243 (5405), 290-293 (1973).
- Stam, K., et al. Evidence of a new chimeric bcr/c-abl mRNA in patients with chronic myelocytic leukemia and the Philadelphia chromosome. N Engl J Med. 313 (23), 1429-1433 (1985).
- Holly, S. P., Larson, M. K., Parise, L. V. The unique N-terminus of R-ras is required for Rac activation and precise regulation of cell migration. Mol Biol Cell. 16 (5), 2458-2469 (2005).
- Pierce, J. H., et al. Macrophage-colony-stimulating factor (CSF-1) induces proliferation, chemotaxis, and reversible monocytic differentiation in myeloid progenitor cells transfected with the human c-fms/CSF-1 receptor cDNA. Proc Natl Acad Sci U S A. 87 (15), 5613-5617 (1990).
- Pierce, J. H., et al. Signal transduction through the EGF receptor transfected in IL-3-dependent hematopoietic cells. Science. 239 (4840), 628-631 (1988).
- Oomen, S. P., et al. Somatostatin modulates G-CSF-induced but not interleukin-3-induced proliferative responses in myeloid 32D cells via activation of somatostatin receptor subtype 2. Hematol J. 2 (5), 322-329 (2001).
- Oomen, S. P., et al. Somatostatin is a selective chemoattractant for primitive (CD34(+)) hematopoietic progenitor cells. Exp Hematol. 30 (2), 116-125 (2002).
- Nogami, A., et al. FLT3-ITD confers resistance to the PI3K/Akt pathway inhibitors by protecting the mTOR/4EBP1/Mcl-1 pathway through STAT5 activation in acute myeloid leukemia. Oncotarget. 6 (11), 9189-9205 (2015).
- Rodel, J. E., Link, D. C. Suppression of apoptosis during cytokine deprivation of 32D cells is not sufficient to induce complete granulocytic differentiation. Blood. 87 (3), 858-864 (1996).
- Daley, G. Q., Baltimore, D. Transformation of an interleukin 3-dependent hematopoietic cell line by the chronic myelogenous leukemia-specific P210bcr/abl protein. Proc Natl Acad Sci U S A. 85 (23), 9312-9316 (1988).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten