Method Article
Durchflusszytometrische Analyse von partikelgebundenen Bet v 1 Allergens in PM10
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll allergen-beladenen Partikel durch Durchflusszytometrie quantifiziert. Feinstaub in der Luft Partikel können als Träger von adsorbiertem Allergene wirken. Wir zeigen hier, dass der Durchflusszytometrie ist ein Verfahren allgemein zur Charakterisierung von Schwebstoffen verwendet> 0,5 um im Durchmesser, können diese allergen-beladenen Partikel zu messen, verwendet werden.
Zusammenfassung
Durchflusszytometrie ist ein Verfahren allgemein zu quantifizieren Schwebstoffe wie Zellen oder Bakterien in einem Größenbereich von 0,5 bis einigen zehn Mikrometern im Durchmesser verwendet. Zusätzlich zu einer Charakterisierung von Vorwärts- und Seitwärtsstreuungseigenschaften ermöglicht es die Verwendung von fluoreszenzmarkierten Markern wie Antikörpern jeweiligen Strukturen zu erkennen. Verwendung indirekten Antikörperfärbung, Durchflusszytometrie wird hier verwendet birch pollen allergen zu quantifizieren (genau Bet v 1) -beladene Teilchen von 0,5 bis 10 um im Durchmesser in inhalierbaren Partikeln (PM10, Teilchengröße ≤10 & mgr; m im Durchmesser). PM10 Partikel wirken können als Träger von adsorbierten Allergenen sie möglicherweise auf die unteren Atemwege zu transportieren, wo sie allergische Reaktionen auslösen können.
Bisher ist die Allergengehalt von PM10 wurde mittels enzyme linked immunosorbent assays (ELISAs) und Rasterelektronenmikroskopie untersucht. ELISA misst die gelöste und nicht die Partikel-bound Allergen. Im Vergleich zu der Rasterelektronenmikroskopie, die allergen-beladenen Partikel visualisieren kann, Cytometry fließen kann zusätzlich sie quantifizieren. Als Allergengehalt der Umgebungsluft aus Birkenpollen Zahl abweichen können, können allergische Symptome vielleicht besser korrelieren mit Allergenexposition als mit Pollenflug. In Verbindung mit den klinischen Daten, bietet die vorgestellte Methode die Möglichkeit, in zukünftigen Experimenten zu testen, ob allergische Reaktionen Pollenantigene gegen Birkenpollen mit dem Bet v 1 Allergen zugeordnet sind, Gehalt an PM10-Partikel> 0,5 um.
Einleitung
Die Luftverschmutzung ist 1-3 in den letzten Jahrzehnten als wichtiger Umwelt Ursache für die erhöhte Häufigkeit und Schwere von Atemwegsallergien beobachtet werden berücksichtigt. Außerdem gab es bei der Verteilung von häufigen Allergenen in Staub 4,5 zunehmendes Interesse.
Birkenpollen kann Heuschnupfen auslösen kann aber auch ein wichtiger Auslöser von allergischem Asthma 6-8 sein. Whole Birkenpollen ist nicht wahrscheinlich die unteren Atemwege zu betreten oder in PM10 infolge seiner Größe (22 & mgr; m im Durchmesser) zu finden sind. Allerdings Birkenpollenallergenen wie Bet v 1, dem Hauptbirkenpollenallergen - Komponente können nach Pollen Bruch 9 freigesetzt werden und 10 bis Umgebungsluftpartikel binden kann, wodurch möglicherweise die unteren Atemwege gelangen. Tatsächlich hat es sich gezeigt , dass PM10 biologisch aktiven Allergenen durch in vitro Aktivierung von Basophilen von einem Pollen allergischen Probanden wie gezeigt , enthalten 11 .
Bet v 1 Allergengehalt in PM10 - Proben wurde durch Extraktion des jeweiligen Allergen und anschließende Quantifizierung mit ELISA 12-14 untersucht worden. Mit der ELISA-Technik wurde das gelöste Allergen gemessen, aber die Menge des allergenbeladenen Partikel blieben noch unbekannt. Rasterelektronenmikroskopische allergenbeladenen Partikel ergab , aber nicht erlauben die Quantifizierung 10,15.
Diese Studie verwendet Durchflusszytometrie den Anteil der Bet v 1-beladenen Partikel in PM10 Umgebungsluftproben zu quantifizieren. Aufgrund der Nachweisgrenze des Durchflusszytometers nur Partikel größer als 0,5 & mgr; m untersucht werden. Die> 0,5 um Anteil an PM10 weiter als PM10> 0.5 bezeichnet.
Protokoll
Hinweis: Dieses Protokoll beschreibt die indirekte Anfärbung von PM10-Partikel mit einem monoklonalen Antikörper (monoklonaler Maus-IgG1-Antikörper, Klon MA-3B4) gegen Bet v 1, das Birkenpollenhauptantigenkomponente plus einem Allophycocyanin (APC) -markiertem Sekundärantikörper (anti -mouse IgG1-Antikörper, Klon A85-1) und die anschließende Analyse auf einem Durchflusszytometer. Mit geeigneten anderen Antikörpern verfügbar, kann dieses Verfahren auf die Detektion von anderen Antigenen verlängert werden gebunden auf Umgebungs Luftteilchen.
1. PM10 Probenahme
- Sammeln PM10 aus der Umgebungsluft auf Polytetrafluorethylen (PTFE) Filter verwendet ein geringes Volumen Sampler mit einer Strömungsgeschwindigkeit von 2,3 m 3 / h (Abbildung 1). Eine Charakterisierung des Probennehmers für die Experimente verwendet hier beschrieben ist , in 16 zu finden. Laufzeit hängt von der Menge an PM10 benötigt (üblicherweise zwischen 1 und 10 Tage).
- Am Ende der Inkubationszeit, entfernen Sie den Filter aus dem Sampler und frieren es-20 ° C bis zur Verwendung.

Abbildung 1. Geringes Volumen PM10 - Sampler. Beispiel für ein geringes Volumen PM10 - Sampler. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
2. PM10 Abnahme und die Partikelzählung
- Lassen Sie die PTFE-Filter Tauwetter für ca. 5 min. Dann legen Sie den Filter in einem sauberen Polystyrol- Petrischale (2A). Nehmen Sie eine neue Petrischale für jeden Filter, wenn mehr als ein Filter verarbeitet wird.
- Anschließend überlagert die PTFE-Filter mit phosphatgepufferter Kochsalzlösung (PBS). Dieses Protokoll ist für eine endgültige PM10 - Konzentration von 8x10 6 Partikel pro ml hergestellt wird (siehe Schritt 3.3). Zur Erzielung zumindest, dass die Konzentration, verwenden Sie die folgende empirische Volumen PBS, den Filter zu überlagern mit: Wenn die PM10 Sammelzeit war < Vor 2 Tagen, verwenden 2 ml. Für Inkubationszeiten ≥2 Tage, verwenden Sie 4 ml.
HINWEIS: Um die Partikelkonzentration der PM10-Suspension, Suspensionen aus unterschiedlichen Filtern zu erhöhen gebündelt werden können, wenn dies angemessen ist. - Halten Sie die PTFE - Filter mit einer Pinzette und Bürste mit einer elektrischen Zahnbürste mit einem empfindlichen Bürstenkopf für 1 min (2B, 2C). Übertragen Sie die Partikel-PBS-Suspension, die im Folgenden genannt PM10 Suspension, auf eine saubere Reaktionsrohr.

Abbildung 2. PM10 Entfernung mit einer elektrischen Zahnbürste. Polytetrafluorethylen - Filter mit gesampelten PM10 in einer Polystyrol- Petrischale (A) angeordnet und mit 4 ml PBS überschichtet. Dann wird PM10 mit einer elektrischen Zahnbürste entfernt (B: vor dem Zähneputzen und C: nach 1 min Bürsten).= "Http://ecsource-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/54721/54721fig2large.jpg" target = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
- Messen der Konzentration von PM10 Partikel, beispielsweise durch die Verwendung eines Partikelzählers. Verdünnte ein ausreichendes Volumen von PM10 Suspension von beispielsweise 50 & mgr; l in 10 ml isotonischer Messpuffer, messen dreimal und berechnet die mittlere Gesamtzahl der Teilchen pro ml. Achten Sie darauf, einen Partikelzähler zu verwenden, die Partikel der relevanten Größe erfassen kann.
3. Bet v 1-Färbung
- Berechnung der Anzahl der Reaktionsröhren zur Analyse der Probe benötigt: mindestens drei Reaktionsrohre erforderlich sind: (i) ein Rohr mit der Probe nur (native Kontrolle) (ii) ein Rohr mit Probe plus sekundären Antikörper (negative Kontrolle) und ( iii) ein Rohr mit Probe plus primären und sekundären Antikörper (spezifische Probe). Wenn zum ersten Mal gemessen wird, vorbereitet mindestens zwei Reaktionsrohre für (i) (ii),und (iii) genügend Material zu haben, um richtig cytometer Einstellungen anpassen (siehe Schritt 4.1).
- Berechnen der Menge an PM10 Suspension, die für die Anzahl von Reaktionsrohren. Jedes Reaktionsröhrchen erfordert 50 ul Suspension.
- Einstellen , die Partikelkonzentration in Schritt gemessen 2,4 für das Volumen der Suspension in Schritt berechnet 3,2 auf eine Endkonzentration von 8x10 6 Partikel pro ml durch eine entsprechende Menge an PBS hinzugefügt wird .
ANMERKUNG: Die restlichen PM10 Suspension bei -20 ° C eingefroren für zukünftige Experimente werden, obwohl für dieses Protokoll frisch zubereitetes PM10 Suspension empfohlen. - Block unspezifische Bindung durch die PM10 Suspension mit Rinderserumalbumin (BSA) in einer Endkonzentration von 0,02% zu ergänzen, unter Verwendung einer Stammlösung, wie beispielsweise 1% BSA mit PBS hergestellt. Vortex kurz und für 20 Minuten bei Raumtemperatur inkubiert.
- Für jede Probe mittels Durchflusszytometrie analysiert werden, werden 50 ul der Suspension aus Schritt 3.4 bis acmageren Reaktionsrohr. Fügen einen monoklonalen Maus-Antikörper gegen Bet v 1 in einer Endkonzentration von 0,02 ug / ul zu den Reaktionsrohren für spezifische Färbung bezeichnet wird, kurz vortexen und Inkubation für 60 min bei Raumtemperatur.
- Lassen Sie die Reaktionsrohre mit der PM10-BSA Suspension für die native Kontrolle bezeichnet und die negative Kontrolle auch für 60 min bei Raumtemperatur bleiben.
- Waschen Sie alle Proben durch Zugabe von 500 & mgr; l PBS mit 0,02% BSA zu jedem Reaktionsgefäß ergänzt, kurz vortexen und zentrifugieren Sie die Proben anschließend bei 4.700 × g für 5 Minuten bei Raumtemperatur. Überstand vorsichtig verwerfen durch Verwendung einer Vakuumpumpe.
- Wiederholen Sie Schritt 3.6.
- Bestimmung der Gesamtmenge an APC-markierten sekundären anti-Maus-IgG1-Antikörper benötigt: 1 & mgr; g Antikörper, gelöst in 50 ul PBS mit 0,02% BSA ergänzt pro Reaktionsrohr. Verdünne die entsprechende Menge an Antikörper mit dem entsprechenden Volumen von PBS, ergänzt mit 0,02% BSA.
- In 50 ul des verdünnten sekundären Antikörper zu allen Reaktionsgefäßen mit Ausnahme der Reaktionsrohr für die native Steuerung bezeichnet. Ergänzen Sie die letztere mit 50 & mgr; l PBS mit 0,02% BSA ergänzt. Vortex alle Proben für einige Sekunden.
- Inkubieren alle Proben für 30 Minuten im Dunkeln.
- Wiederholen Sie Schritt 3.6 zweimal.
- In 50 ul PBS in jedes Reaktionsröhrchen, Wirbel und Analyse der Proben auf einem Durchflusszytometer.
4. Analyse über Durchflusszytometrie
- Mit der nativen Kontrolle, adjust nach dem Zytometer Parameter Datenanalyse zu optimieren.
- Durch die Verwendung setzen die Vorwärtsstreuung (FSC) -Schwelle Controller auf dem Gerät Steuerplatine angezeigt, das FSC-Schwelle auf dem niedrigsten Wert (200) und die Analyse starten.
- Durch die Verwendung der Streuspannungsregler, stellen Sie den FSC und Seitwärtsstreuung (SSC) auf diese Weise, dass alle PM10-Partikel nachgewiesen werden können und dass die Population von Teilchen befindet sich etwa in the Mitte der FSC-Achse und in der unteren Hälfte der SSC-Achse.
- Durch die Verwendung des Fluoreszenzspannungsregler, stellen Sie die APC-Spannung und eine andere Fluoreszenzspannung wie Fluoresceinisothiocyanat (FITC), die bei der gleichen Wellenlänge emittieren, nicht wie APC, falls erforderlich. Stellen Sie sicher, dass alle Partikel in der unteren Hälfte der beiden Fluoreszenz Achsen sichtbar sind.
- Nacheinander, untersuchen jede Probe einschließlich der nativen Kontrolle und Speicherung der FSC, SSC, APC und FITC Daten von mindestens 10.000 Partikel pro Probe.
- Auswertung der Daten mit der entsprechenden Software. Adsorbiertem Allergengehalt in der bestimmten Probe kann auf zwei Arten quantitativ bestimmt werden:
- Analysieren Sie den APC Fluoreszenzintensität aller Partikel (Medianwert) als Maß für Bet v 1 Last über alle PM10-Partikel.
HINWEIS: Wenn die spezifische Probe Allergen enthalten ist, APC Fluoreszenzintensität in der spezifischen Probe im Vergleich zur Negativkontrolle erhöhen sollte. Im Gegensatz dazu andere fluorescence Intensitäten (z. B. FITC Fluoreszenzintensität) nicht wesentlich ändern. - Berechnen Sie den Prozentsatz der PM10-Partikel mit gebundenen Anti-Bet v 1-Antikörper. Dadurch wird in der Negativkontrolle, setzen Sie ein Tor um die Teilchen APC positiv betrachtet, zu kopieren und dieses Tor in die spezifische Probe einfügen und den Prozentsatz der APC positiven Teilchen in der negativen Kontrolle aus dem Prozentsatz der APC positiven Teilchen in der spezifischen Probe subtrahieren.
- Analysieren Sie den APC Fluoreszenzintensität aller Partikel (Medianwert) als Maß für Bet v 1 Last über alle PM10-Partikel.
Ergebnisse
Bet v 1 Allergen Adsorption an PM10> 0,5 Partikel wurde cytometer durch indirekten Antikörper - Färbung und die anschließende Analyse auf einem Fluss quantifiziert. Eine PM10 Probe von hoher Pollensaison diente als Vorlage. Als 3.1 in Schritt angegeben, bestand die negative Kontrolle von PM10 - Partikel mit APC inkubiert markiert nur sekundäre Antikörper (3A). PM10 Partikel gefärbt mit Anti-Bet v 1 - Antikörper und sekundärem Antikörper zeigte die allergen beladenen Partikel (3B). Wie 4.3 in Schritt beschrieben ist, zwei Möglichkeiten, um die Allergenbelastung der Quantifizierung wurden verwendet: Einerseits wurde der Medianwert der APC Fluoreszenzintensität aller Teilchen ist 137 für die negative Kontrolle und 904 für die spezielle Probe analysiert. Auf der anderen Seite ist der Anteil der Partikel mit der gebundenen anti-Bet v 1-Antikörper bestimmt: Ein Gate um die APC positive Teilchen in der negativen Kontrolle gesetzt wurde und anschließend copied und in die spezifische Probe eingefügt. In der Negativkontrolle, 3% der PM10> 0,5 Teilchen wurden als APC positiv. Dieser Prozentsatz der falsch - positiven Teilchen wurde aus dem Prozentsatz der positiven Teilchen in der spezifischen Probe abgezogen somit in 77,5% APC positive PM10> 0,5 Partikel in der spezifischen Probe ergibt. Um zu beweisen, dass die beobachtete Bindung des anti-Bet v 1-Antikörper spezifisch war, wurde Bindungskapazität mit dem entsprechenden Antigen vor der Färbung blockiert. Diese verminderte Bindung des anti-Bet v 1 - Antikörper von 69%, wenn sie von APC Fluoreszenzintensität quantifiziert, und um 84%, wenn nach prozentualer Bet v 1 positive PM10 quantifiziert> 0,5 Teilchen (3C).
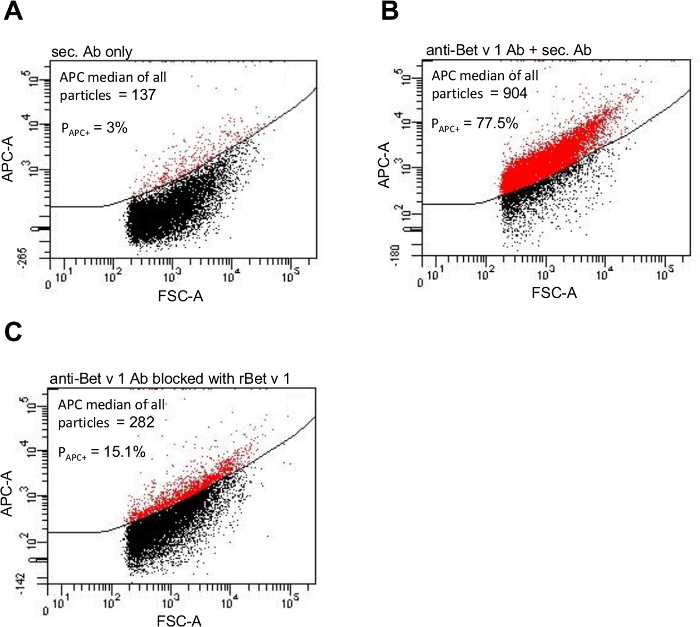
Abbildung 3. partikelgebundenen Bet v 1 Allergen durch Durchflusszytometrie visualisiert werden. APC Fluoreszenzintensität einer Probe von PM10 hohen pollen Zeit nur mit APC markiertem Sekundärantikörper (A), gefärbt mit dem Anti-Bet v 1 primärem Antikörper und anschließend mit dem APC markiertem Sekundärantikörper (B) gefärbt, und nach der primären Antikörper mit rekombinantem Bet v 1 - Antigen blockieren (C ). Die Gate - P APC + wurde um die Partikel eingestellt APC positiv betrachtet (in rot dargestellt) und die jeweiligen Prozentsätze angegeben sind. Diese Zahl wurde von 11 leicht modifiziert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Um zu testen , ob diese Methode Unterschiede in der Menge an adsorbiertem Bet v 1 - Gehalt von PM10> 0,5 Proben von hoch und aus niedrigen Pollensaison angenommen werden könnte offenbaren, 13 PM10 - Proben von hoch und 6 PM10 Proben aus niedrigen Pollensaison analysiert. Abbildung 4zeigt signifikante Unterschiede in der APC - Fluoreszenzintensität und im Verhältnis von Bet v 1 positive PM10> 0,5 Teilchen von PM10 - Proben von hoher Pollensaison im Vergleich zu PM10 Proben aus niedrigen Pollensaison. Beide Quantifizierungsmethoden zeigten hiermit ähnliche Ergebnisse.
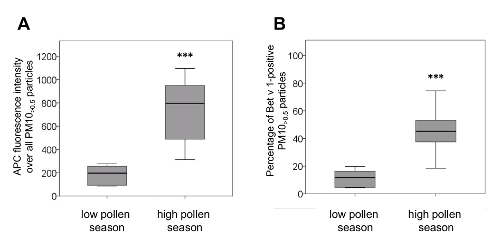
Abbildung 4. PM10 - Proben von niedrigen und hohen Pollensaison unterscheiden sich in ihrer Menge an adsorbiertem Bet v 1. Niedrige Pollensaison PM10 wurde im Herbst / Winter abgetastete 2013 (n = 6), hohe Pollensaison PM10 Mai 2012 und 2013 (n = 13). (A) Die APC - Fluoreszenzintensität von PM10> 0,5 Partikel aus hoch Pollensaison war signifikant höher als von niedrigen Pollensaison (Median / min / max hohe Pollensaison: 796/313/1097; Median / min / max niedrige Pollensaison: 197 / 85/277). (B) PM10 von hoher Pollensaison enthalten significantly mehr Bet v 1-positive PM10> 0,5 Partikel als PM10 von niedrigen Pollensaison (Median / min / max hohe Pollensaison: 45,2 / 18,5 / 74,5; Median / min / max niedrige Pollensaison: 11,8 / 4,4 / 19,8). Box-Plots zeigen Medianwerte (innere Linie der Box), 25. und 75. Perzentile, bzw. (untere und obere Grenzen der Box) und Minimal- und Maximalwerte (Whiskers). *** P <0,001 im Vergleich zu niedrigen Pollensaison, Mann Whitney-U-Test. Diese Zahl wurde von 11 leicht modifiziert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Ein kritischer Schritt des Protokolls ist die Verwendung eines geeigneten Filters für die Sammlung von PM10 Partikel aus der Umgebungsluft (siehe Schritt 1.1). Der Filter muss stark genug sein, mit einer elektrischen Zahnbürste zu ertragen Bürsten, und nicht alle Filtermaterialien erfüllen diese Anforderung. Das Färbungsprotokoll wurde mit einer PM10 Partikelkonzentration von 8x10 6 Partikel pro ml hergestellt. Allerdings, wenn das Material begrenzt ist und die Bündelung von Proben nicht geeignet ist, wird das Verfahren wahrscheinlich genauso gut funktionieren, aber die Antikörper-Konzentrationen (siehe Schritte 3.5 und 3.8) können angepasst werden müssen.
Bet v 1-Färbung von PM10-Partikel ergab keine unterschiedlichen Populationen von positiv und negativ gefärbten Teilchen. Dies könnte durch die unterschiedlichen Mengen von Bet v 1 Allergens auf jede der von sehr kleinen bis zu einer hohen Menge im Bereich Partikel adsorbiert verursacht werden. Dies könnte in der Erweiterung des APC-Signal führen somit die Bevölkerung verschiebt sich in RichtungAPC-Positivität. Da es schwierig ist , den positiven von den negativen Teilchen zu trennen, wurden zwei Quantifizierungsmethoden verwendet , um die Unterschiede in der Bet v 1 - Gehalt der PM10> 0,5 Proben zu bestimmen: (i) eine relative Quantifizierung durch den Median APC Fluoreszenzintensität aller Teilchen Mess und (ii) Bestimmung des Prozentsatzes von APC positive Partikel. Die Bet v 1 - Last von Partikeln aus niedrigen und hohen Pollensaison PM10 In Bezug auf > 0,5 zeigten beide Methoden ähnliche Ergebnisse. Dennoch empfiehlt sich eine relative Quantifizierung durch mittlere Fluoreszenzintensität aller Partikel, wie es das Gate des Anordnens und daher wahrscheinlich weniger fehleranfällig unabhängig ist.
Viele Studien Bisher untersuchen die Allergengehalt in der Umgebungsluft Feinstaub durch das jeweilige Allergen und anschließende Quantifizierung Extraktion mit ELISA 5,12-14,17. Es besteht ein grundlegender Unterschied zwischen der hier beschriebene Verfahren und die quantification mit ELISA: ELISA quantifiziert die extrahiert und aufgelöst Antigen, während der Durchflusszytometrie die partikelgebundenen Antigen analysiert. Mittels ELISA die Bet v 1 Last der getesteten PM10 Proben (n = 8) unterhalb der Nachweisgrenze von 1,2 ng / ml (Daten nicht gezeigt). In ähnlicher Weise identifiziert Buters und andere keine Bet v 1 in der PM <2,5 & mgr; m - Fraktion und nur etwa 7% in der 10 & mgr; m> PM> 2,5 um - Fraktion, aber mehr als 93% in der PM> 10 um Anteil an Umgebungsluft 13. Die kontrastier Ergebnisse des ELISA auf der einen Seite und der FACS-Analyse auf der anderen Seite kann durch Unterschiede in der Detektionsverfahrens in Verbindung mit divergenten Empfindlichkeit verursacht werden. Weitere Forschung ist jedoch nötig, um diesen Unterschied zu verstehen.
Ein Verfahren zur Visualisierung partikelgebundene Antigen wird rasterelektronenmikroskopisch 10,14. Durch Rasterelektronenmikroskopie, Ormstad et al. Visualisierten Bet v 1 an der Oberfläche von suspendierten teilchenförmigen matter Rußpartikeln im Hochpollensaison abgetastet und in geringerem Maße von Partikeln im Niederpollensaison abgetastete 15. Zusätzlich Allergenen aus Pollen, Latex und auch β-Glucane wurden gefunden 10 bis Verbrennungspartikel in der Luft adsorbiert werden. Dieses Verfahren erlaubt jedoch nicht die Quantifizierung des partikelgebundenen Allergen.
Durch die Verwendung der Durchflusszytometrie, partikelgebundene Bet v 1 Allergen quantifiziert werden konnte. Somit Durchflusszytometrie eine neue Möglichkeit bieten kann , die von 10 bis 0,5 & mgr; m biologische Fraktion von PM10 als mit anderen geeigneten Antikörpern auf der Hand zu charakterisieren, kann dieses Verfahren auf die Detektion von anderen Antigenen über die Luftpartikel ausgedehnt werden, beispielsweise Schimmel, Hausstaubmilben Allergene oder LPS. Als PM10 Partikel nicht nur biologische Material adsorbieren, sondern auch Chemikalien und Metalle ganz leicht, unspezifische Bindung von Antikörpern könnte, stellen jedoch ein Problem. Wenn ein neuer Antikörper getestet wird, ist ein kritischer Schritt spezifischen bind beweisening. Dies kann dadurch erfolgen, um beispielsweise die Bindungskapazität des spezifischen Antikörpers mit dem entsprechenden Antigen Blockierung vor 11 bis Anfärbung.
Als Bet v 1 - Gehalt von Umgebungsluft aus Birkenpollen Zahl unterscheiden können 12,13,18, könnten allergische Symptome korrelieren vielleicht besser mit Allergengehalt als mit Pollen 14,18 zählen. Daher ermöglicht das vorgestellte Verfahren in Verbindung mit klinischen Daten in zukünftigen Experimenten zu untersuchen , ob allergische Reaktionen entsprechen dem Bet v 1 Allergenbelastung von PM10> 0,5 bis Birke.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
The authors would like to thank Katrin Bossmann, Anett Neumann and Eike Wolter (German Environment Agency) for their valuable preparatory work.
Materialien
| Name | Company | Catalog Number | Comments |
| Teflon filter | Pall Life Sciences, USA | R2PL047 | 47 mm, 1.0 µm |
| low volume sampler | Sven Leckel Ingenieur Büro GmbH, Germany | LVS3 | air flow of 2.3 m3/h |
| Phosphate-buffered saline | Biochrom, Germany | L1825 | without Ca/Mg, low endotoxin |
| electrical toothbrush | Braun, Germany | Oral-B Vitality Sensitive | |
| Casy cell counter | Schärfe System GmbH, Germany | Model TTC | range of detectable particle size: 0.7 µm to 45 µm |
| FACSCanto II | Becton Dickinson, USA | 3-laser, 8-color (4-2-2) | |
| FACS Diva Software v6.1.3 | Becton Dickinson | ||
| bovine serum albumin (BSA) | Sigma-Aldrich, USA | A2153-10G | |
| monoclonal mouse IgG1 antibody against Bet v 1 | Indoor Biotechnologies, UK | MA-3B4 | clone MA-3B4 |
| APC (Allophycocyanin)-labeled secondary anti-Mouse IgG1 antibody | Becton Dickinson | 560089 | clone A85-1 |
| SPSSTM software version 18 | PASW Statistics 18, Hongkong, China | ||
| Petri Dish | Gosselin, France | BP50-02 | D 55mm, H 15mm |
| FACS Tube | Becton Dickinson, USA | REF 352054 | 5ml Polystyrene |
| CASYton | Roche Germany | REF 05651808001 | |
| Matrix Blank Tubes | Thermo Scientific, USA | 4140 | 1,4 ml, PP |
| Centrifuge | Heraeus, Thermo Scientific | Megafuge 40R | |
| Vacuum Pump | INTEGRA Biosciences AG, Switzerland | Model 158 320 | Inetrgra Vacusafe |
| recombinant Bet v 1a antigen | Indoor Biotechnologies, UK | LTR-BV1A-1 | Concentration: 2.0 mg/ml |
Referenzen
- Cakmak, S., Dales, R. E., Coates, F. Does air pollution increase the effect of aeroallergens on hospitalization for asthma?. J Allergy Clin Immunol. 129 (1), 228-231 (2012).
- Barraza-Villarreal, A., et al. Air pollution, airway inflammation, and lung function in a cohort study of Mexico City schoolchildren. Environ Health Perspect. 116 (6), 832-838 (2008).
- Chen, B. Y., et al. The association of ambient air pollution with airway inflammation in schoolchildren. Am J Epidemiol. 175 (8), 764-774 (2012).
- Cyprowski, M., Buczynska, A., Szadkowska-Stanczyk, I. Indoor allergens in settled dust from kindergartens in city of Lodz, Poland. Int J Occup Med Environ Health. 26 (6), 890-899 (2013).
- Brough, H. A., et al. Distribution of peanut protein in the home environment. J Allergy Clin Immunol. 132 (3), 623-629 (2013).
- Galli, S. J., Tsai, M., Piliponsky, A. M. The development of allergic inflammation. Nature. 454 (7203), 445-454 (2008).
- World Health Organisation, R. O. f. E. Phenology and human health: allergic disorders: report on WHO meeting Rome, Italy. , 256 (2003).
- Wuthrich, B., Schindler, C., Leuenberger, P., Ackermann-Liebrich, U. Prevalence of atopy and pollinosis in the adult population of Switzerland (SAPALDIA study). Swiss Study on Air Pollution and Lung Diseases in Adults. Int Arch Allergy Immunol. 106 (2), 149-156 (1995).
- Grote, M., Valenta, R., Reichelt, R. Abortive pollen germination: a mechanism of allergen release in birch, alder, and hazel revealed by immunogold electron microscopy. J Allergy Clin Immunol. 111 (5), 1017-1023 (2003).
- Namork, E., Johansen, B. V., Lovik, M. Detection of allergens adsorbed to ambient air particles collected in four European cities. Toxicol Lett. 165 (1), 71-78 (2006).
- Süring, K., et al. PM10 contains particle-bound allergens: Dust analysis by Flow Cytometry. Env Technol Inn. 5, 60-66 (2016).
- Schappi, G. F., Suphioglu, C., Taylor, P. E., Knox, R. B. Concentrations of the major birch tree allergen Bet v 1 in pollen and respirable fine particles in the atmosphere. J Allergy Clin Immunol. 100 (5), 656-661 (1997).
- Buters, J. T., et al. The allergen Bet v 1 in fractions of ambient air deviates from birch pollen counts. Allergy. 65 (7), 850-858 (2010).
- Buters, J. T. M., et al. Release of Bet v 1 from birch pollen from 5 European countries. Results from the HIALINE study. Atmos Environ. 55, 496-505 (2012).
- Ormstad, H., Johansen, B. V., Gaarder, P. I. Airborne house dust particles and diesel exhaust particles as allergen carriers. Clin Exp Allergy. 28 (6), 702-708 (1998).
- Brough, H. A., et al. Peanut protein in household dust is related to household peanut consumption and is biologically active. J Allergy Clin Immunol. 132 (3), 630-638 (2013).
- Jochner, S., et al. Seasonal variation of birch and grass pollen loads and allergen release at two sites in the German Alps. Atmos Env. , (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten