Method Article
Tissue Engineering von Intrinsic Vaskularisation in ein
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
This is a guideline for constructing in vivo vascularized tissue using a microsurgical arteriovenous loop or a flow-through pedicle configuration inside a tissue engineering chamber. The vascularized tissues generated can be employed for organ regeneration and replacement of tissue defects, as well as for drug testing and disease modeling.
Zusammenfassung
In der rekonstruktiven Chirurgie gibt es einen klinischen Bedarf nach einer Alternative zu den derzeitigen Methoden der autologe Rekonstruktion, die komplex, teuer und Handel ein Defekt für einen anderen. Tissue Engineering hält das Versprechen dieser steigenden Nachfrage zu begegnen. Allerdings scheitern die meisten Tissue-Engineering-Strategien stabile und funktionelle Gewebeersatz zu erzeugen, wegen der schlechten Vaskularisierung. Dieses Dokument konzentriert sich auf ein in vivo Tissue Engineering Kammer Modell intrinsischen Vaskularisierung wo eine perfundiert Arterie und eine Vene entweder als arteriovenöse Schleife oder einer Durchfluss Pedikel Konfiguration innerhalb einer geschützten Hohlkammer gerichtet ist. In dieser Kammer-basierten System tritt angiogenen Sprießen von den arteriovenöse Gefäße und dieses System zieht ischämischen und entzündlichen endogene Zellmigration angetrieben, die den Kammerraum mit Fibro-Gefäßgewebe allmählich füllt. Exogene Zell / Matrix-Implantation bei der Kammerkonstruktion verbessert Zelle surVival und bestimmt die Spezifität der engineered Gewebe, die zu entwickeln. Unsere Studien haben gezeigt, dass diese Kammer Modell erfolgreich verschiedene Gewebe wie Fett, Herzmuskel, Leber und andere erzeugen kann. Allerdings sind Änderungen und Verbesserungen erforderlich Zielgewebe, um sicherzustellen, Bildung konsistent und reproduzierbar ist. Dieser Artikel beschreibt ein standardisiertes Protokoll für die Herstellung von zwei verschiedenen vaskularisierten Gewebetechnik Kammer Modelle in vivo.
Einleitung
Die Herstellung von funktionellen bluteten Gewebe ein Tissue - Engineering - Ansatz ist eine neue Paradigma in der regenerativen Medizin. 1,2 Viele Ansätze zu konstruieren neue und gesunde Gewebe für den Ersatz von verletztem Gewebe oder defekte Organe entwickelt, 3-6 experimentell in kleinen Tiermodellen mit vielversprechende klinische Potenzial. 7,8 jedoch Vaskularisierung bleibt eine der großen Herausforderungen für das Tissue Engineering sein Potenzial zu begrenzen Gewebe klinisch relevanter Größe zu wachsen. 9
Aktuelle Ansätze Gewebe folgen entweder eine extrinsische Weg zu vaskularisieren wo neue Schiffe von der Empfängergefäßbett wachsen und dringen überall in das implantierte Gewebe konstruiert 10 oder eine intrinsische Vaskularisierung Weg , wo das Gefäßsystem wächst und dehnt sich im Einklang mit dem neu entstehenden Gewebes. 11 Der extrinsische Ansatz traditionell beinhaltet Seeding Zellen auf ein Gerüstin vitro und das vollständige Konstrukt in das lebende Tier mit der Erwartung , Implantieren , die Nährstoffe, die zuvor von Kulturmedien zugeführt wird , wird aus dem Kreislauf stammen. 12,13 Das Konzept vereinfachend als vaskuläre Einwachsen zu langsam und nur sehr dünne Implantate (< 1-2 mm dick) wird lebensfähig bleiben. Bereitstellung von Nährstoffen und Sauerstoff durch eine schnelle und ausreichende Vaskularisierung im Herzen eines jeden erfolgreichen Versuche ist komplexer und größer Tissue-Engineering - Ersatzstoffe wie Knochen, Muskeln, Fett und soliden Organen zu wachsen. 14,15 Intrinsic Vaskularisierung bietet das Potenzial für größere Konstrukte durch progressive Gewebewachstum, die seinem wachsenden Blutversorgung zu entwickeln. Ein Design ist die in vivo - Implantation in eine Kammer eines Gefäßstiel mit oder ohne einer Zelle seeded Gerüst. 5,6 dies der Weg zu neuen Verfahren zur Erzeugung von dickeren intrinsisch vaskularisierten Geweben geebnet. 16,17
vorab vaskularisieren Gewebetransplantate, vor der Implantation in jüngster Zeit wurden Strategien entwickelt. Diese integriert Blutgefäßnetze zielen darauf ab , mit dem Host - Schiffen bei der Implantation zu inosculate so dass für die schnelle Bereitstellung einer vollständigen Blutversorgung das Überleben aller Teile eines transplantierten dicken Gewebetransplantats zu verbessern. 18
Wir waren die ersten in vivo eine gefäß Tissue Engineering Modell in Kleintiere , die eine subkutan implantierte halbstarre geschlossene Kammer , die einen durchbluteten Gefäßstiel und zellhaltigen Biomaterialien umfasst. Die Kammer schafft eine ischämische Umgebung , die von den implantierten Gefäße angiogenen Sprießen stimuliert. 3 Der Gefäßstiel kann entweder eine rekonstruierte arteriovenöse Schleife oder eine intakte Durchfluss Arterie und Vene sein. 3-6,19 Diese Gefäßstiel Sprossen eine funktionierende und umfassende arterio -capillary-venöse Netzwerk, das sowohl auf Kunst verbindeteriole und venöse endet mit dem Gefäßstiel. 3,20 Darüber hinaus ist die umgebende hohle Stützkammer schützt die Entwicklung von Gewebe vor potenziell mechanischen Kräften verformt und verlängert die ischämische Antrieb Vaskularisierung zu verbessern. 3,21,22 Wenn das Schiff pedicle einfach in implantiert normales Gewebe und nicht innerhalb des geschützten Raum der Kammer, hört angiogenen Sprießen entlang der gleichen Zeitachse wie eine normale Wunde und kein neues Gewebe wird um den Stiel akkumulieren. Forscher haben diese in vivo - Konfiguration verwendet dreidimensionalen Funktions vaskularisierten Gewebekonstrukte mit unterstützenden Vaskulatur zu produzieren und klinisch relevanter Größe. 4,23 Weiteren die gentechnisch vaskularisierten Gewebekonstrukte mit seiner intakten Gefäßstiel kann zur anschließenden Transplantation an der Verletzungsstelle geerntet . Eine klinisch machbar Szenario die Kammer für den Wiederaufbau s 24,25 im Rahmen der endgültigen Standort erschaffen würdeuch als die Brust. Somit könnte diese de novo Tissue Engineering Ansatz haben klinische Potenzial eine neue Quelle der funktionellen Zielgewebe für die rekonstruktive Chirurgie bereitzustellen. 26-28
Das folgende Protokoll wird eine allgemeine Anleitung geben einen in vivo vaskularisierten Gewebetechnik Kammer in der Ratte zu konstruieren, die in verschiedenen Tiermodellen und eingesetzt angepasst werden, um die komplizierten Prozesse der Angiogenese, der Matrixproduktion und zelluläre Migration und Differenzierung zu untersuchen.
Protokoll
Die Protokolle hier beschrieben wurden von der Tierethikkommission von St. Vincent Hospital Melbourne, Australien, genehmigt und wurden unter strenger Einhaltung der Australian National Health und Medical Research Council-Richtlinien durchgeführt.
HINWEIS: zwei Kammer Protokolle werden unten beschrieben. Die zwei verschiedenen Modelle und ihre spezifischen Kammerkonstruktionen sind in Abbildung 1 dargestellt. Kammer (1) aus Polycarbonat (Kammermodell Ratte arteriovenöse Schleife). Es ist zylindrisch mit einem Innendurchmesser 13 mm und die Höhe 4 mm. Ein Fenster an einer Stelle in der Wand erlaubt den ungehinderten Zugang für den Stiel. Im zweiten Modell (für Ratten - Flow-Through - Stiels Kammer - Modell) wird die Kammer von Polyacryl und ist rechteckig (10 x 8 x 4 mm 3 Innenmaße). Es hat zwei 1,5 mm Öffnungen auf gegenüberliegenden Seiten der Femoralarterie und Vene aufzunehmen, wie sie in die Kammer übertreten.
1. Ratte arteriovenöse Schleifenkammer Modell (Ein Chamber pro Tier)
HINWEIS: Vor der Operation beginnen, stellen Sie sicher, dass alle Instrumente ordnungsgemäß sterilisiert wurden. Ebenso sorgen die übrigen Instrumente auf sterilen Tüchern und sind in einem angemessenen Abstand vom Operationsfeld Kontamination während des Verfahrens zu vermeiden.
- Vorbereitung der Tiere für Chirurgie
- Verwenden Ratten mindestens 250 g für ihre Größe der Schiffe, für die Erstellung der arteriovenöse Schleife wiegen.
- Betäuben des Tieres mit 4% Isofluran Einatmen. Erhärten ausreichende Tiefe der Anästhesie durch Teilnahmslosigkeit bis Fuß-Pinch beurteilen. Nach der Anästhesie, halten das Tier ausreichend während des gesamten Verfahrens mit 2% Isofluran betäubt.
- Legen Sie das Tier in Rückenlage auf einem wärmenden Kissen und steriler Schmiermittel auf die Augen Austrocknung während der Operation zu verhindern.
- Mit einem elektrischen Rasierer, rasieren beide Buhnen und entfernen Sie die Haare mit einem Stück feuchten Gaze.
- Bereiten Sie die Operationsstellen mit Chlorhexidin/ 70% Ethanol-Lösung und das Tier mit sterilen Tüchern drapiert. Verwalten einer Einzeldosis von Carprofen (5 mg / kg, subkutan) als Analgetikum.
- Ernte der Oberschenkelvene Graft
- Unter Verwendung eines # 15 Klinge, machen Sie eine 4 cm lange Hautschnitt auf der linken Leiste parallel zum Leistenband. Dies legt den Leistenfettpolster.
- Schnitt durch das Fettpolster am Umfang mit einer Schere an den epigastrischen Gefäße es an seinem Gefäßstiel Basis zu verlassen.
- Mit Mikro Schere, befreien die duftige Bindegewebe Verwachsungen zwischen Bauchdecke und die zugrunde liegenden Femoralgefäße.
- Legen Sie einen Aufroller auf der Bauchdecke und ziehen medial. Dies legt das Leistenband und über die gesamte Länge des Oberschenkelgefäße.
- Mit Mikropinzette und einer gebogenen Schere sezieren die epigastrische Vene und zu isolieren, es von seiner umgebenden Fett durch leichtes Ziehen und Schneiden. Diese Ader wirkt als Haltegurt, wenn die Schleife zu konstruieren.
- Using Mikropinzette und gebogenen Mikro Schere öffnen Sie die perivaskuläre Hülle die Oberschenkelgefäße und Nerven den ganzen Weg von dem Leistenband zu seiner Gabelung distal der epigastric Zweig enthält.
- Mit Mikropinzette, die Oberschenkelvene durch seine adventitia abholen und es vorsichtig aus dem umgebenden Gewebe trennen und begleitende Arterie. Tun Sie dies mit Mikropinzette und gebogenen Rund spitz Mikro Schere durch das Gewebe Auseinanderziehen und Schneiden durch sie.
HINWEIS: Niemals die ganze Dicke der Venenwand greifen, da dies ein Trauma der Intima verursachen könnten es anfällig für Thrombose zu machen. - Ligat Seitenzweige während der Präparation mit 10/0 Nylonnaht oder gerinnen sie mit einem bipolaren Koagulator gefunden.
- Mit der Oberschenkelvene völlig frei, abzubinden seinem proximalen und distalen Ende mit 4/0 Seidenfäden. Achten Sie darauf, eine Vene Graft von mindestens 10 mm Länge zu erhalten und umfassen etwa 0,5 cm Länge des epigastric Zweig als ein Halteseil Haltegurt verwendet werdendie Schleife offen in der Kammer zu halten.
- Mit Mikropinzette und gerade Mikro Schere, schneiden Sie die Adventitia von den Enden des Transplantats durch leichtes Ziehen und Schneiden. Dies kann auch später durchgeführt werden, bevor mikrochirurgisches Anastomosen.
- Spülen Sie das Venentransplantat mit heparinisierter Kochsalzlösung (10 U / ml Heparin) und lassen Sie es in der Lösung zur Ruhe. Schließen Sie die Wunde Dauerlauf 4/0 Seidennaht plus zwei oder drei zusätzlichen einfachen unterbrochenen Stichen.
- Erstellung von arteriovenöse Schleife und Implantierung von Kammer
- Wiederholen Sie die Schritte 1.2.1 in der exakt gleichen Art und Weise zu 1.2.4 auf der Gegen Glied.
- Mit Mikropinzette, sezieren und sowohl die epigastrische Arterie und Vene isolieren die umgebende Fettpolster bilden. Tun Sie dies, indem Sie vorsichtig das Gewebe ziehen weg von den Gefäßen
- Mit Mikropinzette, wählen Sie die Oberschenkelarterie durch ihre Adventitia und frei, um es aus den umliegenden Geweben. Tun Sie dies mit Mikropinzette und gebogenen runden zackigen micro Schere durch das Gewebe Auseinanderziehen und Schneiden durch sie. Abzubinden oder gerinnen ihre Seitenäste.
- Ligieren der Arteria und Vena femoralis distal der Entstehung der epigastrischen Gefäße mit 4/0 Seidennaht.
- Legen Sie eine einzelne Klemme proximal an jedem der Arteria und Vena femoralis. Mit einem scharfen gerade Mikro Schere, machen einen sauberen quer geschnitten in jedem Gefäß distal der Entstehung der epigastric Zweige. Legen Sie einen sterilen Plastik Kontrast Hintergrund unter den Gefäßen.
- Spülen Sie die Behälter kräftig mit großzügigen Mengen von heparinisierter Kochsalzlösung, bis das gesamte Blut aus dem Lumen entfernt wird.
- Bringen Sie das Venentransplantat in das Operationsfeld und entfernen Sie alle redundanten adventitia aus der Schiffsenden gemäß Schritt 1.2.10, wenn nötig.
- Führen Sie beide mikrochirurgisch Anastomosen mit 10/0 Nylonfaden. Anastomosieren das proximale Ende des Venentransplantats die Oberschenkelvene und dem distalen Ende der Oberschenkelarterie. Dies ermöglicht es dem Blut zu fließen fROM mit der arteriellen zur venösen Seite ohne Widerstand von den Ventilen in der Vene Graft.
HINWEIS: Stellen Sie sicher, dass die Oberschenkelgefäße und die Vene Graft-Rest in ihrer natürlichen Position ohne Wendungen. - Prüfen Sie auf Lecks an beiden Anastomosen. Lösen Sie kleine Lecks, die aussehen wie nicht pulsierendem Blut aus der Anastomose kommt, durch ein kleines Stück von Fett auf der Oberseite platziert und sanft für 5-10 min zu komprimieren. Größere pulsierende Lecks, die schnell das gesamte Feld überschwemmen zusätzliche Stiche müssen.
- Überprüfen Sie die Durchgängigkeit der arteriovenöse Schleife. Sanfte Verschluss der Arteria femoralis sollte es schrumpfen, während das gleiche in die Oberschenkelvene sollte es anschwellen.
- Legen Sie die Basis des Tissue Engineering Kammer unter der arteriovenöse Schleife mit dem letzteren ruht in seiner natürlichen Position ohne Drehungen oder Knicke.
- Befestigen Sie den Boden der Kammer zu dem Leistenband und das darunter liegende Muskelfaszie mit 6/0 Nylonnähten.
- Setzen Sie den Deckel über dieBasis, so dass die Femoralgefäße die Kammer durch eine Kerbe (Fenster in der Seite der Kammer) eingeben. Wenn Sie den Deckel schließen, stellen Sie sicher, dass es fängt die epigastric Zweige, zwischen der Kammer Boden und Deckel, die wirken als Anbindehaltung die arteriovenöse Schleife in Position zu halten.
- Schließen Sie die Wunde Dauerlauf 4/0 Seidennaht plus zwei oder drei zusätzlichen einfachen unterbrochenen Stichen.
- Lassen Sie das Tier aus der Narkose auf eine wärmende Unterlage zu erholen.
- Nicht das Tier unbeaufsichtigt lassen, bis es genügend Bewusstsein zu halten Brustlage wiedergewonnen hat. Ebenso kehren nicht ein Tier, dass eine Operation für das Unternehmen von anderen Tieren unterzogen wurde, bis sie vollständig erholt. 24 Stunden später, zu verwalten eine weitere Einzeldosis von Carprofen (5 mg / kg, subkutan) als Analgetikum.
- Behandeln Sie die Wunde mit topischen antibiotischen Salbe für 5 Tage. Wenn die Wunde geöffnet wird, betäuben das Tier, wie in Schritt 1.1.2 bis 1.1.5 und schließen Sie die Wunde wie in 1.3.14. Überwachen Sie die Gesundheit von Tier täglich. Euthanize das Tier eine tödliche Dosis intraperitoneale lethabarb Injektion unter Verwendung von (163 mg / kg in 0,25 ml von 23 G-Nadel), wenn das Tier mehr als eine moderate Anzeichen von inacitivity zeigt, Appetitlosigkeit, Gewichtsverlust und Verlust der Farbe.
2. Durchfluss Pedicle Kammer (zwei Kammern pro Tier)
- Vorbereitung der Tiere für Chirurgie
- Wiederholen Sie die Schritte 1.1.1 bis 1.1.4. Zwei Kammern in beide Leistenbereiche eines einzelnen Ratte implantiert werden.
- Isolierung von Femoralgefäße und Insertion der Kammer
- Wiederholen Sie die Schritte 1.2.1 bis 1.2.8.
- Mit beiden Arterie und Vene vollständig befreit Gewebe umgibt, und ihre Äste ligiert, bringen die Kammer in das Operationsfeld.
- Platzieren Sie jede der intakten Femoralgefäße auf den entsprechenden Schlitz des Kammerbodens sicherstellen, dass es keine Drehungen oder Knicke.
- Schließen Sie die Kammer von attaching des Deckels an der Basis. Schließen Sie die Wunde mit Dauerlauf 4/0 Seidennaht plus zwei oder drei zusätzliche einfache unterbrochene Stiche und lassen Sie das Tier, wie zuvor beschrieben zu erholen.
3. Ernte der Kammern und Gewebeverarbeitung
- Sobald die Zeitpunkte Experiment (4-6 Wochen nach der Implantation) erreicht sind, betäuben das Tier, wie in Schritt 1.1.2 und 1.1.3 Schritte durch 1.1.5 wiederholen.
- Öffnen Sie die Wunde einer # 15 Klinge und schneiden durch die Gewebe mit einer Schere, bis die Kammer vollständig ausgesetzt ist.
- Setzen Sie die Femoralgefäße proximal zu dem Konstrukt und Test für die Gefäßdurchgängigkeit: sanft, das Schiff mit zwei microforceps verschließen, dann melken das Blut in eine distale Richtung und lassen schließlich die proximalen Zange. Wenn das Schiff wieder mit Blut füllt, bestätigt dies die Durchgängigkeit. Ligieren die Oberschenkelgefäße proximal in dem Fall der arteriovenöse Schleife und sowohl proximal und distal in dem Fall the Flow-Through - Konfiguration, und entfernen Sie en bloc die Kammern mit dem haltigen Gewebe.
- Am Ende des Experiments euthanize das Tier eine tödliche Dosis intraperitoneal lethobarb Injektion unter Verwendung von (163 mg / kg in 0,25 ml von 23 G Nadel).
- Fix Gewebe in 4% Paraformaldehyd bei Raumtemperatur für 24 Std. Teilen Sie Gewebe in mehrere Querschnitte (1-2 mm dick) und in Paraffinwachs oder optimale Schnitttemperatur Verbindung für Paraffinschnitte (5 & mgr; m) oder Gefrierschnitten (10 & mgr; m) einzubetten sind. 3,4,8,17,22, 24
- Eine regelmäßige histologischen Färbung wie Hämatoxylin und Eosin die allgemeine Morphologie der Gewebe zu untersuchen. Führen Sie immunhistochemischen Färbung mit spezifischen Antikörper Zelltyp von Interesse zu identifizieren, 3,4,8,17,22,24,29 zum Beispiel kardiales Troponin T - Immunfärbung für Kardiomyozyten.
Ergebnisse
Die mikro Schaffung von Tissue-Engineering-Kammern wurde in dem Protokoll, wie oben beschrieben, durchgeführt. Die Gewebe innerhalb der Kammern erzeugt wird, kann in Protokollschritt 3. Verschiedene Gewebetypen erfolgreich unter Verwendung der in - vivo - gefäßKammer entwickelt wurden histologisch als beschreiben untersucht werden (Abbildung 2). Diese schließen Herzgewebe mit neonatalen Cardiomyocyten der Ratte (2A), Muskelgewebe mit Ratten Skelettmyoblasten (2B), und Fettgewebe mit einem Hydrogel aus Fettgewebe abgeleitete extrazelluläre Matrix (Abbildung 2C).
Morphometrische Auswertung der Gewebe kann entweder mit einem Stereo Investigator Systems oder ImageJ Software durchgeführt werden. 3,4,8,17,22,29 Neben qualitative Beurteilung der verschiedenen Gewebekomponenten, die stereology System ermöglicht auch unvoreingenommene quantifizierung von bestimmten Gewebevolumens. Beispielsweise Lectin (ein Marker für rodent Endothelzellen) gefärbt Querabschnitte (3) verwendet werden kann , das Gefäßvolumen der geernteten Gewebekonstrukte mit stereology System mittels Videomikroskopie abzuschätzen. Ähnliche Quantifizierungsmethoden können die Lautstärke anderer Gewebetypen zu beurteilen, angewendet werden.
Die Tissue - Engineering - Kammern können auch in vivo Implantation eingesetzt werden folgende Zellschicksal zu verfolgen. Die Zellen können mit Fluoreszenzfarbstoffen wie Dil, PKH26 oder Quantenpunkte vor der Implantation vorge markiert werden. Zum Beispiel können neonatale Cardiomyocyten der Ratte vormarkiert mit DiI in den Gewebekonstrukten an 3 Tage nach der Implantation (4A) geerntet werden detektiert. Wir haben auch implantierten Zellen erfolgreich verfolgt, die für bis zu 4 Wochen nach der Implantation mit DiI vormarkiert wurden. Alternativ speziesspezifische Antikörper können an i verwendet werdenimplantierten Zellen in der Xenotransplantation Studien ekb.html. Zum Beispiel menschlichen induzierten pluripotenten Stammzellen innerhalb des Tissue Engineering Kammern in immunsupprimierten Ratten implantiert kann durch Immunfärbung mit humanspezifischen Ku80 - Antikörper (4B) in den geernteten Gewebekonstrukte identifiziert werden.
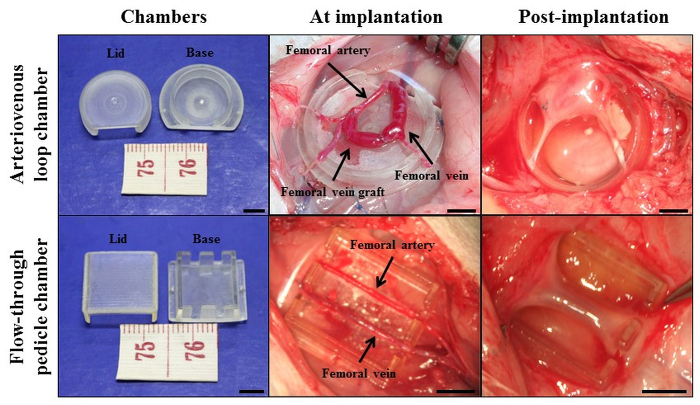
Abbildung 1: Cardiac Tissue Engineering mit der in vivo gefäß Kammer Intrinsic Vaskularisierung Ansatz mit arteriovenöse Schleifenkammer Modell und Durchfluss pedicle Kammer - Modell.. Die Kammern wurden aus entweder Polycarbonat oder Polyacryl, wurden diese Materialien in vivo zu sein , nicht-entzündliche und ungiftig getestet. Maßstabsbalken = 5 mm. Re-gedruckt mit freundlicher Genehmigung von 30. Plea se hier klicken, um eine größere Version dieser Figur zu sehen.
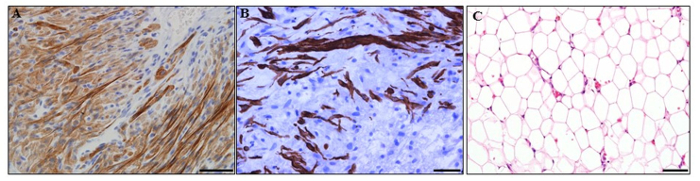
Abbildung 2:. Gewebe aus den in vivo gefäßKammern entwickelt (A) Herzgewebe mit neonatalen Ratten Kardiomyozyten. Kardiomyozyten wurden mit Troponin T Antikörper (braun) immunhistochemisch. (B) Muskelgewebe mit Ratten - Skelett-Myoblasten. Muskelzellen wurden mit Desmin-Antikörper (braun) immungefärbt. (C) Fettgewebe mit einem Hydrogel aus dem Fettgewebe extrazellulären Matrix abgeleitet. 31 Hämatoxylin und Eosin - Färbung. Maßstabsbalken = 50 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
/files/ftp_upload/54099/54099fig3.jpg "/>
Abbildung 3: Vaskularität eines Gewebekonstrukten bei 4 Wochen nach Implantierung geerntet repräsentative Bilder von Lektin-gefärbten Schnitten.. Die Blutgefäße aus der Femoralarterie sprießen (*) wurden mit Lektin (braun) markiert. Maßstabsbalken = 200 & mgr; m (links) und 100 & mgr; m (rechts). Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Fig . 4: Identifizierung von transplantierten Zellen in den Gewebekonstrukten (A) DiI-label neonatalen Cardiomyocyten der Ratte (rote und weiße Pfeile) in einem Konstrukt Rattengewebe bei 3 Tage nach der Implantierung geerntet. (B) ein Vertreter humanspezifischen Ku80 gefärbten histologischen Bild eines Gewebekonstrukt aus einer Ratte tissu geerntete Ingenieurkammer mit menschlichen induzierten pluripotenten Stammzellen 28 Tage nach der Implantation implantiert. Menschliche Kerne wurden Immuno-markiertem braun und immunsupprimierten Ratten verwendet wurde Abstoßung menschlicher Zellen zu verhindern. Maßstabsbalken = 50 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Technik der Mikrozirkulation wird derzeit im Wesentlichen durch zwei Ansätze untersucht. Die erste umfasst innerhalb des Konstrukts in vitro eine hoch vernetzte vaskuläre Netzwerk entwickeln , so dass , wenn es implantiert, Kapillaren vom Host Gefäßbett mit denen das durch einen Prozess namens inosculation konstruieren transplantierten verbinden, wodurch die Lieferung von Nährstoffen nicht nur an die Peripherie zu gewährleisten , aber auch auf den Kern. 21,32,33 Dies wird pre-Vaskularisierung genannt. Der zweite Ansatz versucht die Host-eigenen Gefäßen direkt in vivo zu verbessern, so dass Kapillare sprießen entweder vor oder gleichzeitig mit implantierten Zelldifferenzierung und Gewebewachstum auftritt. 17,34
Die in vivo Tissue Engineering Kammer Protokoll präsentiert hier nutzt das letztere Konzept durch eine Arterie und eine Vene platziert, entweder als arteriovenöse Schleife oder einem Durchfluss pedicle Konfiguration,in einem geschützten leeren Raum, so dass signifikante Sprießen und Bildung neuer Kapillaren über die Zeit 3 Vorteile der Kammer umfassen (1) das Fehlen von in vitro - Manipulationen. (2) die Erzeugung eines vollständig autologe Gefäßnetz, das nicht durch den Host abgelehnt werden; und (3) die Tatsache , dass es keine inosculation Zeit braucht , die zwischen 1 bis 7 Tage beträgt das Gewebe konstruieren anfällig für Ischämie zu nehmen. 35,36
Dennoch ist zu beachten, dass es etwa 3-7 Tage signifikante Kapillare nimmt einen Zeitraum auftreten keimen, während der das implantierte Gewebe wird auch schlecht versorgt. 3 Verzögerte Zellimplantation , sobald die Kammer ausreichend ist vaskularisiert tatsächlich verbesserten Überleben gezeigt. 17 Ein weiterer Vorteil umfasst die Biokompatibilität und nicht-Immunogenität der Kammern 'Material (dh Polycarbonat und Polyacryl). Darüber hinaus ist die starre nicht-kollabierbaren chamber stellt einen geschützten Raum für das Gewebe und Gefäße ohne Zusammenführung und Integration mit der Umgebung zu wachsen, die andernfalls Expansions behindern würde und der Ernte des neu gebildeten Gewebes erschweren. Im Gegensatz dazu sind die Tatsache, dass die Kammern geschlossen können Gewebewachstum begrenzen. Dies jedoch ist in der arteriovenöse Schleife Modell angesprochen, die nun eine perforierte Kammer verwendet , die gezeigt worden ist , Gewebe effektiver als die geschlossene einem wachsen. 37
Die Gewebe-Engineering-Kammer-Protokolle hier vorgestellten sind in hohem Maße reproduzierbar, aber es sollte betont werden, dass die Kammern selten vollständig zu füllen, in der Regel auf etwa 70% der Kapazität. Konsistente Ergebnisse werden erzielt, vorausgesetzt, dass einige kritische Schritte und technischen Fragen berücksichtigt werden. Pedicle Durchgängigkeit ist das ultimative Ziel, wenn sie mit Blutgefäßen arbeiten, besonders wenn mikrochirurgisch Anastomosen durchgeführt werden. Wir haben festgestellt, konsequent kein Gewebe wächst, wenn der vascdere pedicle Thrombosen früh nach der Operation. Faktoren, die Durchgängigkeit beeinflussen lassen sich grob in vier Kategorien eingeteilt werden, nämlich chirurgische Technik, Durchblutung, Thrombose und Krampf.
Zuerst wird eine empfindliche chirurgische Technik ist der Schlüssel zum Erfolg. In diesem Sinne sollte beachtet werden, dass diese Verfahren, insbesondere die, die Schaffung eines arteriovenöse Schleife erfordern ein gewisses Maß an chirurgische Geschicklichkeit denen, die ohne weiteres durch das Praktizieren ersten in nicht-lebenden Modelle und anschließend in der Ratte Femoralgefäße erworben werden können folgende die Prinzipien und Techniken , die hier und an anderer Stelle beschrieben. 38 Schäden an der Gefäßwand, insbesondere der Intima, muss jederzeit durch die richtige Handhabung der Gefäße vermieden werden, die die volle Dicke der Gefäßwand greifen schließt nie, übermäßige verhindert Stretching, vernünftige Verwendung der bipolaren Koagulator, und im Fall der arteriovenösen loop, Leistung sorgfältige und atraumatische mikrochirurgisches Anastomosen. Obwohl mit heparinisierter Kochsalzlösung gespült Blutgerinnung verhindern hilft, wird es nie eine feine chirurgische Technik zu ersetzen. Zweitens beziehen Blutfluss Faktoren hauptsächlich und Stase zu Turbulenzen. Turbulente Strömung sekundär zu Verdrehungen, Biegungen oder Knicke der Schiffe fördert Thrombusbildung. Daher ist eine Stromlinie uneingeschränkte Strömung muss sowohl in der arteriovenöse Schleife sichergestellt werden, und die Flow-Through-Modelle. In diesem Sinne ist die Anbindehaltung Wirkung der epigastric Filialen in der arteriovenöse Schleife Modell Biegen zu verhindern, wesentlich ist; wenn aus irgendeinem Grund diese Zweige nicht verwendet werden kann, einfach 10/0 Nylonmaschen von der Gefäßwand in die umliegenden Gewebe sollten sorgfältig statt platziert werden. Statische Blut an der Anastomose während des Verfahrens arteriovenöse Schleife ist auch hoch thrombogenen und muss durch Spülen des Gefäßes kräftig mit heparinisierter Kochsalzlösung vor und während der Anastomose verhindert werden. Drittens pro-thrombotischen Faktoren wie Schadstoffe aus dem operativen Bereich und die meisten importantly das Vorhandensein von Stücken von Adventitia innerhalb der Anastomose sind zu vermeiden. das Gefäß vorbereiten endet richtig vor mikrochirurgisch Vernähen und das Feld und Anastomose sauber zu halten, indem sie regelmäßig wichtige Aspekte sind Spülung zu berücksichtigen, wenn die arteriovenöse Schleife zu konstruieren. Last but not least gibt es das Problem der Gefäßkrampf. Obwohl die Pathophysiologie von Gefäßspasmen nicht vollständig aufgeklärt wurde, ist es wahrscheinlich aufgrund sowohl lokale als auch systemische Faktoren. Lokale Faktoren gehören Gefäßtrauma, das Vorhandensein von Blut in das Operationsfeld und Gewebeaustrocknung. Die systemische Faktoren, auf der anderen Seite, umfassen niedrige Kerntemperatur, Blutdruckabfall und sympathische Reaktion auf Schmerz. 38
So wird in beiden arteriovenöse Schleife und Flow-Through-Modelle, die richtige Handhabung und Vorbereitung des Tieres zusammen mit einem empfindlichen OP-Technik kann nicht genug betont werden. Strategien Krampf umfassen Bewässerung mit warmem Salzlösung zu lösen oder unverdünnt1% Xylocain und eine Ruhezeit von 5-10 min. Gefäßerweiterung und Strippen des adventitia kann auch helfen , Spasmus aufgrund seiner lokalen sympathectomy Wirkung zu entlasten. 38 die Notwendigkeit zu umgehen mikrochirurgisch Anastomosen durchzuführen und die technische Herausforderung es bedeutet, kann die Manschette Technik , wie an anderer Stelle beschrieben eingesetzt werden. 39 Diese Technik besteht eines des Schiffes Einsetzen in einer Manschette endet, stülpen, und es mit einer umlauf 6/0 Nylonnaht sichern. Als nächstes wird das andere Gefäß Ende über die Manschette geschoben und in ähnlicher Weise gesichert.
Das Gewebe-Engineering-Kammer hat ein neues Fenster der Möglichkeiten in der experimentellen Forschung eröffnet und ist stetig in Richtung einer möglichen klinischen Zweck voran. Bislang stellte die Modelle hier sind vor allem für die Erzeugung von Geweben verschiedener Abstammungslinien verwendet. 4,7,8,17,22, 24,25,27-29,37,40 Trotzdem haben sie eine Reihe von weitere mögliche Anwendungen. Zum Beispiel, ha wirhabe die Durchflusskammer als effektive und vergleichsweise schnelles Modell für teratoma Bildung nach der Implantation von humanen induzierten pluripotenten Stammzellen verwendet. 41,42 So kann dieser Ansatz als "Qualitätskontrolle" Werkzeug zu erreichen tumorfreien Tissue Engineering verwendet mit pluripotenten Stammzellen. Auch Drogen toxikologischen Studien konnte in menschlichen Geweben im Inneren der Kammer angebaut werden erforscht. Ebenso kann die Erzeugung von pathologischen Gewebe könnte einen interessanten Ansatz in Richtung Krankheit Modellierung und Drogentests ergeben. Schließlich könnte das Gewebe-Engineering - Kammer auch ein mögliches Modell zu studieren Wachstum von Gewebe und Verfolgung von Zellschicksal in vivo werden.
Zusammenfassend haben wir ein Protokoll denen die Platzierung einer subkutanen Kammer in Tieren durch zwei verschiedene Ansätze beschrieben: ein mikrochirurgisches arteriovenöse Schleife oder eine Durchfluss Pedikel-Konfiguration. Die Technik ist sehr gut reproduzierbar und liefert konsistente Ergebnisse. Seine Verwendung hwie bisher auf dem Gebiet des Tissue Engineering ausgebeutet hauptsächlich worden ist, gibt es jedoch andere Forschungspotenzial Felder, für die diese Kammern von großer Anwendung sein könnte.
Offenlegungen
Die Autoren erklären, keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde durch Zuschüsse aus NHMRC und Stafford Fox Medical Foundation unterstützt. Die Autoren erkennen die chirurgische Hilfe von Sue McKay, Liliana Pepe, Anna Deftereos und Amanda Rixon der Experimental medizinischen und chirurgischen Einheit, St. Vincent Hospital in Melbourne. Unterstützung wird auch von der viktorianischen Staatsregierung Department of Innovation, Industrie und regionale Entwicklung operative Infrastruktur-Support-Programm zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 15 Blade Scalpel | Braun | BB515 | |
| 1 Toothed Adson Forceps | Braun | BD527R | |
| 1 Needle Holder | Braun | BM201R | |
| 1 Bipolar Coagulator | Braun | US335 | |
| 1 Micro Needle Holder B-15-8.3 | S & T | 00763 | |
| 1 Micro Dilator Forceps D-5a.2 | S & T | 00125 | |
| 1 Micro Jeweler's Forceps JF-5 | S & T | 00108 | |
| 1 Micro Scissors - Straight SAS-11 | S & T | 00098 | |
| 1 Micro Scissors - Curved SDC-11 | S & T | 00090 | |
| 2 Single Clamps B-3 | S & T | 00400 | |
| 2 10/0 nylon suture | S & T | 03199 | |
| 1 6/0 nylon suture | Braun | G2095469 | |
| 2 4/0 Silk Sutures | Braun | C0760145 | |
| Xilocaine 1% | Dealmed | 150733 | 10 mg/ml |
| Heparin Sodium | Dealmed | 272301 | 5,000 UI/ml |
| Ringer Lactate | Baxter | JB2323 | 500 ml |
| 1 dome-shaped tissue engineering chamber | custom made | ||
| 1 flow-through chamber | custom made | ||
| Lectin I, Griffonia Simplicifolia | Vector Laboratories | B-1105 | 1.67 μg/ml |
| Troponin T antibody | Abcam | Ab8295 | 4 μg/ml |
| Human-specific Ku80 antibody | Abcam | Ab80592 | 0.06 μg/ml |
| Desmin antibody | Dako | M0760 | 2.55 μg/ml |
| Cell Tracker CM-DiI dye | Thermo Fisher Scientific | C-7000 | 3 mg/106 cells |
| Lethabarb (sodium pentobarbitone) |  Virbac Animal Health Virbac Animal Health | LETHA450 | 325 mg/ml |
| Heat pad flexible |  Redzone Heating Redzone Heating | RZ/Medium |
Referenzen
- Spiliopoulos, K., et al. Current status of mechanical circulatory support: A systematic review. Cardiol Res Pract. , 574198 (2012).
- Hsu, P. L., Parker, J., Egger, C., Autschbach, R., Schmitz-Rode, T., Steinseifer, U. Mechanical circulatory support for right heart failure: Current technology and future outlook. Artif Organs. 36 (4), 332-347 (2012).
- Lokmic, Z., Stillaert, F., Morrison, W. A., Thompson, E. W., Mitchell, G. M. An arteriovenous loop in a protected space generates a permanent, highly vascular, tissue-engineered construct. FASEB J. 21 (2), 511-522 (2007).
- Morritt, A. N., et al. Cardiac tissue engineering in an in vivo vascularized chamber. Circulation. 115 (3), 353-360 (2007).
- Tanaka, Y., Tsutsumi, A., Crowe, D. M., Tajima, S., Morrison, W. A. Generation of an autologous tissue (matrix) flap by combining an arteriovenous shunt loop with artificial skin in rats: preliminary report. B J Plast Surg. 53 (1), 51-57 (2000).
- Cronin, K. J., et al. New murine model of spontaneous autologous tissue engineering, combining an arteriovenous pedicle with matrix materials. Plast Reconstr Surg. 113 (1), 260-269 (2004).
- Forster, N. A., et al. A prevascularized tissue engineering chamber supports growth and function of islets and progenitor cells in diabetic mice. Islets. 3 (5), 271-283 (2011).
- Choi, Y. S., Matsuda, K., Dusting, G. J., Morrison, W. A., Dilley, R. J. Engineering cardiac tissue in vivo from human adipose-derived stem cells. Biomaterials. 31 (8), 2236-2242 (2010).
- Jeyaraj, R., G, N., Kirby, G., Rajadas, J., Mosahebi, A., Seifalian, A. M., Tan, A. Vascularisation in regenerative therapeutics and surgery. Mater Sci Eng C Mater Biol Appl. 54, 225-238 (2015).
- Dew, L., Macneil, S., Chong, C. K. Vascularization strategies for tissue engineers. Regen Med. 10 (2), 211-224 (2015).
- Weigand, A., et al. Acceleration of vascularized bone tissue-engineered constructs in a large animal model combining intrinsic and extrinsic vascularization. Tissue Eng Part A. 21 (9-10), 1680-1694 (2015).
- Vacanti, J. P., Langer, R., Upton, J., Marler, J. J. Transplantation of cells in matrices for tissue regeneration. Adv Drug Deliv Rev. 33 (1-2), 165-182 (1998).
- Beahm, E. K., Walton, R. L., Patrick, C. W. Progress in adipose tissue construct development. Clin Plast Surg. 30 (4), 547-558 (2003).
- Vunjak-Novakovic, G., et al. Challenges in cardiac tissue engineering. Tissue Eng Part B Rev. 16 (2), 169-187 (2010).
- Garcia, J. R., Garcia, A. J. Biomaterial-mediated strategies targeting vascularization for bone repair. Drug Deliv Transl Res. , (2015).
- Forster, N., et al. Expansion and hepatocytic differentiation of liver progenitor cells in vivo using a vascularized tissue engineering chamber in mice. Tissue Eng Part C Methods. 17 (3), 359-366 (2011).
- Tilkorn, D. J., et al. Implanted myoblast survival is dependent on the degree of vascularization in a novel delayed implantation/prevascularization tissue engineering model. Tissue Eng Part A. 16 (1), 165-178 (2010).
- Chang, Q., Lu, F. A novel strategy for creating a large amount of engineered fat tissue with an axial vascular pedicle and a prefabricated scaffold. Med hypotheses. 79 (2), 267-270 (2012).
- Walton, R. L., Beahm, E. K., Wu, L. De novo adipose formation in a vascularized engineered construct. Microsurg. 24 (5), 378-384 (2004).
- Debels, H., Gerrand, Y. W., Poon, C. J., Abberton, K. M., Morrison, W. A., Mitchell, G. M. An adipogenic gel for surgical reconstruction of the subcutaneous fat layer in a rat model. J Tissue Eng Regen Med. , (2015).
- Lokmic, Z., Mitchell, G. M. Engineering the microcirculation. Tissue Eng Part B Rev. 14 (1), 87-103 (2008).
- Yap, K. K., et al. Enhanced liver progenitor cell survival and differentiation in vivo by spheroid implantation in a vascularized tissue engineering chamber. Biomaterials. 34 (16), 3992-4001 (2013).
- Findlay, M. W., et al. Tissue-engineered breast reconstruction: Bridging the gap toward large-volume tissue engineering in humans. Plast Reconstr Surg. 128 (6), 1206-1215 (2011).
- Tee, R., Morrison, W. A., Dusting, G. J., Liu, G. S., Choi, Y. S., Hsiao, S. T., Dilley, R. J. Transplantation of engineered cardiac muscle flaps in syngeneic rats. Tissue Eng Part A. 18 (19-20), 1992-1999 (2012).
- Dolderer, J. H., et al. Long-term stability of adipose tissue generated from a vascularized pedicled fat flap inside a chamber. Plast Reconstr Surg. 127 (6), 2283-2292 (2011).
- Sekine, H., et al. Endothelial cell coculture within tissue-engineered cardiomyocyte sheets enhances neovascularization and improves cardiac function of ischemic hearts. Circulation. 118, 145-152 (2008).
- Ting, A. C., et al. The adipogenic potential of various extracellular matrices under the influence of an angiogenic growth factor combination in a mouse tissue engineering chamber. Acta Biomater. 10 (5), 1907-1918 (2014).
- Zhan, W., et al. Self-synthesized extracellular matrix contributes to mature adipose tissue regeneration in a tissue engineering chamber. Wound Repair Regen. 23 (3), 443-452 (2015).
- Messina, A., Bortolotto, S. K., Cassell, O. C., Kelly, J., Abberton, K. M., Morrison, W. A. Generation of a vascularized organoid using skeletal muscle as the inductive source. FASEB J. 19 (11), 1570-1572 (2005).
- Lim, S. Y., Hernández, D., Dusting, G. J. Growing vascularized heart tissue from stem cells. J Cardiovasc Pharmacol. 62 (2), 122-129 (2013).
- Poon, C. J., et al. Preparation of an adipogenic hydrogel from subcutaneous adipose tissue. Acta Biomater. 9 (3), 5609-5620 (2013).
- Dilley, R. J., Morrison, W. A. Vascularisation to improve translational potential of tissue engineering systems for cardiac repair. Int J Biochem Cell Biol. 56, 38-46 (2014).
- Lesman, A., Koffler, J., Atlas, R., Blinder, Y. J., Kam, Z., Levenberg, S. Engineering vessel-like networks within multicellular fibrin-based constructs. Biomaterials. 32 (31), 7856-7869 (2011).
- Hussey, A. J., et al. Seeding of pancreatic islets into prevascularized tissue engineering chambers. Tissue Eng Part A. 15 (12), 3823-3833 (2009).
- Chen, X., Aledia, A. S., Popson, S. A., Him, L., Hughes, C. C., George, S. C. Rapid anastomosis of endothelial progenitor cell-derived vessels with host vasculature is promoted by a high density of cotransplanted fibroblasts. Tissue Eng Part A. 16 (2), 585-594 (2010).
- Lin, R. Z., Melero-Martin, J. M. Fibroblast growth factor-2 facilitates rapid anastomosis formation between bioengineered human vascular networks and living vasculature. Methods. 56 (3), 440-451 (2012).
- Dolderer, J. H., et al. Spontaneous large volume adipose tissue generation from a vascularized pedicled fat flap inside a chamber space. Tissue Eng. 13 (4), 673-681 (2007).
- Wei, F. C., Lin Tay, S. K., Neligan, P. C., Gurtner, G. C. Principles and techniques of microvascular surgery. Plastic Surgery. Volume 1. , 587-620 (2013).
- Sekine, H., et al. In vitro fabrication of functional three-dimensional tissues with perfusable blood vessels. Nat.Comm. 4 (1399), 1-10 (2013).
- Lim, S. Y., Sivakumaran, P., Crombie, D. E., Dusting, G. J., Pébay, A., Dilley, R. J. Trichostatin A enhances differentiation of human induced pluripotent stem cells to cardiogenic cells for cardiac tissue engineering. Stem Cells Transl Med. 2 (9), 715-725 (2013).
- Lim, S. Y., et al. In vivo tissue engineering chamber supports human induced pluripotent stem cell survival and rapid differentiation. Biochem Biophys Res Commun. 422 (1), 75-79 (2012).
- Piao, Y., Hung, S. S., Lim, S. Y., Wong, R. C., Ko, M. S. Efficient generation of integration-free human induced pluripotent stem cells from keratinocytes by simple transfection of episomal vectors. Stem Cells Transl Med. 3 (7), 787-791 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten