Method Article
Entwicklung und Charakterisierung von
In diesem Artikel
Zusammenfassung
Primary human umbilical vein endothelial cells (HUVECs) were grown to confluence within a microfluidic network device. The endothelial cell junction and F-actin distributions were illustrated and the changes in intracellular calcium concentration and nitric oxide production in response to adenosine triphosphate (ATP) were quantified in real-time at individual cell levels.
Zusammenfassung
Endothelzellen (ECs) sind die Wände der Blutgefäße in vivo Futter ständig fließen ausgesetzt, aber kultiviert ECs werden oft unter statischen Bedingungen gezüchtet und eine pro-inflammatorischen Phänotyp aufweisen. Obwohl die Entwicklung von Mikrofluidik-Vorrichtungen hat von den Ingenieuren mehr als zwei Jahrzehnten, ihre biologischen Anwendungen beschränkt bleiben gut angenommen. Eine physiologisch relevanten in vitro microvessel Modell durch biologische Anwendungen validiert ist wichtig , um das Feld zu fördern und um die Lücken zwischen in vivo- und in vitro - Studien überbrücken. Hier präsentieren wir detaillierte Verfahren für die Entwicklung von kultivierten microvessel Netzwerk eine Mikrofluidik-Vorrichtung mit einer langfristigen Perfusions-Fähigkeit verwenden. Wir zeigen auch , ihre Anwendungen für die quantitative Messung von Agonist-induzierter Veränderungen in EC [Ca 2+] i und Stickstoffmonoxid (NO) Produktion in Echtzeit konfokale und konventionelle Fluoreszenzmikroskopie. Das gebildete microvessel NetzArbeit mit kontinuierlicher Perfusion zeigte gut ausgebaute Verbindungen zwischen ECs. VE-Cadherin war Verteilung zu beachten, dass eine engere in intakten microvessels als statisch kultivierten EC Monolayern. ATP-induzierte vorübergehende Erhöhung des EC [Ca 2+] i und NO - Produktion wurden bei einzelnen Zellebenen quantitativ gemessen, die die Funktionalität der gezüchteten microvessels validiert. Diese mikrofluidischen Vorrichtung ermöglicht ECs unter einer gut kontrollierten, physiologisch relevanten Strömungs zu wachsen, die die Zellkulturumgebung näher an in vivo als bei den herkömmlichen, statischen 2D - Kulturen macht. Das Mikrokanalnetzdesign ist sehr vielseitig, und der Herstellungsprozess ist einfach und wiederholbar. Das Gerät kann einfach an die konfokale oder konventionellen mikroskopischen System integriert werden ermöglicht hochauflösende Bildgebung. Am wichtigsten ist, weil das kultivierte microvessel Netzwerk kann durch primären humanen ECs gebildet werden, wird dieser Ansatz als ein nützliches Instrument dienen zu untersuchen, wiepathologisch veränderten Blutkomponenten aus Patientenproben beeinflussen menschliche ECs und Einblick in die klinische Fragen bieten. Es kann auch als Plattform für Arzneimittelscreening entwickelt werden.
Einleitung
Endothelzellen (ECs) , um die Wände der Blutgefäße in vivo Futter ständig fließen ausgesetzt, aber kultiviert ECs werden oft unter statischen Bedingungen gezüchtet und weisen eine pro-inflammatorischen Phänotyp 1,2. Die Mikrofluidik - Technologie ermöglicht eine präzise gesteuerte Fluid durch eine geometrisch eingeschränkten mikroskaligen (Submillimeterbereich) Kanäle 3, die die Möglichkeit für die kultivierten Zellen bietet, insbesondere für vaskulären ECs unter gewünschten Strömungsbedingungen zu wachsen. Diese Eigenschaften machen die Zellkulturbedingungen näher an in vivo als die herkömmlichen, statischen 2D - Zellkulturen. Sie sind äußerst wichtig, wenn die Mikrofluidik-Vorrichtungen verwendet werden, um verschiedene Arten von Gefäßsystemen modellieren und EC Reaktionen auf mechanische und / oder chemische Reize zu studieren.
Trotz der Vorteile, die durch die Mikrokanalnetzwerk über eine statische Zellkultur zeigten, die Anpassung und Anwendung von Mikrofluidik in der biomedizinischen field begrenzt bleiben. Berichtet von einer kürzlich erfolgten Überprüfung, die Mehrheit der Veröffentlichungen dieser Bereich (85%) sind nach wie vor in den Ingenieurzeitschriften 4. Die Leistung von mikrofluidischen Systemen ist nicht überzeugend genug gewesen, um für die meisten Biologen von aktuellen Techniken zu wechseln wie die Transwell-Assay und der Makroebene Kulturschale / Glasträger auf diese miniaturisiertes Gerät. Mikrofluidik ist ein multidisziplinäres Feld, das interdisziplinäre Zusammenarbeit erfordert uns darauf, dieses Feld zu bewegen. Das Ziel dieser technischen Artikel ist es, die Wissenslücken zwischen den Disziplinen zu reduzieren und die Herstellungsverfahren verständlich von Biologen machen, während die biologische Anwendung und funktionale Validierung der mikrofluidischen microvessels bereitstellt. Die visualisierten experimentelle Protokolle umfassen die Herstellung von sowohl Mikrofluidik-Vorrichtungen und deren biologische Dienstprogramme, die eine enge Zusammenarbeit zwischen Ingenieuren und Biologen darstellt.
Vor kurzem berichteten wir einigebiologische Anwendungen , die in vitro microvessel Netzwerk mit mikrofluidischen Vorrichtung 5 verwendet wird . Um in geeigneter Weise die Dimensionen des Mikrokanalnetz entwerfen und anwenden, um das gewünschte Schubspannung, ein numerisches Modell mit Computational Fluid Dynamic Software gebaut, um genau das Strömungsprofil abzuschätzen. Primäre humane Nabelschnurvenen - Endothelzellen (HUVECs), die in die Mikrokanäle erreicht Konfluenz ausgesät wurden, dh bedeckt die gesamten Innenflächen des Mikrokanals, in 3-4 Tagen mit kontinuierlicher Perfusion. Die geeignete Barrierebildung wurde durch VE-Cadherin-Färbung nachgewiesen, und im Vergleich mit denen unter statischen Zellkulturbedingungen und in intakten microvessels gebildet. Durch die Anwendung der experimentellen Protokolle einzeln durchbluteten intakten microvessels entwickelt 6-8, gemessen wir quantitativ die Veränderungen in der EG [Ca 2+] i und Stickstoffmonoxid (NO) in Reaktion auf Adenosintriphosphat (ATP) mit Fluoreszenz - inindikatoren und konfokale und konventionelle Fluoreszenzmikroskopie. Die Agonist-induzierten Anstieg der EG [Ca 2+] i und NO - Produktion wurden als notwendig intrazelluläre Signale für Entzündungsmediator-induzierten Anstieg der microvessel Permeabilität 6-15 berichtet. Obwohl einige frühere Studien Bilder zeigten DAF-2 DA geladen mikrofluidischen Geräte 16,17, entsprechende Auflösung und Datenanalyse war noch nicht erreicht 18. Unseres Wissens zeigt diese Studie die erste quantitative Messungen von Agonisten induzierte dynamische Veränderung der endothelialen [Ca2 +] i und NO - Produktion unter Verwendung von Mikrofluidik - basierten System.
Mikrofabrikationstechniken haben die Flexibilität , Mikrokanäle bis zu wenigen Mikrometern herzustellen und die Entwicklung von komplexen Mustern zu ermöglichen , um die Geometrien der in vivo microvasculature imitieren. Hier präsentierten wir ein typisches Mikrokanalnetz mit drei Ebenen der Verzweigung. DiesNetzwerk wird durch die Kombination von Photolithographie hergestellt, die in einem Mikrofabrikations Reinraum- und Weichlithographie durchgeführt wird.
Protokoll
1. Mikrofluidikvorrichtung Fabrication
- Standard-Lithografie Herstellung eines SU-8 50 Master-Mold
- Reinigen Sie den Siliziumwafer vor Spin-Coating. Spülen mit einem nackten 2 inch Siliciumwafer mit Aceton für 15 min, gefolgt von Isopropylalkohol (IPA) für 15 min. Dehydratisieren des Wafers, indem es auf einer Heizplatte bei 150 ° C für 1 Stunde platziert. Nach der Dehydratisierung, Abkühlen des Wafers bei Raumtemperatur.
- Spin-Beschichtung der Silizium-Wafer mit SU-8 Photoresist. 2 ml SU-8 Photoresist auf dem Wafer. Rampe des Wafers auf 500 Upm bei 100 rpm / sec Beschleunigung für 10 sec, gefolgt von 1000 Umdrehungen pro Minute bei 300 rpm / sec Beschleunigung für 30 sec. (Siehe Zusatz Video 1)
- Pre-Bake-Wafer auf einer Heizplatte bei 65 ° C für 10 min, dann weich backen bei 95 ° C für 30 min.
- Verwenden UV-Belichtung die entworfenen Muster von einer Filmmaske auf den Photoresist schleuderbeschichtet, zu transformieren. Drucken Sie das Muster auf einem dünnen transparenten Film als Filmmaske. Legen Sie den Film Maske oben auf derschleuderbeschichtet Photoresist und belichten mit einer Dosis von 300 mJ / cm 2 bis UV - Licht. (Siehe Zusatz Video 2)
Hinweis: In diesem Protokoll, das Mikrokanalnetzmuster (159 & mgr; m breite Mutter Kanäle in vier 100 & mgr; m breit Tochter Kanäle Verzweigung) wird mit CAD-Software entwickelt. Das Muster auf dem Film zeigt, als ein klares Feld und der Rest des Films wird durch schwarze Tinte bedeckt. Weil SU8 ein negativer Photoresist ist, der Teil des Photolacks, die UV ausgesetzt wird, vernetzt sein und während der Entwicklung der Form (Schritt 1.1.6) zu dem Lösungsmittel unlöslich werden. Nach der Entwicklung wird das unlösliche Teil des entworfen Netzmuster replizieren und dienen als Masterform. - Post-Bake der belichtete Wafer auf einer Heizplatte bei 65 ° C für 1 min, dann 95 ° C für 10 min.
- Entwickeln Sie die Urform. Verwenden SU-8-Entwickler als Lösungsmittel das unvernetzte Photoresist zu entfernen. Tauchen Sie die Wafer in SU-8-Entwickler für 3 min und Spülen mit IPAfür 1 min.
- Wiederholen Sie diesen Entwicklungszyklus 2-3 mal, bis es keine weiße Streifenbildung (Rückstand von nicht ausgehärteten Photoresist) ist nach der IPA-Spülung. Trocknen Sie vorsichtig den Wafer mit Stickstoffgas und untersuchen die kleinen Merkmale des Musters unter einem Mikroskop. Wiederholen Sie zusätzliche Entwicklungszyklen, wenn nötig.
- Hartbacken des Wafers auf einer Heizplatte bei 150 ° C für 15 min.
- Weich-Lithographie
- mischen Sie manuell die beiden Teile (Basis und Härter) von Polydimethylsiloxan (PDMS) Elastomer bei einem Gew. Verhältnis von 10: 1.
- De-Gas die PDMS-Mischung mit einem Exsikkator mit einem Hausvakuum für 15 Minuten verbunden. Cast der PDMS-Lösung auf dem Photoresist-Vorlagenform. Die Dicke des PDMS muss mehr als 3 mm sein, um eine stabile Halterung des Einlass- / Auslass-Rohrleitung zu schaffen. De-Gas das PDMS wieder für 15 Minuten, und entfernen Sie die verbleibenden Luftblasen mit Stickstoffgas, wenn nötig. Härten des gegossenen PDMS in einem Ofen bei 65 ° C für 3 Stunden.
- Reinigen Sie die Oberfläche vondas Deckglas mit einem Klebeband und einem Plasma-Reiniger (30 sec Plasmabehandlung). Spin-coat ungehärteten PDMS (0,5 ml) auf das Deckglas von 30 s bei 500 rpm / sec Beschleunigungsrate bis 4000 rpm ramping. Härten des PDMS schleuderbeschichtet Deckglas in einem Ofen bei 65 ° C für mindestens 30 min.
- Schneiden Sie und lassen Sie die gehärtete PDMS aus der Urform. Dann einen Einlass schaffen und einen Auslass mit einem Durchmesser von 1 mm Lochers am distalen Ende der Mutter Kanäle.
- Bond das Gerät mit dem PDMS durch Spin-Coating Deckglas. Oxidieren der Oberflächen der PDMS und mit einem Plasmareiniger für 1 min Deckglas. Nach der Plasmabehandlung Sauerstoff, stellen ein Tröpfchen entionisiertes Wasser (DI-Wasser) an der Verbindungsfläche, und legen die beiden Teile zusammen. Backen der Vorrichtung in einem Ofen bei 65 ° C für 30 min eine dauerhafte Bindung zu erreichen.

Supplemental Video 1 (Rechtsklick zum Download).

Supplemental Video 2 (Rechtsklick zum Download).
2. Endothelzell Säen und Kultur
- Vorrichtung Sterilisation und Fibronectin Coating
- Erhalten, die die hydrophobe Eigenschaft der PDMS-Oberfläche um den Einlass / Auslass von Oxidation. Decken Sie die PDMS-Oberfläche um den Einlass und Auslass mit kleinen Streifen Klebeband auf die Oxidation zu verhindern. Dieses Verfahren kann DI-Wasser verhindern, dass überall auf der Oberseite des Gerätes während des Befüllungsschritt (2.1.3) zu verbreiten.
- Behandeln Sie die PDMS-Gerät mit Sauerstoffplasma for 5 min die Oberfläche hydrophil zu ändern ist, wodurch eine Fluidströmung durch den Mikrokanal zu erleichtern und die Blase zu verhindern in dem Füllvorgang Trapping (2.1.3).
- Verwenden Sie entweder eine Spritze mit einer Nadel befestigt oder einer Pipette das Gerät mit DI-Wasser von dem Einlass zu füllen. Weiterhin die Füllung bis ein Tröpfchen aus DI Wasser (30-50 ul) am Auslass angesammelt. Untersuchen Sie das Gerät unter einem Mikroskop zu prüfen, ob Blasen im Inneren der Mikrokanal gefangen sind. Entfernen Sie die überschüssige Wassertropfen am Einlass und Auslass mit einem Papiertuch.
- Sterilisieren der Vorrichtung in einer Petrischale mit UV für mindestens 3 Stunden in einer laminaren Biosicherheit Haube. Um zu verhindern, Verdunstung, decken Sie den Einlass / Auslass mit einem dünnen Stück PDMS, legte ein nasses Papiertuch in der Schale, und wickeln Sie die Schale mit Parafilm.
- Coat das Gerät mit Fibronektin. Spülen Sie das Gerät zunächst mit phosphatgepufferter Salzlösung (PBS), dann streicht es mit 100 ug / ml Fibronektin über Nacht im Kühlschrank (4 ° C). Platzieren eines Tropfens der Lösung am Einlaß, und dann ein Unterdruck an dem Auslass mit einem Hausvakuum erzeugen, eine Spritze mit einer Nadel oder einer Pipette.
- Füllen Sie das Gerät mit Zellkulturmedien. Spülen Sie das Gerät mit PBS manuell für 3-mal, bevor die Zellkulturmedien zu laden. Wärmen Sie das Gerät in einem Inkubator bei 37 ° C.
- ECs Säen und Langzeit Perfusions
Hinweis: Im Vergleich mit konventionellen statischen 2D - EC - Kultur, die in - vitro - microvessel Netzwerk - Modell mit kontinuierlicher Perfusion machte die Zellkulturumgebung näher an den in - vivo - Bedingungen. Die in vitro microvessel Netzwerk in diesem Protokoll demonstriert können bis zu zwei Wochen aufrechterhalten werden. Die gut kontrollierte Perfusion werden Nährstoffe kontinuierlich ergänzen, entfernen Abfälle und Über Einmündung der EG einschichtigen verhindern. Daher kann es zu einer längerfristigen Untersuchungen erweitert werden, um die zellulären und hämodynamischen Umgebung unter verschiedenen PHYSIOLOGISCHER nachahmtl und pathologischen Bedingungen.- Mischen Sie primäre HUVECs in HUVEC Kulturmedien (MCDB 131) mit 8% Dextran (Molekulargewicht 70.000). Das Dextran wird verwendet, um die Viskosität der Lade Medien zu erhöhen und eine bessere Zellaussaat Ergebnis erzielen. Die empfohlene Zelldichte beträgt etwa 2-4 x 10 6 Zellen / ml.
- Seed die Zellen in das Gerät. Legen Sie eine 10-20 ul Tröpfchen von Zellen über den Einlass. Einführung einer sanften Strömung entweder durch Kippen des Geräts oder Kapillarwirkung unter Verwendung einer Glaspasteurpipette am Ausgang. Der Schlüssel für eine erfolgreiche Zellenbelastung wird die Strömungsgeschwindigkeit kleiner als 1 mm / sec innerhalb der kleinsten Kanäle zu steuern.
- Überprüfen Sie die Zellaussaat. Nach dem anfänglichen Aussäen bebrüten das Gerät für 15-20 min (befeuchteten Atmosphäre von 5% CO 2 bei 37 ° C) , bevor die Aussaat Status unter dem Mikroskop zu prüfen. Falls erforderlich, zusätzliche Zelle Laden eines gewünschten Zelldichte zu erreichen.
- Spülen Sie vorsichtig das Gerät mit Zellkulturmedium (37° C), um das Dextran zu entfernen. Kultur die Vorrichtung in Abwesenheit von Strömung für die ersten 6 Stunden in einem Inkubator (5% CO 2 bei 37 ° C).
- Stellen Sie die Schlauchverbindung für die Langzeit Perfusion auf. Band das Gerät in eine Petrischale Bewegung zu verhindern. Erstellen kleine Löcher auf dem Deckel der Petrischale für Ein- und Auslaufschlauch Einfügungen. Verbinden der Einlassleitung an einer Spritze mit einer Nadel für den Zellkulturmedien Perfusion. Schließen Sie den Ablaufschlauch an einen Abfallsammler.
Hinweis: Stellen Sie das Gerät und den Abfallsammler in einer Zellkultur-Inkubator, während eine Perfusions-Pumpe außerhalb des Inkubators platzieren und verbinden Sie es mit dem Gerät durch den langen Zulaufschlauch. Die Perfusionsrate wird durch die Versuchsanordnung bestimmt. In der vorliegenden Vorrichtung verwenden , um eine Perfusion Rate von 0,35 ml / min und einer Scherspannungsbereich zwischen 1-2 dyn / cm 2. Unter dieser Bedingung Perfusion erreichen die HUVECs Einmündung in etwa 3-4 Tage.
3. ichmmunofluorescent Anfärben
- Fixieren den ECs in der Vorrichtung durch Perfusion mit 2% Paraformaldehyd für 30 min bei 4 ° C, gefolgt von 1x PBS bei Raumtemperatur für 15 min gespült, und 1% BSA für 30 min blockiert. Verwenden eine Perfusionsrate, die die gleiche wie die für die Zellkultur verwendet wird.
- Permeabilisieren die feste ECs für Antikörper-Färbung mit 0,1% Triton X-100. Perfuse das Gerät mit Triton für 5-7 min zu Etikett VE-Cadherin und 3 min zu Label F-Actin.
- Laden Sie die Antikörper in das Gerät. Perfuse das Gerät mit 1x PBS für 15 min die bisherigen Lösungen auszuwaschen. laden Sie manuell den primären Antikörper gegen VE-Cadherin (anti-Ziege) in das Gerät bei einer Konzentration von 2 ug / ml (das Gesamtvolumen beträgt 20-50 ul). Halten Sie das Gerät in einem Kühlschrank bei 4 ° C über Nacht. Perfundieren des sekundären Antikörpers (Esel-anti-Ziege) durch eine Spritzenpumpe bei einer Konzentration von 7 ug / ml für 45-60 min.
- Schild EC F-Aktin mit Phalloidin. Perfuse das Gerät mit 1x PBS for 15 min vor Phalloidin (10 ug / ml) für 7-10 min manuell geladen werden.
- Schild EC-Kerne (siehe Materialliste).
- Spülen der Vorrichtung mit 1x PBS und halten sie bei 4 ° C bis zur Bildgebung.
4. Fluoreszenz - Imaging von Endothelial [Ca 2+] i
- Perfundieren, die Vorrichtung mit Albumin (10 mg / ml) -Ringer Lösung für 15 min bei 37 ° C. Verwenden Sie die gleiche Perfusionsrate wie die für die Zellkultur verwendet. Die Konzentrationen aller Komponenten von Albumin-Ringer-Lösung sind in der Materialliste beschrieben.
- Richten Sie konfokales System für EG [Ca 2+] i - Bildgebung mit Fluo-04.00. Verwenden Sie ein konfokales mikroskopisches System für Ca 2+ Bildgebung. Verwenden Sie ein Argon-Laser (488 nm) für die Anregung und stellen Sie den Emissionsband als 510-530 nm. Sammeln Sie die Bilder mit einem 25X Objektiv (Eintauchen in Wasser, NA: 0,95) bei 512 x 512 Scan-Format. Verwenden, um eine z-Schritt von 2 um und einem Abtastintervall für jeden Stapel von iMagiern von 20 sec.
- das Lumen fluo-4 AM mit Albumin-Ringerlösung perfundiert, die Vorrichtung mit Fluo-4 AM (5 & mgr; M) für 40 min bei 37 ° C, dann auszuwaschen.
- Erwerben Sie Bilder von Fluo-4 geladen microvessels. Sammeln Sie die Basis-Images für 10 min. Perfuse das Gerät mit ATP (10 & mgr; M) und die Änderungen der Fluoreszenzintensität (FI) für 20 Minuten aufzeichnen.
5. Fluoreszenz-Imaging von Stickoxid-Produktion
- Perfundieren das Gerät mit Albumin-Ringer-Lösung für 15 min. Verwenden eine Perfusionsrate, die die gleiche wie die für die Zellkultur verwendet wird.
- Stellen Sie die Fluoreszenz-Bildgebungssystem auf ATP-induzierte Produktion von Stickoxid zu messen. Verwenden eines Mikroskops, ausgestattet mit einem 12-Bit-Digital-CCD-Kamera und einer computergesteuerten Shutter für Stickstoffmonoxid-Messung. Verwenden Sie eine 75-W-Xenonlampe als Lichtquelle.
Hinweis: Wählen Sie die Anregungs- und Emissionswellenlänge für DAF-2 DA durch ein Interferenzfilter (480/40 nm) und einen dichroitischen Spiegel(505 nm) mit einem Bandpasssperre (535/50 nm). Verwenden Sie ein 20-fach Objektivlinse (NA: 0,75), um die Bilder zu sammeln. Um Photobleichens minimieren, positionieren Sie einen Neutraldichtefilter (0,5 N) vor dem Interferenzfilter und begrenzen Sie die Belichtungszeit auf 0,12 Sekunden. - Legen Sie die Zellen mit DAF-2 DA (5 uM). Perfundieren, die Vorrichtung mit DAF-2 DA für ca. 35-40 min bei 37 ° C. Notieren Sie sich die Basislinie von DAF-2 - Fluoreszenzintensität (FI DAF) nach dem ersten Laden.
Hinweis: DAF-2 DA im Perfusat während des gesamten Experiments 7 kontinuierlich vorhanden ist. - Sammeln Sie DAF-2 Bilder. Notieren Sie sich die Basislinie von FI DAF für 5 min. Perfuse das Gerät mit ATP (10 uM) und sammeln Sie die Bilder für 30 Minuten mit 1-Minuten-Intervallen. Sammle alle Bilder aus der gleichen Gruppe von Zellen bei der gleichen Brennebene.
6. Datenanalyse
- wählen Sie manuell die Region von Interesse (ROIs) aus den gesammelten Bilder in einzelnen Zellebene. JederROI umfasst den Bereich einer einzelnen Zelle, die durch die Fluoreszenz Umriß angedeutet werden kann.
- Subtrahiert Hintergrundfluoreszenz und den Mittelwert FI jedes ROIs.
- Messen Sie ATP-induzierten Veränderungen in EG [Ca 2+] i und NO - Produktion. Quantifizieren-ATP induzierte Veränderungen in EC [Ca 2+] i durch die Änderungen in Fluo-4 FI Berechnung (FI / FI 0 * 100, wobei FI 0 die mittlere Ausgangswert FI während albumin Ringer Perfusion vor der Zugabe von ATP) minus dem gemessenen Hintergrund. Quantifizieren der NO - Produktion Rate durch die erste Differenz Umwandlung des FI DAF im Laufe der Zeit durch.
Hinweis: Der Zeitverlauf der FI DAF stellt eine kumulative NO - Produktion mit der Zeit. Daher wird keine Produktionsrate basierend auf dem Profil von FI DAF sowohl unter basalen berechnet und ATP stimulierten Bedingungen. Details der Datenanalyse und experimentellen Verfahren wurden in einer früheren Veröffentlichung 7 beschrieben.
Ergebnisse
Dieser Abschnitt zeigt einige der Ergebnisse mit dem kultivierten microvessel Netzwerk mit diesem Protokoll entwickelt erhalten. Die Mikrokanalmuster ist ein Dreipegel - Verzweigungsnetzwerk (1A). In diesem Entwurf ein 159 & mgr; m breiten Mutterkanal verzweigt sich in zwei 126 & mgr; m breite Kanäle und Äste wieder in vier 100 & mgr; m breit Tochter Kanäle. Eine 3D numerische Simulation wurde durchgeführt , um die Scherspannungsverteilungen unter der Strömungsgeschwindigkeit von 0,35 & mgr; l / min (1B) zu schätzen, die in diesem Mikrokanalnetzwerk drei unterschiedlichen Ebenen der Scherspannung zeigt. Die laminare Strömung innerhalb der Mikrokanäle vorhergesagt wird ohne das Vorhandensein von gestörten oder Sekundärströmung hydrodynamisch stabil. Nach einem SU-8 - Master - Form mit einem Standard - Photolithographieverfahren (1C) hergestellt wurde, wurde ein PDMS - Gerät durch Softlithographie hergestellt , um die Mikrokanal ne zu replizierentwork Design in einen transparenten, luftdurchlässige Gerüst (1D - E). Nach EC seeding (1F - G) und 3-4 Tage kontinuierlicher Perfusion erreicht ECs Konfluenz und erfolgreich die Innenflächen der Mikrokanäle bedeckt.
EG F-Actin und Kerne wurden innerhalb des Netzwerks fluoreszierend markierten und konfokalen Bildern dargestellt. Unter der Scherspannung von 1,0 dyne / cm 2, etwa 30% der HUVECs länglich entlang der Strömungsrichtung mit einer erhöhten zentralen Stressfasern, während der Rest 70% ihrer Pflastersteinmuster mit dominiertem peripheren F-Aktin 5 gehalten. Die Scher-induzierte Zellformänderung erscheint weniger prominent als die üblicherweise in statischen 2D-Zellkulturen beobachtet. Eigentlich unter in vivo - Bedingungen haben die ECs verschiedenen Zellformen in verschiedenen Arten von Schiffen, aber nicht leicht Zellform als Reaktion auf den Fluss cha ändernnges. Weitere Studien werden benötigt , um zu bestimmen , ob diese Differenz die Ergebnisse der Kanalgeometrie und Perfusions - Umgebung war, die in vivo - Bedingungen näher sind.
Wir maßen auch erfolgreich ATP - induzierten Veränderungen in EG [Ca 2+] i und NO - Produktion (4 und 5). ATP induziert eine vorübergehende Erhöhung des EC [Ca 2+] i und NO - Produktion. Die mittlere Spitzen FI fluo-4 betrug 187 ± 22% der Basislinie, die bei 35 ± 10 sec nach Beginn der Perfusion ATP auftrat. Die NO-Produktionsrate wurde aus einem Grundniveau von 0,15 ± 0,05 AU pro min auf 1,18 ± 0,37 AU pro min innerhalb der ersten fünf Minuten der ATP Belichtung erhöht. Alle Ergebnisse wurden als Mittelwert ± Standardfehler (SE) angegeben. Sie sind vergleichbar mit den Ergebnissen aus einzeln perfundiert intakten Venolen abgeleitet 6,9,14,19.

Abbildung 1: Mikrofluidikvorrichtung Fabrication und EC Belastung (A) Die schematische Ansicht des Mikrokanalnetzwerk.. Die Breite und die Verzweigungswinkel der Mikrokanäle sind an jedem Verzweigungsstufen angegeben. (B) Die numerische Simulation von Schubspannungsverteilung. Die Fließgeschwindigkeit beträgt 0,35 & mgr; l / min. Die Höhe des Mikrokanals nach der Entwicklung beträgt 80 & mgr; m. Diese beiden Zahlen wurden aus früheren Veröffentlichung mit zusätzlichen Details modifiziert 5. (C) Die Entwicklung der Master - Form. Die Urform des Mikrokanalnetz ist mit SU-8 Photoresist auf Silizium-Wafer hergestellt. (D) Der Prozess der Softlithographie. PDMS-Mischung wird auf die Masterform gegossen und in einem Ofen ausgehärtet. (E) Bonding PDMS Kanal zum Substrat. Das Substrat für dieses Gerät verwendet wird, ein Deckglas spin mit einer dünnen Schicht aus PDMS beschichtet. Der Einlass und Auslass sind mit einem Loch-Puncher erstellt. (F und G) EC Belastung. Etwa 10 & mgr; l der Zelllösung wird am Einlass platziert. Eine sanfte Strömung wird dann induziert durch eine Pasteur - Pipette am Ausgang über Kapillarfluss platzieren. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
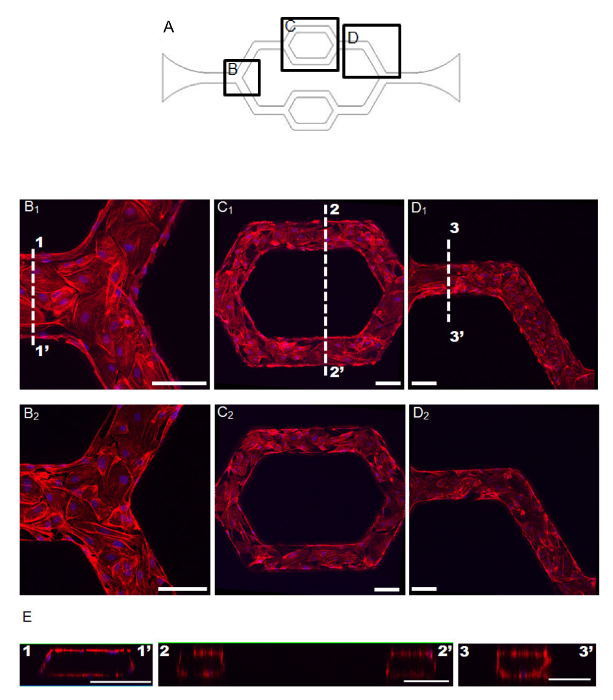
Abbildung 2: Konfokale Bilder von EC F-Aktin in kultivierten Mikrokanalnetzwerk (A) eine schematische Ansicht der Netzgestaltung.. Die ausgewählten Bereiche in B gezeigt - D sind in dem Diagramm angegeben. (B - D) Konfokale Bilder von EG F-Aktin (rot) und Kerne (blau) der in vitro microvessel Netzwerk B 1. , C 1 und D 1 sind die projizierten Bilder von der oberen Hälfte der Mikrokanal - Bildstapeln und B 2, C 2 und D 2 die Bild Projektionen aus der unteren Hälfte der Bildstapel werden. E. Der Querschnitt angegeben als 1-1 ', 2-2' und 3-3 'in B 1 - D 1, Maßstabsbalken = 100 & mgr; m. Diese Bilder werden aus früheren Veröffentlichung 5 angepasst. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 3: Vergleiche von VE-Cadherin Verteilung in kultivierten microvessel Netzwerk mit statisch kultivierten EC - Monoschicht und intakte Ratte mesenteric venule (. A) Die schematische Darstellung des Netzwerk - Design mit ausgewählten Regionen in B gezeigt - D. (B - D) VE-Cadherin (grün) und Zellkerne (blau) Färbung des in vitro microvessel Netzwerk D 1 und D 2 sind die obere und untere der projizierten Bilder von derselben Verzweigungsregion gesammelt, respectively.. (E) VE-Cadherin - Färbung von statisch kultivierten ECs. (F) VE-Cadherin - Färbung von individuell intakten Ratte venule perfundiert. Diese Zahl bisher 5 veröffentlicht. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 4: ATP-induzierten Anstieg der EG [Ca 2+ p>] i. Die Experimente wurden von 4 Geräten durchgeführt und 7 bis 12 ROIs (Einzel ECs) pro Gerät wurden für die Datenanalyse ausgewählt. (A) Der zeitliche Verlauf der ATP (10 uM) induzierte Veränderungen in der EG [Ca 2+] i (Fluo 4 FI / FI 0 × 100% ± SE) von einem repräsentativen Experiment. (B) Die Bilder des repräsentativen Experiment (Daten in A gezeigt ist). Dies ist eine bisher veröffentlichten Abbildung 5. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 5: ATP-induzierte NO - Produktion Die Experimente wurden in 3 - Geräten durchgeführt , und 11 bis 12 ROIs (Einzel ECs) pro Gerät wurden für die Datenanalyse ausgewählt.. (A ) Zeitabhängige Änderungen von DAF-2 - Fluoreszenzintensität (FI DAF SE ±. Die NO - Produktionsrate (df / dt, gestrichelte Linie), wurde aus dem ersten Differenz Umwandlung der akkumulierten FI DAF (rechte Y - Achse) abgeleitet. (B) Repräsentative Bilder von einem Experiment. Der FI DAF weiter erhöht nach einer NO - Donator, Natriumnitroprussid (SNP), wurde zu dem Perfusat zugesetzt, um eine ausreichende Menge an intrazellulärem DAF-2 angibt , mit NO reagieren. Dies ist eine bisher veröffentlichten Abbildung 5. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
In diesem Artikel präsentieren wir detaillierte Protokolle für die Entwicklung von kultivierten microvessel Netzwerk, die Charakterisierung von EC Kreuzungen und Zytoskelett F-Actin - Verteilung und die quantitative Messungen der EG [Ca 2+] i und NO - Produktion eine Mikrofluidik - Vorrichtung verwendet wird . Perfundierten mikrofluidischen Vorrichtung stellt ein in vitro - Modell , das eine enge Simulation der in vivo mikrovaskulärer Geometrien und Scherströmungsbedingungen ermöglicht. Da die kultivierten microvessel Netzwerk von primären humanen ECs gebildet werden kann, kann dieser Ansatz als ein nützliches Instrument dienen zu untersuchen, wie krankhaft veränderten Blutkomponenten aus Patientenproben durch direkte Perfusion von Patienten Blutproben zu den kultivierten microvessels menschlichen ECs beeinflussen und einen Einblick in die klinische bieten Probleme. Die humanen ECs entwickelt microvessels kann auch für Wirkstoff-Screening verwendet werden, die mögliche Unterschiede bei Arzneimittelreaktionen zwischen menschlichen und tierischen Gewebe zu vermeiden.
ve_content "> Das Substrat der Mikrofluidik-Vorrichtungen in diesem Protokoll gezeigt ist ein Glasdeckglas (150-180 & mgr; m) durch Schleuderbeschichtung mit einer dünnen Schicht aus PDMS. Diese dünne Schicht von PDMS wesentlich für hohe Auflösung und lebendem Gewebe in Echtzeit Bildgebung, da die größere numerische Apertur Ziele der Regel kurzen Arbeitsabstand hat. die laminare Strömung innerhalb des Mikrokanals (Submillimeterbereich) hat einen sehr niedrigen Reynolds-Zahl, und die Druckdifferenz linear mit der Strömungs bezogen, damit die Schubspannungsverteilung ist allein abhängig auf der Kanalgeometrie. Daher kann es durch hochgenaue Perfusionspumpe 20. In unserer vorliegenden Studie die Scherspannung , die auf die HUVEC kultiviert microvessel Netz wurde zwischen 1 bis 10 dyne / cm 2, die in die gut kontrolliert werden ist Bereich der Scherspannung in das venöse System gemessen 21,22. die Makro fluidische Systeme , wie beispielsweise parallele Strömungskammer fehlt komplexen Strömungsmuster. in größerem Maßstab Strömungskammern (mm-cm - Bereich) ECs sind typischerweise nur in der unteren Oberfläche (2D einschichtigen), fehlt die geometrischen Ähnlichkeiten zu microvessels in vivo gewachsen. Wenn die Breite der Strömungskammer mehr als 2 mm ist, wird der homogene Strömung in einem Bereich beschränkt, der von dem Auslass / Einlass der Regel mehrere Millimeter entfernt ist, und ein paar hundert Mikrometern von der Seitenwand 23 weg. Wenn die Breite der Kammer auf den Bereich von Zentimetern erhöht wird, wird die Strömung in verschiedene Stromlinien differenzieren und die Strömungsgeschwindigkeiten werden 24 über die gesamte Fläche ändern. Zusätzlich verbraucht der größeren Maßstab Strömungskammer zumindest 100-mal mehr Perfusat die gleiche Scherspannung wie die in Mikrokanälen zu erreichen. Die Scherspannungsverteilung innerhalb des Mikrokanalnetzwerk kann unter Verwendung eines numerischen Modellierungswerkzeug simuliert werden, und die feststehenden inkompressiblen Navier-Stokes-Gleichungen können von den meisten Finite-Elemente-Software gelöst werden.Die Mikrofluidik-Vorrichtung kann mit einem singl gemacht werdene Maske Mikrofabrikationsprozess. Der Erfolg von kultivierten microvessel Entwicklung erfordert jedoch besondere Aufmerksamkeit auf die Details. Nachdem die Lösung in die Mikrokanäle laden, muss jedes Gerät für die Blasenfallen unter dem Mikroskop vor EC Aussaat überprüft werden. Wenn eine Blase auftritt, ist es noch möglich, es in dieser Phase zu zwingen, indem ein hydraulischer Druck am Einlass mit einem geschlossenen Auslass Anwendung als PDMS ein luftdurchlässiges Material ist. Um eine gewünschte Perfusionsrate, eng anliegende ohne Leck aufrechtzuerhalten ist notwendig, dass alle der Nadel / Schlauchanschlüsse. Das abgestimmte Loch-Puncher und Schlauchgröße sind entscheidend, um eine eng anliegende zu erreichen. Um eine präzise Abgabe der Strömungsgeschwindigkeit, die Spritze auf der Perfusionspumpe und der Vorrichtung sicherzustellen, sollten auf dem gleichen Niveau angeordnet werden. Um das Perfusat ändern, sollten die eingelegte Schlauch vorsichtig aus dem Gerät getrennt werden, um eine Dehnung zu vermeiden. Scherspannung, Schritt erhöht (beispielsweise 10 Stufen der Erhöhung in 18 Stunden) zu erhöhen, sind Empded plötzliche Stromänderung Peeling verursacht EG zu vermeiden.
Frühere Studien einzeln perfundiert intakten microvessels durchgeführt auf zeigten , daß Agonist-induzierte Erhöhungen der EC [Ca 2+] i, und die anschließende endothelialen Stickoxid - Synthase (eNOS) Aktivierung und NO - Produktion erforderlich Signalisierung für erhöhte mikrovaskuläre Durchlässigkeit unter Entzündungsbedingungen 6,7 , 9-13,25. In diesem Protokoll wählen wir ATP als Vertreter Agonisten, da sie häufig von roten Blutkörperchen, Blutplättchen aggregiert, und das verletzte Gewebe oder unter Entzündungsbedingungen in vivo freigesetzt wird. Ein Fluoreszenzcalciumindikator, Fluo-4 AM, wurde verwendet , um die Änderungen in endothelial [Ca 2+] i nach der Einwirkung von ATP zu messen. Die EG [Ca 2+] i Antworten in kultivierten microvessels sind ähnlich denen in intakten microvessels gefunden 7,9. EG NO-Produktion Messung wurde für Biologen technisch anspruchsvoll gewesen.Bis heute hat es keine Fluoreszenzindikator, der die Erfassung von dynamischen Veränderungen in der NO-Konzentration in einer ähnlichen Weise zu den Calciumindikatoren ermöglicht. DAF-2 DA wurde die NO-Produktion zu beurteilen, weit verbreitet. Allerdings müssen die richtige Verwendung, Datenauswertung und Datenanalyse der Nutzer aufmerksam machen. Da die chemische Umwandlung von DAF-2 DAF-2T in Gegenwart von NO ist irreversibel (one way conversion) 26, die detektierte DAF Fluoreszenzintensitätsprofil nicht die Veränderungen der NO - Konzentration darstellen wird. Stattdessen gibt es die akkumulierte DAF-2T Produktion mit der Zeit. Auf der Grundlage dieser kumulierten DAF-2 - Fluoreszenz (FI DAF) -Kurve, die NO - Produktionsrate (df / dt) durch die erste Differenz Umwandlung des FI DAF 7,11 abgeleitet werden. Zeigt nämlich an, die Steigung der FI-Kurve, die Produktionsrate NO und die Plateauphase nicht erkennbar wird die NO-Produktion erhöht. Nach der Konvertierung erzeugten Daten aus diesem Protokoll presented sowohl die basale NO Produktionsrate und die Veränderungen in der NO-Produktion in Reaktion auf ATP mit zeitlicher und räumlicher Auflösung in den einzelnen EG-Ebenen innerhalb des microvessel Netzwerk.
Derzeit wurde PDMS weithin für mikrofluidische Anwendungen verwendet, da es eine optisch transparente, nicht - toxisch ist und gasdurchlässigen weichen Elastomer 27-30. Da jedoch PDMS nicht wasserdurchlässig ist, konnten wir nicht direkt die Permeabilität der EC-Monoschicht zu messen. Um diese Einschränkung zu überwinden, modifiziert einige Anwendungen , die Kanalwandstrukturen wie eine durchlässige Membran in den Kanal zu integrieren 31, oder ein durchlässiges "Fensteröffnungen" mit Mikrosäulen oder Mikrolöcher 32,33 zu schaffen, während andere auf die konzentriert Modifikation von Vorrichtungsmaterialien , wie beispielsweise die Hydrogel Vorrichtungen oder Hydrogel / PDMS Hybridvorrichtungen 17,34-36 verwenden. Die Nachteile solcher Vorrichtungen sind ihre Natur schwächsten Dehydratation und ihrer relativ schwachen mechanische Eigenschaften Stress oder Druck zu stehen. Die zukünftige Entwicklung aus durchlässigem Material mit mechanischer Festigkeit verbessert weiter das Gerät und sein Potenzial für eine breitere biologische Anwendungen.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen oder Interessenkonflikte offen zu legen.
Danksagungen
Diese Arbeit wurde von National Heart, Lung unterstützt, and Blood Institute gewährt HL56237, National Institute of Diabetes und Magen-Darm-und Nierenerkrankungen Institut DK97391-03, National Science Foundation (NSF-1227359 und EPS-1.003.907).
Materialien
| Name | Company | Catalog Number | Comments |
| ATP | Sigma-Aldrich | A2383 | |
| Acetone | Fisher Scientific | A929 | |
| Biopsy punch | Miltex | 33-31 AA | |
| Bovine Albumin | MP Biomedicals | 810014 | |
| Bovine Brain Extract (BBE) | Lonza | CC-4098 | |
| Cover-slip | Fisher Scientific | 12-542C | |
| DAF-2 DA | Calbiochem | 251505 | |
| Dextran | Sigma-Aldrich | 31390 | |
| Donkey anti-Goat IgG (H+L) Secondary Antibody | Life technologies | A-11055 | |
| DPBS, no calcium, no magnesium | Gibco | 14190-250 | |
| DRAQ5 (nuclei staining) | Cell Signaling Technology | 4084 | |
| Endothelial Cell Growth Supplement (ECGS) | Sigma-Aldrich | E2759-15MG | |
| Fetal Bovine Serum | Gibco | 16000-044 | |
| Fibronectin | Gibco | PHE0023 | |
| Fluo-4 AM | Life technologies | F-14201 | |
| Gelatin from porcine skin | Sigma-Aldrich | G1890-100G | |
| Gentamicin (50 mg/ml) | Gibco | 15750-078 | |
| Glass coverslip | Fisher Scientific | 12-548B | |
| Glass Pasteur pippette | VWR | 14672 | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3393-10KU | |
| HEPES Buffered Saline Solution | Lonza | CC-5024 | |
| Human umbilical vein endothelial cells (HUVECs) | Lonza | CC-2517 | |
| Isopropyl alcohol (IPA) | VWR | 89125 | |
| L-Glutamine (200 mM) | Gibco | 25030-081 | |
| Mammalian Ringer Solution Ingredient | |||
| NaCl (132 mM) | Fisher Scientific | S671-3 | |
| KCl (4.6 mM) | Fisher Scientific | P217-500 | |
| CaCl2 · 2H2O (2.0 mM) | Fisher Scientific | C79-500 | |
| MgSO4 ·7H2O (1.2 mM) | Fisher Scientific | M63-500 | |
| Glucose (5.5 mM) | Fisher Scientific | BP350-1 | |
| NaHCO3 (5.0 mM) | Fisher Scientific | S233-500 | |
| Hepes Salt (9.1 mM) | Research Organics | 6007H | |
| Hepes Acid (10.9 mM) | Research Organics | 6003H | |
| MCDB 131 Culture Medium | Life technologies | 10372-019 | |
| Paraformaldehyde | Electron Microscopy Sciences | 15710 | |
| Phalloidin (F-actin staining) | Sigma-Aldrich | P1951 | |
| Phosphate Buffered Saline | Life technologies | 14040-133 | |
| Polydimethylsiloxane (PDMS) | Dow Corning Corporation | Sylgard 184 | |
| Scalpel | Exel Int | 29552 | |
| Scotch tape | 3M | 34-8711-3070-3 | |
| Silicon wafer | VWR | 14672 | |
| SU-8 photoresist | MicroChem | SU-8 2050 Y111072 | |
| SU-8 developer | MicroChem | Y020100 | |
| tissue culture flasks | Sigma-Aldrich | Z707503-100EA | |
| Triton X-100 | Chemical Book | T6878 | |
| Trypsin Neutralizer solution | Gibco | R-002-100 | |
| Trypsin/EDTA Solution (TE) | Gibco | R-001-100 | |
| Tubing | Cole-Parmer | PTFE microbore tubing, 0.012" ID x 0.030" OD | |
| VE-cadherin | Santa Cruz Biotechnology | SC-6458 | |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| Biosafety Laminar hood | NuAire | NU-425 Class II, Type A2 | |
| CCD camera | Hamamatsu | ORCA | |
| Confocal microscope | Leica | TCS SL | |
| Desiccator | Bel-Art | F42022 | |
| Hotplate | Wenesco | HP-1212 | |
| Incubator | Forma Scientific | 3110 | |
| Isotemp oven | Barnstead | 3608-5 | |
| Lithography bench | Karl Suss | MA6 Contact Lithography | |
| Optical microscope | Nikon | L200 ND & Diaphod 300 | |
| Shutter for the CCD camera | Sutter Instrument | Lambda 10-2 | |
| Plasma cleaner | PVA TePla/Harrick plasma | M4L/PDC-32G | |
| Spin coater | Brewer Science | Cee 200X | |
| Syringe pump system | Harvard Apparatus | 703005 | |
| Name of Software | Company | Catalog Number | Comments/Description |
| CAD software | Autodesk | AutoCAD 2015 | |
| CFD simulation software | COMSOL | COMSOL Multiphysics 4.0.0.982 | |
| Images acquire and analyse for NO production | Universal Imaging | Metafluor |
Referenzen
- Curry, F. R. E., Adamson, R. H. Vascular permeability modulation at the cell, microvessel, or whole organ level: towards closing gaps in our knowledge. Cardiovasc Res. 87, 218-229 (2010).
- Michel, C. C., Curry, F. E. Microvascular permeability. Physiol Rev. 79, 703-761 (1999).
- Rogers, J. A., Nuzzo, R. G. Recent progress in soft lithography. Mater Today. 8, 50-56 (2005).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507, 181-189 (2014).
- Li, X., Xu, S., He, P., Liu, Y. In vitro recapitulation of functional microvessels for the study of endothelial shear response, nitric oxide and [Ca2+]I. PLoS One. 10, 0126797(2015).
- He, P., Pagakis, S. N., Curry, F. E. Measurement of cytoplasmic calcium in single microvessels with increased permeability. Am J Physiol. 258, 1366-1374 (1990).
- Zhou, X., He, P. Improved measurements of intracellular nitric oxide in intact microvessels using 4,5-diaminofluorescein diacetate. Am J Physiol-Heart C. 301, 108-114 (2011).
- Yuan, D., He, P. Vascular remodeling alters adhesion protein and cytoskeleton reactions to inflammatory stimuli resulting in enhanced permeability increases in rat venules. Journal of Applied Physiology. 113, 1110-1120 (2012).
- He, P., Zhang, X., Curry, F. E. Ca2+ entry through conductive pathway modulates receptor-mediated increase in microvessel permeability. Am J Physiol. 271, 2377-2387 (1996).
- Zhou, X., He, P. Endothelial [Ca2+]i and caveolin-1 antagonistically regulate eNOS activity and microvessel permeability in rat venules. Cardiovasc Res. 87, 340-347 (2010).
- Zhu, L., He, P. Platelet-activating factor increases endothelial [Ca2+] i and NO production in individually perfused intact microvessels. Am J Physiol-Heart C. 288, 2869-2877 (2005).
- He, P., Curry, F. E. Depolarization modulates endothelial cell calcium influx and microvessel permeability. Am J Physiol. 261, 1246-1254 (1991).
- He, P., Curry, F. E. Endothelial cell hyperpolarization increases [Ca2+]i and venular microvessel permeability. J Appl Physiol. 76 (1985), 2288-2297 (1994).
- Xu, S., Zhou, X., Yuan, D., Xu, Y., He, P. Caveolin-1 scaffolding domain promotes leukocyte adhesion by reduced basal endothelial nitric oxide-mediated ICAM-1 phosphorylation in rat mesenteric venules. Am J Physiol Heart Circ Physiol. 305, 1484-1493 (2013).
- Zadeh, M. H., Glass, C. A., Magnussen, A., Hancox, J. C., Bates, D. O. VEGF-Mediated Elevated Intracellular Calcium and Angiogenesis in Human Microvascular Endothelial Cells In Vitro are Inhibited by Dominant Negative TRPC6. Microcirculation. 15, 605-614 (2008).
- Tsai, M., et al. In vitro modeling of the microvascular occlusion and thrombosis that occur in hematologic diseases using microfluidic technology. The Journal of clinical investigation. 122, 408-418 (2012).
- Kim, S., Lee, H., Chung, M., Jeon, N. L. Engineering of functional, perfusable 3D microvascular networks on a chip. Lab Chip. 13, 1489-1500 (2013).
- D'Amico Oblak, T., Root, P., Spence, D. M. Fluorescence monitoring of ATP-stimulated, endothelium-derived nitric oxide production in channels of a poly(dimethylsiloxane)-based microfluidic device. Analytical chemistry. 78, 3193-3197 (2006).
- Zhou, X. P., Yuan, D., Wang, M. X., He, P. N. H2O2-induced endothelial NO production contributes to vascular cell apoptosis and increased permeability in rat venules. Am J Physiol-Heart C. 304, 82-93 (2013).
- Lee, P. J., Hung, P. J., Rao, V. M., Lee, L. P. Nanoliter scale microbioreactor array for quantitative cell biology. Biotechnol Bioeng. 94, 5-14 (2006).
- Zakrzewicz, A., Secomb, T. W., Pries, A. R. Angioadaptation: Keeping the Vascular System in Shape. Physiology. 17, 197-201 (2002).
- Lipowsky, H. H., Kovalcheck, S., Zweifach, B. W. The distribution of blood rheological parameters in the microvasculature of cat mesentery. Circulation Research. 43, 738-749 (1978).
- Pisano, M., Triacca, V., Barbee, K. A., Swartz, M. A. An in vitro model of the tumor-lymphatic microenvironment with simultaneous transendothelial and luminal flows reveals mechanisms of flow enhanced invasion. Integr Biol (Camb). 7, 525-533 (2015).
- McCann, J. A., Peterson, S. D., Plesniak, M. W., Webster, T. J., Haberstroh, K. M. Non-uniform flow behavior in a parallel plate flow chamber : alters endothelial cell responses. Ann Biomed Eng. 33, 328-336 (2005).
- Curry, F. E. Modulation of venular microvessel permeability by calcium influx into endothelial cells. FASEB J. 6, 2456-2466 (1992).
- Kojima, H., et al. Detection and imaging of nitric oxide with novel fluorescent indicators: diaminofluoresceins. Anal Chem. 70, 2446-2453 (1998).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442, 368-373 (2006).
- Lamberti, G., et al. Bioinspired microfluidic assay for in vitro modeling of leukocyte-endothelium interactions. Anal Chem. 86, 8344-8351 (2014).
- Myers, D. R., et al. Endothelialized microfluidics for studying microvascular interactions in hematologic diseases. J Vis Exp. , (2012).
- Smith, A. M., Prabhakarpandian, B., Pant, K. Generation of Shear Adhesion Map Using SynVivo Synthetic Microvascular Networks. Jove-J Vis Exp. , e51025(2014).
- Booth, R., Kim, H. Characterization of a microfluidic in vitro model of the blood-brain barrier (iBBB). Lab on a Chip. 12, (vol 12, pg 1784, 2012) 5282-5282 (2012).
- Shao, J. B., et al. Integrated microfluidic chip for endothelial cells culture and analysis exposed to a pulsatile and oscillatory shear stress. Lab on a Chip. 9, 3118-3125 (2009).
- Yeon, J. H., et al. Reliable permeability assay system in a microfluidic device mimicking cerebral vasculatures. Biomed Microdevices. 14, 1141-1148 (2012).
- Golden, A. P., Tien, J. Fabrication of microfluidic hydrogels using molded gelatin as a sacrificial element. Lab Chip. 7, 720-725 (2007).
- Zheng, Y., et al. In vitro microvessels for the study of angiogenesis and thrombosis. Proc Natl Acad Sci U S A. 109, 9342-9347 (2012).
- Baker, B. M., Trappmann, B., Stapleton, S. C., Toro, E., Chen, C. S. Microfluidics embedded within extracellular matrix to define vascular architectures and pattern diffusive gradients. Lab Chip. 13, 3246-3252 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten