Method Article
Die Quantifizierung der Endothelial Cell Haftfähigkeit
In diesem Artikel
Zusammenfassung
We report an in vitro method that allows the quantitation of the actual number of adhesive cells within an endothelial cell monolayer.
Zusammenfassung
Einen der wesentlichen Prozesse der Entzündung ist die Infiltration von Immunzellen aus dem Lumen des Blutgefäßes zu dem umgebenden Gewebe. Dies geschieht, wenn Endothelzellen, die die Blutgefäße auskleiden, werden Klebstoff auf zirkulierenden Immunzellen, wie Monozyten. In vitro-Messung der Haftfestigkeit wurde bis jetzt durch die Quantifizierung der Zahl der Monozyten, die einer Endothelschicht haften entweder als direkte Zählung geschehen oder durch indirekte Messung der Fluoreszenz der anhaftenden Monozyten. Während solche Maße tun gibt die durchschnittliche Haftfestigkeit der endothelialen Zellpopulation, werden sie von einer Reihe von Faktoren, wie beispielsweise Zellzahl verwechselt werden, und der Anteil der Endothelzellen, die tatsächlich Klebstoff nicht verraten. Hier beschreiben wir und zeigen ein Verfahren, das die Zählung von Haftzellen innerhalb eines Versuchspopulation der endothelialen Monoschicht ermöglicht. Endothelzellen werden auf Deckgläsern gezüchtet und nach WunschBehandlung mit Monozyten in Frage gestellt (das fluoreszenzmarkierte werden kann). Nach der Inkubation einer Spülprozedur, die mehrere Runden des Eintauchens und Entleeren werden die Zellen fixiert. Klebstoff Endothelzellen, die durch Monozyten, umgeben sind, leicht identifiziert und aufgezählt, so dass eine Haftindex, den tatsächlichen Anteil der Endothelzellen in der Population, die Klebe, offenbart.
Einleitung
Infiltration von Immunzellen, wie Monozyten durch die endotheliale Zellschicht, die Blutgefäße auskleiden, ist ein wichtiger Schritt im Entzündungsprozess 1. Dies ermöglicht die Referenzierung von Immunzellen (Immunzellen) zu einem Ort der Verletzung. In anderen Fällen und Orten wie der koronaren Arterie und Carotis Arterie kann die Infiltration von Monozyten durch Endothel um das unerwünschte langfristiger Aufenthalt dieser Zellen in die Wand der Arterie führen, was möglicherweise zur Bildung von Plaques 2 führt. In allen Fällen der Immunozyt Infiltration, beinhaltet der erste Schritt der Aktivierung der Endothelzellen in einem lokalisierten Bereich des Blutgefäßes. Endothelzellen werden durch proinflammatorische Zytokine wie TNF-α und IL-6, um die Expression von Zelloberflächenproteinen, wie VCAM, ICAM und E-Selectin, welche die Einstellung und Befestigung des Immunozyten auf die Endothelzelloberfläche 3- erleichtern erhöhen aktivierten 6.
Zunächst Messung Endothelzelladhäsion wurde durch Zählen Monozyten, die Monoschicht 7 endotheliale halten durchgeführt. Die Grenzen dieses Verfahrens in Bezug auf Genauigkeit führte zur Verwendung von radioaktiv markierten Lymphozyten oder Monozyten, gefolgt von Quantifizierung der radioaktiven Materials, das Lymphozyten oder Monozyten Adhäsion 4 entspricht. Dieses Verfahren wurde schließlich durch eine auf Fluoreszenz basierende Methode, wobei die Immunozyten von Interesse wurden mit Fluoreszenzfarbstoff, wie oben mit dem Unterschied, dass die Fluoreszenz anstelle von Radioaktivität markiert und mit demselben Verfahren gemessen, 8 ersetzt. Derzeit ist diese Methode als die bequemste entstanden und wird als Bausatz von mehreren kommerziellen Anbietern vertrieben. Während dieser Assay relativen Grade der Haft zwischen Kontrollen und Versuchsproben zu messen, ist es nicht erkennen, ob eine Veränderung der Fluoreszenz ist auf eine gleichmäßige Veränderung der Haftfähigkeit über die gesamte Endothelial Zellpopulation oder wenn die Änderung auf Grund einer Differenz des Haftvermögens innerhalb einer Subpopulation von Zellen. Es ist auch offensichtlich, dass die Stringenz der Wasch übt einen großen Einfluss auf das Ergebnis, und was noch wichtiger ist, wird die Gleichförmigkeit der Abspülen ungebundenen Monozyten zwischen verschiedenen Endothelzell-Monoschichten stark vom Grad der Übereinstimmung der Ergebnisse von Wiederholungsversuchen und Reproduzierbarkeit der Ergebnisse zwischen den Proben auswirken . In jüngerer Zeit mehrere Systeme, die Monozyten auf eine endotheliale Zellschicht Pumpe in Medien wurden verwendet, um dieses Problem anzugehen 9. Darüber hinaus sind diese Flusssysteme die Wirkung der Scherkraft auf den Endothelzellen rekapitulieren auch. Während die Vorteile dieser Systeme sind klar und sehr attraktiv ist, ist es auch wichtig zu erkennen, dass, während endothelialen Zellhaftfähigkeit kann stark erhöht werden, wie es bei akuten Entzündungen der Fall ist, die durch Faktoren wie TNF & einigen anderen Aktivatoren, wie ionisierende Strahlung 10 entlocken ändert that nicht ohne weiteres in in vitro Versuchszeitrahmen von diesen sehr strengen Systemen erkannt. Während solche kurzfristigen Änderungen der endothelialen Zellhaftfähigkeit nicht leicht zu entdecken oder in vitro entlassen, ist es nicht in vivo, wenn diese kleinen Änderungen innerhalb eines Lebenszeit, die charakteristisch für die chronische Entzündung ist, kann auch Resultate ausüben notwendigerweise gutartig. Daher ist eine robuste und zugleich empfindliche und spezifische Verfahren zum Nachweis und zur Messung von Endothelzellen Klebrigkeit erforderlich ist.
Hier berichten wir ein Verfahren zur Haftfähigkeit der Endothelzellen direkt zu messen. Dieses Verfahren hängt nicht von der Fluoreszenzmessung angewiesen als indirekter Indikator Surrogat endothelialer Zellhaftfähigkeit. Es offenbart, ob Änderungen in Haftfähigkeit durch einheitliche Änderung in allen Zellen oder zu einer Teilpopulation beschränkt sind. Ferner ermöglicht es co-Färbung von Endothelzellen mit Markern wie Seneszenz-assoziierte & beta; -Galactosidase, die Lebensfähigkeit der Zellen marker, Calcien AM und Antikörper gegen Zelloberfläche und intrazellulären Proteinen, so dass die Zuordnung der einzelnen Klebstoff Endothelzellen an bestimmte Zellzustände oder Expression spezifischer Proteine.
Protokoll
1. Herstellung von Deckgläsern
- Sterilisieren, 12 mm Durchmesser Runddeckgläser durch Einweichen in 70% Ethanol für mindestens 10 Minuten unter gelegentlichem Rühren auf Gesamtengagement aller Deckgläser an den Ethanol zu gewährleisten. Gießen Sie Deckgläser und Ethanol in einen sterilen Zellkulturschale (entweder 6 cm oder 10 cm Durchmesser).
- Mit einem Paar von sterilen feinen Pinzette 5B, abholen und legen jedes einzelne Deckglas in eine Vertiefung einer 24-Well-Clusterplatte. Achten Sie darauf, dass die Deckgläser sind nicht die Seiten der gut zu berühren und sind etwa in der Mitte des Brunnens.
- Verlassen Sie die un-überdachte 24 Clusterplatte mit Deckgläsern in der Flussschrank trocknen. Dieser Vorgang dauert ca. 10 min
- Während dieser Zeit bereiten die Beschichtungsmischung durch Verdünnen von 10 mg / ml humanem Fibronectin in Hanks ausgewogener Salzlösung (HBSS) mit 0,1 mg / ml.
- Wenn die Deckgläser trocken sind, Pipette 100 ul Beschichtungslösung auf jedes Glas Coverslip so dass die Lösung nur den Glas ohne Bündelung auf der Außenseite der Wanne. Legen Sie die überdachte 24 Clusterplatte in einem Zellkulturbrutschrank für mindestens eine Stunde.
- Kurz vor der Verwendung das Beschichtungslösung. Die gleiche Beschichtungslösung kann in ein steriles Röhrchen überführt und bis zu dreimal ohne sichtbaren Verlust der Wirksamkeit verwendet werden.
2. Herstellung von endothelialen Zellschicht
- Kultur menschlicher Koronararterien-Endothelzellen (EC) in Medium bei 37 ° C und 5% Kohlendioxid.
- Absaugen Kulturmedien und spülen EC-Monoschicht mit 10 ml HBSS
- Absaugen HBSS und 2 ml 0,5% Trypsin, 0,2% EDTA-Lösung. Inkubieren bei Raumtemperatur für ca. 5 min.
- Bei EC kann durch einen Wasserhahn an der Seite des Kolbens verdrängt werden 5 ml Sojabohnen-Trypsininhibitor und mit Pipette spritzen die Oberfläche der Kolben weiter zu verdrängen die Zellen.
- Transfer Zellen in ein 15 ml Zentrifugenrohr und das Rohrbei 200 · g für 5 min.
- Absaugen des Überstandes und Resuspendieren der EC Pellet in 5 ml Medium. Zählen Sie die Zellen mit einem Hämozytometer und stellen Sie die Zellkonzentration zu 50.000 EC pro ml EC Medien.
- Verzichtet werden 1 ml der Zellsuspension in jede Vertiefung der 24 Well-Platte mit beschichteten Deckgläser. Zellen O / N in Zellkulturbrutschrank bei 37 ° C und 5% Kohlendioxid.
- Die Zellen sind bereit für den Einsatz in Experimenten, wenn ein konfluenter Monolayer gebildet wird, innerhalb von 3 Tagen.
3. Herstellung von Monozyten
- Übertragen HL-60-Zellen, die in RPMI kultiviert, das mit 10% fötalem Kälberserum, als Suspensionskultur in eine 15 ml Röhre. Zentrifugieren der Zellen bei 200 g für 5 min.
- Entfernen Sie den Überstand und resuspendieren Zellen in 5 ml Medium und stellen Sie die Zellkonzentration mit Medien zu 2 Millionen Zellen / ml. Wenn die Fluoreszenzmarkierung der HL-60 erwünscht ist, Resuspendieren der Zellen in RPMI ohne Serum und proceed, wie in Kapitel 4 beschrieben.
- 0,5 ml von HL-60-Zellsuspension in jede Vertiefung der 24-Well-Clusterplatte, die EC-Monoschicht und Inkubieren der Platte in einem Zellkulturbrutschrank bei 37 ° C und 5% Kohlendioxid für eine gewählte feste Zeitperiode zwischen 1 und 3 hr. Kaum einen Unterschied zwischen 1 Stunde und 3 Stunden Zeitpunkt, an dem Bindungssättigung erreicht wird beobachtet.
- Bereiten Sie sich auf Zellwasch / Ernte: Füllen Sie einen 120-ml-Tube mit 100 ml HBSS. Dispense 1 ml Formalin in jede Vertiefung einer Platte mit 24 Vertiefungen frisch.
- Nach der Inkubationszeit, verwenden Sie ein Paar scharfe Pinzette und holen sich das Deckglas aus dem Brunnen und halten Sie die Deck vertikalen und tupfen Sie den Rand des Deckglases auf einem Stück Gewebe auf der Bank für 3 Sekunden, dabei nicht zur Note Zelle bedeckten Oberfläche des Deckglases mit dem Gewebe.
- Halten Sie das Deckglas fest mit einer Zange, tauchen sie das Deckglas in die und aus den HBSS fünfmal.
- Nach dem fünften dunkin HBSS, dab die Kante des Deckglases auf dem Gewebe für 3 sec.
- Wiederholen Sie die in 3.6 und 3.7 beschrieben Dunking und Abtupfen Verfahren, so dass insgesamt drei Sätze von 5 Dunks, gefolgt von einem DAB.
- Übertragen der Deck in eine Vertiefung, die 10% Formalin, um die Zellen bei Raumtemperatur zu fixieren. Das Deckglas ist bereit für Aufzählung für langfristige Lagerung oder zu anderen nachfolgend beschriebenen Verfahren unterzogen werden.
4. Kennzeichnung von HL-60-Zellen mit Zell Tracker (optional)
- Zählen und übertragen entsprechende Menge an HL-60-Zellen (beispielsweise 10 Millionen) in ein 15 ml Zentrifugenröhrchen. Zentrifuge HL-60-Zellen bei 200 g für 5 min. Überstand entfernen.
- Resuspendieren Zellpellet in Cell Tracker in RPMI-Medium ohne Serum in einer Konzentration von 1 Million Zellen / ml. Zellen in Zellkulturbrutschrank für 1 Stunde.
- Centrifuge Zellen bei 200 xg für 5 min und den Überstand verwerfen. Resuspendieren Zellpellet in Medium auf eine Konzentration von 2 Mio cEllen / ml.
- 0,5 ml der Zell Tracker-markierten HL-60 in jede Vertiefung enthält Endothelzellen auf Deckglas aufgewachsen. Weiterhin bei 3,3.
5. Enumeration von Adhesive Endothelzellen
- Berg Deckgläser auf Objektträger mit DAPI Gegenfärbung, einzelne Zellen zu identifizieren.
- Mit einem inversen Mikroskop mit einer 4X oder 10X-Objektiv erwerben Bilder aus mehreren Feldern (zB 5-Felder) und zähle die höchste Anzahl von Monozyten, die auf nicht-bestrahlte Endothelzellen aggregieren (Dies sollte in der Regel 3-5 sein).
- Stellen Sie zweimal diese Zahl als die Schwelle von Monozyten auf Endothelzellen zu werden, dass als Cluster definiert. Falls erforderlich, kann ein anderes Kriterium für die Definition eines Clusters je nach Art des Experiments verwendet werden.
- Zählen die Anzahl der Cluster und die Anzahl der Endothelzellen in dem Feld. Unterteilen den ersteren durch den letzteren, um den Prozentsatz von Klebstoff endothelialen Zellen zu erhalten. Ergebniszahlreichen Bereichen, um einen Mittelwert und Standardabweichung der Grafen zu erhalten.
6. Gegenfärbung mit Antikörpern
- Nachdem der Adhäsionstest und Zellen auf dem Deckglas in 10% Formalin für 15 min bei RT fixiert worden ist, zu unterwerfen, die Deckgläser der Immunfluoreszenz unter Verwendung von Standardverfahren 10 und Antikörper der Wahl.
- Hinzufügen und die verschiedenen Lösungen zu entfernen sehr vorsichtig, um zu vermeiden, verdrängen Monozyten, die gebunden sind an Endothelzellen.
7. Gegenfärbung für Seneszenz-assoziierte Beta-Galactosidase-Aktivität
- Nachdem der Adhäsionstest und Zellen auf dem Deckglas in Formalin für 15 min Färbung für Seneszenz-assoziierte & beta; -Galactosidase-Aktivität fest, wie in den Anweisungen, die Färbekit begleiten beschrieben. Hinzufügen und die verschiedenen Lösungen zu entfernen sehr vorsichtig, um zu vermeiden, verdrängen Monozyten, die gebunden sind an Endothelzellen.
Ergebnisse
Dieses Verfahren erlaubt den Nachweis von einzelnen Klebstoff Endothelzellen innerhalb einer Population. Während beispielsweise eine Monoschicht von nicht-bestrahlten Endothelzellen beibehalten einige sporadische HL-60-Monozyten nach Inkubation und Waschen, endothelialen Monoschicht nach 7 Tagen post-10Gy Bestrahlung vor der Inkubation mit Monozyten wurden durch Monozyten in Clustern um einzelne Endothelzellen gebunden ( Abbildung 1). Obwohl dieses Phänomen ist unter Phasenkontrastmikroskopie leicht beobachtbar, Fluoreszenzmikroskopie zeigt ein noch klareres Bild von den Monozyten-Clustern.
Nach Durchführung des beschriebenen Adhäsionstest, ist es möglich, bis zu Färbung der Zellen für Membran cytoplasmatische oder Kern (Abbildung 2) von Proteinen unter Verwendung geeigneter Antikörper, die mit Standard-Immunfluoreszenz-Methoden vorgehen. Weiterhin kann enzymbasierten Assay wie Seneszenz-assoziierte & beta; -Galactosidase (Figur 3) auch sein performed.
Da jeder Monozyten Cluster entspricht einem einzelnen Endothelzellen wird Aufzählung der Cluster die tatsächliche Anzahl der Klebe Endothelzellen in der Monoschicht zeigen (Figur 4) und somit der Klebstoffanteil Endothelzellen innerhalb der Population (Tabelle 1, Abbildung 6) . Dies ist die einzige Methode, um Datum, wie die Quantifizierung von endothelialen Zellhaftfähigkeit ermöglicht. Es ist bemerkenswert, dass die Endothelzellen in den hier beschriebenen Experimenten verwendeten kontaktinhibiert und nicht in Reihe nach dem Erreichen Konfluenz erhöhen. Das beseitigt das Komplexität durch erhöhte endotheliale Zellzahl zu späteren Zeitpunkten gestellt. Falls gewünscht, kann Monozyten an Endothelzellen-Monoschichten angebracht um 0,5% Trypsin-EDTA-Lösung, 0,2% (statt Fixierung 3.9) abgelöst werden und deren Fluoreszenz gemessen unter Verwendung eines Plattenlesegeräts, wie es in der zeitgenössischen Methoden der Fall ist (Abbildung 5).

Abbildung 1. Adhäsion von Monozyten an Monoschicht von Endothelzellen. Auf nicht-bestrahlte Endothelzellen, Monozyten als Einzelzellen in einer sporadischen und zufällige Weise (linke Felder) und in Clustern auf einzelnen Endothelzellen der 7 Tage nach 10 Gy bestrahlten geklebt Monoschicht (rechte Bilder). Lower Panels sind Fluoreszenzbilder der oberen Platten, die bestätigt, dass die kleinen und hellen Kugelzellen unter Phasenkontrast sichtbar sind in der Tat Monozyten, die mit den Cell-Tracker-Grün vor, markiert waren. Einige der Monozyten Cluster sind durch weiße Pfeile angedeutet. Bilder wurden unter Verwendung eines 10X-Objektiv genommen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Färbung der Endothelzellen für Proteine post-Adhäsionsassay. Nach Durchführung des beschriebenen Adhäsionstest Zellen an den Deckgläsern wurden einer für den Nachweis von (A) Membranprotein (CD44) Immunfluoreszenz, b) cytoplasmatische Protein (Tubulin) oder c) Kernprotein (γ-H2AX). Linke Felder aus (A) und (B) (mit 20x-Objektiv gesehen) mit Handy Tracker Grün und dem ähnlichen Bild auf der rechten Panels zeigen Monozyten vormarkiert offenbaren CD44 und Mikrotubuli (rot) und DAPI-gefärbten Zellkernen (blau). Weiße Pfeile in (C) zeigen Sie bestrahlten Endothelzellen-Kerne, die mit Antikörpern gegen γ-H2AX färbt wurden. Monozyten-Kerne, die ein helleres Blau durch DAPI gefärbt sind, werden leicht von den oval geformten Kernen der Endothelzellen aus. Die Bilder wurden mit 20x-Objektiv genommen. jove.com/files/ftp_upload/52924/52924fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
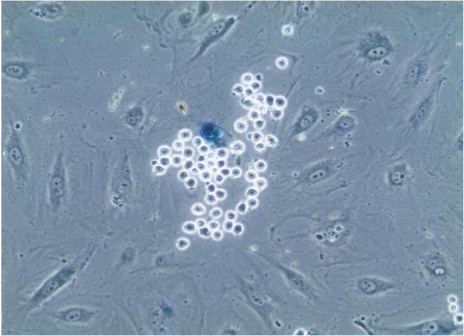
Abbildung 3. Seneszenz-assoziierte beta-Galaktosidase-Färbung von Endothelzellen. Nach Adhäsionsassay, Zellen auf Deckgläsern wurden Färbung für Seneszenz-assoziierte beta-Galactosidase, die Lysosomen von alternden Zellen zu blau verursacht unterzogen, wie sich in den Endothelzellen, dass wird selektiv durch zahlreiche Monozyten, die leicht identifiziert werden aufgrund ihrer geringen Grße und Kugelform gebunden. Bild durch 20X Ziel gesehen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
2924 / 52924fig4.jpg "/>
Abbildung 4. Bestimmung von Monozyten Clustern einzelner Endothelzellen. Nach Adhäsionsassay, Bilder der Zellen wurden aus verschiedenen Positionen und Monozyten-Cluster identifiziert sind, und eingekreist (grün). Ein Cluster als eine Agglomeration von 10 oder mehr Monozyten auf einer Endothelzelle definiert. Die Anzahl der Monozyten-Cluster und Anzahl von 12 Tagen nach der bestrahlten Endothelzellen (Dotted in rot) im Bild wurden gezählt und der Prozentsatz der adhärenten Endothelzellen berechnet, wie in Tabelle 1. Bild durch 10X-Objektiv genommen gezeigt. Bitte klicken Sie hier, um einen Blick Größere Version der Figur.

Abbildung 5. Quantifizierung der Fluoreszenz von adhärenten Monozyten. Nach adhe sion Assay Zellen auf Deckgläsern wurden mit Trypsin behandelt und die Fluoreszenz der Monozyten voretikettierten mit Celltracker Grün wurde gemessen, wobei ein Fluoreszenz-Plattenlesegeräts, als indirekter Indikator für die Haftfähigkeit der endothelialen Monoschicht. Die Ergebnisse aus diesen Messungen zu festgesetzten Tage nach der Bestrahlung wurden erhalten und flochten in der Grafik oben.

Abbildung 6. Darstellung der Adhäsionstest Scores aus Tabelle 1. Klebstoff Endothelzellen in fünf verschiedenen Stellen auf drei Glasdeckgläser wurden wie in Figur 4 beschrieben, und die obigen Ergebnisse zeigen, dass 12 Tage nach 10 Gy Bestrahlung, 8 bis 10 Prozent der bestrahlten tabellarisch erzielte Endothelzellen wurde Klebstoff.
Endothelzellen
| Disc 1 | Disc 2 | Disc 3 | |
| Feld 1 | 8.65 | 8.29 | 8.21 |
| Feld 2 | 10,44 | 7.27 | 7.21 |
| Feld 3 | 9.63 | 9.05 | 8.33 |
| Feld 4 | 11.11 | 7.09 | 8.41 |
| Feld 5 | 10,55 | 9.4 | 11,61 |
| Durchschnitt | 10.07 | 8.22 | 8.75 |
Tabelle 1 Adhesion Assay Partituren. Adhesive Endothelzellen in fünf verschiedenen Standorten auf drei Deckgläser wurden wie in F beschrieben hatBBILDUNG 4 und die obigen Ergebnisse zeigen, dass 12 Tage nach 10 Gy Bestrahlung, 8 bis 10 Prozent der bestrahlten Endothelzellen wurde Klebstoff tabelliert.
Diskussion
Die oben beschriebene Monozytenadhäsion Assay wurde erfolgreich in Experimenten entwickelt, um die biologischen Wirkungen von ionisierender Strahlung auf endothelialen Monoschichten 10 Studie verwendet. Obwohl dies nicht die einzige Methode zur Verfügung, um die Haftfähigkeit einer endothelialen Monoschicht zu bewerten, ist es das einzige Verfahren, das die Quantifizierung der Anteil oder Prozentsatz der Endothelzellen in einer Monoschicht, die Klebemittel ermöglicht. Dies ist ein wichtiger Unterschied, als globale quantitative Änderung der Haftung der Monozyten kann durch andere Methoden gemessen, entweder auf eine allgemeine Erhöhung der Haftfähigkeit aller Zellen der endothelialen Monoschicht oder auf die Erhöhung Haftfähigkeit einer Teilpopulation von Endothelzellen zurückzuführen in der Monoschicht, wie im obigen Beispiel gezeigt. Der Wert der mit diesen Daten wird durch die Tatsache veranschaulicht, dass die Fähigkeit der Anteil der Endothelzellen, die eine verbesserte Haftfähigkeit zeigte quantifizieren nach Bestrahlung führte zu den inesfähig Schlussfolgerung, dass dieser Effekt nicht auf genetische Mutation eines bestimmten Gens als der Prozentsatz von Zellen, die Klebstoff waren, waren wesentlich höher (mehr als 1000-mal mehr), was aus zufälligen Mutation eines Gens durch Röntgenstrahlung bei dieser Dosis zu erwarten wäre, .
Der Faktor, der eine gute Reproduzierbarkeit der Ergebnisse ermöglicht, ist die Waschregime. Als Waschverfahren beinhaltet das Eintauchen des Glasdeckglases in Waschpuffer, gefolgt von Abtupfen auf einem Gewebe, wird die Variabilität in der Puffer Turbulenz, die zwangsläufig entsteht aus der alten Methode der Zugabe der Waschpuffer in ein Bohrloch vermieden. Tatsächlich war es die Beobachtung der übermäßigen Variabilität zwischen Wiederholungen mit der Pipettierverfahren die uns gezwungen, einen Waschvorgang, der die Variabilität Element aus dem Waschschritt entfernt ersinnen erhalten.
Zugegeben, die Grenzen dieses Tests liegen in der Notwendigkeit zur Durchführung von manuellen Zählung der Monozyten-Cluster, die n tunot damit sie angepasst werden für die Hochdurchsatzanalysen. Zweitens hat die Entscheidung darüber, wie viele Monozyten bilden ein Cluster bis halb willkürlich festgelegt werden und der Pegel zu hoch eingestellt und führen zum Ausschluss von einigen echten Cluster werden. Der Mangel an Schubkraft in diesem Verfahren kann auch als eine Beschränkung in Experimenten, in denen grob verbesserte Haftfähigkeit von Endothelzellen induziert (zB + TNFa) betrachtet werden. In anderen Situationen ist jedoch die mangelnde Scherkraft ein Vorteil, da es den Nachweis von weniger triebene Steigerung des Haftvermögens ermöglicht. Moderaten Anstieg der Monozyten Haftfähigkeit besonders wichtig und relevant sein. In vivo würde Monozyten nicht (in einer typischen Versuchszeit) erwartet, in großer Zahl anzubringen, um Zellen mit moderaten Anstieg der Haftfähigkeit, vor allem aufgrund einer Scherkraft endotheliale werden. In der Zeit jedoch würden wahrscheinlich einen Monozyten, und dies ist eher die Umgebung der chronischen Entzündung dar. Als solche,die Abwesenheit von Scherkraft kann ein Vorteil sein, da es die Möglichkeit bietet geringen Anstieg des endothelialen Zellhaftfähigkeit in Versuchszeitrahmen, die typischerweise kurz und möglicherweise zu flüchtig, um zu ermöglichen bescheidene Erhöhung der Haftfähigkeit unter Scherbeanspruchung beobachtet werden offenbart werden.
Die Fähigkeit, die Zellen nach diesem Test zu anderen Analysen wie Seneszenz Assays und Immunfluoreszenz-Färbung unterwerfen erhöht die Nützlichkeit dieses Verfahrens, wie es erlaubt die Assoziation von Haft spezifischer Endothelzellen an bestimmten zellulären Proteinen oder Zellzuständen, wie oben gezeigt, eine Funktion, die ist nicht verfügbar, mit den älteren Adhäsionsassays.
Dieses Verfahren wurde mit est2 immortalisierte menschliche koronare Endothelzellen und ähnlichen Ergebnissen verwendet wurden auch mit primären menschlichen Koronar-Endothelzellen 10 erhalten, was zeigt, dass es nicht spezifisch für nur eine bestimmte Zelllinie. Auch die adoption dieses Verfahren zum Testen der Haftfähigkeit Endothelzellen nicht entgegenWerfen der gleichen Zellen auf die Standard Adhäsionsassay die Fluoreszenz von markiertem Immunzellen mißt. Gemeinsam dieser Bericht zeigt, dass diese Methode ist vielseitig, inclusive und bietet viel mehr Informationen als die Standard Adhäsionsassay.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
We are very grateful to Simon Bouffler for his full support and to Public Health England for infrastructure support. This work was supported by Public Health England throughthe National Institute for Health Research (NIHR) grant. This report is work commissioned by the NIHR. The views expressed in this publication are those of the authors and not necessarily those of the NHS, NIHR or the Department of Health. The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
Materialien
| Name | Company | Catalog Number | Comments |
| Hepes Buffered Saline Solution (HBSS) | Sigma | H6648 | |
| Glass coverslips Round 12 mm Diameter | Menzel-Glaser | CB00120RA1 | |
| 24-well cluster plate | Costar | 3526 | |
| Meso-Endo Cell media | Cell Applications | 212-500 | |
| Trypsin-EDTA | Sigma | T4174 | |
| Soybean trypsin inhibitor | Life Technologies | 17075-029 | |
| Cell Tracker Green | Life Technologies | C7025 | |
| RPMI | Sigma | R8758 | |
| Foetal Calf Serum | Life Technologies | 10500064 | |
| Beta glasctosidase Assay kit | CellSignaling | 9860 | |
| Fibronectin | Sigma | F0895 |
Referenzen
- Ortega-Gomez, A., Perretti, M., Soehnlein, O. Resolution of inflammation: an integrated view. EMBO Mol Med. 5 (5), 661-674 (2013).
- Libby, P. Inflammation and cardiovascular disease mechanisms. Am J Clin Nutr. 83 (2), 456S-460S (2006).
- Ikuta, S., Kirby, J. A., Shenton, B. K., Givan, A. L., Lennard, T. W. Human endothelial cells: effect of TNF-alpha on peripheral blood mononuclear cell adhesion. Immunology. 73 (1), 71-76 (1991).
- Watson, C., et al. IL-6 acts on endothelial cells to preferentially increase their adherence for lymphocytes. Clin Exp Immunol. 105 (1), 112-119 (1996).
- Sans, M., et al. VCAM-1 and ICAM-1 mediate leukocyte-endothelial cell adhesion in rat experimental colitis. Gastroenterology. 116 (4), 874-883 (1999).
- Su, Y., Lei, X., Wu, L., Liu, L. The role of endothelial cell adhesion molecules P-selectin, E-selectin and intercellular adhesion molecule-1 in leucocyte recruitment induced by exogenous methylglyoxal. Immunology. 137 (1), 65-79 (2012).
- Hallahan, D., Kuchibhotla, J., Wyble, C. Cell adhesion molecules mediate radiation-induced leukocyte adhesion to the vascular endothelium. Cancer Res. 56 (22), 5150-5155 (1996).
- Vaporciyan, A. A., Jones, M. L., Ward, P. A. Rapid analysis of leukocyte-endothelial adhesion. J Immunol Methods. 159 (1-2), 93-100 (1993).
- Prabhakarpandian, B., Shen, M. C., Pant, K., Kiani, M. F. Microfluidic devices for modeling cell-cell and particle-cell interactions in the microvasculature. Microvasc Res. 82, 210-220 (2011).
- Lowe, D., Raj, K. Premature aging induced by radiation exhibits pro-atherosclerotic effects mediated by epigenetic activation of CD44 expression. Aging Cell. 13 (5), 900-910 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten