Method Article
Lumineszenz-Resonanzenergietransfer zu Konformationsänderungen in Membranproteinen in Säugerzellen exprimiert Studieren
In diesem Artikel
Zusammenfassung
Wir beschreiben hier eine verbesserte Lumineszenz-Resonanz-Energie-Transfer (LRET) Verfahren, wo wir eine Protease-Schnittstelle zwischen dem Spender und Akzeptor-Fluorophor Stellen einzuführen. Diese Modifikation erlaubt es uns, spezifische LRET Signale aus Membranproteinen von Interesse, so dass für die Untersuchung von Membranproteinen ohne Proteinreinigung erhalten.
Zusammenfassung
Lumineszenz-Resonanz-Energie-Transfer oder LRET, ist eine leistungsstarke Technik verwendet, um Abstände zwischen zwei Standorten in Proteine innerhalb der Reichweite von 10-100 Å messen. Durch Messen der Abstände unter verschiedenen Bedingungen ligiert, können Konformationsänderungen des Proteins leicht beurteilt werden. Mit LRET, einem Lanthaniden, meist Chelat Terbium, als Donorfluorophor verwendet, BIETEN Vorteile wie eine längere Donor-Emission nur Lebenszeit, die Flexibilität, mehrere Akzeptorfluorophore zu verwenden, und die Möglichkeit, sensibilisierte Akzeptor-Emission als eine einfache Möglichkeit zu erkennen Energieübertragung ohne das Risiko der auch Donor-Erfassungssignal nur zu messen. Hier beschreiben wir ein Verfahren zur LRET auf Membranproteine exprimiert und auf der Oberfläche von intakten Säugetierzellen getestet verwenden. Wir stellen eine Protease-Schnittstelle zwischen der LRET Fluorophor-Paar. Nach dem Erhalt des ursprünglichen LRET Signal, Spaltung an dieser Stelle entfernt die spezifischen LRET Signal von dem Protein vonInteresse ermöglicht es uns, das Hintergrundsignal, das nach der Spaltung bleibt quantitativ zu subtrahieren. Dieses Verfahren ermöglicht eine physiologisch relevante Messungen ohne die Notwendigkeit für die Reinigung von Protein hergestellt werden.
Einleitung
Lumineszenz-Resonanz-Energie-Transfer (LRET) ist ein Derivat des bekannten Fluoreszenz-Resonanz-Energie-Transfer (FRET) Technik 1. Ähnlich FRET kann LRET verwendet, um Abstände und Abstandsänderungen zwischen Donor und Akzeptor-Fluorophore an spezifische Stellen auf dem Protein von Interesse in dem Bereich von 10-100 Å 1-3 befestigt messen. Die Prinzipien der LRET sind auch ähnlich in dem Resonanzenergietransfer zwischen zwei FRET auftritt proximalen Fluorophore wenn das Emissionsspektrum des Donor-Fluorophors überlappt sich mit dem Absorptionsspektrum des Akzeptor-Fluorophors. Die Effizienz dieser Übertragung wird der Abstand zwischen den beiden Fluorophoren, die durch die folgende Gleichung in Beziehung:
 Gl. 1
Gl. 1
wobei R der Abstand zwischen den beiden Fluorophoren, E die Effizienz der DEEnergietransfer und R 0, wie unten diskutiert, ist der Förster-Radius für den Fluorophor-Paar, dh der Abstand, bei dem die Effizienz der Übertragung ist eine halbmaximale. Aus dieser Gleichung kann man erkennen, dass die Effizienz der Grße des Abstandes zu der inversen sechsten Potenz 1 angesprochen wird. Es ist dieser inversen sechsten Potenz Abhängigkeit, die für FRET-Messungen und LRET ermöglicht außerordentlich empfindlich auch auf kleine Abstandsänderungen, wenn in der Nähe des R 0 des FRET-Paar sein. Die Fähigkeit, spezifisch zu markieren gewünschten Stellen auf Proteinen oder anderen Makromolekülen ermöglicht es, die Vorteile dieser Empfindlichkeit, um Konformationsänderungen zu überwachen.
Im Vergleich zu FRET, die herkömmliche organische Farbstoffmoleküle nutzt, bietet LRET zusätzliche Vorteile. In LRET, anstelle der Verwendung eines organischen Farbstoffs als Donor-Fluorophor, einem Lanthaniden-Reihe Kation, typischerweise Tb 3 + oder Eu 3 +, verwendet wird, 1,4-6. Fluorophore, die u fallennder die Kategorie, beispielsweise Terbium-Chelat, sind auch sehr vielseitig, dass sie mit einer Vielzahl von Akzeptor-Fluorophore verwendet werden. Diese Flexibilität ist möglich, weil die Emissionsspektren von Chelat Lanthaniden enthalten mehrere scharfe Emissionsspitzen, so dass für eine einzige Art von Donor-Fluorophor mit einem von einer Vielzahl von Akzeptor-Fluorophore verwendet werden. Somit kann sensibilisierten Akzeptor-Emission ohne Angst vor kontaminierenden Durchbluten von Donoremission 5 detektiert werden. Der Experimentator wählt den spezifischen Akzeptor auf Basis der erwarteten Abstand zwischen den beiden Fluorophoren (Abbildung 1 und Tabelle 1). In dieser chelatisierten Lanthanid Fluorophore, die Metallionen von einem Molekül, das eine Antennengruppe, die in der Regel schlecht absorbierende Lanthanid sensibilisiert als auch als Anregungs bioreaktiven funktionellen Gruppe, um die Ionen auf eine bestimmte funktionelle Gruppe an das Makromolekül anzubinden 1 enthält chelatisierte 5,6. ONCe aufgeregt, Lanthaniden entspannen in den Grundzustand über die Freisetzung von Photonen mit einer Zerfallsrate im Millisekundenbereich. Da der Zerfall weder ein Singulett-Singulett-zu-Entspannung noch eine Triplett-Singulett-zu-Entspannung, die Emission von Photonen nicht richtig Fluoreszenz oder Phosphoreszenz genannt werden, ist jedoch genauer Lumineszenz 1 bezeichnet. Der lange Verfall der Lanthaniden-Lumineszenz hilft sehr bei Lebensdauermessungen. Lebensdauermessungen können dann verwendet werden, um die Effizienz über folgende Beziehung zu bestimmen:
 Gl. 2
Gl. 2
wo E ist die Effizienz der Übertragung, ist τ D die Lebensdauer des Donors (chelatisiert Lanthanid), wenn nicht in der Energieübertragung teilnehmen, und τ DA ist die Lebensdauer des Donors bei der Teilnahme an der Energieübertragung mit dem Akzeptor. Mit LRET, kann τ DA alum so die Lebensdauer der sensibilisierten Akzeptor-Emission gemessen werden, da Terbium Lebenszeit so viel größer ist als die eines organischen Akzeptor-Fluorophor. Der Akzeptor emittiert mit der gleichen Laufzeit wie der Anstiftung Anregung (Donor Lanthaniden) und jeder Beitrag auf die Lebensdauer aus der Akzeptor eigene intrinsische Fluoreszenzlebensdauer ist relativ unbedeutend. Durch Messen der sensibilisierten Emission statt Donoremission wir auch die Notwendigkeit der Kennzeichnung an genau einer 1 zu gewährleisten: 1-Verhältnis von Donor zu Akzeptor. Protein kann statt gleichzeitig mit sowohl Akzeptor und Donor Fluorophoren markiert werden. Eine heterogen markiert Bevölkerung resultieren, aber doppelt Donor markierten Proteine nicht in der Akzeptor-Wellenlänge zu emittieren, und doppelklicken Akzeptor markierten Proteine werden nicht angeregt werden. Darüber hinaus ist der Abstand zwischen Fluorophoren sollte unabhängig von der Cystein-Website eine gegebene Fluorophor isst, insbesondere bei Verwendung der isotropen Lanthanide als Donor gleich sein, so dass der geborened, um eine bestimmte Website, um entweder der Spender oder Akzeptor ist unnötig angeben. Intensität kann mit einer heterogenen Population betroffen sein, aber sollte noch mehr als ausreichend, um erkannt zu werden.
Bei der Planung Experimente, sollte die Wahl der Fluorophore von der R 0-Wert des Paares als auch die zu erwartende Reichweite diktiert werden gemessen. Der R 0-Wert wird durch die folgende Gleichung definiert ist:
 Gl. 3
Gl. 3
wobei R 0 der Förster-Radius in Angström, κ 2 der Orientierungsfaktor zwischen den beiden Farbstoffen (gewöhnlich angenommen 2/3 sein), φ D ist die Quantenausbeute des Donors, j die spektrale Überlappungsintegral zwischen Donor ist Emissionsspektrum und Akzeptor des Absorptionsspektrums in M - 1cm -1 nm 4 und n der Brechungsindex des Mediums 1.
Unser Labor hat eine Modifikation der herkömmlichen LRET Technik durch die Einführung einer Protease-Erkennungsstelle zwischen dem Donor und Akzeptor-Markierung Stellen auf dem Protein, die geprüft wird zugegeben. Diese Modifikation ermöglicht eine Untersuchung nicht gereinigten Systemen wie ganze Säugerzellen 7. Diese Technik ist besonders nützlich, wenn Cysteine als Stellen für die Kennzeichnung, da in dem Verfahren der Markierung mit Maleimid-konjugierten Farbstoffe, die in Cystein Sulfhydrylgruppen, andere Proteine von den Zellen, die Cysteine auch markiert sind binden. Jedoch, indem Proteasespaltstellen an dem Protein von Interesse und Mess Lebensdauer vor und nach der Spaltung der Experimentator kann quantitativ subtrahiert die Hintergrundsignal nach der Protease-Spalt aus dem Rohsignal. Diese Subtraktion isoliert das spezifische Signal aus dem Protein von Interesse (Figure 2). Unter Verwendung der oben beschriebenen Modifikation kann LRET zur Abstandsänderungen zwischen dem Terbium-Chelat-Donor und dem Akzeptor-Sonde auf einem Protein zu messen und zu kontrollieren, Konformationsänderungen in der Nähe von physiologischen Zustand des Proteins ohne das Erfordernis der Reinigung werden.

Abbildung 1. Die Absorption und Emissionsspektren von Chelat Terbium in schwarz, sowie einem Vertreter Akzeptor, Alexa 488, rot. Beachten Sie die mehrere Emissionsspitzen und den scharfen, schmalen Emissionsbereich für jeden Höhepunkt der Terbiumchelat. Dieses Muster ermöglicht Terbium, mit einer Vielzahl von Akzeptor-Fluorophore verwendet werden und ermöglicht die Messung der sensibilisierten Emission innerhalb dieser Bereiche, wo Terbium zeigt keine Emission. Terbium der Emissionsmaximum bei 486 nm sehr gut mit der ein überlappt bsorption Spitze des Alexa 488, so dass für Resonanzenergietransfer zwischen den beiden Fluorophoren auftreten. Eine Wellenlänge von 515 nm ist eine ausgezeichnete Wahl an sensibilisierte Emission für dieses Paar zu erkennen, wie es ist im Tal zwischen den Terbium Emissionsspitzen, und ganz in der Nähe des Alexa 488 Emissionsmaximum von 520 nm auf. Beachten Sie, dass die Nähe der Akzeptor-Spitze, obwohl wünschenswert, ist nicht erforderlich-565 nm ist immer noch in der Lage, Alexa 488 Emissions erkennen, ohne auch Erkennen Terbium-Emission.
| Akzeptor-Fluorophor | R 0 (a) | Emissionswellenlänge (nm) |
| Atto 465 | 36 | |
| Fluorescein | 45 | 515 |
| Alexa 488 | 46 | 515 |
| Alexa 680 | 52 | 700 |
| Alexa 594 | 53 | 630 |
| Alexa 555 | 65 | 565 |
| Cy3 | 65 | 575 |
Tabelle 1. Liste der am häufigsten verwendeten Akzeptorfluorophore für LRET mit Terbiumchelat als Donor 11. Die R 0-Werte wurden gemessen, wenn der Donor und Akzeptor wurden dem löslichen Agonisten-Bindungsdomäne von AMPA-Rezeptoren gebunden. Es ist ideal, um die R 0-Wert erneut zu messen für jeden neuen System untersucht.

Abbildung 2. Eine Übersicht der Verfahren vorgestellt LRET. (A) Die AMPA-Rezeptor ist ein Membranprotein, das Konformationsänderungen bei Ligandenbindungs erfährt. Das Clamshell-förmigen Liganden-binden Domain ist hier rot eingekreist. (B) Das Liganden-bindende Domäne von AMPA als nicht an Proteine gebunden vorliegt in einer offenen Konformation (links). Wenn gebunden an Glutamat Ligand schließt das Protein um seine Liganden (rechts). Durch Anordnen Fluorophore an Beweisstellen auf der LBD kann die Natur dieser Konformationsänderung, wenn der Abstand zwischen den Fluorophoren Änderungen, die dann beeinflussen Fluoreszenzlebensdauer zu sehen. (C) Wenn die Kennzeichnung ganze Zellen, die Kennzeichnung sowohl der Protein von Interesse sowie Hintergrundmembranproteinen auftreten (links). Nach Protease-Schnittstelle, wird LRET Signal aus dem Protein von Interesse durch die Freisetzung eines löslichen Fragment verschwinden, so dass Hintergrundsignal intakt (rechts). Dieses Hintergrundsignal kann dann von dem Ausgangssignal subtrahiert werden.
Protokoll
1. Erstellen Sie das Konstrukt, das das Protein von Interesse
Klonierung des Gens für das Protein von Interesse exprimieren, in einen geeigneten Vektor. Verwendung Vektoren wie der pcDNA-Reihe oder pRK5 wie sie sind für die Expression in Säugersystemen wie HEK293 und CHO-Zellen geeignet.
2. Wählen Sie die Stellen auf dem Protein mit der Fluorophore markiert werden
- Wählen Kennzeichnung Websites, die in der Lage, mögliche Konformationsänderungen innerhalb des Proteins widerspiegeln. Wenn möglich, verwenden Sie eine Kristallstruktur des Proteins oder eines homologen Proteins zu helfen, diese Bestimmung. Wenn es keine Kristallstruktur vorhanden, verwenden Sie Online-Software, um die mögliche Struktur des Proteins vorherzusagen und damit erhalten Einblick in geeigneten Standorten.
- Wählen Reste, so dass die Seitenketten der Reste, ausgewählt Oberfläche freigelegt und zugänglich zu den Fluorophoren, so dass das Protein markiert werden.
- Wählen Rückstände,sind nicht kritisch für die Proteinfunktion, beispielsweise Websites, die nicht an der Ligandenbindung beteiligt sind.
- Bei der Einführung Cystein Mutation bevorzugen Websites, die ähnlich sind, zum Beispiel Serin, die eine minimale Störung der Proteinstruktur führen würde.
- Nach der Auswahl der Markierungsstellen, machen die Mutationen, um sicherzustellen, dass das Protein gibt nur LRET von diesen bestimmt Sites. Verwenden Standardortsgerichtete Mutagenese-Protokolle entfernt mutieren nicht-Disulfid-gebundenen Cysteine, die möglicherweise zu binden könnte Fluoreszenzmarkierungen konjugiert Maleimid. Mutieren nicht weg Disulfid-gebundene Cystein und begraben, freie Cysteine, da sie nicht mit Fluoreszenzfarbstoffen in der gefalteten Form des Proteins reagieren.
- Vorstellen Cysteinreste in den gewünschten Stellen, indem Punktmutationen mit Standard-gerichtete Mutagenese-Protokolle.
- Gehören eine Protease-Spaltstelle, die spezifisch spalten kann, die einen der Cysteine von dem Protein. Wenn dieProteinsequenz ermöglicht es, stellen die Website von konservativ Mutation des Proteins, ein Thrombin haben (Erkennungssequenz LVPRGS) oder Faktor Xa (Erkennungssequenz IDGR oder IEGR)-Sequenz in der Nähe des eingeführten Cystein und zugänglich Spaltung Protease; andernfalls kann das Tetra oder Hexa-Peptid-Sequenz als Ganzes eingefügt werden. Wähle die Website, so dass bei der Spaltung einer der eingeführten Cysteine distanziert vom Rest des Proteins in einigen Fällen kann dies erfordern zwei Spaltstellen flankiert, die ein mutiertes Cystein.
3. Testen Sie die Expression und Funktionalität des Proteins
- Durchführen eines Western-Blot auf die Expression des mutierten Proteins zu bestätigen.
- Eine Funktionstest des Proteins zu gewährleisten, dass die Mutationen die Proteinfunktion nur minimal verändert wird, wenn überhaupt, zu vermeiden Studium Konformationsänderungen eines dysfunktionalen Protein.
Hinweis: Da alle Proteine haben verschiedene Funktionen, es gibt keinen einzigen f unctional Test, der speziell für LRET verwendet wird; jedoch einige Beispiele für funktionelle Assays umfassen Enzym-Aktivitätstests für Enzyme, Liganden-Bindungsassays für Rezeptoren und elektrophysiologischen Studien für Ionenkanäle.
4. Wählen Sie die zu verwendenden Fluorophore
Wählen Fluorophoren auf der Grundlage der erwarteten Abstandsbereich ist, so dass der Bereich zwischen 0.5-1x R 0 des Fluorophors Paar gemessen.
ANMERKUNG: Dies ermöglicht eine einfachere Subtraktion des Hintergrunds, die typischerweise eine wesentlich längere Lebensdauer. Wenn beispielsweise die erwartete Abstandsbereich gemessen etwa 35 Å, ein geeignetes Fluorophor-Paar zu verwenden, würde Terbiumchelat als Donor und Alexa 594 als Akzeptor sein, weil die R 0 für dieses Paar ist 53 Å (Tabelle 1).
5. das Protein durch transiente Transfektion der erforderlichen Menge an Säugerzellen
ntent "> transient zu transfizieren, die das Protein von Interesse in der ausgewählten Säugetierzellen mit einem gemeinsamen Transfektionsreagenzien Typischerweise können vier 10-cm-Schalen pro LRET Experiment HEK und CHO-Zelllinien;. jedoch kann diese Menge in Abhängigkeit von der Proteinexpression variieren , Stabilität, etc.. Lassen Sie die Zellen, die das Protein für 36-48 h vor der Ernte auszudrücken.6. Beschriften Sie die Proteine
- Lösen Zellen von der Kulturschale. HEK-Zellen zu lösen, indem Sie einfach Pipettieren Puffer gegen den Boden der Schale. Lösen CHO-Zellen mit einem Zellschaber, Abwaschen der Medien mit extrazellulären Puffer.
- Sammle die Zellen durch Zentrifugation bei 1.100 × g für 3 min. Verwenden Sie die gleichen Einstellungen für Zentrifugen Sammeln von Zellen nach der Markierung, als auch nach den nachfolgenden Wäschen.
- Aussetzen Zellen in 3 ml extrazelluläre Puffer, dann fügen Donor und Akzeptor-Fluorophore in äquimolaren Mengen bis zu einer Endkonzentration von 100-300 nM. Inkubieren auf einem Rotor foder 1 h bei RT.
- Diese markierten Zellen 3-4x mit extrazellulären Puffer, um ungebundenen Fluorophore zu entfernen, dann diese Zellen in der extrazellulären Puffer (in der Regel 2 ml) für Messungen LRET auszusetzen waschen.
- Als Kontrolle zu kennzeichnen einen separaten Satz von Zellen mit nur Donorfluorophor (Terbiumchelat) ohne Zusatz eines Akzeptor-Fluorophor.
HINWEIS: Die Daten aus diesen Donor-Experimente nur notwendig ist, um die Analyse zu vervollständigen. Diese Versuche können für den gleichen oder verschiedenen Tagen durchgeführt werden. - Wieder, führen Funktionsvalidierung, dieses Mal mit der Bezeichnung mutierte Protein, wie der Labelling-Verfahren kann auch mit der Funktion abhängig von der Website für die Etikettierung verwendet werden, beeinträchtigt.
ANMERKUNG: Diese Experimente können auf der gleichen oder verschiedenen Tagen durchgeführt werden.
7. die LRET Experiment Set
- Platzieren Sie die resuspendierten Zellen in eine Quarzküvette mit einem Mindestvolumen von 1 ml.
- Einschalten des Computers und des Instruments und die Parameter des DATein Akquisitionsprogramm entsprechend.
- Stellen Sie die Anregungswellenlänge auf dem Absorptionsbereich des Donor-Fluorophors (330-340 nm gut für Terbium-Chelat).
- Stellen Sie die Emissionswellenlänge entsprechend, wenn man bedenkt, dass der Akzeptor-Emission hängt von der Akzeptor verwendet wird. Wichtig ist, wählen Sie eine Detektionswellenlänge, die nur die Akzeptor-Emission misst und keine Durchschlagen von Emissions des Spenders enthalten. Verwenden Sie beispielsweise eine Wellenlänge von 565 nm für Alexa 555 als Akzeptor Tabelle 1. Für Donor-nur Messungen, in denen Protein wurde nur mit Spender aber ohne Akzeptor markiert, verwenden Sie eine Wellenlänge von 545 nm zur Messung Terbiumchelat Emission.
- Stellen Sie die Länge des Emissionsdetektion auf mindestens das Dreifache der erwarteten Lebensdauer LRET sein, um sicherzustellen, dass eine lange Lebensdauer-Komponente nicht fehlen.
- Führen Sie den Scan. Sie mindestens drei Scans von 99 Sweeps, um die Konsistenz der Ergebnisse zu gewährleisten. Sparen the Ergebnisse als Textdatei (TXT).
- Konformationsänderungen des Proteins im Hinblick auf unterschiedliche Bedingungen (wie die Zugabe eines Liganden) zu messen, zu ändern und diese Bedingungen wieder mindestens drei Abtastungen je 99 Durchläufe durchzuführen auf die gleiche Probe nach diesem neuen Zustand. Wenn die Untersuchung der Auswirkungen von Glutamat auf die Konformation von Glutamat-Rezeptoren, zum Beispiel, fügen Glutamat bis 1 mm zu den gleichen Probe in Schritt 7.3 gescannt und anschließend erneut zu scannen.
- Fügen Sie bis zu fünf Einheiten der entsprechenden Protease und nehmen Scans kontinuierlich, bis die Spaltung abgeschlossen ist und keine weitere Änderung in der Lebenszeit für drei aufeinanderfolgende Scans gesehen. Normalerweise ist die Spaltung in zwei bis 3 Stunden abgeschlossen. Wenn ein Faktor Xa-Spaltstelle, die für Protease-Schnittstelle verwendet, zum Beispiel werden 3 ul Faktor Xa zur Probe und scannen alle 30 min für 3 Stunden.
8. Analysieren Sie die erhaltenen Daten
- Öffnen Sie die Datenanalyse-Software.
- Laden Sie die FluoreszenzlebensdauerDaten mithilfe von ASCII-Import, um die Text-Dateien zu öffnen. Laden Sie alle Wiederholungen sowie die letzten Hintergrundmessungen, in einer Datei.
- Der Mittelwert der Daten aus allen Scans für jede experimentelle Bedingung, um die endgültigen Daten zu erhalten. Dazu markieren Sie die Spalten, die die einzelnen Studien enthalten, dann unter dem Menü Daten in der Menüleiste, klicken Sie auf Zeilenstatistik, die durchschnittlichen Fluoreszenzintensitäten aus den Prüfungen, sowie die Standardabweichung und Standardfehler anzuzeigen.
- Plotten der Mittelwerte als Liniendiagramm mit der Fluoreszenzintensität auf der Y-Achse und der Lebensdauer in Mikrosekunden auf der X-Achse, um eine Kurve, die die Lebensdauer der sensibilisierten Emission des Akzeptors repräsentiert. Ändern Sie die Y-Achse des Diagramms auf einer logarithmischen Skala, um für eine bessere Visualisierung der Daten zu ermöglichen.
- Wiederholen Sie Schritt 8.3 auf dem Hintergrund von Messdaten, die Mittelung der letzten Scans, die Überlappung zeigen, was eine vollständige Spaltung.
- Zeigen Sie die mittlere Hintergrunddaten auf derelbe Handlung, die den gemittelten Rohdaten enthält. Um dies zu tun, öffnen Sie das Dialogfeld Layer Control unter dem Menü Zeichnen gefunden. Dann übertragen Sie die Daten, die den Hintergrund bedeuten, in die Liste der Layer-Inhalt.
- Richten Sie die mittlere Hintergrunddaten zu den Durchschnitts Rohdaten. Um dies zu tun, verwenden Sie die Funktion Einfaches Mathe unter der Math-Menü zu multiplizieren oder dividieren Sie die Hintergrunddaten wie nötig, bis das hintere Ende des Hinterüberschneidet sich mit dem hinteren Ende der Rohdaten.
HINWEIS: Bei dieser Schwanzende, die Lebensdauer von dem Protein von Interesse sollte bereits vollständig abgeklungen ist weg; Was ausgerichtet ist einfach das Hintergrundsignal vorhanden vor und nach Protease-Spaltung. - Subtrahieren Sie die Hintergrundsignal ausgerichtet von der ersten rohen LRET Signal, wieder unter Verwendung des Simple Math-Funktion.
- Passen die Daten zu einem exponentiellen Abfall (einzelne oder mehrere Exponenten, abhängig von den Standorten und dem experimentellen Design).
- Stellen Sie die Startgrenze für die Montage nach dem Ende beginnendes Laserpulses. Verwenden Sie diese gleichen Startpunkt für alle nachfolgenden Kurve Armaturen.
- Im Dialogfeld Fit-Funktions, wählen exponentiellen Abfall, um die Lebensdauer der folgenden Gleichung für einen einzigen exponentiellen Abfall passen zu:
 Gl. 4
Gl. 4
wobei die Fluoreszenzintensität repräsentiert y, y 0 die Hintergrund-Intensität aufgrund von Rauschen aus dem System ist, A 1 die Signalintensität, t ist die Fluoreszenzlebensdauer, x die Zeit, und x 0 ist der Zeitversatz. - Fix x 0-0, starten Sie den Fitting-Funktion, und passen Sie die Daten.
HINWEIS: Wenn das Experiment entworfen, um das Signal nur von einem Paar von Websites haben, sollten die daraus resultierenden Daten passen leicht durch einen einzigen exponentiellen Abfall 8 sein. Die Rest der Passform ist eine gute Methode, um die Güte der Anpassung zu bestimmen, und wenn zusätzliche Zerfall Lebensdauern requirHrsg.
- Mit den von den Datenlaufzeiten erhalten, den Abstand zwischen Fluorophoren mit der Förster Gleichung (A Umordnung der Gleichungen 1 und 2) zu berechnen:
 Gl. 5
Gl. 5
HINWEIS: Alle Variablen wie oben mit τ DA, die als der sensibilisierten Akzeptor Emissionslebensdauer gemessen wurde erwähnt. Weitere Details und Beispiele von Messungen von R 0 und R 7,9,10 anderswo gefunden werden. - Versuch wiederholen und Datenanalyse mindestens dreimal, um die Reproduzierbarkeit zu gewährleisten. Inkonsistenz zwischen den einzelnen Wiederholungen der gleichen Messung in Frage, die Gültigkeit der Daten; verwenden Sie zusätzliche Kontrollexperimente oder Wiederholungen. Berechnen Messfehler mit der kostenlosen Gustavus Fehleranalyse-Rechner (von Dr. Thomas Huber entwickelt) oder ein ähnliches System, das den Fehler in der propagiertpasst der Lebensdauer.
Ergebnisse
Eine erfolgreiche LRET Messung mit einem Lanthaniden Spender sollte ein Spender nur Lebenszeit im Millisekunden-Zeitbereich. Die Lebensdauer der sensibilisierten LRET Emission für das Protein sowohl mit dem Spender und dem Akzeptor markiert wird deutlich kürzer sein, mit einer Lebensdauer im Mikrosekundenbereich nach Abzug des Hinter Abbildung 3. Protease-Schnittstelle führt zu einer Erhöhung der Lebensdauer, die stabiler geworden ist im Laufe der Zeit ( dh nicht mehr ändern), die zeigen, dass die Protease-Spaltung ist komplett 4. Wenn die LRET Signal von nur einem Satz von Websites, sollte die daraus resultierende Emissionslebensdauer nach Abzug des Hintergrundes einen einzigen exponentiellen Lebensdauer zu geben.
Bei der Messung von Konformationsänderungen, sollte die spezifische LRET Signal eine Änderung der Lebensdauer außerhalb der Fehler der Messung Abbildung 3 zeigen. Können die Fehler der Messung durch die Ausbreitung des Fehlers berechnet werdens mit der Passform der Lebenszeit verbunden. Nach dem Anpassen der Daten an die Mindestanzahl der exponentielle Gleichung 4 kann die Lebensdauer τ beschriebenen Zerfallsfunktionen bestimmt werden. Unter Verwendung von Gleichung 5 kann der Donor-Akzeptor-und Donor-Lebensdauer nur mit der R-Wert 0 verwendet wird für das Paar LRET, um den Abstand zwischen den beiden Fluorophoren unter den getesteten Bedingungen zu berechnen. Über die Abstandsänderung aus Änderung dieser Bedingungen auf die Gesamtstruktur und Funktion des Proteins resultiert, ist nun die Aufgabe des Experimentators.
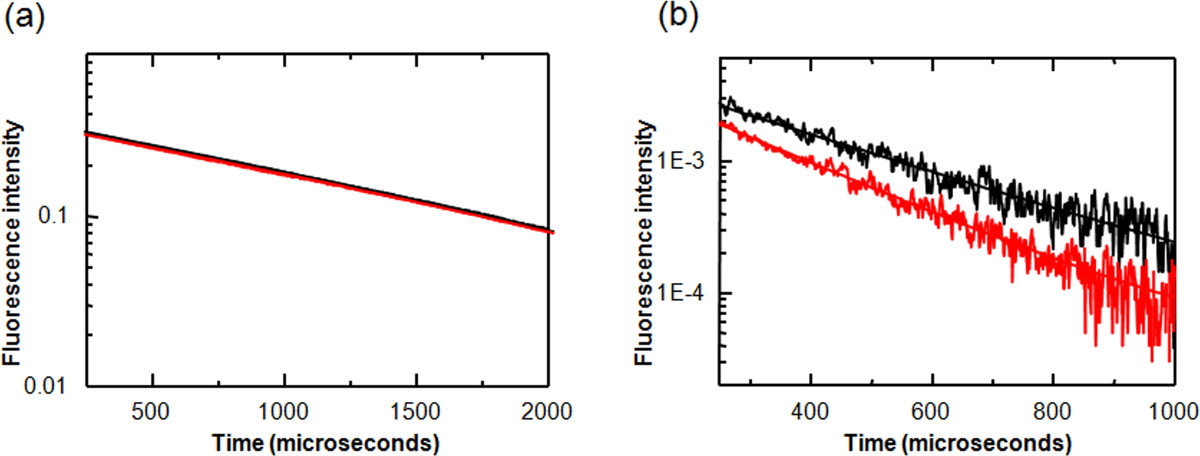
Abbildung 3. LRET Messungen der säureempfindlichen Ionenkanal 1a (ASIC1a). Fluoreszenzintensität wurde auf einer logarithmischen Skala aufgetragen worden, um die Leichtigkeit der visuellen Interpretation verbessern. (A) Donor-Proben zeigen nur eine Einzel eXponential Zerfall, die nicht mit pH ändert. (B) In-Donor-Akzeptor-markierten Proben wird eine Abnahme in der Lebensdauer der sensibilisierten Emission bei einer Abnahme des pH-Werts von 8 auf 6 (schwarz auf rot) zu sehen. Diese Lebensdauer Abnahme eine Abnahme in dem Abstand zwischen dem Finger und Daumen Domänen ASIC1a. Diese Zahl hat sich von Ramaswamy et al 2013 8 geändert.

Abbildung 4. Die Wirkung der Hintergrund-Subtraktion auf LRET Messungen auf der Säure empfindlichen Ionenkanal 1a (ASIC1a) hergestellt. Die Stellen gezielt durch Fluorophore durch eine Protease-Spaltstelle getrennt markiert werden. Nach LRET Messungen vorgenommen werden, wird die Protease auf die Proteinprobe und anschließender Spaltung des Proteins von Interesse zu einem Verlust des spezifischen Signals eingeführt. Alle LRET, die bleibtHintergrund ist die Fluoreszenz von Fluorophore zu anderen auf anderen Membranproteine vorhanden Cysteine gebunden. Zieht man diesen Hintergrund isoliert die wahre LRET Daten für das Protein von Interesse. Diese Zahl hat sich von Ramaswamy et al 2013 8 geändert.
Diskussion
LRET ist eine leistungsfähige Technik, die Wissenschaftler Abstände zwischen Domänen innerhalb eines einzelnen Proteins als auch zwischen Untereinheiten eines multimeren Proteins messen. Als solche LRET auf die Untersuchung der Konformationsänderungen und Dynamik von Proteinen oder anderen Makromolekülen gut geeignet. Das obige Protokoll sollte den entsprechend ausgerüsteten Labor zu ermöglichen, ihre Hypothesen einfach testen; Allerdings gibt es viele gemeinsame Fehlerquellen, die das neue Ermittler plagen können. Wenn wenig oder kein Signal LRET gesehen wird, überprüfen Sie zunächst die Wellenlänge Einstellungen verwendet. Anregung sollte in der Absorptionsbereich von Terbium (330-340 nm). Spender nur Messungen, wobei in der Probe nur mit Donor-Fluorophor und ohne Akzeptor-Fluorophor markiert ist, sollte die Emissionswellenlänge auf eine der in 1 gezeigten Peaks sein, während für Donor-Akzeptor-Messungen sollte die Emissionswellenlänge der Akzeptor-Fluorophor entsprechen verwendet Tabelle 1. Wenn die wavelenge Einstellungen korrekt sind, überprüfen Sie die Kompatibilität der Puffer. Einige Fluorophore kann nicht mit bestimmten Puffern oder in bestimmten pH-Bereichen kompatibel sein. Weiter, dass die Wahl der Reste und Fluorophore kompatibel sind. Wenn die Versuchsanordnung vollständig richtig ist, dann liegt das Problem wahrscheinlich entweder mit den Fluorophoren oder das Protein selbst. Mit der Zeit können Stammlösungen der Fluorophore abgebaut und können in unzureichender Kennzeichnung führen. Schließlich überprüfen Expression und Funktionalität des Proteins. Viele Mutationen wurden hinzugefügt, einschließlich der Einführung von Cysteinen, die Entfernung der nativen Cysteinen, und die Einführung von mindestens einer Spaltstelle für Protease. Somit ist es möglich, dass auch unter normalen Bedingungen der Transfektion werden die eingeführten Mutationen zu destabilisieren, die das Protein und die Ursache einer Unterexpression des Proteins von Interesse, Absenken des Signals erkennen. Wenn exprimiert, können die Mutationen oder Etikettierung Denaturierung des Proteins zu bewirken, wodurch die Reste unterschiedlich platziert werdenvon den erwarteten Distanzen in Wildtyp-Protein zu sehen. Western-Blots verwendet werden, um die Expression des Proteins zu überprüfen. Wenn es irgendeine Frage über den Handel mit einem Oberflächenmembranprotein, Biotinylierung der Zelloberfläche und Pull-down-Oberfläche von Proteinen ausgesetzt, gefolgt von einem Western-Blot für das Protein von Interesse ist, wird speziell Oberfläche Handel zu demonstrieren. Für funktionelle Untersuchungen gibt es keinen einzigen Assay für die Verwendung speziell mit LRET empfehlen, da LRET können auf einer Vielzahl von Proteinarten verwendet werden. Wiederum jedoch möglich Beispiele für funktionelle Assays umfassen Enzym-Aktivitätsassays, Ligand-Bindungsassays und elektrophysiologischen Studien. Wenn Protein-Expression oder Funktion wurde auch negativ von den eingeführten Mutationen betroffen sind, dann müssen neue Markierungsstellen gewählt werden.
Wenn ein Signal LRET gesehen, kann aber nicht von einem einzigen exponentiellen eingebaut werden, wenn ein solches Ergebnis erwartet wird, zunächst prüfen, dass der Hintergrund korrekt abgezogen. Wenn, after Subtraktion, ein multiexponentiellen Zerfall zu sehen ist, könnte dieses Signal eine Anzeige LRET aus als das, was beabsichtigt war mehrere Interaktionen beobachtet werden. Überprüfen Sie, ob alle anderen zugänglich Cysteine aus dem Protein entfernt wurde. Wenn eine Kristallstruktur verfügbar ist, wird es ein sehr nützliches Werkzeug, um diese Cysteine zu überprüfen. Auch Disulfid-gebundenen und begraben, nicht unzugänglich Cysteine nicht brauchen, um weg mutiert werden. Um die Unzugänglichkeit dieser Cysteine zu testen, ob es einen zwingenden Grund, sie nicht zu mutieren entfernt, stellen eine nicht-native Cystein im Protein und sicherzustellen, dass es keine LRET Signal in einem Donor-Akzeptor-markierten Probe. Wenn alle zugänglichen Cysteine mutiert zwar weg, und wenn das Protein mehrere Untereinheiten oder ein Teil eines Komplexes, dann kann es Verwechslung LRET Signal aufgrund Farbstoff Befestigung an dieser in der Nähe Proteine oder Untereinheiten sein. Die Wahl eines anderen Protease-Schnittstelle kann bei diesen Problemen helfen; ansonsten andere Markierungsstelles müssen gewählt werden. Schließlich, wenn das Problem mit Armatur ist einfach eine Frage der Signal-zu-Rauschen ist das Problem wahrscheinlich aufgrund der geringen Expression des Proteins. Ausdruck muss dann durch verschiedene Transfektionsbedingungen, einem anderen Vektor, etc. optimiert werden.
Wenn die LRET Messungen erzeugen eine anomale oder scheinbar physikalisch sinnlos Ergebnis, kann es Protein-spezifischen Themen, die nicht ohne weiteres auf der Hand sein kann. Beispielsweise mit säureempfindlichen Ionenkanäle, selbst vorsichtige Zugabe einer Säure, um den pH-Wert verändern könnte in einigen Zelltod und Proteindenaturierung führt. So müssen mehrere Proben hergestellt werden, eine für jeden pH zu testen. Auch neben Resonanz-Energietransfer, lokale Umgebung Veränderungen eines Fluoreszenzsignals zu beeinflussen. Eine solche Änderung, sofern signifikant, wäre in der Donor-Messung nur als Doppel-oder Multi-exponentiellen Zerfall beachten. In diesen Fällen zu verschiedenen Positionen bewegt werden, um m müssen die Markierungsstellenake sicher, dass die Änderung der Bedingungen nicht die spektralen Eigenschaften der Fluorophore ändern.
Selbst während diese Problemquellen im Auge, gibt es einige Einschränkungen und Grenzen zu LRET von denen ein Experimentator muss bewusst zu sein. Zunächst herkömmlichen Markierungstechnik setzt auf Kennzeichnungs Cysteinreste. Die Kennzeichnung von nicht-spezifischen Rückstände zu reduzieren, werden in der Regel andere Cysteine mutiert aus; Jedoch ist dieses Verfahren nicht immer praktisch. Wenn beispielsweise ein Protein viele nicht-Disulfid-gebundenen Cysteine nativen seiner Struktur, die entscheidend für die Struktur des Proteins oder Funktion sind, dann mutiert sie aus unmöglich sein wird, die Einschränkung der Technik und die Interpretation der Daten erheblich erhöht wird. Auch ist die LRET Technik mehr auf Erfassen von Änderungen in der Entfernung, anstelle von absoluten Abständen als Fehler auf absolute Entfernung aufgrund der Wirkung der Orientierungsfaktor κ 2 auf der R 0-Wert wahrscheinlichin Abstandsänderung Analyse reduziert werden, da diese Fehler beeinflussen Messungen unter allen Bedingungen gleich. Alternative Techniken durchgeführt, um einige dieser Beschränkungen zu überwinden. Zum Beispiel, indem zu viele Cysteine zu vermeiden, könnte man einen His-Tag anbringen und beschriften Sie sie mit einem Fluorophor zu Nickel-NTA gebunden. Auch können native Tryptophan als eines der Fluorophore mit der Maßgabe verwendet werden, dass, wenn als Donor verwendet werden, haben einen viel kleineren Tryptophan Lebensdauer als Terbium, so intensitätsbasierten Messungen geeigneter als Lebensdauermessungen sein. Wenn genauere Atom zu Atom Abstände erforderlich sind, sind Techniken wie Röntgenkristallographie, Molekulardynamik oder NMR noch geeigneter Techniken, um diese absoluten Entfernungen zu erhalten.
Durch seine exquisite Empfindlichkeit gegenüber Veränderungen zu distanzieren, kann LRET Abstandsänderungen mit Angstrom-Level-Auflösung für Lösungsphase Proteine messen und können experimentelle Daten, ohne die Notwendigkeit für hoch Puri bietenty, Isotopenmarkierungen oder die Größenbeschränkung, die sowohl NMR und Molekulardynamik beeinträchtigt. Nach dem Erlernen und die Beherrschung der Technik, können Prüfungen in Konformationsänderungen von Proteinen sehr viel schneller und mit mehr Leichtigkeit als bereits verfügbaren konventionellen Techniken durchgeführt werden. LRET bietet auch eine hervorragende Basis für die weitere Fachresonanzenergietransfer Techniken wie Einzelmolekül-FRET (smFRET), die die Verteilung der Bevölkerung von Konformationen von einzelnen Molekülen, sondern als der Gesamtdurchschnitts untersuchen können.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde vom National Institutes of Health Grants GM094246, der American Heart Association Grants 11GRNT7890004, und der National Science Foundation Grant MCB-1110501 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| LanthaScreen Thiol Reactive Tb Chelate | Life Technologies | PV3579 | |
| Acceptor fluorophore-Fluorescein-5-Maleimide | Life Technologies | F-150 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 488 C5 Maleimide | Life Technologies | A-10254 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 555 C2 Maleimide | Life Technologies | A-20346 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 594 C5 Maleimide | Life Technologies | A-10256 | Choice of acceptor depends on the specific experiment |
| Acceptor fluorophore-Alexa Fluor 680 C2 Maleimide | Life Technologies | A-20344 | Choice of acceptor depends on the specific experiment |
| QuantaMaster 3-SS | Photon Technology International | Spectrofluorometer should have pulsed excitation with the ability to measure lifetimes in the millisecond range | |
| FluoreScan 2.0 | Photon Technology International | Data Acquisition Software used in manuscript. Software provided with fluorescence instrument | |
| Origin 8.6 | OriginLab | Origin is the data analysis software used in protocol. Can use other similar data analysis software | |
| Quartz cuvette | Starna Cells, Inc | 3-Q-10 | |
| Stir bar | Bel-Art Products | F37119-0007 | Used in cuvette to keep cells in suspension. Can use any stir bar that fits the cuvette |
Referenzen
- Selvin, P. R. Principles and biophysical applications of lanthanide-based probes. Annual Review of Biophysics and Biomolecular Structure. 31, 275-302 (2002).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences of the United States of America. 58, 719-726 (1967).
- Stryer, L. Fluorescence energy transfer as a spectroscopic ruler. Annual Review of Biochemistry. 47, 819-846 (1978).
- Selvin, P. R., Hearst, J. E. Luminescence energy transfer using a terbium chelate: improvements on fluorescence energy transfer. Proceedings of the National Academy of Sciences of the United States of America. 91, 10024-10028 (1994).
- Chen, J., Selvin, P. R. Thiol-reactive luminescent chelates of terbium and europium. Bioconjugate Chemistry. 10, 311-315 (1999).
- Ge, P., Selvin, P. R. Thiol-reactive luminescent lanthanide chelates: part 2. Bioconjugate Chemistry. 14, 870-876 (2003).
- Gonzalez, J., Rambhadran, A., Du, M., Jayaraman, V. LRET investigations of conformational changes in the ligand binding domain of a functional AMPA receptor. Biochemistry. 47, 10027-10032 (2008).
- Ramaswamy, S. S., Maclean, D. M., Gorfe, A. A., Jayaraman, V. Proton mediated conformational changes in an Acid Sensing Ion Channel. J. Bio. Chem. 288, (2013).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Conformational changes at the agonist binding domain of the N-methyl-D-aspartic acid receptor. The Journal of Biological Chemistry. 286, 16953-16957 (2011).
- Rambhadran, A., Gonzalez, J., Jayaraman, V. Subunit arrangement in N-methyl-D-aspartate (NMDA) receptors. The Journal of Biological Chemistry. 285, 15296-15301 (2010).
- Kokko, T., Kokko, L., Soukka, T. Terbium(III) chelate as an efficient donor for multiple-wavelength fluorescent acceptors. Journal of Fluorescence. 19, 159-164 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten