Method Article
Katheterisierung der Halsschlagader und Vena jugularis zur hämodynamischen Maßnahmen im Conscious Rattenmodell durchführen, Infusionen und Blutentnahme
In diesem Artikel
Zusammenfassung
Vascular accesses to measure hemodynamics, provide fluids and perform blood sampling are important to any small animal model study. We present a technique for implanting catheters into the carotid artery and the common jugular vein in an anesthetized rat for connecting to a system to perform monitoring, infusions and sampling.
Zusammenfassung
Der Erfolg eines Kleintiermodell, um gegen schwere Krankheiten zu studieren, ist teilweise abhängig von der Fähigkeit des Modells, um den Zustand der Menschheit zu simulieren. Intratracheale Inokulation einer bekannten Menge von Bakterien wurde erfolgreich verwendet, um die Pathogenese von Lungenentzündung, dann entwickelt sich Sepsis reproduzieren. Überwachung hämodynamischen Parameter und Bereitstellung von Standard-klinische Behandlung einschließlich Infusion von Antibiotika, Flüssigkeiten und Medikamenten, um den Blutdruck aufrecht zu erhalten ist entscheidend für die Routine unterstützende Pflege in diesem Modell aber zu tun simulieren erfordert also sowohl arteriellen und venösen Gefäßzugang. Das Video beschreibt die Operationstechnik zur Implantation Halsschlagader und der gemeinsamen Halsschlagader-Katheter in einer narkotisierten Ratten. Nach einer 72-stündigen Erholungsphase werden die Tiere erneut betäubt und auf eine Leine und Schwenkaufbau zum Nagetier Gehäuse, die implantierten Katheter in die hämodynamischen Monitoring-System verbindet angebracht angeschlossen werden. Dieses Setup erlaubt freien derRatte während der Studie, während kontinuierlich Überwachen von Drücken, die Infusion von Flüssigkeiten und Medikamenten (Antibiotika, Vasopressoren) und die Durchführung der Blutentnahme.
Einleitung
Arterielle und venöse Katheterisierung von Ratten ist seit langem in der Laborforschung eingesetzt 1., Können 2 Katheterisierung zur Überwachung der hämodynamischen Parameter einschließlich systolischen, diastolischen und mittleren arteriellen Druck (MAP), Herzfrequenz (HR) und der zentrale Venendruck verwendet werden (CVP) . 3,4 Darüber hinaus sind diese Katheter ermöglicht die Infusion von Standardbehandlungen oder potenzielle Therapien sowie Blutentnahme, um die zugrunde liegende Mechanismus einer Krankheit oder Behandlung weiter analysieren. Daher mit Gefäßzugang in einer Kleintiermodell ist entscheidend für die Untersuchung der klinischen Messgrößen und Behandlungseffekte.
Um die Ursachen der kritischen Erkrankung zu untersuchen, ist es wichtig, zunächst ein Modell der menschlichen Lebensbedingungen zu simulieren, zu entwickeln. Intratracheale Inokulation einer bekannten Menge von Bakterien wurde erfolgreich verwendet, um die Pathogenese von Lungenentzündung, eine schwere Lungeninfektion, die dann entwickelt sich Sepsis reproduzieren.3, 5 Überwachung hämodynamischen Maßnahmen und Bereitstellung von Standard-klinische Behandlung ist entscheidend für die Routine unterstützende Pflege zu simulieren. Standard-klinische Behandlung beinhaltet die Infusion von Antibiotika, die für die Klärung der zugrunde liegenden Infektion und die Verabreichung von Flüssigkeiten und Vasopressoren hilft, zwei Therapien bei septischen Patienten eingesetzt werden, um den Blutdruck aufrecht zu erhalten. 5-7 Gefäßzugang, speziell Implantation von Patent Katheter ist besonders wichtig, wenn wir studieren experimentellen Therapien für Sepsis.
Seit vielen Jahren wurde die Fähigkeit, Standard-klinische Behandlung, um Nagetiere zu verwalten durch die Verfügbarkeit der Materialien mit den erforderlichen Eigenschaften für den Bau von implantierbaren Katheter und die Fähigkeit der Infusionstechnologie, um kleine Volumina genau mit der Zeit liefern, begrenzt. Darüber hinaus ermöglicht die Fähigkeit, eine Infusion als Reaktion auf die kontinuierliche Überwachung eines spezifischen hämodynamischen Maßnahme auslösen für eine konsistente und reproduzierbare Standard Behandlungsmodell bei der Verwendung von größeren Probengrößen typisch für Studien an Nagetieren. 8, 9 Diese technischen Einschränkungen in Materialien und Präzisions-Hardware, aber überwunden worden, um gleichzeitig Routinetherapien während der Überwachung hämodynamischen Parameter, muß sowohl arteriellen und venösen Gefäßzugang zur Verfügung stehen.
Das Video beschreibt die Operationstechnik zur Implantation Halsschlagader und der gemeinsamen Halsschlagader-Katheter in einer narkotisierten Ratten. Nach einer 72-stündigen Erholungsphase werden die Tiere erneut betäubt und auf eine Leine und Schwenkaufbau zum Nagetier Gehäuse verwendet werden, um die implantierten Katheter in die hämodynamischen Monitoring-System zu verbinden angebracht angeschlossen werden. Während der Untersuchung kann das System für eine Fluidinfusion, die entweder auf Abgabe eines vorgegebenen Volumens an einer bestimmten Infusionsrate oder ein automatisiertes System, eine Injektionsrate in Abhängigkeit von dem mittleren arteriellen Druck erfasst, um einen gegebenen Druckbereich aufrechtzuerhalten liefert. Flüssigkeitsinfusionssystemnutzt programmierbare Spritzenpumpen, die eine Schnittstelle mit digitalen Ausgängen des Datenerfassungssystems und werden von der Software die Überwachung der MAP gesteuert. Das Fangband und Schwenk Aufbau ermöglicht eine freie Bewegung der Ratte während der Studie, während Überwachen von Drücken, Infusion von Flüssigkeit und Vasopressoren und die Durchführung der Blutentnahme, ohne die Tiere zu manipulieren. Gleichzeitige Überwachung von bis zu 12 instrumentierten Tiere mit 2 Katheter jeweils (im Setup) mit der Hardware erweiterbar auf bis zu 24 Überwachungs instrumentierten Tiere erlaubt eine hohe Flexibilität für die Untersuchung mehrere geschichtete Gruppen in jedem Experiment.
Diese Katheterisierung Verfahren kann vorteilhaft für Forschungseinrichtungen, die ähnlich Nagetiermodellen Gefäßzugang für die Überwachung, Probennahme und Behandlung für bis zu 11 Tage benötigen zu verwenden. Wenn die Forschungseinrichtung der Prüfung dieser Verfahren hat Erfahrung mit Nagetieren und eine richtige Tragekonstruktion für die Pflege dieser Tiere dann developing Diese Fähigkeiten können eine erhebliche Kostenersparnis bieten, die Gesamtbetriebskosten pro katheterisiert Ratte von mehr als $ 180 bis weniger als $ 50 (einschließlich naiven Ratte, Katheter-Komponenten und technische Kosten) und zunehmende Planungsflexibilität (naive Ratten sind leicht verfügbar vs. Unternehmen Lieferplan von implantierten Ratten). Der Erfolg dieses Verfahrens hängt von den Fähigkeiten des einzelnen Durchführen der Katheterisierung. Die Trainings Tieren zur sicheren Beherrschung der dieses Verfahren geworden ist von 20 bis 40 Ratten mit einer daraus resultierenden Katheter Offenheitsrate von> 90% lag.
Protokoll
Die nachfolgend beschriebenen Verfahren wurden im Rahmen eines Protokolls von der Animal Care und Verwenden Ausschuss des Klinikzentrums an den National Institutes of Health genehmigt durchgeführt.
1. Vorbereitung für die Chirurgie
- Gas sterilisieren Katheter und Instrumente.
2. Bereiten Sie den Katheter
- Reinigen Sie den Katheter mit heparinisierter Glycerin (250 IE Heparin / 1 ml Glycerin), um die Durchgängigkeit zu gewährleisten und Auslaufen zu verhindern. Stecker Ende des Katheters mit einem Metallanschlag (20 ga, 15 mm), um heparinisierte Glycerin erhalten.
3. Bereiten Aseptic Workstation
- Verwenden Sie 70% Alkohol, um die Workstation und Instrumentensiebe sprühen. Verwenden Sie eine sterile Abdeckung, um die OP-Tisch und Instrumentensiebe und Ort Instrumente auf dem Tablett zu decken.
4. Bereiten Rats für Chirurgie
- Platz Ratten einzeln in einer Lucite Kammer und setzen auf eine Betäubung; Isofluran (3-5%) Mixmit Sauerstoff ed bis bewusstlos. Entfernen Ratte aus der Kammer und rasieren Pelz von vorderen und hinteren Bereichen des Halses. Schmiermittel Salbe die Augen.
5. Katheter Implantation
- Zeigen narkotisierten Ratten (von Zehe Prise bestätigt) auf eine beheizte Operationstisch in der Bauchlage; legen ihre Nase in die Bugnase Anästhesie mit spontaner Atmung aufrecht zu erhalten (Isofluran; 3,5%). Reiben der OP-Bereich 3-mal abwechselnd Verwendung Betadin und 70% Alkohol. Machen Sie eine 0,5 cm Mittellinie Hautschnitt zwischen den Schulterblättern mit einer chirurgischen Schere.
- Positionieren Ratte in der Rückenlage; sanft zurückhalten die Beine an jeder Seite des Tisches mit Gummibändern; Aufrechterhaltung einer Narkose. Legen Sie zwei gerollt steril 4x4 Gaze unter Nacken leicht für bessere Belichtung überstrecken. Machen Sie eine 2 cm ventralen zervikalen Hautschnitt rechts der Mittellinie des Halses auf der Ebene des Schlüsselbeins mit einem Skalpell.
6. RechtsVena jugularis Katheterisierung
- Mit einer Gefäßklemme, stumpf sezieren die rechte Jugularvene, scheiden sich die Speichel und Lymphgewebe, zu visualisieren und zu isolieren, eine 5 mm-Abschnitt des Schiffes. Mit 4-0 Seidennaht, legen Sie eine lose Bindung an beiden kranialen und kaudalen Enden des Schiffes, um die Belichtung des Schiffes zu maximieren. Mit einem Mikro-chirurgische Schere machen ein Einschnitt groß genug, um den Katheter mit dem Schiff zwischen den beiden Ligaturen Pass, in der Zeile und Krawatte die Schädel Ligatur rund um das Schiff.
- Legen des Katheters in das Gefäß in Richtung zum Herzen mit Hilfe des Mikrosektions Haken und Pinzetten und rückt den Katheter, bis das gesamte Segment PU 3F ist im Behälter. Mithilfe der Ligaturen auf die kranialen und kaudalen Enden der Katheter in das Gefäß zu gewährleisten.
7. Linke Halsschlagader Katheterisierung
- Mit einer Gefäßklemme, stumpf sezieren die M. omohyoideus Längsrichtung, um die linke Halsschlagader zu entlarven und isolate eine 5mm Schnitt des Gefäßes. Achten Sie darauf, den Vagusnerv (weiße Farbe) vollständig aus der Arterie getrennt. Achten Sie darauf, nicht zu zerreißen oder brechen den Nerv.
- Mit 4-0 Seidennaht, legen Sie eine lose Bindung an der kaudalen Ende des Schiffes, binden Sie die Schädel Ende des Behälters und legen Sie eine Bulldogge Klemm kaudal über der Naht, um den Blutfluss nach dem Schnitt zu stoppen. Mit Hilfe eines Mikro chirurgische Schere, einen Einschnitt machen, groß genug, um den Katheter mit dem Schiff zwischen den beiden Ligaturen übergeben, in der Schlange. Legen Sie die Arterienkatheter zum Herzen mit Hilfe des Mikropräparations Haken und Zangen.
- Verwenden Sie eine glatte Nadelhalter ohne Schloss, um den Teil des Katheters innerhalb des Behälters dicht vor dem Entfernen der Bulldog Klemme zu halten. Schieben Sie den Katheter mit einer Pinzette beim Lösen Nadelhalter langsam, bis das gesamte PU 2F Segment der Katheter in das Gefäß. Binden Sie die lose Schwanz Ligatur um den Katheter und Gefäß zu sichern, aber nicht so tight so zu verschließen, den Katheter.
8. Mit einem Hetero Hemostat, Tunnel ein 5 cm Schlauch wieder subkutan hinter dem Ohr und durch den Einschnitt zwischen den Schulterblättern. Exteriorisieren den Katheter durch das Rohr und Entfernen Sie die U-Bahn.
9. Schließen Sie das ventrale Inzision mit drei Edelstahl-Wundklammern, und die dorsale Inzision mit 4-0 Seidennähte, um die nach außen gelegt Katheter zu befestigen.
10. Postoperative Überwachung und Pflege
- Nach Katheterisierung, beenden die Anästhesie und Wiederherstellung der Ratte in Seitenlage in einem Käfig mit Zellulose Betten. Beachten Sie die Ratten 2 h Abständen für mindestens 4 Stunden oder bis keine Anzeichen von Schmerz und dann einmal täglich. Geben Ketoprofen [5 mg / kg, subkutane Injektion (SQ)] direkt nach dem Verfahren und jede 12 Stunden, wenn die Ratten Anzeichen von Schmerzen oder Leiden. Nach unserer Erfahrung sind keine Ratten zusätzliche Analgesie für Schmerzen nach der initia erforderlichl Injektion. Eigenschaften beobachtet, die Berücksichtigung zusätzlicher Dosen von Analgesie hervorrufen würden umfassen, sind aber nicht darauf beschränkt; abnormale Körperhaltung; Zunahme / Abnahme der Atemfrequenz, unthrifty / ungroomed, Infektionen / Entzündungen der Einschnittstelle, Augenausfluss, Piloerektion ("Stachelhaarkleid"), Reduktion der Aktivität in Reaktion auf akustische oder taktile Reize.
HINWEIS: Ratten 72 Stunden, die> 10 g von der Vorschule Katheterisierung Gewichtszunahme wird in die Studie aufgenommen werden wiederhergestellt.
11. Anschluss an hämodynamische Systems
- Nach der Erholung, einschreiben gesunden Ratten (Gewichtszunahme> 10 g) in der Studie. Platzieren Ratten in Lucite Kammer und zu betäuben, wie zuvor beschrieben.
- Zeigen sterilen Tuch auf OP-Tisch mit sterilem Gefäßklemme, Mikropinzette, 1 ml Spritzen mit stumpfen Nadel auf.
HINWEIS: Die Spitzen der blutstill sollte mit Gummi überzogen werden, um eine Beschädigung des Katheters zu vermeiden. Zeigen narkotisierten Ratte auf einem OP-Tabelle in der Bauchlage und Ort Nase in den Nasenkegel auf die Anästhesie (3-5%) mit spontaner Atmung aufrecht zu erhalten. - Klemm arteriellen und venösen Kathetern unter Verwendung eines Paares von Gummi capped Hämostatika gerade unterhalb der Metallsteckerstiften. Verwenden Sie eine Pinzette, um den Metallstift am Ende des Katheters zu entfernen und eine 1 ml Spritze mit Heparin Kochsalzlösung mit einer stumpfen Nadel befestigt gefüllt. Im Gegenzug, entfernen Sie die Hämostatika und ziehen 0,1 ml, um sicherzustellen, die Katheter-Patent.
- Re-klemmen die Katheter, entfernen Sie die Nadel und befestigen dieses Ziel zu einer längeren Katheter (vorgespült mit Heparin Kochsalzlösung), dass ist mit einem Schwenk angeschlossen und angebunden an der Oberseite des Schuhkarton Käfig. Verbinden Sie diese Katheter zu den Wandlern für die Datenerfassung und Aufzeichnung, die Probenahme, oder Infusion.
HINWEIS: Alle Katheter werden mit Spiralfeder Leitungen lang genug, um volle Bewegungsfreiheit eines Tieres im Käfig ermöglichen geschützt. - Nach Katheterverbindung beenden Anästhesie underholen, die Tiere in der Brustbeinstellung in einem Käfig mit Zellulose Betten. Um arteriellen Katheter Durchgängigkeit zu erhalten, die Linien mit 0,05 ml Heparin Kochsalzlösung (50 IU / ml) jeder 1 Stunde für 24 Stunden, die mit den regelmäßigen Bewertungen der Tiere decken Hand spülen.
12. Blutentnahme, Pressure Monitoring and Drug Administration
- Bringen Sie leere Spritze angeschlossen Absperrhahn Katheter arteriellen und ziehen 0,6 ml Inline-Flush. Bringen Probenspritze nehmen Probe und senden Sie das 0,6 ml Inline bündig, gefolgt von 0,7 ml heparinisierter Kochsalzlösung spülen.
- Verwenden Sie Datenerfassungshardware und Software zu messen und aufzuzeichnen MAP und die Herzfrequenz kontinuierlich.
- Schließen Sie den automatischen Wirkstoffabgabesystem (ADDS) mit dem Katheter.
HINWEIS: ADDS stellt die Rate der Vasopressor Infusion (hoch, niedrig oder 0 Dosis) auf der Grundlage des zu wart Drücke innerhalb des normalen physiologischen Bereich erkannt MAP.
Ergebnisse
Veränderungen in der Gefäßdruck werden durch die Flüssigkeit gefüllt Katheter (1) in elektrische Signale von den hämodynamischen Kurven dargestellt übertragen und umgewandelt (2, 3). Ohne Gefäßzugang könnte diese Maßnahmen nicht hergestellt werden. Echtzeit-Streaming der Wellenformen können zum Nachweis und zur Analyse der Veränderungen auf einer Schlag auf Basis schlagen (Abbildung 2). Komprimierung der Zeitskala der Wellenformen ermöglicht die Quantifizierung Änderungen, die über eine längere Dauer (Minuten bis Tage) auftreten (Abbildung 3, obere 4-Wellenformen), die mit den Veränderungen in Vasopressor Infusionsraten korreliert werden kann (Abbildung 3, untere 4-Wellenformen).
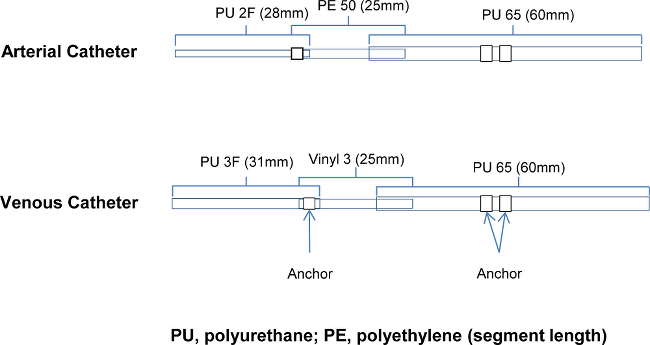
Abbildung 1. Katheter Ausführung: Details zu den Komponenten der arteriellen und venösen Kathetern PU Polyurethan;. PE, PolyEthylen (Segmentlänge) Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
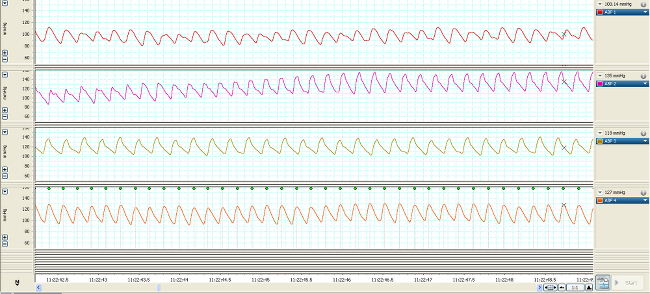
Abbildung 2. Echtzeit-MAP-Wellenformen von 4 typischen Nagetiere 7 Tage nach der Katheterisierung über 7 sec. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
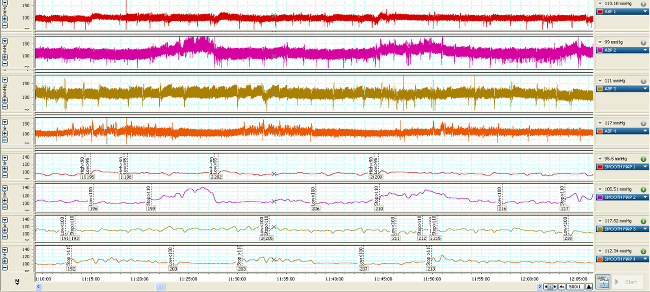
Abbildung 3. Zeitdruck MAP Wellenformen von 4 typischen Nagetiere (obere 4-Wellenformen) 7 Tage nach der Katheterisierung über 1 Std., Wenn die Karte gemittelt (untere 4-Wellenformen), wird dieser Wert auf Trigger verwendet ADDS hoch (<90 mmHg) , niedrig (<100 mmHg) oder beenden (> 110) Fluss Antwort von der Infusionspumpe. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Diskussion
Untersuchung therapeutischer Ansätze in die klinische Krankheitsmodell erfordert die Fähigkeit, genau durchzuführen hämodynamische Monitoring, also Gefäßzugang erfordern. In unserem Modell der Sepsis stellt arteriellen Katheterisierung systemische Drucküberwachung und Katheterisierung ermöglicht die Anwendung der klinischen Standardtherapie. Die Standardtherapie bei Sepsis umfasst die Infusion von Antibiotika, um bakterielle Infektion und die Infusion von Flüssigkeiten und Vasopressoren behandeln, um arteriellen Druck im gewünschten Bereich zu halten. Beide Katheter zur Blutentnahme verwendet. Bei dieser Konstruktion ist die Anwendung von programmierbaren Infusionspumpen mit automatischer Auslösung der Vasopressor Infusionsrate, basierend auf Echtzeit den mittleren arteriellen Druck ist ein Fortschritt gegenüber der klinischen Einstellung, die manuelle Titration durch das medizinische Personal und in der präklinischen Einstellung lässt die benötigt Verwendung dieser Behandlungsform möglich, das Studium einer großen Anzahl von Tieren.
. e_content "> Einige Komplikationen wurden früh in der Entwicklung des Modells erlebt Dazu gehörten teilweise Verstopfung des arteriellen und venösen Kathetern von Überdrehen, Krawatten auf PU2 und PU3 Komponenten (1-2%); Abhanden jugularvenöse Katheter in eine kleinen Zweig, (<1%); ungeklärten plötzlichen Todes nach der Wiederherstellung (keine Lungen Thrombus oder andere Organschäden erkennbar), (1-2%) von mit O 2 Strömungsgeschwindigkeit von 2 l / min halten Isofluran-Konzentration von 2 bis 3,5% gelöst . Andere häufige chirurgischen Komplikationen von Blutungen, lokale Infektion und selbstverschuldete Schäden wurden nicht beobachtet. Nach chirurgischer Kompetenz erreicht wird, die einzelnen Verfahren sollten in der Lage, in nicht mehr als 15 Minuten abgeschlossen sein. Die Erfolgsquote, gemessen als eine gesunde Erholung und Patent Katheter, kann erwartet werden, 90% einmal voll ausgebildet. Eine zusätzliche Tier in jeder Studie überschreiten ", um den Verlust von Daten und die Gesamtzahl der Tiere erforderlich und Rechnung für eine fehlgeschlagene Katheter, sein können, zu minimierenFusion nur "oder Mortalität aufgrund von Komplikationen.Der wichtigste Schritt in diesem Verfahren ist die Konstruktion und die Anordnung der Katheter. Die Materialien müssen an der Spitze, weich zu sein, um nicht die Gefäßwand ohne allzu leicht Crimpen durchbohren. Der Körper des Katheters zu sein steifer (als die Spitze), um in das Gefäß ausreichend voranzutreiben, und an ihrem Platz gesichert werden. Figur 1 zeigt die 3 Durchmesser der Schläuche, die für den Arterienkatheter und 2 verschiedene Rohrdurchmesser verbunden sind, für die Venenkatheter. Diese Komponenten sind ineinander geschoben, um Katheterdurchmesser an der Spitze zu verringern, und werden zusammen mit Ankern hinzugefügt, um die Platzierung des Katheters in dem Gefäß oder Herz aufrechterhalten wird verklebt.
Nach der Wiederherstellung und der Dreh- und Halteseil verbunden ist, sollten die MAP und CVP Wellenformen ähnlich den in Abbildung 2 dargestellten Daten angezeigt. Um ein arterieller Katheter patenc pflegeny während der Überwachung sollte eine stündliche Heparin Kochsalzspülung (0,05 ml) durchgeführt werden. Kontinuierliche Infusion erhält die Katheter Durchgängigkeit. Beim Leitungsanschluss und bündig, muss Aufmerksamkeit zu zahlen, um sicherzustellen, dass keine Luftblasen in der Leitung. Eine Luftblase ≥0.1ml kann in einer Embolie in der Lunge, Gehirn oder anderen Organen führen. Hämodynamische Wellenformen erfasst und über den Verlauf der Studie untersucht. Beim Komprimieren der Zeit in der x-Achse, Abbildung 3 zeigt die Entwicklung der MAP und CVP im Laufe von 1 Stunde sowie die Veränderungen der Geschwindigkeit und Wirkung Vasopressor Infusion.
Das Verfahren hat mehrere potentielle Einschränkungen. In unseren Studien bleiben die Katheter Patent für bis zu 11 Tage. Es ist nicht bekannt, wie lange die Katheter würde Patent über diesen Zeitraum hinaus bleiben. Um den Katheter zu passen, wie beschrieben, gibt es eine minimale Gefäßgröße, die etwa korreliert mit Nagetier Gewicht, Tiere in dieser Studie aufgenommen erfordern, um größer zu sein200 g. Die Verwendung eines kleineren Katheterdurchmesser würde in zunehmenden Strömungswiderständen Reduktionslässigkeit führen. Das Erreichen der zentrale Venendruck Maßnahmen erfordert eine genaue Platzierung des Katheters im Atrium während der Studiendauer ausreichen, um Konto für Größe und Wachstum und kann eine Herausforderung sein.
Einmal gemeistert, arterielle und Gefäßkatheter kann die Basis für eine Vielzahl von Tiermodellen erfordern hämodynamische Monitoring, Blutentnahme und Infusion von Flüssigkeiten oder Therapien bei minimalen Schmerzen und Leiden während der Instrumentierung oder Handhabungs einmal erholt werden. In der Tat, in Verbindung mit einer vorherigen JOVE Veröffentlichung 10 beschreibt Katheterisierung der Vena femoralis, haben wir erfolgreich durchgeführt, dieses Modell mit 3 implantierten Katheter.
Offenlegungen
The authors have no potential conflicts of interest.
Danksagungen
Intramural NIH program supported the development of this model. Publication support was provided by Harvard Apparatus Inc. and ADInstruments Inc. The work by the authors was done as part of US government–funded research; however, the opinions expressed are not necessarily those of the National Institutes of Health.
Materialien
| Name | Company | Catalog Number | Comments |
| Straight micro dissecting forceps | Roboz | RS-8102 | surgical instrument |
| Delicate straight hemostatic forceps | Roboz | RS-7114 | surgical instrument |
| Delicate curved hemostatic forceps | Miltex | 7-4 | surgical instrument |
| Serrefine curved, very delicate micro clamp | Roboz | RS-5471 | surgical instrument |
| Micro dissecting hook | Miltex | 19-220 | surgical instrument |
| Angled on edge micro dissecting spring scissor | Roboz | RS-5618 | surgical instrument |
| Light operating scissor | Roboz | RS-6750 | surgical instrument |
| Scalpel handle and blade (#10) | Cincinnati Surgical | RS-9843 | surgical instrument |
| Pack of 4-0 silk suture with curved needle | Ethicon | FS-2 | surgical instrument |
| Straight micro suturing needle holder | Roboz | RS-6410 | surgical instrument |
| Wound clip | Stoelting | 59027 | surgical instrument |
| Sterile gauze 2"x2" | Dynarex | 3362 | consumable |
| Gauze 4"x4" | Covidien | 2556 | consumable |
| Anesthesia vaporizer | Surgivet | V703001 | equipment |
| Lucite box | Custom | equipment | |
| Isoflurane | Baxter | equipment | |
| Downdraft Table | Airscience | equipment | |
| Table top surgical platform | Custom | equipment | |
| Arterial Catheter | Custom - Scientific Commodities Inc. | consumable | |
| Venous Catheter | Custom - Scientific Commodities Inc. | consumable | |
| Data acquisition system | ADInstruments | Powerlab 16/30 | equipment |
| Data analysis software | ADInstruments | LabChart v7.3 | equipment |
| Programmable infusion pumps | Harvard Apparatus | PHD Ultra | equipment |
Referenzen
- Buckingham, R. E. Indwelling catheters for direct recording of arterial blood pressure and intravenous injection of drugs in the conscious rat. J Pharm. Pharmacol. 28 (5), 459-461 (1976).
- Buckle, J. W., Nathaniels, P. W. Proceedings: A dual catheter system for the simultaneous infusion and sampling of the vascular system of the unrestrained rat. J. Physiol. 242 (2), 55P-56P (1974).
- Solomon, S. B., et al. Effective dosing of lipid A analogue E5564 in rats depends on the timing of treatment and the route of Escherichia coli infection. J. Infect. Dis. 193 (5), 634-644 (2006).
- Cui, X., et al. Bacillus anthracis cell wall produces injurious inflammation but paradoxically decreases the lethality of anthrax lethal toxin in a rat model. Intensive Care Med. 36 (1), 148-156 (2010).
- Quezado, Z. M., Natanson, C. Systemic hemodynamic abnormalities and vasopressor therapy in sepsis and septic shock. Am. J. Kidney Dis. 20 (3), 214-222 (1992).
- Perdue, P. W., Kazarian, K. K., Nevola, J., Law, W. R., Williams, T. The use of local and systemic antibiotics in rat fecal peritonitis. J. Surg. Res. 57 (3), 360-365 (1994).
- Qiu, P., et al. The individual survival benefits of tumor necrosis factor soluble receptor and fluid administration are not additive in a rat sepsis model. Intensive Care Med. 37 (10), 1688-1695 (2011).
- Cui, X., et al. Severity of sepsis alters the effects of superoxide anion inhibition in a rat sepsis model. J. Appl. Physiol. 97 (4), 1349-1357 (2004).
- Karzai, W., et al. Protection with antibody to tumor necrosis factor differs with similarly lethal Escherichia coli versus Staphylococcus aureus pneumonia in rats. Anesthesiology. 99 (1), 81-89 (2003).
- Jespersen, B., Knupp, L., Northcott, C. A. Femoral Arterial and Venous Catheterization for Blood Sampling, Drug Administration and Conscious Blood Pressure and Heart Rate Measurements. J. Vis. Exp. (59), e3496 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten