Method Article
In vivo optogenetische Stimulation des Nager Central Nervous System
In diesem Artikel
Zusammenfassung
Optogenetics has become a powerful tool for use in behavioral neuroscience experiments. This protocol offers a step-by-step guide to the design and set-up of laser systems, and provides a full protocol for carrying out multiple and simultaneous in vivo optogenetic stimulations compatible with most rodent behavioral testing paradigms.
Zusammenfassung
The ability to probe defined neural circuits in awake, freely-moving animals with cell-type specificity, spatial precision, and high temporal resolution has been a long sought tool for neuroscientists in the systems-level search for the neural circuitry governing complex behavioral states. Optogenetics is a cutting-edge tool that is revolutionizing the field of neuroscience and represents one of the first systematic approaches to enable causal testing regarding the relation between neural signaling events and behavior. By combining optical and genetic approaches, neural signaling can be bi-directionally controlled through expression of light-sensitive ion channels (opsins) in mammalian cells. The current protocol describes delivery of specific wavelengths of light to opsin-expressing cells in deep brain structures of awake, freely-moving rodents for neural circuit modulation. Theoretical principles of light transmission as an experimental consideration are discussed in the context of performing in vivo optogenetic stimulation. The protocol details the design and construction of both simple and complex laser configurations and describes tethering strategies to permit simultaneous stimulation of multiple animals for high-throughput behavioral testing.
Einleitung
Optogenetik hat sich auf Systemebene Neurowissenschaften bei der Suche nach den neuronalen Schaltelemente Fahr normalen und krankheitsrelevanten Verhaltenszustände revolutioniert. Die Entdeckung, dass lichtempfindliche Mikroben Opsinen 1 könnte funktionell in Säugerzellen exprimiert werden, vorausgesetzt, die Plattform für den Einsatz von Licht, um eine beispiellose Kontrolle neuronaler Aktivität mit hoher räumlicher und zeitlicher Präzision 2 zu gewinnen. Im Gegensatz zu herkömmlichen elektrophysiologischen oder pharmakologische Ansätze zur Manipulation der neuronalen Aktivität, ermöglicht Optogenetik zur Kontrolle von spezifischen Zelltypen (basierend auf genetischen Identifizierung oder räumlichen Projektion) in heterogenen Populationen und bei physiologisch relevanten Zeitskalen. Die anschließende Einführung eines neuronalen-optische Schnittstelle ein praktisches Werkzeug für die Lieferung von Licht verhaltenden Tier 3. Dies hat für die Echtzeitmodulation definiert neuronale Schaltkreise in wach verhalten Nagetieren um kausal testen die erlaubtRolle der neuronalen Schaltkreise im Governance relevanten neurologischen und psychiatrischen Erkrankungen 4-6 Verhaltenszustände. Optogenetik stellt daher ein leistungsfähiges Werkzeug für die Einführung in jedem Labor interessiert an der Untersuchung der funktionalen Zusammenhang zwischen Gehirnaktivität und Verhalten oder physiologische Messungen in Tiermodellen.
Gelungenes Design und Fertigstellung eines optogenetische Experiment beinhaltet verschiedene Schritte und Überlegungen (siehe Abbildung 1). Das Ziel des derzeitigen Protokolls ist es, Personen mit den Werkzeugen und Komponenten zusammen mit der theoretischen und praktischen Kenntnisse notwendig, optogenetische Stimulation wach verhalten Nagetieren durchzuführen vorzusehen. Derzeit gibt es zwei zur mikrobiellen Opsin Kanäle aktivieren vorherrschenden Wellenlängenbereiche: im blauen Spektrum (üblicherweise 473 nm) und grün-gelb-Spektren (üblicherweise 532 oder 591 nm). Beide Laser und lichtemittierende Dioden (LEDs) als Lichtquellen verwendet werden, um deliver spezifische Wellenlängen des Lichts zum Hirngewebe. Die nicht-kohärentes Licht von LEDs emittierte macht jedoch effektive Übertragung von Licht schwierig, wenn die Kopplung in die für in vivo Nager Stimulation erforderlichen kleinen Kernfasern. Die Entscheidung über die geeignete Laseranordnung ist ein wichtiger erster Schritt, und wird von der beabsichtigten Verwendung der Optogenetik im Labor abhängen. Das aktuelle Protokoll beschreibt zwei grundlegende Konfigurationen, die in ihrer Einfachheit der Montage und Verwendung unterscheiden: Einzelvorgegekoppelten Lasern und Dual-Laser-Systemen (siehe Abbildung 2). Einzellasersysteme, die vom Hersteller vorge gekoppelt sind im Wesentlichen fertige gehen bei der Ankunft mit wenig bis gar keine Einrichtung erforderlich, haben aber den Nachteil, minimal Endbenutzer individuell gestalten. Ein Dual-Laser-System ermöglicht die Bereitstellung von zwei verschiedenen Wellenlängen auf der gleichen Faser. Dies wird zunehmend wichtig geworden mit dem Aufkommen von kombiOptoGenetik wobei verschiedene Wellenlängen verwendet werden, um zu aktivieren / zu hemmen bezeichnendesT-Zell-Typen, die räumlich co-lokalisiert sind. Dies ist auch für den Einsatz mit bistabilen Sprungfunktion Opsinen wo Photoströme initiiert und von blauem und gelbem Licht beendet bzw. 7,8. Dual-Lasersysteme sind auch kundengerecht, wie der Benutzer kann hinzufügen oder Komponenten (zB Außenjalousien, Strahlfilter, Inline-Stromversorgung Meter) aus dem Strahlengang zu entfernen, wie erforderlich. Aufgrund seiner Vielseitigkeit ist der Dual-Laser-Set-up zu empfehlen, wenn Optogenetik wird eine Fortsetzung Werkzeug im Labor verwendet werden. Die Kopplung der Laser kann jedoch eine Herausforderung darstellen und so eine schnelle, einfache und zuverlässige Kupplungsmechanismus wird in diesem Protokoll vorgesehen sind. Hinweis, dieses Protokoll beschreibt die Montage von optischen Komponenten und nutzt Rangierkabel und Komponenten, die bei Stufenindex-Multimodefasern mit einer 200 & mgr; m-Kern und einer numerischen Apertur (NA) von 0,22 optimiert sind. Verschiedene Kerngrößen und NA sind käuflich zu erwerben, aber alle Komponenten sollten idealerweise in Bezug auf die Kern entsprechenGröße und NA Lichtverlust bei Faserverbindungsstellen zu vermeiden. Alternativ können bei einer Faserverbindung, Licht von einem kleineren zu einem größeren Kerngröße übergeben; und / oder von einem niedrigeren auf einen höheren NA-NA Faser ohne zusätzliche Verluste.
Anbinden Strategien vorgesehen sind, die zur gleichzeitigen Stimulation von mehreren Mäusen für Hochdurchsatz-Verhaltenstests ermöglichen. Die zur Verfügung gestellten Protokolle annehmen Verwendung einer chronischen implantierbare Fasern für Verhaltenstests, sondern kann für akute Stimulationsprotokolle geändert werden. Akut implantierten Fasern sind zum Kombinieren optogenetische Stimulation mit pharmakologischen Manipulation vorteilhaft, da die gleiche Kanüle verwendet werden, um Medikamente und die Spitze einer optischen Faser auf die gleiche Stelle zu liefern. Die Verwendung von chronisch implantierten Fasern wird jedoch höchst für mehrere Tage Verhaltenstests zu empfehlen, da es reduziert Gewebeschädigung bei wiederholtem Einführen und Entfernen der Fasern zugeordnet ist, und erhöht die Genauigkeit in Bezug auf die einheitliche Anordnung der Fasern fürGewebe Beleuchtung 3. Wenn mit den hier beschriebenen Tethering Konfigurationen kombiniert werden, kann das Verhalten zuverlässig über mehrere Tage aufgenommen werden. In der Tat, zuverlässige Lichtdurchlässigkeit wurde berichtet Monate nach Faserimplantation 9, so dass chronische Stimulation und Verhaltenstests Paradigmen können theoretisch aus über mehrere Tage und Wochen durchgeführt werden. Zusätzliche Hinweise zur Hardware-Komponenten haben, um dem Protokoll hinzugefügt, um die Leserwahl in der besten Produkt, das ihren individuellen Bedürfnissen gerecht wird, auch kostengünstige Alternativen und Produkte, die im eigenen Haus gemacht werden können zu ermöglichen. Wichtige Tipps, die bei der Einrichtung und Durchführung nützlich sind, sind ebenfalls vorhanden.
Protokoll
! ACHTUNG: Dieses Protokoll beinhaltet die Verwendung von Laser der Klasse 3b und der richtigen Ausbildung und Sicherheitsrichtlinien erfordern, zu beachten. Schutzbrille muss jederzeit im Betrieb Laser getragen werden, mit Assoziierung Verfahren stellt ein besonders hohes Risiko. Kontaktieren Sie den Laser-Anbieter, um die Brillen, die maximale Dämpfung für einen bestimmten Laser bieten wird zu bestimmen. Falls verfügbar, einschreiben in einem institutionellen Laserschutz-Schulung. Nie einen Laser zu betreiben, ohne die entsprechende Schutzbrillen und Ausbildung.
1. Laser Apparat Set-up
Gegebenenfalls werden die Schritte in Abschnitt 1 (A) oder (B) bezeichnet, um zwischen einem oder zwei Lasersystemen zu unterscheiden sind.
- Befestigen und sichern Sie Laser mit dem Steckbrett. Breadboards sind hervorragende Wärmeleiter und fungieren als Kühlkörper, um Schäden an internen Laserkomponenten bei längerem Gebrauch zu verhindern.
- (A) Befestigen Sie den Pre-gekoppelten laser auf eine 10 "x 12" Steckbrett (oder nach Bedarf) mit ¼-20 "Kopfschrauben und Unterlegscheiben (Abbildung 2A). Wenn Steckbrett Löcher nicht mit Laser-Befestigungslöcher auszurichten, verwenden Sie kleine "Tischklemmen" zu sichern, um Lasersteckbrett.
- (B) Wenn die 2-Laser verwendet werden sehr unterschiedliche Strahlhöhen (> ~ 1 cm), verwenden Sie kleine 4 "x 6" Breadboards, eine Plattform für einen der Laser zu schaffen. Bringen Sie diese Boards zu den wichtigsten großen 12 "x 18" Steckbrett mit ¼-20 "Zylinderschrauben mit Unterlegscheiben, dann bringen Sie den Laser auf den kleineren Platten mit Schrauben oder Tischklemmen wie in 2B gezeigt. Schließen Sie das andere Laser direkt auf das Steckbrett mit Schrauben oder eine variable Höhe Tischklemme.
Critical Schritt: Breadboards, Schrauben und optischen Komponenten können als metrische oder das Zoll erworben werden so konsequent sein beim Kauf von Artikeln; der Standard für dieses Protokoll ist Kaiser. - (A)Bringen Sie einen dicken Mantelflach spalten / Körperkontakt (FC / PC) Patchkabel an den Koppler (als Koppler Kabel bezeichnet; siehe Abbildung 3), die physisch mit dem vor dem Laser (2A) verbunden ist.
- (B) Führen Sie den Koppler auf eine ¾ "optischen Post, dann Epoxid die Verbindung zwischen dem Koppler und der Spitze der Post mit JB Kwik oder ähnliche Epoxy, Lösen und Fehlausrichtung während der Verwendung zu verhindern. Befestigen Sie den Pfosten mit dem Steckbrett (wie die Steckbrett Bohrungen decken sich nicht immer eine Linie mit der gewünschten Anordnung von optischen Komponenten, ein Posthalter, Standfuß Adapter und Klemmgabel verwendet werden, um des Kopplers optisch Beitrag zu befestigen). Bringen Sie einen dicken Mantelpatchkabel (Koppler Kabel) an der Rückseite des Kopplers.
- (B) Legen Sie die erste Lenkspiegel für den blauen Laser in die kinematische Halterung und befestigen Sie es mit dem Steckbrett mit einem ¾ "optischen Post. Fügen Sie diesen Beitrag zu einer Basis adapter und Spanngabel. Positionieren Sie die Spanngabel und veröffentlichen Montage direkt vor dem blauen Laser mit Spiegel um 45 ° gedreht, um den Laser auf die dichroitischen Spiegel lenken. Verwenden Sie das Raster der Bohrungen auf dem Steckbrett als grobe Ausrichtungsführung. Sobald grob positioniert, mit einem ¼ "-20 Schraube, um die Spanngabel mit dem Steckbrett zu sichern (siehe Abbildung 2B, C).
- (B) Legen Sie die dichroitischen Spiegel in eine kinematische Halterung und befestigen es an einem 1 "optischen Post und direkt zu sichern, um dem Steckbrett. Positionieren Sie den dichroitischen Spiegel auf die weit von links, und in Übereinstimmung mit, blauen Laserspiegel. Winkel der dichroitische Spiegel in einem Winkel von 45 °, so dass blaues Licht reflektiert den ersten Spiegel in den Koppler reflektiert, dann ziehen Sie die Schraube Befestigung des kinematischen Halterung an der Säule (siehe Abbildung 2B, C).
- (B) Befestigen Sie den ersten Umlenkspiegel für die gelbe Laser zu einem ¾ "optischen Post. Befestigen Sie die optical Beitrag zu einem Basisteil und Spanngabel. Positionieren Sie die Spanngabel und Post-Ensemble direkt vor dem gelben Laser und Winkel der Spiegel in einem Winkel von 45 °, so dass gelbes Licht wird in Richtung des zweiten Steuerspiegel gerichtet werden. Sichern Sie die Spanngabel in Ort mit einem ¼ "-20 Kopfschraube und Unterlegscheibe.
- (B) Befestigen Sie den zweiten Steuerspiegel für die gelbe Laser zu einem 1 "optischen Post. Winkel der Spiegel, so daß die gelbe Lichtstrahl von dem ersten Spiegel wird durch den dichroitischen und in den Koppler (2C) reflektiert werden. Sichern Sie die Post direkt an die Steckbrett und ziehen Sie die Befestigungsschraube, wenn der Spiegel ist abgewinkelt angemessen. Feine Spiegel Anpassungen werden über die kinematische Spiegelhalter in einem späteren Schritt durchgeführt werden.
- (B) Schließen Sie einen Neutraldichtefilter Rad zu einem ¾ "optischen Post und legen Sie die Post in eine Stelleninhaber zu einer Montageplatte befestigt. Sichern Sie das Ensemble mit dem Steckbrett zwischen dem ersten und second gelbe Spiegel mit einem einzigen ¼ "-20 Schraube. Dieses Rad wird verwendet, um die Kraft der gelben Laserlicht erreicht den Koppler anzupassen.
Tipp: Alle Komponenten (wie die Schrauben, mit denen kinematische Spiegelhalter an die Spitze der Beiträge und den Fäden hält Basisadapter auf den Boden der Beiträge), bevor Sie sie an die Basis individuell fest. Verwenden Sie eine Welle eines kleinen Sechskantschlüssel in den Durchgangslöchern in der optischen Kommentare über genügend Drehmoment zu erhalten. Dadurch wird verhindert, Komponenten Lösen während des Gebrauchs, erfordern Neuausrichtung. - Befestigen Sie eine FC / PC zu FC / PC L-Winkel-Adapter mit dem Steckbrett.
- Optional: Sichern Sie sich einen 1 x 2 50/50 Miniwürfel Faserteiler direkt auf dem Steckbrett für die gleichzeitige in vivo Stimulation von zwei oder mehr Tiere. Zusätzlich können Griffe zugegeben werden, um eine Bewegung der Lochrasteranordnung zu unterstützen (wie in 2A zu sehen ist).
2. Laser-Kopplung (Berührungslos-Klauenkupplung-)
Dieser Abschnitt bezieht sich auf die Dual-Laser-Set-up (2B). Richten Sie die innere blaue Laser-Pfad vor dem Ausrichten die äußere gelbe Laserpfad.
! ACHTUNG: Verwenden Sie eine niedrige Lichtleistung Kopplung (~ 1 mW) auf Augensicherheit zu gewährleisten. Schutzbrille tragen, um das Gerät dem Laser und bis Lichtintensität gemessen und als sicher zu sein.
- Stellen Sie die Schalter auf der Rückseite des Lasers auf "Curr" (Strom) und Transistor-Transistor-Logik-Modus (TTL) + für konstante Beleuchtung (im Gegensatz zu Analog-Modus). Stellen Sie sicher, dass die Stromknopf auf der Vorderseite des Fahrers wird auf Null gesetzt. Einschalten des Lasers durch Einschalten des Treibers und dann die Lasertaste.
- Langsam stellen Sie den Stromknopf auf der Vorderseite des Lasertreiber, so dass ~ 1 mW Laserlicht emittiert wird entfernt. Warten Sie 10 bis 15 Minuten (oder laut Herstellerangaben) für die Laser, um sich aufzuwärmen.
- Schließen Sie das Glasfaserkabel Tester direkt an den free Ende der Kupplung Patchkabel und schalten Sie den Kabeltester (3A). Stellen Sie den Winkel des Kopplers, so daß der rote Strahl geradeaus fährt zurück in Richtung der Mitte des dichroitischen Spiegels. Der Strahlengang des roten Lichtes von der Kabeltester emittiert ist der genaue Weg, der die ankommende Laserlicht benötigen, um zu folgen, um in den Laser gekoppelt werden.
- Führen Sie eine Grobausrichtung: Verwenden Sie die seitlichen und horizontalen Knöpfe an den kinematischen Spiegel, um den Strahl von Laserlicht in die Kupplung zu steuern. Die Sockelklemmen müssen möglicherweise gelockert, um etwas neu zu positionieren, die Spiegel und die Kupplung werden. Die kinematischen Halterungen sollten noch einige Reisen für weitere Feineinstellungen zur Verfügung. Seien Sie nicht beunruhigt, wenn kein blaues Licht wird von den Koppler angeschlossenen Patchkabel zu diesem Zeitpunkt ausgegeben.
- Platzieren einer einzigen Stück halbdurchlässiges Papier unmittelbar vor dem dichroitischen Spiegel, zwischen dem dichroitischen Koppler und. Es wird sowohl eine blaue und ared Punkt auf diesem Papier aus dem Laser und dem Kabeltester auf. Verwenden Sie Papier, das lichtdurchlässig ist genug, um sowohl die roten und blauen Flecken gleichzeitig über dieselbe Seite des Papiers zu sehen.
- Feineinstellungen für die erste Lenkspiegel (dh diejenige, die näher zu dem Laser, nicht der dichroitischen) durch vorsichtiges Einstellen der seitlichen und horizontalen Reglern die Mitte des roten Punktes mit den blauen Punkt auszurichten.
- Bewegen des Papiers zurück in Richtung des Kopplers, so dass es direkt vor dem Koppler und die Regler auf der zweiten (dh dichroitischen) Spiegel, um den Laserstrahl mit dem roten Strahl auszurichten.
- Durchlaufen Sie die Schritte 2.6 und 2.7, bis die Mitte der blau / gelben und roten Strahlen werden genau in beiden Positionen ausgerichtet (dh bis die roten und blauen Strahlen kollinear sind).
- Entfernen Sie die Kabeltester vom Koppler Kabel. Laserlicht sollte jetzt vom Ende der Kupplung Patchkabel emittiert werden.
- Bestimne Kopplungseffizienz durch die Messung der Lichtenergie von der Faserspitze der Kupplerpatchkabel mit einem Leistungsmesser emittiert. Verwenden Sie die 500 mW Einstellung auf Fotodiode des Power Meters und ändern Sie die Einstellung der Wellenlänge (λ) bis blau (473 nm) oder gelb (635 nm) Spektrumlicht in Abhängigkeit von der verwendeten Lasers.
- Legen Sie die Faserspitze senkrecht zur Photodiode, eine Strommesswert zu erhalten. Vergleichen der Lichtleistung in die Koppler mit der Lichtleistung von dem Faserende ausgestrahlt wird. Eine Kopplungseffizienz von> 80% wird als sehr gut. Sehr kleine weitere Anpassungen des zweiten Steuerspiegel kann manchmal etwas verbessern Kupplung. Im allgemeinen, wenn das Strahlenmuster von dem Ende des Kopplungsfaser ist eine kleine, enge, zentrale Stelle (ohne Ringe umgibt), die Kopplungseffizienz in den Faserkern ist optimal.
- Wiederholen Sie die Schritte 2,1 bis 2,11 für Gelb Lasereinkopplung, außer mit den beiden Lenkspiegeln für die gelbe Laser (siehe 2C). Do not Stellen Sie die Position des dichroitischen Spiegels oder Ausrichtung des blauen Lasers verloren.
3. In vivo optogenetische Stimulation
Stellen Sie sicher, dass alle Verfahren, die Tierversuche sind in Übereinstimmung mit den örtlichen und nationalen Richtlinien, die von der entsprechenden Institutional Animal Care und Verwenden Committee durchgeführt und genehmigt.
- Optikfaseraufbau (siehe 3B zur Identifizierung der verschiedenen Arten von Patchkabeln im Folgenden). Zur Stimulierung einer einzelnen Maus, den Steckverbinder Patchkabel zu einer dicken Mantelpatchkabel mit dem FC / FC L-Winkel-Adapter direkt mit dem Steckbrett befestigt ist (siehe 4A). Um zwei Tiere von einem Laser anregen, den Steckverbinder Patchkabel an zwei dicken Mantelpatchkabel mit dem 1 x 2 50/50 Mini-Cube (siehe 4B). Um drei oder mehr Tiere zu stimulieren, schließen Sie das Kupplungskabel an eine Multimode-Faser-Splitter mit dem 1 x 2 mini-Cube bereits mit dem Steckbrett befestigt (siehe 4C).
- Schließen Sie einen Umschalter / Drehgelenk mit den freien Enden der dicken Mantelpatchkabel / Faser-Splitter. Kommutatoren sind wichtig, da sie die Drehung der Faser mit der Nager Bewegung, die Anhäufung von Drehmoment auf die Patchkabel verhindert ermöglichen. Zu viel Drehmoment Kordeln drehen, führen zu Bruch, und stören die natürliche Bewegung des Tieres während des Tests.
- Befestigen Sie das Tier-Patchkabel an den Kommutator.
- Befestigen Sie eine Verbindungsspalthülse auf die freie Metallring Ende der Tierpatchkabel (Abbildung 5). Sie die Hülse nicht mit Gewalt den ganzen Weg bis die Hülse; verlassen ~ 0,5 cm der Hülse ausgesetzt als das ist, was eine Verbindung mit dem implantierten Glasfaser dem Tier befestigt (Figur 6).
Critical Schritt: Immer Kauf Ärmel, die eine Spaltung enthalten, um Expansion der Hülse über implantiert Faserferrule während der Verbindung zu ermöglichen undEntfernung. Zu eng der Passung kann schwerem Trauma für das Tier führen, wenn sich das Implantat ablöst vom Schädel beim Versuch, die Hülse von dem Implantat zu trennen. Wenn dies auftritt, sollte das Tier aus der Studie entfernt werden und Sie erhalten sofortigen Tierarzt Pflege. In ähnlicher Weise, bevor Sie eine neue Hülse zum ersten Mal, "brechen sie in 'durch Einstecken und Entfernen einer Hülse, bis sie mit der gewünschten Menge an Kraft trennt.
Hinweis: Es ist einfach, einen Faserbruch beim Entfernen einer Hülse, die fest an einer Hülse befestigt ist. Um dies zu vermeiden, drücken Sie die Hülse aus, indem Sie einen kleinen Holzstab in das offene Ende der Hülse (der Griff eines Standard Wattestäbchen ist die richtige Größe). - Verbinden Sie den blauen Laser-Treiber an einen Impulsgenerator mit einem BNC-Kabel und schalten Sie das Aggregat auf.
- Setzen Sie geeignete Schutzbrille auf. Die Schalter auf der Rückseite des Lasers und "TTL +" mode "Curr". Stellen Sie sicher, that die Stromknopf auf der vor dem Fahrer auf Null gesetzt andturn der Laser (drehen Sie den Fahrer auf den ersten und dann den Laser-Taste).
- Stellen Sie den Stromknopf auf der Vorderseite des Lasers, so dass 5 bis 10 mW ist gegen Tierpatchkabel Faserspitze emittiert wie unter Verwendung eines Lichtleistungsmesser. 5-10 mW ist eine allgemeine Richtlinie - die genaue Stromstärke erforderlich ist, um Auswirkungen auf ein gegebenes Gewebevolumen sollte vor Beginn des Experiments berechnet werden, wie in Aravanis et al 3.
- Schalten Sie den blauen Laser in den Modus "Analog" für die in vivo-Stimulation. Hinweis: Yellow DPSS-Laser werden in TTL + Modus für konstante Beleuchtung betrieben. Warten Sie 10-15 Minuten für die der Laser, um sich aufzuwärmen.
- Zurückhalten vorsichtig die Maus und schließen Sie das Split-Hülse auf dem Tierpatchkabel mit dem chronischen implantierbaren Faser (siehe Abbildung 6). Sicherstellen, dass die Enden beider Fasern physischen Kontakt miteinander stehen. Verwenden Sie den Split auf der Verbindungshülse alsFenster, um den direkten Kontakt zwischen den beiden Visualisierung kritischer Schritt. Manchmal Ablagerungen können auf dem Metallring von implantierbaren Faser des Tieres sammeln und stören die richtige Verbindung. In diesem Fall verwenden Sie ein Ethanol abwischen, um sanft reinigen Sie die Hülse auf den Kopf des Tieres vor der Anbringung. Niemals eine Verbindungsmuffe Kraft über die Hülse, da dies zu schweren Verletzungen des Tieres führen. Wenn eine physikalische Verbindung zwischen Faserenden können nach der Reinigung nicht gemacht werden, entfernen Sie das Tier aus der Studie.
Tipp: Leichte Leckage an der Verbindungsstelle zwischen dem implantierten Fasern und Tierpatchkabel erfolgen. Visualisierung von diesem Licht durch Nagetiere können eine experimentelle verwechseln 10 zu präsentieren. Schrumpfschlauch kann an Patchkabel angebracht werden und glitt über den Verbindungspunkt von Fremdlicht zu minimieren. - Lassen Sie die Maus, um ein paar Minuten vor dem Beginn der Verhaltenstests zu gewinnen.
Tipp: D* je nach Verhaltenstest verabreicht werden soll, ist es am besten, um Mäuse zu der Verbindungs- und Anbindungsprozess 2 habituate - 3 Tage vor, da die Handhabung erforderlich ist, um das Tier anschließen kann Stress induzieren und verwechseln Verhaltenstests. - Platzieren Sie die Maus in der Verhaltens-Testgerät sicherstellen, dass die Verbindungsschnur ist frei von Baumstümpfen. Lassen Sie niemals ein Tier unbeaufsichtigt während der Stimulation. Auch bei der Verwendung von Kollektoren, Patchkabel haben eine Tendenz, während der längere Zeit drehen und kann mit Verhaltenstests stören.
- Verwenden Sie einen Impulsgenerator, um die blauen Laser mit einer bestimmten Frequenz, die Opsin der Wahl aktivieren pulsiert. Für gelbe Laser Verwendung: Puls der gelben Laser mit Außenjalousien oder einfach durch die Blockierung der Strahlengang mit einem undurchsichtigen, nicht reflektierenden, nicht brennbar Objekt.
4. Beitrag In vivo Stimulation Überlegungen
Dieser Abschnitt ist nicht beabsichtigt, eine vollständige proto seincol, sondern als Leitlinien für weitere Verfahren, die folgenden in vivo optogenetische Stimulation berücksichtigt werden sollten, angeboten.
- Nach Beendigung des Experiments bestätigen viralen und Faserauflegekopf histologisch auf genaue Interpretation der Verhaltensergebnisse. Euthanize Tier gemäß gültiger Richtlinien und durchströmen das Tier mit eiskalter phosphatgepufferter Kochsalzlösung (PBS) und 4% (w / v) Paraformaldehyd in PBS.
- Entfernen implantierten Lichtwellen durch festes Ergreifen der freiliegenden Metallring mit einer Zange oder Hämostatika. Ziehen Sie in einer gleichmäßigen, aber schnell, Bewegung. Es ist wichtig, die Integrität der implantierten Faser durch Messen der Lichtleistung am Ende jedes Experiments getestet.
- Post-fix die Gehirne in Para für mindestens 24 bis 48 Stunden vor dem Schneiden durch die interessierende Region. (Bei Verwendung eines Gefriermikrotoms, Inkubation Gehirne in einer 30% Saccharoselösung für mehrere Tage vor dem Schneiden). Führen Immunhistochemie mit standard Protokolle zum Nachweis der entsprechenden Opsin-tagged Fluorophore, also grün fluoreszierende Protein (GFP), gelb fluoreszierendem Protein verbessert (eYFP) oder mCherry.
- Überprüfen Website von Opsin Ausdruck und Faser Implantat unter dem Mikroskop visuell geeignete Platzierung der Virusinjektion und Implantat auf Basis von ausgewählten Koordinaten bestätigen.
Ergebnisse
Mit in vivo optogenetische Stimulation erhalten Behavioral Ergebnisse sind völlig abhängig von neuronalen Schaltkreises gezielt, das Tiermodell verwendet, und die Modulationsparameter. Für aktuelle demonstrativen Zwecken Dopaminneuronen im ventral tegmentalen Bereich oder VTA, der Tyrosinhydroxylase :: Cre-Mäuse wurden mit einem stabilen Stufenfunktion Opsin (SSFO) 8 oder Kontrollvirus (eYFP) transduziert und eine Faser Implantat war chronisch implantiert. Die Verwendung von TH :: Cre transgenen Mäusen wird sichergestellt, dass Opsin Expression auf TH + -Zellen (Dopamin) im VTA beschränkt. 7 zeigt repräsentative Verwendung des aktuellen beschriebenen Laseraufbau zur gleichzeitigen Stimulation von mehreren Mäusen erhalten Verhaltensergebnisse. Hier wurden die Mäuse tethered und stimulierte gleichzeitig über separate Laser (3 Mäuse / Laser, wie in 4C) und Bewegungsverhalten wurde für 1 h aufgezeichnet. Wiederholte Stimulation der Dopamin-Neuronen im VTA führte zu einerhyper Phänotyp, während der Dauer des Stimulations anhielt. Keine Änderung der Bewegungsverhalten wurde in eYFP Mäusen beobachtet (siehe Video 1). Nach Verhaltenstests wurden durchgeführt, um die Immunhistochemie genaue Virus Targeting zu VTA Dopamin-Neuronen und Fiber-Placement wurde visuell bestätigt (siehe Abbildung 7) zu überprüfen.

Abbildung 1. Versuchsschritte für in vivo optogenetische Stimulation. Es gibt vier allgemeine Schritte involviert bei der Planung und Durchführung von in vivo optogenetische Stimulation. Dieses Protokoll spezifisch werden die Schritte bei der Bereitstellung von Licht von einer Laserlichtquelle, um tiefe Gehirnstrukturen in den Verhaltensweisen Nagetier beteiligt und umfasst 1) Lasersystem Montage und Lichtkopplung; 2) Anbindung Strategien für ceinen Schritt, die für die Interpretation der Daten ist - nschluss mehrere Tiere auf eine Lichtquelle für die Hochdurchsatz-Verhaltenstests und 3) enthält Richtlinien des Targeting Strategie zur Lichtabgabe bestätigen. Hinweis: Obwohl dieses Protokoll ist nicht exklusiv zu chronischen implantierbare Fasern für Tethering Zwecke, wird empfohlen und angenommen, wenn die Kombination von optogenetische Stimulation mit Verhaltenstests. Siehe auch Ung & Arenkiel 2012 18 und Sparta et al., 2012 9 für die Eigenfertigung und die Implantation von chronischen Lichtwellenleiter. Durchgezogene Linien = Schritte in diesem Protokoll abgedeckt.

Abbildung 2. Lasersysteme für die In-vivo-optogenetische Stimulation verwendet. (A) Einzellasersystem für die In-vivo-Stimulation. Dieser Laser ist ph Nach Hersteller ysically vor, gekoppelt und benötigt wenig Endbenutzer Set-up. (B) Dual-Lasersystem. Zwei Laser werden in einer einzelnen Faser durch die Verwendung von Spiegeln, die auf jedem Strahlengang in einen berührungslosen Art Koppler lenken handeln gekoppelt. Dies ist das vielseitigste Set-up als optische Komponenten können entfernt oder hinzugefügt, wie gebraucht, aber stellt eine größere Herausforderung in Bezug auf die effiziente Laserkopplung werden. (C) Schematische Darstellung der in (B) gezeigt, Dual-Laser-System angibt, Platzierung von Laser und Spiegel mit der entsprechenden Laserlicht-Strahlengang (Pfeile) dargestellt. Hier der dichroitische Spiegel "D" wird verwendet, um blauen Wellenlängen des Lichts abzulenken beim Senden gelben Wellenlängen durch, um den Koppler "C" und in den angeschlossenen Koppler-Patchkabel. B = blauer Laser; C = berührungslosen Stil Koppler; D = dichroitischen Spiegel; FW = Filterscheibe; M = Spiegel; Y = gelb Laser.bekommen = "_ blank"> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 3. (A) Kabeltester in der nicht-physischen Kupplungsprotokolls verwendet. Unten: Kabeltester direkt an einem Patchkabel verbunden. Zeigt Insert Verbindungspunkt des Testers zu Kabel (B) Patchkabel in der gesamten Protokoll bezeichnet Von außen nach innen:.. Multimode-Faser-Splitter, schwarz Manteltier-Patchkabel mit weißen Zirkonia Spalthülse auf die Flach spalten befestigt (FC) Ende, dicken Mantelpatchkabel (auch als "Koppler Kabel" bezeichnet). Dick Mantel Patchkabel sind mit Polyvinylchlorid (PVC) Schläuche für zusätzlichen Schutz beschichtet. Für diese Kabel sind Industriestandard-Farbcodes verwendet werden, um zwischen verschiedenen Fasertypen, wobei orange = Multimode-Faser zu unterscheiden. Tierpatchkabel sind dünnere Mantel während Verhaltenstests Flexibilität für die Tierbewegung ermöglichen. Beachten Sie, dass Staub / PC endet Kappen auf FC gesetzt, wenn Kabel nicht in Gebrauch sind. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
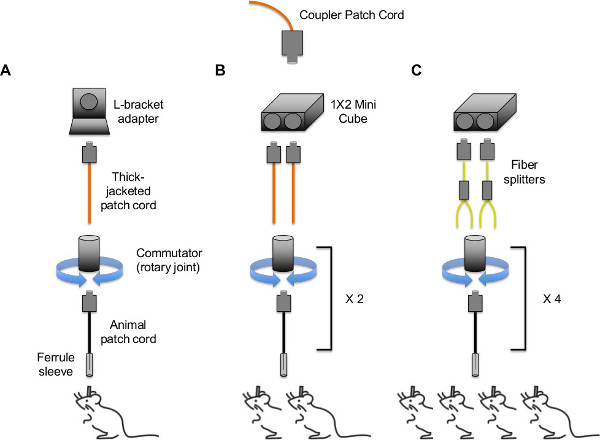
Abbildung 4. Tethering Strategien für In-vivo-optogenetische Stimulation von (A) einem einzigen Tier, (B) zwei Tiere; . (C) drei oder vier Tiere Mögliche Konfigurationen sind nicht auf die oben gezeigten beschränkt - mehrere Konfigurationen sind durch die einzigartige Kombination von Adaptern, Faserteiler und Verzweigung Patchkabel, die im Handel oder mit kundenspezifischen Auftrag vorhanden sind möglich. Hinweis: Patchkabel und Glasfaser-Splitter enthalten FC / PC Steckern an beiden Enden (nur ein Ende dargestellt).ww.jove.com/files/ftp_upload/51483/51483fig4large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 5. Richtige und falsche (rot x) Anschluss eines Patchkabel mit einer implantierbaren Lichtwellen mit einem Split-Ärmel. (Linkes Feld) Zirkondioxid-split-Hülse verwendet wird, um ein Patchkabel mit dem Ring eines implantierbaren LWL (hier nicht gezeigt, um ein Tier anzubringen) verbinden. Pfeil ist mit dem Verbindungspunkt zwischen der Patchkabel und implantierbare LWL zeigt. Vergleichen Sie (rechts), wo ein Spalt zwischen der Patchkabel und implantierbare Glasfaser-, wie durch die Spaltung der Verbindungshülse visualisiert. Notieren Sie sich den Lichtverlust, der mit einem unsachgemäßen Anschluss (unten rechts) auftreten können. Bodeneinsatz auf upper linke Tafel zeigt verwendeten Einzelkomponenten. Von oben nach unten des Einsatzes: Doric implantierbare Glasfaser-Kanüle, weißen Zirkonia Split-Ärmel, Flach cleeve (FC) Ende eines schwarzen Manteltier-Patchkabel (in 3B dargestellt vollen Patchkabel). In allen Platten, beachten Sie, dass die Verbindungshülse ist nicht bündig mit dem FC Ende des Patchkabels. Lassen ~ 0,5 cm von einer Über hängen zum Anschluss an das implantierbare Lichtwellen dem Tier angebracht. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 6. Seite (links) und frontal (rechts) Ansicht einer Maus mit einem implantierten Faseroptik zu einem Patchkabel verbunden ist. Mit dem Split auf der Verbindungshülse zu helfen visualisieren richtige Verbindung des Patchkabels to der Zwinge des implantierten Glasfaser. Der Anschlusspunkt wird durch einen roten gestrichelten Box hervorgehoben und auch im oberen Einsatz dargestellt. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 7. Repräsentative Ergebnisse. (Links) Behavioral Auslesen von in vivo optogenetische Stimulation. Beispiel für das Verhalten, die mit der beschriebenen Laser Aufbau und Anbinden Protokoll erhalten werden können. Entweder mit einer Stufenfunktion Opsin (AAV5-DIO-SSFO-eYFP transduziert - lokomotorische Aktivität wurde während optogenetische Stimulation des ventralen tegmentalen Bereich (VTA) in Tyrosinhydroxylase (TH) :: Cre-Mäusen (8 / Gruppe n = 7) aufgenommenen ) oder Kontrollvirus (AAV5-DIO-eYFP) in der VTA. Gruppen von drei Mäusen wurden gleichzeitig zu einer einzigen bundenLaser, wie in 4C dargestellt ist und mit einer 5 sec Impuls von 447 oder 473 nm Licht angeregt einmal geliefert alle 15 min. Zwei-Wege-ANOVA mit wiederholten Messungen zeigten eine signifikante Gruppe x Zeit Interaktion (F 3,39 = 15,27, p <0,0001), und einen signifikanten Haupteffekt von der Zeit (F 3,39 = 4,67, p = 0,007), wobei optogenetische Stimulation erhöhte lokomotorische Aktivität nur in SSFO Mäusen (Bonferroni post hoc p <0,0001, bezogen auf t = 0 - 15 Zeit bin), was zu einem Gesamtanstieg in der Bewegungsaktivität, verglichen mit eYFP Mäusen (Hauptwirkung der Gruppe: F 1,39 = 10,69, p = 0,0061; Bonferroni post-hoc p <0,01 bei t = 15 bis 30 und p <0,001 bei t = 30 bis 45 und t = 45 - 60). Fiber-Spezifikationen: 200 & mgr; m-Kern, 0,22 NA. Lichtbestrahlungs = 6-66 mW / mm 2, entsprechend Faserspitzenabstand von 0,1 bis 0,6 mm aus viralen Injektionsstelle mit 5 mW Lichtleistung am Faserende vor dem Anbinden emittiert. Fehlerbalken stellen die Standardabweichung des Mittelwerts. eYFPvs. SSFO: ** p <0,01; *** P <0.001; Zeitwirkung: #### p <0,0001 (rechts) histologische Sicherung von viralen und Glasfaser-Platzierung.. Konfokalen Fluoreszenzbild auf einem Leica TCS SP5 Scanning-Laser-Mikroskop aufgenommen wurde verwendet, um Fiber Placement (gepunktete Linie) und viral-vermittelte Expression (grün) in der Maus ventralen Tegmentum folgenden in vivo optogenetische Stimulation zu visualisieren. Dopamin-Neuronen (TH +) sind blau gesehen. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Video 1. In vivo optogenetische Stimulation. Hyperaktivität bei VTA Stimulation mit SSFO in TH :: Cre Mäusen Bitte klicken Sie hier, um dieses Video anzusehen.
| Tabelle 1 Lichtbestrahlungsstärken erforderlich, um häufig verwendete Opsinen aktivieren. | ||||
| Opsin Variant | λ | Leistungsdichte (/ mm 2) | Immobilien | |
| On / Off Kinetics | ||||
| Optische Anregung: Schnell wirkende Channelrhodopsinen | ||||
| ChR2 2 | 470 | 1 - 5 mW | 1.21 / 12 msec | Feuer bis zu 40 Hz |
| Cheta 19 | 490 | 5 mW | 0,86 / 8,5 ms | Feuer bis zu 200 Hz |
| Chef 20 | 450 | 1,65 mW | 1.62 / 12 msec | Nicht Desensibilisierung Form ChR2 |
| C1V 18 | 540-630 | 8 mW (540 nm) | 5/34 ms bei 540 nm | Rotverschoben |
| 3,2 mW (630 nm) | 67 msec (on) bei 630 nm | |||
| Optische Anregung: Langsam wirkende Kanal Rhodopsine | ||||
| Stabile Sprungfunktion Opsin (SFO) 8 | 470/590 | 8 & mgr; W (470 nm) | 20 ms / 29 min | New SFO Variante; mehr geöffneten Zustand. Eröffnet von 470 nm, von 590 nm geschlossen |
| Optische Inhibition | ||||
| eNpHR3.0 21 | 560-630 | 3-5 mW | 2,5 ms / <10 msec | Anhalt Hemmung 30 min 22 mit Konstantlicht * |
| ArchT3.0 11, 23 | 520-560 | 1-5 mW | 2 / <10 msec | Empfindlicher mit größeren Photoströme als eNpHR3.0 |
| Diese Tabelle ist als nur eine Führung vorgesehen ist; spezifisch für neuronale Modulation erforderliche Lichtbestrahlungsstärken sollte unabhängig bestätigt werden. | ||||
| Experimentelle Validierung ist wichtig zu überprüfen, ob das Opsin, Targeting Strategie und Lichtstimulationsparameter zu modulieren neuronale Feuern in der vorgesehenen Art und Weise 5. | ||||
| Leistungsdichte (mW / mm 2) bezieht sich auf die Leistung von Licht in einem bestimmten Bereich des Hirngewebes beleuchtet und nicht an Lichtenergie von der Faserspitze emittiert beziehen. | ||||
| * Verwenden Sie immer den niedrigsten Lichtintensität möglich, vor allem bei längerer Lichtstimulation. | ||||
Tabelle 1 Lichtbestrahlungsstärken erforderlich, um häufig verwendete Opsinen aktivieren.
Abkürzungen
AAV = adeno-assoziierten Virus
DPSS = diodengepumpten Festkörper
EYFP = verbesserte gelb fluoreszierende Protein
FC / PC = Flach spalten / Körperkontakt
GFP = grün fluoreszierende Protein
PBS = phosphatgepufferte Kochsalzlösung
PVC = Polyvinylchlorid
mW = Milliwatt
NA = numerische Apertur
SSFO = stabil Schritt-Funktion Opsin
TH = Tyrosinhydroxylase
TTL = Transistor-Transistor-Logik
V = Spannung
VTA = ventralen Tegmentum
Diskussion
Die aktuellen beschriebenen Laseraufbauten und Tethering Strategien sind mit einer breiten Palette von Nagetier Verhaltenstests kompatibel. In der Tat, eine Vielzahl von Verhaltenstests wurden folgende verwendet worden oder begleitenden, um in vivo optogenetische Stimulation, emotionale Verhaltens Aufgaben, Verhaltensanlage, Lernen und Gedächtnis Paradigmen, Schlaf, Erregung und appetitive Aufgaben gehören einige zu nennen (siehe Nieh et al. 6 eine umfassende Überprüfung). Optogenetik hat sich verändert die Art und Weise traditionelle Verhaltenstests werden, dass mehrtägige Untersuchungen durchgeführt, kann jetzt in einer einzigen Sitzung, in der Verhalten gegen kondensiert werden, Innersubjekt, während verschiedene Epochen des Lichts "auf" versus "off" 5. Zu beachten ist, Verhaltens-Apparate, die Türen enthalten, geschlossene Fächer oder andere Hindernisse müssen möglicherweise geändert werden, um Durchgang der angebundenen Fasern unterzubringen.
Die beschriebene Tethering Strategien Genehmigung sizeitigen Stimulation von mehreren Mäusen aus einem einzigen Laser. Hoher Durchsatz optogenetische Verhaltenstests kann somit durch die Verwendung mehrerer Laser und Prüfeinrichtungen erreicht werden. Die Zahl der Tiere, die gleichzeitig stimuliert werden können, wird jedoch durch die maximale Lichtleistung, die in jeder Faserspitze erreicht werden kann, begrenzt werden. Maximale Ausgangsleistung an der Faserspitze ist von der 1) Ausgangsleistung des Lasers; 2) die Kopplungseffizienz und 3) Anzahl von Strahl Splits. Für eine 100 mW blau Laser mit ~ 80% Kopplungseffizienz und bis zu 4 Strahl spaltet (wie in 4C dargestellt), Durchschnittsleistung an der Faserspitze kann zwischen 5-10 mW bei der Verwendung von 200 & mgr; m-Kern, 0,22 NA Faser Patchkabel reichen (nb erwarten Transmissionsverlust von Drehverbindungen bis 15% <). Messlichtleistung an der Faserspitze ist von wesentlicher Bedeutung für die Bestimmung ausreichende Lichtleistung für Opsin Aktivierung als Opsinen unterscheiden sich in ihrer Empfindlichkeit gegenüber Licht und damit die Lichtleistungsdichte (mW/ Mm 2) für die Aktivierung 11 erforderlich. Zum Beispiel kann die stabile Sprungfunktions Opsin (SSFO) als ein Photon Akkumulator und benötigt daher nur sehr wenig Lichtleistungsdichte für die Aktivierung (<8 uW / mm 2) 8. Vergleichen Sie dies mit den traditionellen Kanal Rhodopsin (ChR2), die ein Minimum von 1 mW / mm 2 Licht um Aktionspotentiale auslösen erfordert 2. Tabelle 1 ist als Kurzreferenz für bekannte erforderlich, um die am häufigsten Opsinen derzeit aktivieren minimale Lichtbestrahlungsstärken zur Verfügung gestellt verwenden. Schließlich muss man bedenken, dass die Licht streut und absorbiert, wie es durch Hirngewebe bewegt, so dass mehr Lichtleistung wird für tiefere Hirnstrukturen 3 erforderlich. Eine nützliche Online-Ressource finden Sie unter http://www.stanford.edu/group/dlab/cgi-bin/graph/chart.php dass die Lichtintensität in verschiedenen Tiefen durch Hirngewebe, indem sie in die Berechnung wirdKonto des Faserkerngröße, numerischen Apertur, der Wellenlänge des verwendeten Lichts, und das Ausgangslichtleistung an der Faserspitze. Für einen guten Überblick über die theoretischen Grundlagen zugrunde gelegten Berechnungen finden Foutz et al. (2012) 12. Beispiele dafür, wie diese Prinzipien und Berechnungen zur experimentellen Design gelten, sind in Aravanis et al (2007) 3 Tye et al. (2012) 13 gezeigt. Und. Durchführen dieser Berechnungen vor dem Beginn eines Experiments ist entscheidend, um eine ausreichende Lichtbestrahlung für Opsin Aktivierung sicherzustellen. Unter diesen Gesichtspunkten ist es vorteilhaft, eine höhere Leistungslasern erhältlich angemessene Leistung zu gewährleisten. Laser mit einer Leistung von 100-200 mW sind im allgemeinen ausreichend, um kleine Kern-Fasern, Mehrfaserspaltkopplungs Ineffizienz zu kompensieren und Übertragung verliert 7. Bei Verwendung von Hochleistungslasern jedoch darauf zu achten, die Nervenzellen Schaden oder Wärme und Licht-Mitarbeiter zu vermeidend Artefakte, die bei längerem und / oder Hochleistungs-Lichtbeleuchtung 7 auftreten können. Ein sicherer Bereich für in vivo-Experimente ist bis zu 75 mW / mm 2. 14
Die Entscheidung über die Art des Lasers erhältlich sind eine komplizierte Angelegenheit, da es viele Faktoren zu berücksichtigen sein. Zum Beispiel direkte Diodenlaser stabiler und wiederholbarer gepulste Ausgangs als dies diodengepumpter Festkörper- (DPSS) Laser und sind im Laufe der Zeit in einer Testumgebung, viel zuverlässiger. In einigen Fällen jedoch, Direkt Diodenlaser, eine niedrigere Lichtleistung, ~ 0,1 mW zu emittieren, selbst wenn die Steuerspannung 0 V aufgrund einer konstanten Vorstrom zu der Diode mit der Lasersteuerelektronik geschickt. Diese "spontane" Emissions hat ein breiteres Spektrum als tut Laseremission aus dem gleichen Laser, so kann gezielt durch den Einbau eines schmalen Bandpass (oder "cleanup") Filter zwischen dem Laser und Koppler (siehe Teilliste) reduziert werden. Dieser Filter wird auchreduzieren Leistung von ca. 50% bei der Laser, so kaufen Sie eine höhere Leistungslaser entsprechend. Es sei darauf hingewiesen, dass Gelb DPSS-Laser sind extrem empfindlich und können fehlerhaft verhalten und haben die Lebensdauer verringert, wenn sich schnell von einem Impulsgeber moduliert werden. Einstellung der gelben Laserleistung sollte durch externe Dichtefilter Räder im Strahlengang (Abschnitt 1.7) angeordnet während des Betriebs des Lasers in TTL + Modus durchgeführt werden. Alternativ Kauf einer grünen 532 nm DPSS-Laser ist eine kostengünstige Alternative, die sowohl halorhodopsins und archaerhodopsins aktivieren können.
Die numerische Apertur (NA) einer Faser ist wichtig, die bei der Gestaltung und Kauffaserkomponenten für die Laseranordnung Aufbaus. Die NA einer Lichtleitfaser bestimmt die Winkel der Lichtstrahlen, die akzeptiert und an der Spitze einer Faser emittiert werden kann. Wenn ein höherer NA Faser einer unteren NA Faser gepaart werden, erhebliche Verluste an dieser Grenzfläche auftritt, so ist es wichtig, eine konsistente wi sein th Faser NA in einer Aufspannung (oder um sicherzustellen, dass die NA erhöht entlang des Lichtwegs). Die Wirkung der Faser NA auf das Volumen des Hirngewebes beleuchtet ist weniger wichtig, da Hirngewebe ist stark streuende und da das Licht von einer Laserquelle verbunden wird, um "Unterfüllung" Fasern mit großer NA neigen; jedoch optische Fasern mit einer NA von 0,22 und 0,37 sind weit verbreitet. In ähnlicher Weise koppelt von einem größeren auf einen kleineren Kernkernfaser wird auch zu erheblichen Verlusten führen, also immer sicher sein, zu erhöhen oder gleich einem Kerndurchmesser zu verwenden, wenn fortschreitend von der Laserquelle an das Tier Implantat. Allgemein kann festgehalten, sollten Faserenden immer verschlossen sein, wenn nicht in Gebrauch ist, um Staub und Partikel Stau zu vermeiden. Es ist eine gute Idee, regelmäßig zu reinigen Faserenden und Steckverbindungen (70% Isopropylalkohol funktioniert gut) bis zur maximalen Lichtleistung zu gewährleisten und Lichtleistung durch einen "Dummy-Implantat" vor Beginn jeden Tag der Experimente zu testen.
"> In Verhaltenstests, zwingend notwendig, dass Maßnahmen ergriffen, um die Auswirkungen der Virusinfektion, exogene Proteinexpression, sichtbares Licht, und mögliche Gewebeerwärmungseffekte und Artefakte auf das Verhalten der Tiere zu kontrollieren ist. Daher ist die richtige Kontrollgruppe von Tieren bestehen mit einem Kontrollvirus transduziert (zB GFP, EYFP mCherry), die identische Lichtstimulationsparameter zu empfangen. Experimentelle Verifizierung ist eine entscheidende letzte Schritt, wie die Verhaltensdaten für die Analyse verwendet wird, ist vollständig abhängig von geeigneten Opsin und faseroptische Anordnung in der Region von Interesse . Insbesondere bei Tieren, wo keine immunhistochemische Signal erkannt wird, oder wenn die Platzierung des Signals oder Faser ist nicht in der interessierenden Region, so Verhaltensdaten für das Tier sollte aus dem Test entfernt werden. Außerdem ist es wichtig, um die Lichtleistung zu testen der Faserspitze, sowohl vor der chirurgischen Implantation wieder post-mortem, um eine ausreichende Lichtleistung für Opsin-Aktivierung zu gewährleisten. In animals denen starke Lichtverlust wurde durch die Faser nach dem Experiment aufgetreten ist (> 30%) 9, sollten die Daten für dieses Tier zur Entfernung berücksichtigt werden. Kriterien für die Entfernung a priori festgelegt werden. Schließlich muß man die erforderlich ist, um neuronale Feuern zu modulieren Pulsfrequenz, die auf der Struktur des Gehirns und neuronaler Subtypen abhängen wird gezielt berücksichtigen. Veröffentlicht optogenetische Lichtstimulationsparameter existieren für mehrere neuronale Subtypen sollte jedoch die Fähigkeit, neuronale Feuern modulieren unabhängig voneinander durch in vivo oder Hirnschnittelektrophysiologischen Ableitungen bestätigt werden.Wie wird man geschickt mit Laser Verwendung und Modifizierung von Laseraufbauten können auch Kombinationen verschiedener Wellenlängen, um mehrere Fasern an einem einzigen Tier angebunden oder unten die gleiche Faser geliefert für die kombinatoOptoGenetik 8 werden. Multi-Wellenlängen-Stimulation wird immer wichtiger angesichts der rasanten Entwicklung der Rotverschiebunged Channelrhodopsinen 8, das Engineering von blauverschoben hyperpolarisierende Opsinen 15, die Verwendung von bistabilen Schritt-Funktion Opsinen 8,16,17, und die allgemeine Liste an Opsinen mit unterschiedlichen Aktivierungsspektren 11. Diese Erweiterung des optogenetische Toolbox wird die beispiellose Kontrolle über mehrere neuronale Subtypen sowohl innerhalb als auch zwischen Hirnregionen gestatten, ihre Rolle bei der Steuerung komplexer Verhaltenszustände bestimmen.
Offenlegungen
The authors have no conflicts of interest to report.
Danksagungen
These studies were funded by grants received from the NIH (MH082876, DA023988).
Materialien
| Name | Company | Catalog Number | Comments |
| 1. Laser Set-up | |||
| 100 mW 473nm or 488nm Diode Laser System , <2% Stability (quantity: 1) | Omicron | Luxx/Phoxx 473/488-100 | Optional accessory includes a remote control box with key switch and LED Display |
| 100 mW 594nm DPSS laser (quantity: 1) | Colbolt | 0594-04-01-0100-300 | 04-01 series yellow laser; sensitive to back reflection from fibers |
| 200 mW 532 nm DPSS laser; 5% power stability (quantity: 1) | Shanghai Lasers | GL532T3-200 | Cost-effective alternative to yellow DPSS laser for activation of halorhodopsins and archaerhodopsins |
| Non-contact style laser to multimode fiber coupler (quantity: 1) | OZ Optics | HPUC-23-400/700-M-20AC-11 | For use with dual laser set-up; Specs: 33 mm OD for 400 - 700 nm; FC receptacle, f = 20 mm lens with post mount laser head adapter #11 |
| Aluminum breadboard, 12" x 18" x 1/2", 1/4"-20 Threaded (quantity: 1) | Thorlabs | MB1213 | For dual laser system |
| Aluminum breadboard, 10" x 12" x 1/2". 1/4"-20 Threaded (quantity: 1) | Thorlabs | MB1012 | For single laser system |
| Aluminum breadboard, 4" x 6" x 1/2", 1/4"-20 Threaded (quantity: 2) | Thorlabs | MB4 | For blue laser; dual laser system |
| Compact variable height clamp, 1/4"-20 Tapped (quantity: 4) | Thorlabs | CL3 | |
| 3/4" stainless post (quantity: 1) | Thorlabs | TR075 | |
| 1" stainless post (quantity: 4) | Thorlabs | TR1 | |
| Post holder with spring-loaded hex-locking thumbscrew (quantity: 2) | Thorlabs | PH1 | |
| Pedestal Base Adapter (quantity: 3) | Thorlabs | BE1 | |
| Small Clamping Fork (quantity: 3) | Thorlabs | CF1253 | |
| Kinematic mount for 1" optics with visible laser quality mirror (quantity: 3) | Thorlabs | KM100-E02 | |
| Neutral filter density wheel (quantity: 1) | Thorlabs | NDC-50C-2M | |
| 1" Longpass dichroic mirror 50% (quantity: 1) | Thorlabs | DMLP505 | |
| Kinematic mount for 1" optics (quantity: 1) | Thorlabs | KM100 | For dichroic mirror |
| 20-piece hex wrench kit with stand (quantity: 1) | Thorlabs | TC2 | |
| 1/4"-20 cap screw and hardware kit (quantity: 1) | Thorlabs | HW-KIT2 | |
| Mounting base 1" x 2.3" x 3/8" (quantity: 1) | Thorlabs | BA1S | |
| FC/PC to FC/PC L-Bracket mating sleeve (quantity: 2) | Thorlabs | ADAFCB1 | Dual FC/PC L-bracket also available |
| Breadboard lifting handles (quantity: 3) | Thorlabs | BBH1 | |
| Ø1" Bandpass Filter, CWL = 450 ± 2 nm, FWHM = 10 ± 2 nm (quantity: 1) | Thorlabs | FB450-10 | For use with diode lasers that spontaneously emit |
| 2. Laser Coupling | |||
| ! Laser protective eyewear (quantity: 1 for every user at each wavelength) | Various | ! Consult with laser provider to ensure proper selection of eyewear that will provide maximal light attenuation for the purchased laser | |
| Fiber optic cable tester (quantity: 1) | Eclipse | 902-186N | |
| One-step fiber connector cleaner (quantity: 1) | Thorlabs | FBC1 | |
| Coupler patch cord (0.75 meter) (quantity: 1) | Thorlabs | 0.75 m 200 μm core, 0.22 NA, FC/PC connectors multimode fibers; for dual laser system | |
| Coupler patch cord (0.5 meter) (quantity: 1) | Thorlabs | 0.5 m 200 μm core, 0.22 NA, FC/PC connectors, multimode; for single laser system | |
| Doric mini cube (quantity: 2) | DORIC | DMC_1x2_FC-2FC | |
| Compact power and energy meter console (quantity: 1) | Thorlabs | PM100D | Digital 4" LCD |
| C-series slim power sensor 5 - 500 mW (quantity: 1) | Thorlabs | S130C | Multiple detectors types are available; check with vendor |
| 3. In vivo Optogenetic Stimulation | |||
| Multimode fiber splitters (quantity: 2) | FONT Canada | Large core fiber optic 1 x 2 splitter, 50/50 ratio, FC connectors, ruggedized. Length, core size and numerical aperture can be specified when ordering; cost-effective smaller core sizes available | |
| Arbitrary waveform function generator (2 channel) (quantity: 1) | Rigol | DG1022 | Can control up to 2 lasers at once |
| Fiber optic rotary joint (commutator) (quantity: 6 - 8) | DORIC* | FRJ_1X1_FC-FC | *Also available through Thorlabs and Prizmatix |
| Animal patch cords (Custom Mono Fiberoptic Cannula with 10mm ferrules, FC/PC connector) (quantity: 8) | DORIC | MFP_200/240/900-0.22_2m_FC-MF2.5 | Length, core size and numerical aperture can be specified when ordering; alternatively, these can be made custom made in-house (see Sparta et al. 2012)9. |
| PFP ceramic split sleeve, 2.5mm ID, 11.40mm length (25/pkg) (quantity: 1) | Precision fiber Products | SM-CS1140S1 | Used for attaching implanted fiber optic on animal to a light-delivering fiber patch cord with flat cleeve (FC) end |
| Clear dust caps for Ø2.5 mm ferrules (25/pkg) (quantity: 1) | Thorlabs | CAPF | |
| Metal cap for FC/PC and FC/APC mating sleeves (quantity: 1) | Thorlabs | CAPF1 | |
| Thick-jacketed patch cords (custom order) (quantity: 4) | Thorlabs | 200 μm core, 0.22 NA, FC/PC connectors multimode fibers; length, core size, and numerical aperture can be specified when ordering | |
Referenzen
- Zhang, F., et al. The microbial opsin family of optogenetic tools. Cell. 147, 1446-1457 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. J Neural Eng. 4, S143-156 (2007).
- Sidor, M. M. Psychiatry's age of enlightenment: optogenetics and the discovery of novel targets for the treatment of psychiatric disorders. J Psychiatry Neurosci. 37, 4-6 (2012).
- Tye, K. M., Deisseroth, K. Optogenetic investigation of neural circuits underlying brain disease in animal models. Nat Rev Neurosci. 13, 251-266 (2012).
- Nieh, E. H., Kim, S. Y., Namburi, P., Tye, K. M. Optogenetic dissection of neural circuits underlying emotional valence and motivated behaviors. Brain Res. 1511, 73-92 (2013).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71, 9-34 (2011).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature. 477, 171-178 (2011).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nat Protoc. 7, 12-23 (2012).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Res. 1511, 21-32 (2013).
- Mattis, J., et al. Principles for applying optogenetic tools derived from direct comparative analysis of microbial opsins. Nat Methods. 9, 159-172 (2012).
- Foutz, T. J., Arlow, R. L., McIntyre, C. C. Theoretical principles underlying optical stimulation of a channelrhodopsin-2 positive pyramidal neuron. J Neurophysiol. 107, 3235-3245 (2012).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using cell-type-specific expression of Channelrhodopsin-2. Nat Protoc. 5, 247-254 (2010).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463, 98-102 (2010).
- Diester, I., et al. An optogenetic toolbox designed for primates. Nat Neurosci. 14, 387-397 (2011).
- Berndt, A., Yizhar, O., Gunaydin, L. A., Hegemann, P., Deisseroth, K. Bi-stable neural state switches. Nat Neurosci. 12, 229-234 (2009).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. J Vis Exp. , e50004(2012).
- Gunaydin, L. A., et al. Ultrafast optogenetic control. Nat Neurosci. 13, 387-392 (2010).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96, 1803-1814 (2009).
- Gradinaru, V., et al. Molecular and cellular approaches for diversifying and extending optogenetics. Cell. 141, 154-165 (2010).
- Goshen, I., et al. Dynamics of retrieval strategies for remote memories. Cell. 147, 678-689 (2011).
- Han, X., et al. A high-light sensitivity optical neural silencer: development and application to optogenetic control of non-human primate cortex. Front Syst Neurosci. 5 (18), (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten