Method Article
Mikrowellen-unterstützte Funktionalisierung von Poly (Ethylenglycol) und On-Harz Peptide zur Verwendung in Kettenpolymerisationen und Hydrogelierung
In diesem Artikel
Zusammenfassung
Dieses Video wird eine schnelle, effiziente Methode, um Poly (Ethylenglycol) Methacrylat veranschaulichen, so dass Kettenpolymerisationen und Hydrogel-Synthese. Es wird gezeigt, wie Methacrylamids Funktionalitäten ähnlich vorstellen in Peptide, Detail gemeinsamen analytischen Methoden zur Funktionalisierung Effizienz zu bewerten, bieten Anregungen zur Problembehebung und erweiterte Modifikationen und zeigen typische Hydrogel Charakterisierungstechniken.
Zusammenfassung
Einer der Hauptvorteile der Verwendung von Poly (ethylenglycol) (PEG)-Makromeren in Hydrogelbildung synthetisch vielseitig. Die Möglichkeit, aus einer Vielzahl von PEG Molekulargewichte und Konfigurationen zu ziehen (Arm Zahl-, Arm-Länge und Verzweigungsmuster) bietet Forschern eine strenge Kontrolle über entstandene Hydrogel Strukturen und Eigenschaften, einschließlich der E-Modul und Maschenweite. Dieses Video wird eine schnelle, effiziente, lösungsmittelfrei, Mikrowellen-unterstützte Methode, um PEG-Vorläufern in Poly (Ethylenglycol) Dimethacrylats (PEGDM) Methacrylat illustrieren. Dieses synthetische Methode bietet dringend benötigte Ausgangsstoffe für Anwendungen in der Medikamentenabgabe und der regenerativen Medizin. Die nachgewiesene Methode ist den herkömmlichen Methoden Methacrylierung wie es ist deutlich schneller und einfacher sowie kostengünstiger und umweltfreundlich, mit kleineren Mengen von Reagenzien und Lösungsmittel. Wir werden auch eine Anpassung dieser Technik für on-Harz methacr demonstrierenylamid Funktionalisierung von Peptiden. Diese auf dem Harz erlaubt es, den N-Terminus von Peptiden mit Methacrylamid-Gruppen vor der Entfernung der Schutzgruppen und Abspaltung vom Harz funktionalisiert werden. Dies ermöglicht die selektive Zugabe von Methacrylamid-Gruppen an den N-Termini der Peptide während Aminosäuren mit reaktiven Seitengruppen (z. B. primäre Amin von Lysin-, primären Alkohol von Serin, Threonin sekundärer Alkohole und Phenol von Tyrosin) geschützt bleiben, verhindert Funktionalisierung an mehreren Stellen. Dieser Artikel wird ausführlich gemeinsamen analytischen Methoden (Protonenkernresonanz-Spektroskopie (; H-NMR) und Matrix-Assisted Laser Desorption Ionisation Time of Flight-Massenspektrometrie (MALDI-ToF)), um die Effizienz der Funktionalisierung zu beurteilen. Häufige Fehlerquellen und Methoden zur Problembehandlung vorgeschlagen werden angesprochen, ebenso wie Modifikationen der Technik, die zu weiteren Melodie Macromer Funktionalität genutzt werden kann und die daraus resultierenden Hydrogel physikalischen und chemischenEigenschaften. Verwendung von Syntheseprodukte für die Bildung von Hydrogelen für Drug-Delivery-und Zellstoffwechselwirkungsstudien nachgewiesen werden kann, mit besonderem Augenmerk auf die Änderung Hydrogel-Zusammensetzung zu Maschenweite beeinflussen, Controlling Hydrogel Steifigkeit und Wirkstofffreisetzung bezahlt.
Einleitung
Poly (Ethylenglycol) (PEG)-Hydrogele sind häufig Biomaterialien in der regenerativen Medizin und Drug-Delivery-Anwendungen 3.1 verwendet. Diese Hydrogele bieten erhebliche Vorteile gegenüber anderen Biomaterialien. PEG-Hydrogele sind synthetische und bietet ein hohes Maß an Kontrolle über technischen Eigenschaften wie E-Modul und Abbaurate im Vergleich zu ihren natürlichen Gegenstücke ein Biomaterial. Da sie synthetisch abgeleitet werden, hat PEG deutlich weniger von Charge zu Charge Variabilität gegenüber natürlich gewonnenen Materialien 4. Aufgrund der chemischen Zusammensetzung des PEG, sind diese stark hydrophile Hydrogele, resistent gegen Proteinadsorption und biokompatiblen 3. Dieser Widerstand gegen Proteinadsorption erlaubt PEG-Hydrogele als ein "unbeschriebenes Blatt" zu handeln, so dass die Forscher befragen und untersuchen spezifische biologische oder chemische Faktoren (Drogen, Biomoleküle, Zelladhäsion Peptide, etc.) und die spezifischen Rollen, die diese factors spielen bei der Kontrolle der Zell-und / oder Gewebeverhalten.

Klicken Sie hier für eine größere Ansicht .
Abbildung 1: Beispiele für Poly (ethylenglycol) (PEG)-Architekturen A) lineare PEG B) 4-arm PEG mit einem Kern Pentaerythrit C) 8-Arm-PEG mit einem Hexaglycerin Kern D) 8-Arm-PEG mit einem.... Tripentaerythritol Kern. n ist die Anzahl von PEG wiederholt an jedem Arm. Jede Wiederholung ein Molekulargewicht von 44 g / mol, also n von dem Gesamtmolekulargewicht und die Struktur / Arms berechnet werden.
PEG-Vorstufen sind mit einer Vielzahl von Architektur und Molekulargewichte (Abbildung 1 ). Verändern der Architektur (Arms) und Ethylenglykol Wiederholungen (n) von PEG verwendet werden, um Eigenschaften des Hydrogels Netzwerke aus diesen Makromeren gebildet steuern. Unmodifizierten PEG endständige Hydroxylgruppen, die mit einer alternativen Funktionalität ersetzt werden müssen, um eine kovalente Vernetzung durch Polymerisation, die am häufigsten eingesetzten Vernetzungsstrategie für PEG-Hydrogele vor der Bildung des Hydrogels Netzwerken zu erleichtern. Es gibt eine Vielzahl von chemischen Gruppen, die in PEG-Makromere eingebaut ist, um die Polymerisation und Vernetzung Netzwerk (Acrylat-, Methacrylat-, Vinylether-, Norbornen, etc.) erleichtern. Trotz der Vielfalt der terminalen Funktionalitäten zur Verfügung, um die Vernetzung zu erleichtern, gibt es nur zwei Mechanismen, durch die Polymerisation auftreten können: Schritt-und Kettenwachstum (oder ein Gemisch der beiden, Mixed-Mode).
g2.jpg "width =" 600px "/>
Klicken Sie hier für eine größere Ansicht .
Abbildung 2:.. Theoretische Hydrogel-Netz schema A) Traditionelle Kettenwachstumspolymerisation Ergebnisse in heterogenen Netzwerken mit dichten Poly (methacrylat) Vernetzungs Regionen und erhöhte Netzwerkidealitäten wie Schleifen, nicht umgesetztes Vorläufer und Dauer Verstrickungen B) Schritt-für Wachstum Polymerisation Ergebnisse in deutlich homogenere Netzwerkstrukturen (nicht maßstabsgetreu).
Funktionalitäten, die über Kettenwachstums-Polymerisation vernetzen erfordern nicht die Anwesenheit eines zusätzlichen Vernetzers. Allerdings Ketten polymerisiert Hydrogele heterogenen Netzwerkstrukturen, die dichte Vernetzung Regionen (2A) ein. Im Gegensatz dazu Stufenwachstums Polymerisation Erforres die Verwendung eines Vernetzungsmittels oder Co-Monomer, das mit den endständigen funktionellen Gruppen der reaktiven PEG-Makromere ist. Da die endständigen funktionellen Gruppen an der PEG kann nur reagieren mit dem Vernetzungsmittel und das Vernetzungsmittel kann nur mit den terminalen funktionellen Gruppen des PEG reagieren, führt dies zu größeren Netzwerkstruktur Homogenität (2B) 1. Schritt-für Wachstum Polymerisationen in der Regel auch zu höheren Umwandlung von funktionellen Gruppen führen, die Verringerung der Menge an nicht umgesetzten Ausgangsstoffen und Potenzial für Immun / Entzündungsreaktionen durch lösliche, nicht eingetragene Macromere ein. Mixed-Mode-Polymerisation Methoden wurden entwickelt, die sowohl die Schritt-und Kettenwachstums Polymerisation durch die Verwendung von Makromeren, die sowohl selbst reagieren können (Kettenwachstum) und mit einem Vernetzer (Schritt-Wachstum) reagieren zu kombinieren. Dies erzeugt Hydrogele mit Charakteristiken jedes Polymerisationsmechanismus und können komplexere, verschiedene Netzstrukturen verwendet werden als entwederSchritt-oder alleine ein Kettenwachstums Netzwerken.
Zwar gibt es eine Vielzahl von funktionellen Gruppen, die verwendet werden können, um PEG zu funktionalisieren und Hydrogel-Bildung zu erleichtern, sind einige der häufigsten Ketten und Stufenwachstums-Polymerisation Reste jeweils Methacrylate und Norbornene. Beide Funktionalitäten bieten hervorragende raumzeitliche Kontrolle über Netzwerk-Polymerisation, und wenn verwendet, um Zellen zu verkapseln, diese Netzwerke zu unterstützen hohe Gesamtzelllebensfähigkeit 7.5. Dimethacrylat funktionalisierte PEG (PEGDM) Vernetzungs über Ketten Polymerisation und ermöglicht die Aufnahme von Biomolekülen oder anderen Faktoren durch Copolymerisation mit Acrylat-, Methacrylat-oder ähnlich funktionalisierten Biomolekülen 5,6. PEGDM Hydrogele weisen deutliche Vorteile gegenüber alternativen Kettenwachstumspolymerisation Systeme wie Acrylat-funktionalisiertes PEG (PEGDA). Mit traditionellen Methoden kann PEGDA schneller hergestellt werden als PEGDM; hoWever, mit Mikrowellen-unterstützte Synthese ist PEGDM Synthese noch effizienter. PEGDA ist oft über Nacht in 8 oder 24 h 9 Reaktionen synthetisiert, kann aber auch in vier Stunden bei erhöhten Temperaturen 10 synthetisiert werden. PEGDM traditionell auch durch Reaktion über Nacht für 11 oder 24 h 5 synthetisiert, mit der einige Methoden zur Verlängerung der Reaktionszeit auf 4 Tagen 12. Mit dem Mikrowellen-unterstützte Methode, die hier gezeigt hat, kann PEGDM in einem 5-min-Reaktion hergestellt werden. Während PEGDM langsamer Reaktionskinetik als PEGDA 13 ist die Vernetzungsreaktion noch zur schnellen PEGDM in Minuten auftritt, und erreicht eine höhere Umwandlung als Makromer PEGDA als die erhöhte Hydrophobie der Methacrylatgruppe erhöht funktionelle Gruppe Aggregation in Lösung, wodurch die Wahrscheinlichkeit zu erhöhen Radikalüber-und Methacrylat-Umwandlung 14. PEGDM Hydrogele sind ebenfalls mit einem erhöhten Zelllebensfähigkeit und Wachstum verbundenPEGDA-Hydrogele im Vergleich zu, wahrscheinlich wegen der Abnahme der Reaktionsgeschwindigkeit zu einem bestimmten Zeitpunkt, die Radikalkonzentration und 14 nicht umgesetzte vorliegenden Makromeren reduziert. Thiol-En-Polymerisation, wie sie mit Norbornen-funktionalisierte PEG (PEGN) bilden Hydrogele durch Stufenwachstum-Polymerisation und die Verwendung von PEGN und ein Vernetzungsmittel, das durchschnittlich mehr als zwei funktionelle Gruppen enthalten. Da Thiylradikalen reagieren mit Norbornen Kohlenstoff-Doppelbindungen, multi-thiol enthaltenden Vernetzer werden üblicherweise verwendet, um PEGN Hydrogele zu vernetzen, was eine leichte Einarbeitung von Peptiden mit Cystein Aminosäuren Funktionalitäten 7. Zwar gibt es zahlreiche andere Chemikalien, die über Stufenwachstum-Polymerisation reagieren (Michael-Additionsreaktionen wie Thiol-Acrylat 15 und Thiol-Vinylsulfon 16 "auf" Reaktionen wie Alkin-Azid-17 etc.), Thiol-Norbornen-Hydrogele sehr häufig, wie der Stamm ausdie Norbornenring die Reaktionsgeschwindigkeit deutlich erhöht und verringert die Chance der Norbornen-Doppelbindung unterzieht Kette 7 Polymerisation.
Die Entscheidung zwischen Methacrylat, Norbornen, oder alternative Funktionalisierung Hydrogelbildung erleichtern, ist weitgehend von der Ansatz. Zum Beispiel sind Kettenwachstums polymerisierten PEGDM Netzwerke nachgewiesen als gut geeignet, um die Zelllokalisierung in der Entwicklung eines Tissue-Engineering Periost 18,19 steuern. Stufenwachstums polymerisiert PEG-Netzwerke sind für den Einbau von Peptidsequenzen enzymatisch ansprechenden Hydrogel Abbau erleichtern besser geeignet, wegen der Leichtigkeit der Einarbeitung des Enzym-Substrat-Sequenzen unter Verwendung von Thiol (Cystein) und Norbornen enthaltenden Peptiden funktionalisierten Makromere 20. Wenn die Forschungsfrage wird am besten durch den Einsatz von Stufenwachstums Hydrogele angesprochen werden, Fairbanks et al. Liefert eine detaillierte Beschreibung des Norbornennene Funktionalisierung Strategie für PEG-7. Dieses Papier wird ausführlich, wie PEG-und Peptid-Sequenzen funktionalisiert werden können (mit einem Methacrylat für PEG und eine Methacrylamids für Peptide) für Ketten Polymerisationsreaktionen.
Traditionell wird PEGDM durch Umsetzung mit PEG Methacryloylchlorid und Triethylamin in Dichlormethan hergestellt. Die Reaktion wird bei Raumtemperatur über Nacht für 11 oder 24 h fortschreiten 5, bei einigen Verfahren die Reaktionsdauer verlängert bis 4 Tage 12 vor der Filtration, Fällung in Diethylether und Sammlung. Während viele Variationen dieses Ansatzes bestehen, sind alle zeitaufwendig, erfordern eine große Auswahl an chemischen Synthesetechnik und sind nicht umweltfreundlich, da sie die Verwendung von relativ großen Mengen von hochreinen Reagenzien und Lösungsmittel umfassen. Um diese Einschränkungen zu umgehen, Lin-Gibson et al. Entwickelte eine Mikrowellen-unterstützte, lösemittelfreie Methode, um mit PEG te funktionalisieren rminal Methacrylatgruppen (3A) 12. Bei dieser Reaktion, die endständige Alkoholgruppen des PEG mit einer der Carbonylgruppen Atome des Methacrylsäureanhydrid umgesetzt, um eine Carboxylgruppe zu bilden. Dies erzeugt das Produkt PEGDM mit Methacrylsäure als Nebenprodukt. Diese Synthese hat viele der charakteristischen Vorteile der Mikrowellensynthese, einschließlich der Verringerung der Reaktionszeit und lösungsmittelfreie Synthese-Verfahren 21. Die Mikrowellensynthese ist bevorzugt, die zuvor diskutierten Verfahren, wie es ist wesentlich schneller, benötigt weniger umfangreichen Synthesegeräte (z. B. Glaswaren, Reaktionsplatten) und verwendet insgesamt weniger Reagenz und als Lösungsmittel Lösungsmittelmengen werden nur für die Produktreinigung / Sammlung und nicht erforderlich für Synthese, so dass es wirtschaftlich und umweltfreundlich.
0px "/>
Klicken Sie hier für eine größere Ansicht .
Figur 3:.. Funktionalisierung Schemata A) Poly (ethylenglycol) ist mit 10fach molaren Überschuß Methacrylsäureanhydrid, um Poly (ethylenglycol) methacrylat B) Das gleiche Verfahren kann verwendet werden, um den N-Terminus der Peptid-Sequenzen funktionalisiert werden umgesetzt, wodurch ein Methacrylamid funktionalisierten Peptids. Durch Ausführen dieser Prozedur vor der Abspaltung des Peptids von dem Harz kann eine selektive Funktionalisierung der N-Terminus als Aminosäure-Seitengruppen geschützt bleiben durchgeführt werden. n: Anzahl der PEG wiederholt in Makromer (n = 45,5, 227 und 455, jeweils für die 2, 10 und 20 kDa linearen PEG verwendet werden). R1 bis RN: Aminosäure-Seitenketten. PG1 PGN: Seitenkettenschutzgruppen. TFA: Trifluoressigsäure. Tipps: Triisopropylsilan. Dodt: 3,6-dioxa-1 ,8-octanedithiol. H 2 O: Wasser.
Die Mikrowellen-unterstützte Methacrylierung Methode wurde kürzlich von unserer Gruppe geeignet ist, die N-Terminus von Peptiden mit Methacrylamid-Gruppen (3B) zu funktionalisieren, um Peptid Einbau in eine Vielzahl von Polymeren und Polymernetzwerke zu ermöglichen. Bei dieser Reaktion wird das primäre Amin des N-Terminus des Peptids reagiert mit dem Carbonyl-Atom am Methacrylsäureanhydrid, um ein Amid zu bilden. Dies erzeugt das Methacrylamid funktionalisierten Peptid, mit Methacrylsäure als Nebenprodukt erzeugt. Bei Verwendung dieses Verfahrens, um die N-Terminus-Peptid-Sequenzen zu funktionalisieren, ist es wichtig, dass die Aminosäuren mit reaktiven Seitenketten (primären Aminen (Lysin), Alkohole (Serin, Threonin) und Phenole (Tyrosin)) während der Funktionalisierung geschützt sind, und Schutzgruppen werden nur nach Methacrylamid Einbau abgespalten.
In diesem Artikel werden diese beiden microw zeigenave-unterstützte Methoden zur Synthese und Funktionalisierung PEGDM am Harz Peptidsequenzen, Hervorhebung häufigsten Fallstricke und schlägt Methoden zur Problembehandlung. In diesem Artikel werden Methoden zur analytischen chemische Techniken, die üblicherweise zur Funktionalisierung Produkt bewerten führen detailliert, und Anregungen und Ressourcen zur Durchführung von fortgeschrittenen Änderungen gegeben. Typische Ergebnisse demonstriert werden, die unter Verwendung der synthetisierten PEGDM Hydrogel Netzwerke zu bilden, die Nutzung der gebildeten Hydrogele zur Freisetzung von einem Modell der Drogenkontrolle und den Einsatz funktionalisierter Peptide an Zell-Hydrogel-Interaktionen erleichtern. Besonderes Augenmerk wird auf die Charakterisierung Hydrogel Maschenweite und diskutieren, wie Hydrogel-Zusammensetzung kann abgestimmt werden, um dieses zugrunde liegende physikalische Eigenschaft, die wiederum steuert Schüttguteigenschaften wie Steifigkeit und Arzneimittelfreisetzungsprofil zu beeinflussen bezahlt werden.
Protokoll
1. Mikrowellen-unterstützte Synthese von PEGDM
- Um eine Kontamination mit Wasser zu verhindern, ist vor allem trockene Glasgeräte in einem Ofen (> 60 ° C) für 1 Stunde verwendet.
Hinweis: Erforderliche Glaswaren beinhaltet: zwei 100-ml-Bechergläser, ein 250-ml-Becherglas, 3 Spatel, eine 250-ml-Büchner-Kolben, ein 7-cm-Büchner-Trichter, ein 10-cm-Uhrglas. - Pre-Chill 100-150 ml wasserfreiem Diethylether (74.12 g / mol) für die Fällung anschließend im Schritt 1.6, indem sie in ein Becherglas und deckt das Becherglas mit einem Uhrglas, und man das Becherglas in eine Rekristallisation Gericht mit Eis gefüllt durchgeführt. Bewegen Mikrowelle und Vortexer in einem Laborabzug.
Hinweis: Diethylether kann auch durch man das Becherglas in einem chemischen Gefrierfach vorgekühlt werden. Die untere Diethylether Temperatur durch Kühlen in einem Gefrierschrank erreicht wird die Geschwindigkeit und Effizienz von Niederschlag zu erhöhen. - In einem kleinen Wägeschiffchen abzuwiegen 5 g Poly (ethylenglycol) (PEG) der molekularenlar Gewicht Ihrer Wahl (1.000-100.000 Da).
- Falls vorhanden, entfernen Sie die Plastikstück aus dem Deckel des Szintillationsfläschchen. Tarieren Sie die Flasche, und verzichten 10 molaren Überschuß von Methacrylanhydrid in das Fläschchen (MA, 154.16 g / mol) pro Gleichung 1 in der Haube. In PEG auf die Szintillationsfläschchen.
 (1)
(1)
wo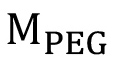 die Masse des PEG in g,
die Masse des PEG in g,  das Molekulargewicht von PEG in g / mol,
das Molekulargewicht von PEG in g / mol, 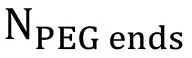 ist die Anzahl der endständigen OH-Gruppen auf dem PEG und
ist die Anzahl der endständigen OH-Gruppen auf dem PEG und 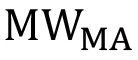 ist die molekularenlar Gewicht von MA in g / mol.
ist die molekularenlar Gewicht von MA in g / mol.
- Falls vorhanden, entfernen Sie die Plastikstück aus dem Deckel des Szintillationsfläschchen. Tarieren Sie die Flasche, und verzichten 10 molaren Überschuß von Methacrylanhydrid in das Fläschchen (MA, 154.16 g / mol) pro Gleichung 1 in der Haube. In PEG auf die Szintillationsfläschchen.
- Lose drehen die Kappe auf das Szintillationsfläschchen. Stellen Sie die Mikrowelle bis 5 min auf Höchstleistung. Tragen hitzebeständige Handschuhe, entfernen Sie das Fläschchen aus der Mikrowelle alle 30 Sekunden.
- Voll ziehen Sie die Kappe und Wirbel für 30 Sekunden. Wiederholen, bis die Lösung für die volle 5 Minuten in der Mikrowelle ist. Die Kappe muss möglicherweise während des Verfahrens aufgrund von Rißbildung ersetzt werden.
- Mit der Deckel gelöst, lassen Sie die PEGDM auf Raumtemperatur abkühlen. Löse den PEGDM in einer kleinen Menge (10-15 ml), Dichlormethan (DCM, 84.93 g / mol).
Hinweis: Es wird empfohlen, dass die PEGDM erlaubt deutlich (ca. 5 min) vor der DCM zusätzlich zu kühlen, um das Sieden des DCM (Verdacht, krebserzeugend) durch Restwärme zu verhindern. Die PEGDM können in kleine Stücke mit einem Spatel gebrochen und verwirbelt, um die Auflösung zu unterstützen. - Man fällt in die PEGDM 10x Über eiskaltem Diethylether für 20 min.
Hinweis: Es kann notwendig sein, um scRatch das Becherglas Seite mit einem Spatel um die Kristallbildung zu initiieren, um mit niedrigerem Molekulargewicht PEGs (2500 Da) ausfallen, jedoch PEG mit einem Molekulargewicht unter 1.000 Da wird trotz Kratzen auszufällen. - Verwendung eines Büchner-Trichters und eines Kolbens, sammeln die PEGDM durch Vakuumfiltration. Nicht filtern, um Trockenheit zu vervollständigen, da dies Wasser Adsorption an die PEGDM fördern.
Hinweis: Wenn die für die spezifischen Vakuumsystem verwendet wird, kann eine Vakuumfalle zwischen dem Filteraufbau und der Vakuumquelle, um die Vakuumpumpe vor Schäden durch Lösemitteldämpfe abgegeben werden. - Übertragen des gefilterten PEGDM zu einem 50 ml konischen Röhrchen mit einer großen Nadel durch die Kappe für die Belüftung durchbohrt. Speichern über Nacht in einer Vakuumkammer zum Trocknen.
- PEGDM in DCM wieder auflösen und wieder ausfallen (wie in den Schritten 1.5-1.7) als letzter Schritt an nicht umgesetztem MA zu entfernen. Trocknen wieder wie in Schritt 1.8.
2. Charakterisierung von PEGDM Funktionalisierung
- Verwendung von deuteriertem Chloroform (120,38 g / mol) als Lösungsmittel vorbereiten Proben für 1 H-NMR. Eine kleine Probe des PEGDM (≈ 10 mg) in einem Szintillations-Fläschchen mit einer kleinen Menge des Lösungsmittels (≈ 1,0 ml). Die Zielkonzentration von 10 mg / ml.
- Sobald die Probe gelöst ist, überträgt es auf eine saubere NMR-Röhrchen. Die Probe sollte die unteren 4-5 cm der NMR-Röhrchen zu füllen.
- Sammeln Sie die Protonen-NMR-Spektren. Unsere Daten wird unter Verwendung eines 400 MHz-Spektrometers gesammelt. Führen Proben bei Raumtemperatur für mindestens 64 Scans, um eine ausreichende Datenauflösung zu erhalten.
- Wenn NMR-Analyse (Fig. 4) zeigt PEGDM Funktionalisierung von weniger als 90%, sollte die Methacrylierung Verfahren wiederholt werden. Stellen Sie die Masse MA verwendet, um die verringerte Menge an nicht-funktionalisierten PEG-Konto.
Hinweis: Die Prozent PEG in PEGDM funktionalisierten kann aus der beobachteten berechnet: theoretische Verhältnis von endständigen methacrylate Protonen (a, b und c), um zentrale PEG Protonen (d) (Fig. 4). Für lineare PEG wird die theoretische Anzahl der zentralen PEG Protonen durch Gleichung 2 berechnet:
 (2)
(2)
wo 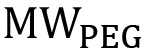 das Molekulargewicht des PEG in g / mol und
das Molekulargewicht des PEG in g / mol und 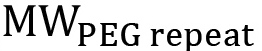 ist das Molekulargewicht eines einzelnen PEG Wiederholung (44 g / mol). Bei nichtlinearen PEG muß diese Gleichung modifiziert werden, um die spezifische Verzweigungsstruktur (Fig. 1) zu reflektieren. Die prozentuale Funktionalisierung kann dann unter Verwendung von Gleichung 3 werden:
ist das Molekulargewicht eines einzelnen PEG Wiederholung (44 g / mol). Bei nichtlinearen PEG muß diese Gleichung modifiziert werden, um die spezifische Verzweigungsstruktur (Fig. 1) zu reflektieren. Die prozentuale Funktionalisierung kann dann unter Verwendung von Gleichung 3 werden: 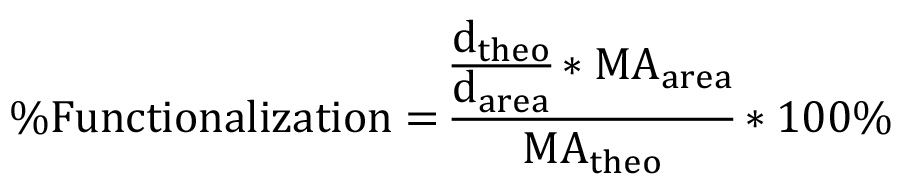 (3)
(3)
wo  ist die beobachtete Fläche unter Peak d (δ = 6,63 ppm),
ist die beobachtete Fläche unter Peak d (δ = 6,63 ppm), 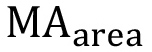 die beobachtete Fläche unter den Methacrylat Protonenpeaks (a, δ = 1,94 ppm, b und c, δ = 5.57 und 6.12 ppm), und
die beobachtete Fläche unter den Methacrylat Protonenpeaks (a, δ = 1,94 ppm, b und c, δ = 5.57 und 6.12 ppm), und 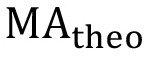 ist die theoretische Anzahl der Protonen-methacrylat (a = 3 *
ist die theoretische Anzahl der Protonen-methacrylat (a = 3 * 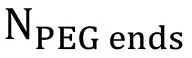 , B = 1 *
, B = 1 * 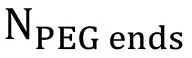 und c = 1 *
und c = 1 * 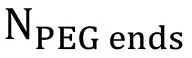 - 6, 2 bzw. 2 für lineare PEG). Die prozentuale Funktionalisierung Berechnung sollte mit Spitzen a, b Mittedurchgeführt werden und c getrennt und danned, um eine Gesamt Prozent Funktionalisierung erhalten.
- 6, 2 bzw. 2 für lineare PEG). Die prozentuale Funktionalisierung Berechnung sollte mit Spitzen a, b Mittedurchgeführt werden und c getrennt und danned, um eine Gesamt Prozent Funktionalisierung erhalten.
Hinweis: Ausreichend funktionalisierten PEGDM kann dann dialysiert werden (in Wasser, gegen Wasser) und durch Gefriertrocknung gesammelt, um Rest Methacrylanhydrid und Methacrylsäure entfernen. Das Endprodukt sollte mit einer kleinen Menge (0,01 Gew.%) der Inhibitor wie Zitronensäure oder Vitamin C gemischt und mit Trockenmittel bei -20 ° C bis zur Verwendung gelagert werden. Die endgültige PEGDM Produkt kann verwendet werden, um Hydrogele herzustellen, wie in dem Artikel von JoVE Khetan Burdick und 22 beschrieben.
3. Mikrowellen-unterstützte Funktionalisierung von On-Harz Peptide
Hinweis: Die Peptide werden unter Verwendung von Fmoc-Gly-Wang-Harz synthetisiert, unter Verwendung eines automatisierten Peptid-Synthesizers mit UV-Überwachung, und 0,2 M Aminosäurelösungen in N-Methylpyrrolidon (NMP, 99,1 g / mol). 5% Piperazin (86,1 g / Mol) in Dimethylformamid (DMF, 73,1 g / mol) für die Entfernung der Schutzgruppe verwendet wird, 0,5 M O-Benzotriazol-N, N, N ', N'-tetramethyl-uronium-hexafluoro-phosphat (HBTU, 379,3 g / mol) in DMF als Aktivator verwendet wird, und 2 M Diisopropylethylamin (DIEA, 129,3 g / mol) in NMP als Aktivator Basis verwendet. Peptide können auch von einem kommerziellen Peptid Lieferanten erhältlich. Bei der Verwendung von kommerziellen Quellen ist es entscheidend, dass Peptide auf dem Harz mit der Aminosäure-Seitenketten-Schutzgruppen intakt und nicht vollständig gespalten beschafft, als Standard.
Hinweis: Es ist wichtig, dass alle Aminosäuren mit reaktiven Seitenketten geschützt, um sicherzustellen, bei dem primären Amin des N-Terminus der Sequenz, Methacrylamid Funktionalisierung vorkommt. Siehe Tabelle 1 für Aminosäuren mit reaktiven Seitengruppen und typische Schutzgruppen. Aminosäuren mit Schutzgruppen werden während der Peptidsynthese in der gleichen Weise wie nicht geschützte Aminosäuren in die Sequenz eingebaut ist, und sind oft von der gleichen Aminosäure Lieferanten erhältlich.
| Aminosäure | Reaktive Gruppe | Schutzgruppe |
| Lysin | Primäre Amine | tert-Butyloxycarbonyl (Boc) |
| Serine | Primäre Alkohol | tert-Butyl (tBu) |
| Threonin | Sekundäre Alkohol | tBu |
| Tyrosin | Phenol | tBu |
Tabelle 1: Reaktive Aminosäuren und typische Schutzgruppen.
- Peptide zu synthetisieren, mit Standard-Festphasenpeptidsynthese, und speichern Sie auf Harz bei 4 ° C in DMF bis zur Verwendung.
- Mit einer 7 cm Büchner-Trichter mit Filterpapier und 250 ml-Kolben, sammeln das Peptid-Harz aus der DMF durch Filtration.
- Falls vorhanden entfernen Sie die Plastikstück aus dem Deckel des Szintillationsfläschchen. Übertragen des Harzes auf der Szintillationsampulle. Mit einer Einwegpipette, fügen gerade genug, MA, um das Harz in der Szintillationsfläschchen abzudecken.
- Locker legen die Kappe auf das Szintillationsfläschchen. Stellen Sie die Mikrowelle bis 3 min auf Höchstleistung. Tragen hitzebeständige Handschuhe, entfernen Sie das Fläschchen aus der Mikrowelle, alle 15-20 sek.
- Voll ziehen Sie die Kappe und Wirbel für 15 Sekunden. Wiederholen, bis die Lösung für die Zukunft der Mikrowelle erwärmt wordenll 3 min.
- Mit der Deckel gelöst, lassen Sie die Peptidlösung auf Raumtemperatur abkühlen. Verwendung einer kleinen Menge von DMF und einem Büchner-Trichter mit Filterpapier und Kolben zu sammeln, die das Peptid-Harz aus dem Fläschchen.
- Übertragen Sie das Peptidharz zu einem frischen Szintillationsfläschchen und spalten und Entschützung des Peptids.
- Per 0,25 mmol Harz, verwenden wir ein 2 Stunden bei Raumtemperatur Reaktion mit Drehung, mit einem Cocktail-Spaltung von 18,5 ml Trifluoressigsäure (TFA, 114.02 g / mol) mit je 0,5 ml Triisopropylsilan (TIPS, 158.36 g / mol), 3,6-Dioxa-1 ,8-octandithiol (Dodt, 182.30 g / mol) und VE-Wasser (18,02 g / mol).
Anmerkung: Dieser Cocktail ist ausreichend für die meisten Peptide, aber nicht zu entschützen 2,2,4,6,7-Pentamethyl-dihydrobenzofuran-5-sulfonyl (Pbf)-geschützten Aminosäuren (üblicherweise zur Arginin-Seitenketten zu schützen). Wenn die Sequenz keine Pbf-geschützten Gruppen sollte 0,5 ml TFA mit 0,5 ml Thioanisol (124 ersetzt werden.20 g / mol) und Abspaltung der Zeit erhöht, um 4 Stunden.
Hinweis: Wenn eine trübe, kristalline Substanz bildet sich in der Cocktail-Spaltung wird das Peptid wahrscheinlich Absturz aus der Lösung und dem Volumen der Spaltung Cocktail sollte verdoppelt werden.
- Per 0,25 mmol Harz, verwenden wir ein 2 Stunden bei Raumtemperatur Reaktion mit Drehung, mit einem Cocktail-Spaltung von 18,5 ml Trifluoressigsäure (TFA, 114.02 g / mol) mit je 0,5 ml Triisopropylsilan (TIPS, 158.36 g / mol), 3,6-Dioxa-1 ,8-octandithiol (Dodt, 182.30 g / mol) und VE-Wasser (18,02 g / mol).
- Chill-400 ml wasserfreiem Diethylether auf Eis in einem Becherglas mit Uhrglas abgedeckt.
- Man fällt das Peptid in 10x Überschuss Diethylether, und teilen Sie die Lösung gleichmäßig auf vier 50 ml konischen Röhrchen. Zentrifuge bei 3200 g für 10 min, um das Peptid zu sammeln.
- Dekantieren Sie den Äther, und resuspendieren das Peptid in 100 ml frisch Diethylether zwischen zwei 50 m konische Röhrchen aufgeteilt. Wiederholen Sie die Zentrifugation, Resuspendieren in 50 ml frischem Ether zweimal für insgesamt 4 Äther Wäschen.
Hinweis: Dieses entfernt die Chemikalien in der Spaltungscocktails verwendet und abgespaltenen Schutzgruppen von dem festen Peptids.
- Dekantieren Sie den Äther, und resuspendieren das Peptid in 100 ml frisch Diethylether zwischen zwei 50 m konische Röhrchen aufgeteilt. Wiederholen Sie die Zentrifugation, Resuspendieren in 50 ml frischem Ether zweimal für insgesamt 4 Äther Wäschen.
- Nach dem letzten Zentrifugationsschritt, dekantiert die Abfall etsie und trocknen Sie das Peptid über Nacht unter Vakuum.
4. Charakterisierung von Peptid-Funktionalisierung
- Verwenden 50:50 H 2 O: Acetonitril (41.05 g / mol) + 0,1% TFA als Lösungsmittel für die MALDI-TOF-Analyse von Peptidproben. Eine kleine Probe (1 - 2 mg) des Peptids in ein 1,5 ml Eppendorf-Röhrchen und die Probe in 1 ml MALDI Lösungsmittel zu lösen.
- Bereiten Sie die Matrix-Lösung. Eine üblicherweise verwendete Matrix α-Cyano-4-Hydroxyzimtsäure (CHCA, 189,2 g / mol) als Matrix. Lösen Sie 10 mg / ml Matrix in MALDI Lösungsmittel, wodurch ein Lager Matrix-Lösung.
Hinweis: Die Matrix-Stammlösung kann bei Raumtemperatur für bis zu einer Woche für weitere Analysen aufbewahrt werden. - Kombinieren des Peptids und Matrixlösung in einem Verhältnis von 1:1. Finde diese kombinierte Lösung auf drei verschiedenen Orten auf der MALDI-Probenplatte, Zugabe von 1 ul / Ort.
- Trocknen Sie die Flecken, entweder durch Trocknen an der Luft oder mit Hilfe einer Heißluftpistole. Respot und trocken jederProbe.
Hinweis: Respotting eine gleichmäßigere Peptid / Matrixprobe, und hilft bei der Beschaffung ein klares Signal. Ein Standard-Peptid-Mischung sollte auch mit der Matrixlösung in einem Verhältnis von 1:1 kombiniert werden und gesichtet (einmalig) auf das MALDI-Platte.
- Trocknen Sie die Flecken, entweder durch Trocknen an der Luft oder mit Hilfe einer Heißluftpistole. Respot und trocken jederProbe.
- Sammeln Sie die MALDI-ToF-Daten. Aufgrund der Zugabe des Methacrylamid an den N-Terminus des Peptids sollte ein 68 g / mol Molekulargewichtserhöhung über dem Peptid-Molekulargewichts allein.
Anmerkung: Im Gegensatz zu den PEGDM Synthese können Peptide nicht refunktionalisiert werden, wie bei der Spaltung der Schutzgruppen an Aminosäuren mit reaktiven Seitenketten entfernt werden, und die selektive Funktionalisierung der N-Termini nicht mehr gewährleistet werden.- Wenn der MALDI-Analyse (Fig. 5) zeigt das Peptid vollständig funktionalisierten und alle Schutzgruppen in geeigneter Weise abgespalten, kann das Peptid dialysiert werden (in Wasser, gegen Wasser) und durch Lyophilisierung gesammelt RemovE Restverunreinigungen (Spaltung Cocktail-, Ether-Schutzgruppen abgespalten etc.). Der Feststoff Peptid sollte zu einem kleinen Eppendorf-Röhrchen überführt und bei -20 ° C bis zur Verwendung gelagert werden.
Ergebnisse
Protonen-Kernresonanz ist eine der häufigsten Analysetechniken, um die Effizienz einer chemischen Reaktion zu beurteilen, da die Fläche unter jedem Peak-Spektren im Verhältnis zu den relativen Pegel dieser Protonen in der Probe, so dass die Bestimmung der Verhältnisse der Reaktanten und Produkt in der Probe. Für diese Reaktion kann 1 H-NMR-Analyse (Fig. 4) verwendet, um die% Funktionalisierung von der beobachteten berechnen: theoretische Verhältnis von terminalen Protonen methacrylat (a, b und c), um zentrale PEG Protonen (d). Die in Fig. 4 gezeigte PEGDM war 2.000 Da vor der Funktionalisierung, daher n = 2000 Da / (44 Da / PEG Wiederholung) = 45,5, also d = 4 * (n-1) = 178, so dass die Protonen: NMR Einheitsverhältnis 178 / 102,16 = 1,74. In diesem Fall kann ein Spitzenwert nicht in die Bewertung% Funktionalisierung verwendet werden, da die Anwesenheit von Wasser in der Probe künstlich erhöht die Fläche unter dem Peak. Mit Spitzen b, ist die Funktionalisierung 1,00% * 1,74 / 2 * 100% = 87,1%; using Spitze c, ist die Funktionalisierung% 1,08 * 1,74 / 2 * 100% = 94,1%. Daher ist die Gesamt% Funktionalisierung 91% PEGDM und dies ist ausreichend zur Verwendung in Hydrogel Synthese funktionalisiert. Typischerweise wird ca. 90% Funktionalisierung nach einer einzigen Runde von Methacrylierung erreicht.
Aufgrund der Vielzahl von Protonen-Gipfel, die in 1 H-NMR-Analyse von Peptiden auftreten, wird Peptid Funktionalisierung leichter untersucht mittels MALDI-TOF-Massenspektrometrie. Dies ist in Fig. 5, wobei das Peptid GKRGDSG wurde synthetisiert und unterzogen Funktionalisierung Methacrylamid gezeigt. Eine kleine Fraktion des Peptids wurde prefunctionalization Molekulargewicht Lage (Fig. 5A), die bei 676 g / mol, mit dem erwarteten Molekulargewicht des Peptids, das beobachtete Molekulargewichts-Spitzenwert auftritt, anzeigt korrekte Synthese der Peptidsequenz zeigte gespalten. Der Rest des Peptids unter Methacrylamid Funktionssierung vor der Spaltung. Da dieses Peptid Pbf geschützt R Aminosäuren, wurde die Spaltung in einem Cocktail enthält Thioanisol für 4 Stunden durchgeführt. Nach Funktionalisierung Methacrylamid, bei 744 g / mol (Fig. 5B) erfolgt die beobachtete Molekulargewichtsspitze, die erwartete Gewicht des Methacrylamid funktionalisierten Peptid (676 + 68 g / mol) und nicht mit dem erwarteten Molekulargewicht des nicht-funktionalisierten Peptid, was korrekte Funktionalisierung.
Um die Funktionalität von sowohl dem PEG und dem Methacrylamid funktionalisierten Peptid demonstrieren, wurden PEGDM Hydrogele mit und ohne 0,5 mM Methacrylamid funktionalisierten GKRGDSG (Fig. 6) erzeugt. Hydrogele wurden mit 10 Gew.% lineares 10 kDa PEGDM in PBS hergestellt, mit 0,05 Gew.% Lithium-phenyl-2 ,4,6-trimethylbenzoylphosphinate (LAP) als Photoinitiator. Das Hydrogel-Vorläuferlösung wurde zwischen zwei Glasobjektträgern mit einem Glasträger Spacer getrennt und zusammen mit Bindemittel Clips befestigt spritzt. Vorläuferlösung wurde dann auf 365 nm UV-Licht bei 2 mW / cm 2 für 10 Minuten, um eine Vernetzung zu induzieren, wonach 8 mm Durchmesser Gele wurden unter Verwendung eines zylindrischen Stempels gesammelt. Gele wurden in PBS gespült, und man ließ sie 2 Tage lang quellen, um sicherzustellen Gleichgewicht quellenden Bedingungen erzielt wurden 16,20. Humane MSCs (Durchgang 3) wurden zu 80% Konfluenz gezüchtet und auf Hydrogele gesät bei 15000 Zellen / cm 2. Die Zellen wurden für 48 Stunden halten, bevor sie in frisches Medium, enthaltend 0,5 &mgr; l / ml Calcein AM und 2 ul / ml Ethidium-Homodimer (LIVE / DEAD Viability Kit von Invitrogen) bei 10-facher Vergrößerung überführt und unter Phasenkontrast und Fluoreszenz aufgenommen mit einem Nikon Eclipse-Ti 2000. MSCs waren nicht in der Lage, auf die nicht funktionalisierten PEG-Hydrogele (6A) haften, sondern auf Einbeziehung der Zelladhäsion Peptid RGD sie in der Lage, um zu haften und verteilt auf das Hydrogel Oberfläche (6B) waren. Die LIVE / DEAD Bilderpräsentiert nicht stellen die Lebensfähigkeit der geimpften MSC Bevölkerung, MSCs sind haft abhängigen Zellen, die von der Gel-Oberfläche auf den Tod zu lösen und wird während der Medienübertragung entfernt werden, was künstliche Aufblähung der Lebensfähigkeit der Zellen ausgesät. Vielmehr werden die Fluoreszenzbilder bestimmt ist, zwischen adhärenten Zellen und kleine Variationen in der Hydrogel-Topologie, die nur schwer unter Phasenkontrast allein sein kann abgrenzen. Interessanterweise ausgesät nonspread die Zellen auf den PEG-Gelen Fleck nur positiv für beide Calcein AM und Ethidium-Homodimer, das anzeigt, daß Zellen wurden zum Zeitpunkt der Bildgebung zu sterben.
Einer der vielen Vorteile, die PEG-Hydrogele ist ihre hoch abstimmbaren Natur. Ändern der spezifischen Zusammensetzung des PEG-Hydrogel bietet Forschern ein hohes Maß an Kontrolle über Eigenschaften wie E-Modul. Wie in Fig. 7 dargestellt ist, sowohl PEG-Molekulargewicht (7A) und Gewichtsprozent ( 7B) bekannt zu kontrollieren Hydrogel Maschenweite (ξ) und die daraus resultierende Hydrogel Steifigkeit und Freisetzungsrate von verkapselten Drogen. Dies wurde durch die Herstellung von Hydrogelen mit unterschiedlichem Molekulargewicht PEGDM und Untersuchung des resultierenden Hydrogels Modul und Maschenweite (Fig. 8) gezeigt. Alle Hydrogele wurden mit 10 Gew.% lineare PEGDM in PBS hergestellt, mit 0,05 Gew.% LAP als Photoinitiator. 40 ul von Hydrogel-Vorläuferlösung wurde in 1 ml-Spritzen Spitzen abgeschnitten und 365 nm UV-Licht bei 2 mW / cm 2 für 10 min ausgesetzt, um Hydrogele zu bilden, wodurch zylindrische Geometrien ungefähr 5 mm im Durchmesser und 2 mm in der Höhe . Gele wurden in PBS für 2 Tage vor der mechanischen Prüfung quellen. Hydrogel Modul wurde unter Verwendung eines MTS QT / 5 mit einer 5 N Lastzelle unter Kompression zwischen 5 und 10% der ursprünglichen Höhe Hydrogel mit einer Geschwindigkeit von 0,1 mm / sec bestimmt. Nach der mechanischen Prüfung abgeschlossen war, wurde Maschengröße durch Messung bestimmt Hydrogel-mass pre-(M s) und Post-(M D) 24 h Gefriertrocknen über die Flory-Rehner-Gleichung wie in der Diskussion Schnitt mit Berechnungen in MATLAB durchgeführt detailliert. Wie angenommen Erhöhung des Molekulargewichts des PEG Makromer eine Erhöhung Hydrogel mesh (8A) und eine Abnahme der Steifigkeit Hydrogel (8B) verursacht. Hydrogel Maschenweite und das resultierende Gel Steifigkeit kann auch durch Änderung Gewichtsanteil PEG gesteuert werden. Hydrogele wurden mit variiere Gew.% lineares 10 kDa PEGDM hergestellt und Hydrogel Steifigkeit und Maschen wurden wie zuvor beschrieben bestimmt (Abb. 9). Wie in Fig. 7B dargestellt, wodurch Gew.% PEG bewirkt eine signifikante Abnahme der Maschenweite (9A) und der Erhöhung der Steifigkeit Hydrogel (9B).
Hydrogele, die eingekapselt Rinderserumalbumin (BSA) wurden gebildet unter Verwendung verschiedener molecular Gewicht PEG (2, 10, und 20 kDa). Alle Hydrogele wurden mit 10 Gew.% PEGDM in PBS, enthaltend 50 ug / ml BSA hergestellt, wie für Fig. 6 beschrieben. Gele wurden in 1 ml PBS bei 37 ° C inkubiert und die frische PBS zu jedem Zeitpunkt übertragen. Veröffentlicht BSA wurde mit der Bradford-Assay von Thermo Scientific quantifiziert. Hydrogel Maschengröße wurde wie für Abbildung 8 beschrieben, bestimmt. Wie in 7A dargestellt ist, tritt BSA Freisetzung schneller von Hydrogelen mit höherem Molekulargewicht gebildet PEGDM infolge der größeren Maschenweite innerhalb des Hydrogels (Abbildung 10).

4. Repräsentative 1 H-NMR von 2 kDa funktionalisierten linearen PEGDM mit der Mikrowellen-unterstützten Verfahrens. Prozent Funktionalisierung kann ca seinbasierend auf lculated die beobachtete:. theoretischen Verhältnis von endständigen Methacrylat-Protonen (a, b und c) auf zentrale PEG Protonen (d) Klicken Sie hier für eine größere Ansicht .
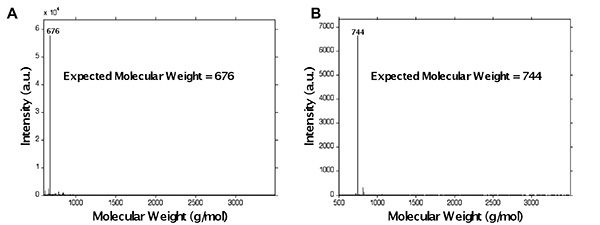
5. Repräsentative MALDI-TOF von Peptid GKRGDSG (A) vor und (B) nach Funktionalisierung mit der Mikrowellen-unterstützten Verfahrens. Beachten Sie, dass die beobachtete Peakmolekulargewicht nach der Funktionalisierung an 744 g / mol auf, die erwartete Gewicht des Methacrylamid funktionalisierten Peptid (676 68 g / mol) und nicht an der erwarteten Molekulargewicht des nicht-funktionalisierten Peptid (676 g / mol). Klicken Sie hier für eine größere Ansicht .
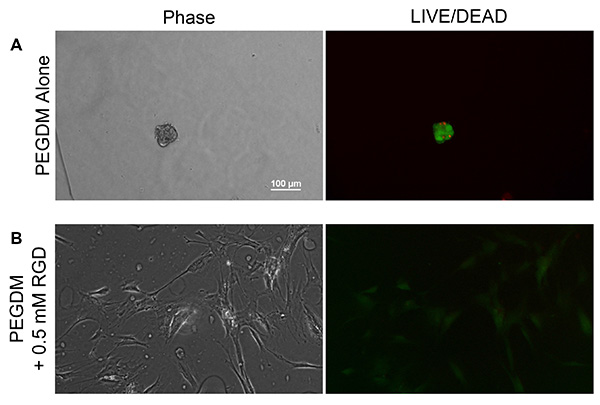
6. Repräsentative Phasenkontrast (links) und LIVE / DEAD (grün / rot) Fluoreszenzbilder (rechts) von MSCs auf A) PEG Gele allein und kultivierten B) PEG-Gelen, die 0,5 mM Methacrylamid funktionalisierten GKRGDSG. MSCs sind nicht in der Lage, um zu haften und verteilt auf die PEGDA Gele allein, sondern bei der Gründung der Zelladhäsion Peptid RGD, sind in der Lage, um zu haften und verteilt auf der Oberfläche Hydrogel. Klicken Sie hier für eine größere Ansicht .

Abbildung 7. A) PEG Molekulargewicht und B) Gewichtsanteil PEG Hydrogel verwendet, um Netzwerke zu bilden wirkt Hydrogel Maschenweite (_8 ;) und die daraus resultierende Hydrogel Steifigkeit und Freisetzungsrate von verkapselten Drogen. A) Erhöhung der PEG-Molekulargewicht (links nach rechts) bei konstanter Gewichtsanteil erhöht Hydrogel Maschenweite, abnehm Hydrogel Steifigkeit und Erhöhung der Geschwindigkeit der Wirkstofffreisetzung. B) Verringerung der Gewichts Prozentsatz der PEG (links nach rechts) verwendet werden, um Hydrogele bilden erhöht Hydrogel Maschenweite, ähnlich wie abnehm Hydrogel Steifigkeit und die Erhöhung der Wirkstoff-Freisetzung (nicht maßstabsgetreu). Klicken Sie hier für eine größere Ansicht .

Abbildung 8. A) Netzgröße steigt und B) Hydrogel Steifigkeit nimmt mit zunehmendem Molekulargewicht des PEG Macromer. N = 10, Fehlerbalken = SEM, *** p &# 60; 0,001 durch Einweg-ANOVA mit Tukey HSD Post-hoc-Test. Alle statistischen Analysen wurden unter Verwendung von Prism 5. Klicken Sie hier für eine größere Ansicht .

Abbildung 9. A) Maschenweite ab, und B) Hydrogel Steifigkeit mit zunehmender Gew.% PEG. N = 9-10, Fehlerbalken = SEM, ** p <0,01, *** p <0,001 durch Einweg-ANOVA mit Tukey-HSD-Post- hoc-Test. Klicken Sie hier für eine größere Ansicht .

Abbildung 10. Veröffentlichung encapsulated Modellarzneirinderserumalbumin (BSA) von Hydrogelen unter Verwendung von 2 kDa, 10 kDa, 20 kDa Molekulargewicht PEG ausgebildet. BSA-Freisetzung erfolgt schneller von Hydrogelen mit höherem Molekulargewicht gebildet PEGDM infolge der größeren Maschenweite innerhalb des Hydrogels . n = 6, Fehlerbalken = SEM. Die BSA% freigesetzt ist signifikant (p <0,0001) zwischen allen drei Gruppen zu jedem Zeitpunkt außer t = 1 und 2,5 Stunden, wenn die Freisetzung aus den 2 und 10 kDa Gele äquivalent sind, durch zwei-Wege-Wiederholungsmaßnahmen ANOVA mit Bonferroni Post-hoc-Test. Klicken Sie hier für eine größere Ansicht .
Diskussion
Die zuvor veranschaulichten Verfahren sind von unschätzbarem Wert für die Synthese von PEGDM und Methacrylamid Funktionalisierung von Peptiden oder anderen aminhaltigen Verbindungen. Diese Materialien können dann für die regenerative Medizin und Drug-Delivery-Anwendungen verwendet werden. Aufgrund der hydrophilen Natur von PEG, PEG-Hydrogele, die aus Makromeren gebildet haben einen hohen Wassergehalt ähnlich vielen Geweben in dem Körper 2. Diese Qualität macht PEG sehr resistent gegen Proteinadsorption und somit inert in dem Körper 3. Jedoch ist die Hygroskopizität von PEG während Funktionalisierung lästig erweisen. Wenn Wasser in der Probe vorhanden ist PEG während der Methacrylierung Verfahren wird die Methacrylanhydrid bevorzugt mit Wasser reagieren zu Methacrylsäure zu produzieren, und der arme Funktionalisierung von PEG führen wird.
Daher ist einer der wichtigsten Schritte, die ergriffen werden, um erfolgreiche Methacrylierung der PEG-oder Peptid sein, um sicherzustellen, wasserfrei zu haltenrous Reaktionsbedingungen. Die empfohlene Schritt des Trocknens alle Glaswaren vor Gebrauch soll Wasserverschmutzung zu verhindern. Die Anwesenheit von Wasser in der Probe in dem NMR-Analyse ersichtlich ist, als breiter Peak bei 1,7 ppm (Abbildung 4). Wenn schlechte Methacrylierung wird auch nach dem Trocknen alle Gläser beobachtet werden, können Chemikalien über Natriumsulfat oder andere Trockenmittel (Molekularsiebe etc.) vor der Verwendung getrocknet werden. Destillation kann ebenfalls verwendet werden, um Wasser zu entfernen und zu reinigen, Methacrylsäureanhydrid vor der Verwendung, und die azeotrope Destillation zu trocknen PEG 23 verwendet werden. In extremen Fällen kann die Synthese in einer Handschuhbox durchgeführt werden, um ausreichend wasserfreien Bedingungen weiter sicherzustellen. Eine zweite Runde von Methacrylierung, nach dem gleichen Verfahren, kann auch durchgeführt werden, um Funktionalisierung zu erhöhen. Da gibt es immer eine Chance, dass zusätzliche Runden der Funktionalisierung erforderlich sein wird, sollte darauf in Schritt 1.7 und 1.9 getroffen, um schnell PEGDM sammeln durch Vakuumfiltration werden. Vakuumfiltration länger als unbedingt notwendig steigt Exposition von PEG in die Luft, die Erhöhung der Chance für die Wasseraufnahme.
Auch wenn die Über Prozent Methacrylsäureanhydrid zu Hydroxyl-funktionellen Gruppen bleibt unverändert, die Erhöhung der PEG-Funktionalisierung (zB arm #) auf der PEG-Vorstufe ist in der Regel mit einer Abnahme der Funktionalisierung Prozent erreicht (unveröffentlichte Ergebnisse, Benoit Labor) verbunden. Präventiv adressieren diese Verringerung Funktionalisierung Effizienz, oder wenn besondere Schwierigkeiten angetroffen Erzielung ausreichend hoher Funktionalisierung, die Dauer der Mikrowellenreaktion kann erhöht werden, wenn die Mikrowellen-Intervall auf 30 Sekunden lang aufrechterhalten. Während 10 molarer Überschuß ist in der Regel ausreichend ist, kann die Menge an Methacrylsäureanhydrid in der Reaktion verwendet ebenfalls erhöht, um den Prozentsatz der Funktionalisierung erreicht 12 zu erhöhen.
Es ist wichtig, dass diezusätzliche Fällungsschritt (1.9) durchgeführt werden, um gute NMR-Signale zu erzielen. Obwohl es verlockend ist, um die zweite Fällung am selben Tag wie die Synthese durchzuführen, Trocknen der Probe über Nacht vor Umfällen wurde gefunden, daß die Entfernung von überschüssigem Methacrylsäureanhydrid und Methacrylsäure unterstützen. Probenvorbereitung ist auch wichtig für das Erreichen saubere NMR-Spektren und damit Proben sollten mit den empfohlenen Bedingungen hergestellt. Fig. 4 zeigt repräsentativ 1 H-NMR-Ergebnisse für vollständig funktionalisierten PEGDM. Durch die Analyse des Verhältnisses von Anschluß Methacrylat Protonen zentrale PEG Protonen, die PEGDM bestimmt angemessen funktionalisiert werden. MALDI-Probenvorbereitung ist für das Erreichen einer klaren Lese ähnlich wichtig. MALDI ist besonders empfindlich gegenüber der Anwesenheit von Salzen und hohen Probenkonzentrationen. Wenn eine klare MALDI Lesen (eine Intensität über 50 beliebigen Einheiten (au) mit einem hohen Signal: Rausch-Verhältnis) nicht erhalten werden können, die Probe slösung sollte 1:100 in MALDI Lösungsmittel verdünnt werden, bevor sie mit der Matrix-Lösung versetzt und erneut analysiert. Abbildung 5 zeigt, Vertreter MALDI-ToF Ergebnisse nach korrekter Peptid Funktionalisierung, Spaltung und Probenvorbereitung. Abspaltung einer kleinen Probe des Harzes vor der Funktionalisierung (5A) zeigt korrekte Synthese des Peptids GKRGDSG mit korrekten Methacrylamid Funktionalisierung des in 5B gezeigt Peptid.
Während Funktionalisierung von Peptiden auf dem Harz ist eine relativ robuste Verfahren, die für jede Sequenz erforderlich Spaltungsbedingungen erfordert häufig Tuning. Für lange Sequenzen, in denen viele Aminosäuren-Seitenketten (> 30 Aminosäuren lang ist, oder> 15 Aminosäuren mit Schutzgruppen) zu schützen, sollte die Dauer der Spaltung eine Stunde erhöht werden. Allerdings, wenn die Spaltung der Zeit zu sehr verlängert, Peptid-Bindungsspaltung kann auf langfristige sauren Belastung führen. MALDI ana Lyse in enthüllt Fehler in der Peptid-Synthese oder Spaltung traten sehr hilfreich sein. Eine beobachtete Abnahme unter dem erwarteten Molekulargewichte zeigen, dass Aminosäure (n) nicht richtig Paar oder das Peptid Fraktionierung stattgefunden (siehe Tabelle 2 für die Quellen der häufigsten beobachteten Veränderungen im Molekulargewicht). Wenn der beobachtete Molekulargewicht höher ist als die durch das Gewicht eines Schutzgruppe erwartet, ist es wahrscheinlich, dass die Spaltung und Entschützung unzureichend war und das Peptid sollte zusätzliche Zeit nachgeschnitten werden.
MW Änderung (g / mol)| Aminosäure-Deletion | MW Änderung (g / mol) | Ungespaltenen Schutzgruppen | Häufig vorhandenen Ionen | MW Änderung (g / mol) | |
| Ala | -71 | Acetyl | +42 | Cl - | +35 |
| Arg | -158 | Allyl | +40 | K + | +39 |
| Asn | -114 | Alloc | +85 | Mg 2 + | 24 |
| Natter | -115 | Boc | 100 | Na + | +23 |
| Cys | -103 | Fmoc | 223 | ||
| Gln | -128 | OtBu | +56 | ||
| Glu | -129 | Pbf | 252 | ||
| Gly | -57 | tBu | +56 | ||
| Seine | -137 | Trt | 242 | ||
| Ile | -113 | ||||
| Leu | |||||
| Lys | -128 | ||||
| Met | -131 | ||||
| Phe | -147 | ||||
| -97 | |||||
| Ser | -87 | ||||
| Thr | -101 | ||||
| Trp | -186 | ||||
| -147 | |||||
| Val | -99 |
Tabelle 2. Häufig beobachtete Veränderungen in der Peptidmolekulargewicht.
Makromere mit Mikrowellen-unterstützte Methoden hergestellt Methacrylierung kann in einer Anzahl der regenerativen Medizin oder Arzneimittelabgabeanwendungen verwendet werden. Die funktionalisierten Peptide synthetisiert und PEGDM hier können auch in Polymere unter Verwendung von Nitroxid-vermittelte Polymerisation (NMP), Atomtransfer-Radikalpolymerisation (ATRP) oder der Reversible Addi aufgenommen werdention-Fragmentierung Transfer (RAFT)-Methoden 24. Hydrogel-Netzwerke können auch in Gegenwart von Zellen hergestellt werden, wie zuvor in dem Artikel von JoVE Khetan Burdick und 22 gezeigt. Dies erfordert häufig die Einarbeitung von Zelladhäsion Peptide wie RGD oder extrazelluläre Matrixmoleküle, wie PEG allein bietet keine Zell-Material-Wechselwirkungen entscheidend für das Überleben und die Funktion einiger Zelltypen 25. Peptide können beispielsweise unter Verwendung von herkömmlichen Festphasen-Peptidsynthese synthetisiert und funktionalisiert wie hier beschrieben, für den Einbau in Hydrogel-Netzwerke zu ermöglichen. Wie in Fig. 6, die Aufnahme des Methacrylamid-funktionalisierten Zelladhäsion Peptid RGDS GK G in Hydrogelen (0,5 mM) erleichtert Adhäsion von humanen mesenchymalen Stammzellen (MSCs) in PEG Hydrogel-Oberflächen, die Erhöhung der Zahl der gebundenen Zellen und Ausbreitung (6B gesehen ), im Vergleich zu PEG-Hydrogele ohne Zelladhäsion Peptid ( 6A). Allerdings hat früheren Arbeiten gezeigt, dass Zell-Material-Interaktionen werden durch die Aufnahme von 3.400 Da PEG Abstandshalter zwischen Klebstoff Peptide und Hydrogel-Netzwerke erweitert, um Peptid-Integrin sterische Behinderung zu reduzieren. Ohne Einbeziehung des Abstands können Zellen mit PEG-Hydrogele durch unspezifische Proteine, die an das Peptid zu adsorbieren, zu kommunizieren, und nicht durch die Integrin-vermittelte Wechselwirkungen mit Peptiden 26. Um diese PEG-Spacer nehmen und unspezifische Wechselwirkungen zu vermeiden, können Peptide konjugiert werden, um über PEG N-Hydroxysuccinimidyl-aktivierte Ester monofunktionalisierte, wie von Hern und Hubbell 26 beschrieben.
Anwendungen von Hydrogel-Netzwerke erfordern eine strenge Kontrolle über Materialeigenschaften. Ein wesentlicher Vorteil gegenüber PEG-Hydrogele ist ein hohes Maß an Kontrolle über diese Eigenschaften. Beispielsweise das Molekulargewicht, Anzahl der Arm und die Gew.% PEG in der Bildung von Hydrogel-Netzwerken verwendet werden, können verändert werden, um Fein tun werden,E Eigenschaften für spezifische Anwendungen. Dies ermöglicht eine strenge Kontrolle über Hydrogel mesh (ξ), die Hydrogel-Quellverhältnis (Q) und Steifigkeit (Elastizitätsmodul E) steuert. Dies ist in Fig. 7A dargestellt, und in Fig. 8, wo immer quantifiziert PEG Makromer Molekulargewicht ergibt eine Erhöhung in Hydrogel mesh (8A) und eine Abnahme der Steifigkeit Hydrogel (8B).
Das zugrunde liegende physikalische Eigenschaft, die Groß Verhalten in diesen Hydrogel Netzwerke steuert, Maschengröße, wird mit der Flory-Rehner Gleichung 16 berechnet. Um diese Berechnung durchzuführen, wird das Volumenquellverhältnis (Q) zunächst aus der Gleichung 4 berechnet:  (4)
(4)
wobei ρ s die Dichte von Wasser (1 g / ml), ist p ρ Dichte von PEG (1,12 g / ml), M s gequollene Masse des Hydrogels und M D Trockenmasse des Hydrogels (häufig nach dem Einfrieren und Gefriertrocknung von Hydrogelen gemessen). Das Molekulargewicht zwischen den Vernetzungen (M c, in g / mol) wird dann aus Gleichung 5 berechnet: 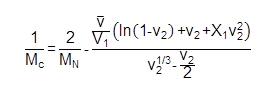 (5)
(5)
wobei M n das zahlenmittlere Molekulargewicht von PEG (in g / mol),  das spezifische Volumen des Polymers
das spezifische Volumen des Polymers 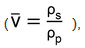 Ist, V 1 das molare Volumen von Wasser (18 ml / mol) ist, V 2 die Gleichgewichtspolymervolumenanteil des Hydrogels
Ist, V 1 das molare Volumen von Wasser (18 ml / mol) ist, V 2 die Gleichgewichtspolymervolumenanteil des Hydrogels
(  ) Und X 1 ist die Polymer-Lösungsmittel-Wechselwirkungsparameter für PEG und Wasser (0,426) 16. Die Anzahl der Bindungen zwischen den Vernetzungen (n) wird dann aus der Gleichung 6 berechnet:
) Und X 1 ist die Polymer-Lösungsmittel-Wechselwirkungsparameter für PEG und Wasser (0,426) 16. Die Anzahl der Bindungen zwischen den Vernetzungen (n) wird dann aus der Gleichung 6 berechnet:  (6)
(6)
wobei N b die Anzahl der Bindungen in der PEG-Wiederholung (3) und M r der MW des PEG-repeat (44 g / mol) 27. Dies ermöglicht es dem Root-Mean-Square Ende-zu-Ende-Abstand der Polymerkette 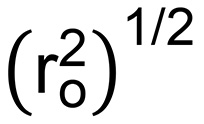 (In nm) von Gleichung 7 berechnet werden:
(In nm) von Gleichung 7 berechnet werden:  (7)
(7)
wobei l die durchschnittliche Bindungslänge (0.146 nm bezogen auf CC-und CO-Bindungslängen berechnet) und C n die charakteristische Verhältnis des Polymers (4,0 PEG) 28. FiNally, Maschenweite des Hydrogels aus Gleichung 8 berechnet werden:  (8)
(8)
Hydrogel-Eigenschaften können in ähnlicher Weise durch Einstellen der Menge des PEG bei der Bildung von Hydrogelen verwendet, abgestimmt werden. Verringern der Gewichtsprozentanteil von PEG Makromers zu einer Zunahme in Hydrogel Maschengröße, die anschließend reduziert Hydrogel Steifigkeit. Fig. 7B veranschaulicht und Fig. 9 quantifiziert, wie der Gewichtsanteil von PEG in Hydrogelbildung verwendet werden, können verwendet werden, um Maschengröße zu steuern (Fig. 9A) und resultierende Hydrogel Steifigkeit (Fig. 9B). Als Substrat Steifigkeit hat sich gezeigt, Zellverhalten wie Stammzelldifferenzierung 29 beeinflussen, ist die Fähigkeit, genau steuern Steifigkeit eine wichtige Eigenschaft in Hydrogel Herstellung.
Hydrogele können auch contr verwendet werdenol Drug Delivery. Wie in 7A dargestellt, und in Fig. 10 gezeigt, wodurch das Molekulargewicht des PEG-Makromere erhöht Maschennetz des Hydrogels, anschließend Erhöhung der Freisetzung von eingekapselten Modellarzneistoff, Rinderserumalbumin (BSA). Während Hydrogel-Proben in dieser Studie wurden bei t = 195 Stunden zerstört, um für die Messung der Hydrogel-Nass-und Trockenmassen für Maschen Berechnungen zu ermöglichen, ist es unsere Erfahrung, die weiter BSA Release auftreten würde, hatte die Proben für längere Zeiträume inkubiert worden. Die unvollständige Freisetzung von BSA in Abbildung 10 beobachtet wird, ist nicht unerwartet, als andere Gruppen haben auch berichtet, dass BSA ist beständig gegen Diffusion innerhalb PEG-Hydrogel-Netzwerke 30. Unvollständige Freisetzung von verkapselten Protein kann durch Wasserstoffbrückenbindungen zwischen Proteinen und PEG Makromere oder kovalente Bindung zwischen der Methacrylat-Gruppe auf der PEG-und Primäramingruppen auf Lysinreste in BSA 31 auftreten . Zusätzlich ist BSA zur Aggregation neigen und Disulfidbindungsbildung über die Zeit, was die effektive Stokes-Radius zu erhöhen und seine Freisetzung aus Hydrogelen behindern können. Als Kettenwachstums Hydrogele, wie diese PEGDM Hydrogele, sind anfällig für Unvollkommenheiten und heterogene Netzwerk Hydrogel Maschenweite (2A), ist es auch möglich, dass eine Fraktion der eingekapselten BSA in Regionen des Hydrogels, die wesentlich kleiner Maschen enthalten Größe als der Gesamtdurchschnitt innerhalb des Gels, die Verhütung der Veröffentlichung. Während unvollständig, nonFickian Mitteilung (Daten nicht gezeigt) von verkapselten BSA wurde in diesem Fall beobachtet, kontrollierte Freisetzung von Fickschen zahlreiche andere Modell Medikamente, darunter Insulin und Ovalbumin, wurde mit ähnlichen PEGDM Hydrogele 30 demonstriert. Zusätzlich Watkins und Anseth haben konfokalen Laser-Scanning-Mikroskopie verwendet, um diesen Freisetzung von fluoreszierenden Molekülen aus ähnlichen Hydrogele zeigen, ist annehmbar mit Fickschen Diffusion modelliert michthoden 32.
Während die in dieser Studie gebildeten Hydrogele sind nicht abbaubaren, Netzwerk-Abbau anderer Parameter, die in eingebaut und innerhalb dieser Netzwerke eingestellt werden können. Mit kontrollierter Abbau Hydrogel kann in Veränderungen im Zellverhalten 33, der Förderung des Gewebewachstums oder Host das Einwachsen von Gewebe oder Beseitigung der Notwendigkeit für die Explantation 34 führen. Abbaubaren PEG-Hydrogele werden üblicherweise durch Ringöffnung hydrolytisch abbaubaren D, L-Lactid, Glykolid, ε-Caprolacton oder Gruppen in Hydroxyl-Gruppen innerhalb PEG vor Methacrylierung 35 synthetisiert. Diese drei Gruppen verschlechtern durch Hydrolyse von Ester-Funktionen, wobei die Ester Glykolid mit der grßten Empfindlichkeit gegenüber Zersetzung, gefolgt von Lactid, Caprolacton und Ester, die aufgrund ihrer unterschiedlichen Hydrophobie. Nach dem Einbau von hydrolytisch abbaubaren Gruppen können weiter mit der PEG Methacrylierung detaile Verfahren funktionalisiert werdend in diesem Artikel, was die Bildung von Hydrogel-Netzwerke durch nachfolgende radikalisch initiierte Polymerisation Kette 36,37. Die Abbaugeschwindigkeit von Hydrogel-Netzwerke können durch Variieren der Identität des hydrolytisch abbaubaren Gruppe (Glycolid, Lactid, usw.) und durch Variieren der Anzahl von Wiederholungen abbaubar in der Struktur eingebaut 35,38 gesteuert werden.
Theoretisch könnte das Verfahren hier gezeigt für Acrylierung von PEG und Peptide durch Ersetzen des Methacrylsäureanhydrid mit Acrylsäureanhydrid in den Schritten 1.3 und 3.3, die jeweils verwendet werden. Jedoch ist acrylsäureanhydrid mehr als 20-fache der Kosten Methacrylsäureanhydrid 39,40, wodurch Mikrowellen-unterstützte Acrylierung deutlich weniger attraktiv als Mikrowellen-unterstützte Methacrylierung.
Wir haben ein einfaches, schnelles Verfahren zur Funktionalisierung von PEG und Peptide, wie die Effizienz des Verfahrens zu bewerten gezeigt, gegeben und Ressourcen für usingen die synthetisierten Materialien zu Hydrogel-Netzwerke zu bilden. Diese synthetischen Tools sind in ihrer Anwendung sehr vielseitig, und sollte ein Grundnahrungsmittel in einer beliebigen Anzahl von Drug-Delivery-und Materialforschungslabors beweisen.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen konkurrieren.
Danksagungen
Diese Arbeit wurde zum Teil durch einen Howard Hughes Med-in-Grad-Stipendium (AVH) gefördert, von Start-up-Fonds Dr. Danielle Benoit von der University of Rochester und die Unfallchirurgische Forschung und Bildung Stiftung / Muskel-Skelett-Transplant Foundation (OREF vorgesehen / MTF). Die Autoren danken Herrn Dr. James L. McGrath für die Verwendung seiner Geräte zu danken.
Materialien
| Name | Company | Catalog Number | Comments |
| 3,6-Dioxa-1,8-octanedithiol | Tokyo Chemical Industry Co, LTD | D2649 | CAS 14970-87-7 |
| Acetonitrile | J.T. Baker | UN1648 | CAS 75-05-8 |
| Amino Acids | AAPPTech | Glycine: AFG101 | CAS 29022-11-5 |
| Arginine: AFR105 | CAS 154445-77-9 | ||
| Asparagine: AFD105 | CAS 71989-14-5 | ||
| Serine: AFS105 | CAS 71989-33-8 | ||
| Anhydrous diethyl ether | Fisher Scientific | UN1155 | CAS 60-29-7 |
| Citric acid | Sigma Aldrich | C1857 | CAS 77-92-9 |
| Deuterated chloroform | Cambridge Isotope Laboratories Inc. | DLM-7-100 | CAS 865-49-6 |
| Dichloromethane | Fisher Scientific | UN1593 | CAS 75-09-2 |
| Diisopropylethylamine | Alfa Aesar | A1181 | CAS 7087-68-5 |
| Dimethylformamide | Fisher Scientific | D119-4 | CAS 68-12-2 |
| Fmoc-Gly-Wang resin | Peptides International | RGF-1301-PI | 100-200 mesh size |
| Methacrylic anhydride | Alfa Aesar | L14357 | CAS 760-93-0 |
| N-Methylpyrrolidone | VWR | BDH1141-4LG | CAS 872-80-4 |
| On-resin peptides | Synthesized in-house | On-resin peptides can also be purchased from Peptides International, GenScript, AAPPTec, etc. | |
| O-Benzotriazole-N,N,N’,N’-tetramethyl-uronium-hexafluoro-phosphate | AnaSpec Inc | 510/791-9560 | CAS 94790-37-1 |
| Peptide Calibration Standard | Care | 206195 | |
| Piperazine | Alfa Aesar | A15019 | CAS 11-85-0 |
| Poly(ethylene glycol) 2 kDa linear | Alfa Aesar | B22181 | CAS 25322-68-3 |
| Poly(ethylene glycol) 10 kDa linear | Alfa Aesar | B21955 | |
| Poly(ethylene glycol) 20 kDa linear | Sigma Aldrich | 81300 | JenKem Technologies USA is an alternate supplier of linear and multi-arm PEG |
| Thioanisole | Alfa Aesar | L5464 | CAS 100-68-5 |
| Trifluoroacetic acid | Alfa Aesar | A12198 | CAS 76-05-1 |
| Triisopropylsilane | Alfa Aesar | L09585 | CAS 6485-79-6 |
| α-Cyano-4-hydroxycinnamic acid | Tokyo Chemical Industry Co, LTD | C1768 | CAS 28166-41-8 |
Referenzen
- Lin, C. C., Anseth, K. S. PEG Hydrogels for the Controlled Release of Biomolecules in Regenerative Medicine. Pharm. Res. 26, 631-643 (2009).
- Ifkovits, J. L., Burdick, J. A. Review: Photopolymerizable and degradable biomaterials for tissue engineering applications. Tissue Eng. 13, 2369-2385 (2007).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in biology and medicine: From molecular principles to bionanotechnology. Adv. Mater. 18, 1345-1360 (2006).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat. Biotechnol. 23, 47-55 (2005).
- Benoit, D. S., Durney, A. R., Anseth, K. S. The effect of heparin-functionalized PEG hydrogels on three-dimensional human mesenchymal stem cell osteogenic differentiation. Biomaterials. 28, 66-77 (2007).
- Benoit, D. S., Collins, S. D., Anseth, K. S. Multifunctional hydrogels that promote osteogenic human mesenchymal stem cell differentiation through stimulation and sequestering of bone morphogenic protein 2. Adv. Funct. Mater. 17, 2085-2093 (2007).
- Fairbanks, B. D., et al. A Versatile Synthetic Extracellular Matrix Mimic via Thiol-Norbornene Photopolymerization. Adv. Mater. 21, 5005(2009).
- Moon, J. J., Hahn, M. S., Kim, I., Nsiah, B. A., West, J. L. Micropatterning of Poly(Ethylene Glycol) Diacrylate Hydrogels with Biomolecules to Regulate and Guide Endothelial Morphogenesis. Tissue Eng. A. 15, 579-585 (2009).
- Burdick, J. A., Anseth, K. S. Photoencapsulation of osteoblasts in injectable RGD-modified PEG hydrogels for bone tissue engineering. Biomaterials. 23, 4315-4323 (2002).
- Yanez-Soto, B., Liliensiek, S. J., Murphy, C. J., Nealey, P. F. Biochemically and topographically engineered poly(ethylene glycol) diacrylate hydrogels with biomimetic characteristics as substrates for human corneal epithelial cells. J. Biomed. Mater. Res. A. 101A, 1184-1194 (2013).
- Benoit, D. S. W., Anseth, K. S. Heparin functionalized PEG gels that modulate protein adsorption for hMSC adhesion and differentiation. Acta Biomater. 1, 461-470 (2005).
- Lin-Gibson, S., et al. Synthesis and characterization of PEG dimethacrylates and their hydrogels. Biomacromolecules. 5, 1280-1287 (2004).
- Anseth, K. S., Wang, C. M., Bowman, C. N. Reaction Behavior and Kinetic Constants for Photopolymerizations of Multi(Meth)Acrylate Monomers. Polymer. 35 (94), 3243-3250 (1994).
- Bencherif, S. A., et al. End-group effects on the properties of PEG-co-PGA hydrogels. Acta Biomater. 5, 1872-1883 (1016).
- Rydholm, A. E., Bowman, C. N., Anseth, K. S. Degradable thiol-acrylate photopolymers: polymerization and degradation behavior of an in situ forming biomaterial. Biomaterials. 26, 4495-4506 (2005).
- Zustiak, S. P., Leach, J. B. Hydrolytically Degradable Poly(Ethylene Glycol) Hydrogel Scaffolds with Tunable Degradation and Mechanical Properties. Biomacromolecules. 11, 1348-1357 (2010).
- Malkoch, M., et al. Synthesis of well-defined hydrogel networks using Click chemistry. Chem. Commun. , 2774-2776 (2006).
- Hoffman, M. D., Benoit, D. S. Emerging Ideas: Engineering the Periosteum: Revitalizing Allografts by Mimicking Autograft. , (2012).
- Hoffman, M. D., Xie, C., Zhang, X., Benoit, D. S. The effect of mesenchymal stem cells delivered via hydrogel-based tissue engineered periosteum on bone allograft healing. Biomaterials. , (2013).
- Hubbell, J. A., Lutolf, M. P., Raeber, G. P., Zisch, A. H., Tirelli, N. Cell-responsive synthetic hydrogels. Adv. Mater. 15, 888-892 (2003).
- Lidstrom, P., Tierney, J., Wathey, B., Westman, J. Microwave assisted organic synthesis - a review. Tetrahedron. 57, 9225-9283 (2001).
- Khetan, S., Burdick, J. Cellular encapsulation in 3D hydrogels for tissue engineering. J. Vis. Exp. (32), e1590(2009).
- Antonios, M., Kurtis, K., Lucas, K. Drying poly(ethylene glycol). Nat. Protoc. Exchange. , (2012).
- Nicolas, J., Mantovani, G., Haddleton, D. M. Living radical polymerization as a tool for the synthesis of polymer-protein/peptide bioconjugates. Macromol. Rapid Comm. 28, 1083-1111 (2007).
- Nuttelman, C. R., Benoit, D. S. W., Tripodi, M. C., Anseth, K. S. The effect of ethylene glycol methacrylate phosphate in PEG hydrogels on mineralization and viability of encapsulated hMSCs. Biomaterials. 27, 1377-1386 (2006).
- Hern, D. L., Hubbell, J. A. Incorporation of adhesion peptides into nonadhesive hydrogels useful for tissue resurfacing. J. Biomed. Mater. Res. 39, 266-276 (1998).
- Andreopoulos, F. M., Beckman, E. J., Russell, A. J. Light-induced tailoring of PEG-hydrogel properties. Biomaterials. 19, 1343-1352 (1998).
- Merrill, E. W., Dennison, K. A., Sung, C. Partitioning and Diffusion of Solutes in Hydrogels of Poly(Ethylene Oxide). Biomaterials. 14, 1117-1126 (1993).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126, 677-689 (2006).
- Weber, L. M., Lopez, C. G., Anseth, K. S. Effects of PEG hydrogel crosslinking density on protein diffusion and encapsulated islet survival and function. J. Biomed. Mater. Res. A. 90A, 720-729 (2009).
- Mellott, M. B., Searcy, K., Pishko, M. V. Release of protein from highly cross-linked hydrogels of poly(ethylene glycol) diacrylate fabricated by UV polymerization. Biomaterials. 22, 929-941 (2001).
- Watkins, A. W., Anseth, K. S. Investigation of molecular transport and distributions in poly(ethylene glycol) hydrogels with confocal laser scanning microscopy. Macromolecules. 38, 1326-1334 (2005).
- Anseth, K. S., Benoit, D. S. W., Durney, A. R. Manipulations in hydrogel degradation behavior enhance osteoblast function and mineralized tissue formation. Tissue Eng. 12, 1663-1673 (2006).
- Hillwest, J. L., et al. Prevention of Postoperative Adhesions in the Rat by in-Situ Photopolymerization of Bioresorbable Hydrogel Barriers. Obstet. Gynecol. 83, 59-64 (1994).
- Sawhney, A. S., Pathak, C. P., Hubbell, J. A. Bioerodible Hydrogels Based on Photopolymerized Poly(Ethylene Glycol)-Co-Poly(Alpha-Hydroxy Acid) Diacrylate Macromers. Macromolecules. 26, 581-587 (1993).
- Skaalure, S. C., Milligan, I. L., Bryant, S. J. Age impacts extracellular matrix metabolism in chondrocytes encapsulated in degradable hydrogels. Biomed. Mater. 7, 024111-0210 (2012).
- Hoffman, M. D., Benoit, D. S. Agonism of Wnt-beta-catenin signalling promotes mesenchymal stem cell (MSC) expansion. J. Tissue. Eng. Regen. Med. , (2013).
- Sawhney, A. S., Pathak, C. P., Vanrensburg, J. J., Dunn, R. C., Hubbell, J. A. Optimization of Photopolymerized Bioerodible Hydrogel Properties for Adhesion Prevention. J. Biomed. Mater. Res. 28, 831-838 (1994).
- Methacrylic Anhydride [Internet]. , Available from: https://us.vwr.com/store/catalog/product.jsp?catalog_number=AAAL14357-18 (2013).
- Acrylic Anhydride [Internet]. , Available from: http://www.polysciences.com/Catalog/Department/Product/98/productid--40/ (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten