Method Article
Imaging und 3D-Rekonstruktion der zerebrovaskuläre Strukturen in embryonalen Zebrafisch
In diesem Artikel
Zusammenfassung
Imaging von zerebrovaskulären Entwicklung in Zebrafisch-Larven beschrieben. Techniken zur 3D-Bildgebung zu erleichtern und zu ändern zerebrovaskuläre Entwicklung mit chemischen Behandlungen sind ebenfalls vorhanden.
Zusammenfassung
Zebrafische sind ein mächtiges Werkzeug, um die Entwicklungsbiologie und Pathologie in vivo zu untersuchen. Die geringe Größe und die relative Transparenz der Zebrafisch-Embryonen machen sie besonders geeignet für die visuelle Untersuchung der Prozesse, wie Herz-und Gefäßentwicklung. In mehreren aktuellen Studien wurden transgene Zebrafisch, die EGFP in vaskulären Endothelzellen exprimieren zur Abbildung und Analyse komplexer Gefäßnetze im Gehirn und Netzhaut, mit Hilfe der konfokalen Mikroskopie. Beschreibungen sind vorgesehen, um vorzubereiten, zu behandeln und Bild Zebrafischembryonen, die verstärkt grün fluoreszierende Protein (EGFP) ausdrücken, und dann erzeugen umfassende 3D-Renderings des zerebrovaskulären Systems. Protokolle umfassen die Behandlung von Embryonen, konfokale Bildgebung, und die Fixierung Protokolle, die EGFP-Fluoreszenz zu bewahren. Weiterhin werden nützliche Tipps für die Beschaffung qualitativ hochwertiger Bilder von zerebrovaskulären Strukturen, wie das Auge die Entfernung ohne Beschädigung in der Nähe von Nervengewebe zur Verfügung gestellt. Mögliche Fallstrickemit konfokaler Bildgebung diskutiert, zusammen mit den notwendigen 3D-Rekonstruktionen aus konfokalen Bildstapeln mit frei verfügbaren Open-Source-Software erzeugen Schritte.
Einleitung
Zebrafisch bieten ein leistungsfähiges System zur Entwicklungsbiologie zu studieren, und die relative Transparenz ihrer Embryonen zugänglich ist Imaging-basierte Studien ein. Der Zebrafisch ist nun als Modell für die Entwicklung von Wirbeltieren seit Jahrzehnten eingesetzt. Knochenfischen, einschließlich Zebrafisch, eine vereinfachte Wirbelkreislauf-System, die keine angemessenen Homolog in Wirbellosen hat. Blut wird aus der vorderen Kammer eines Zwei-Kammer-Herz durch Kiemen, wo es mit Sauerstoff angereichert wird, gepumpt. Blut von den Kiemen konvergiert an der dorsalen Aorta und durch Arterien, Zweig in immer kleinere Schiffe erreicht schließlich Kapillaren in Organgeweben. Innerhalb Kapillaren Sauerstoff freigesetzt und Kohlendioxid absorbiert. Auf der venösen Seite des Blut Kapillaren fließt in immer größeren Venen und wird schließlich in die hintere Kammer des Herzens, wobei der Zyklus wiederholt gezogen.
Ein erwachsener Zebrafisch kann 200 oder mehr Eier auf einmal legen und ONCE befruchtet, entwickeln sie schnell zwei. Innerhalb eines Tages die Körperachse ist gut entwickelt, einschließlich der Muskeln, die Vertrags-und um den Embryo innerhalb der Chorion-Membran zu bewegen. Von 2-7 Tage nach der Befruchtung (DPF) die meisten Körpersysteme zu entwickeln, einschließlich der Augen und des Zentralnervensystems, die koordinieren können schwimmen in Richtung Essen oder weg von hellem Licht. Bis zu 7 dpf Embryonen sind klein genug, um für die Visualisierung mit der Mikroskopie zu ermöglichen. Transgene Linien, die fluoreszierende Proteine exprimieren, können mit konfokaler Fluoreszenzmikroskopie oder abgebildet werden. Die konfokale Bildgebung kann mit Open-Source-Software 3 bis 3D-Renderings von kompletten Gefäßstrukturen in Zebrafischembryonen, die einen systembiologischen Perspektive der Gefäßentwicklung bieten erstellen gepaart werden. Mit Veränderungen in der Gefäß-und zerebrovaskuläre Komplexität betreffenden Studien werden von diesem Protokoll profitieren, da sie ermöglicht eine Analyse der Systemebene Gefäßnetze 4,5. Eine Zusammenstellung von Methoden und Ressourcen zur Verfügung stellend für die einfache Annahme und dieser Techniken für Studien, die Abbildung von Gefäßstrukturen in embryonalen Zebrafisch erfordern können. Die Kosteneffizienz der Zebrafisch als Tiermodell ist mit Schwellen Imaging-Technologien kombinieren, um neue Plattformen, mit dem angiogenen Effekte der molekularen Signalwege in der Wirbeltierentwicklung und Homöostase beurteilen zu können.
Protokoll
1. Zebrafisch Haltung, Embryo-Generation, und Behandlung
- Führen Sie die folgenden Protokolle Zebrafisch unter der Leitung von einem institutionellen Tierpflege und Verwendung Ausschuss (IACUC) und innerhalb der Tierpflege Richtlinien der NIH oder anderen Regulierungsbehörden / Richtlinien.
- Zebrafisch-Stämme, die fluoreszierende Proteine exprimieren in bestimmten Geweben, Zellen oder Organe sind von der Zebrafisch International Resource Center (ZIRC). Zum Beispiel, Tg (kdr: EGPF) S843 EGFP in vaskulären Endothelzellen 6, die verwendet werden können, um eine vollständige 3D-Gefäßstrukturen zu erzeugen, wie in diesem Protokoll gezeigt auszudrücken. Andere Linien transgener Zebrafische sind von ZIRC.
- Haus erwachsenen Zebrafisch in einem geeigneten Aquakultursystem, pH-Wert, Salzgehalt, Temperatur, Sauerstoff, Licht und anderen Umweltfaktoren 7 überwacht. Das hier gezeigte Zebrafisch wurden in einem Aquaneering Inc. System (San Diego, CA) bei 28,5 ° C mit einer 14 Stunden lig untergebrachtht/10 Stunden Dunkel-Zyklus. Feed-erwachsenen Zebrafisch eine ausgewogene Ernährung der Artemia und NRD 06.04 Fischfutter (Artemia-Direct, Ogden, Utah).
- Erwachsene männliche und weibliche Zebrafisch-Zucht Alter sollten separat untergebracht werden Paarung erfolgreich zu erhöhen.
- Stimulieren Eiablage und Befruchtung, indem Weibchen (2-4) und Männchen (4-6) zusammen in einer passenden Container, der eine Gitterboden mit Löchern groß genug für die Eier durchfallen hat, aber zu klein für die Zebrafisch Erwachsene weitergeben . Bis Paarungen am Abend vor Set; Eier werden in der Nähe der Dämmerung gelegt, in der Regel während der Tageslichtzyklus in der Intensität (Morgendämmerung) steigt langsam. Check für Eier an der Unterseite des Gegen Behälter alle 15-30 Minuten.
- Sammeln Sie Eier mit einem Mesh-Sieb und sauber mit E3-Puffer (5 mM NaCl, 0,17 mM KCl, 0,33 mM CaCl 2, 0,33 mM MgSO 4). Übertragen Sie die Eier zu 100 mm Kulturplatten mit E3 Pufferspeicher gefüllt und in einem 28 ° C-Inkubator.
- Um Chemikalien, die cer ändern studierenebrovascular Verzweigung hinzufügen gewünschten chemischen Konzentrationen. Zum Beispiel kann neovasular Verzweigung mit γ-Sekretase-Inhibitor (GSI IX/DAPT/N- [N-(3,5-Difluorophenacetyl-L-alanyl)]-S-phenylglycinet-butylester) in DMSO solubilisiert 4, beginnend 24 induziert werden, Stunden nach der Befruchtung (hpf). Zu dieser Zeit-Punkt-Embryonen sind immer noch in dem Chorion, und viele Chemikalien können durch sie 8 weiterzugeben. Wenn ein Behandlungszustand hat Nerven-oder Motor-Effekte, die die Fähigkeit von Embryonen zu befreien von dem Chorion beeinträchtigen können, dann Embryonen sollte zwischen 24 und 48 hpf, die entweder mit einer Pinzette Pronase 2 getan werden kann, de-chorionated werden. Die Embryonen in den bereitgestellten Bilder gezeigt wurden von griff vorsichtig das Chorion mit zwei geschärften Pinzette und es zu zerreißen offenen dechorionated.
- Falls erforderlich / wünschenswert, Pigmentbildung kann durch Zugabe von 0,003% N-Phenylthioharnstoff (PTU) an die E3-Puffer bei 24 hpf gehemmt werden.
2. Konfokale Bildgebung von zerebrovaskulären Structnahmen in Festzebrafischembryonen
- Sacrifice Embryonen in 250 mg / L Tricainmethansulfonat, und befestigen Sie sie durch Eintauchen in 2-4% Paraformaldehyd über Nacht bei 4 ° C Behälter mit fluoreszierenden Embryonen in Folie eingewickelt werden. Einmal festgelegt, sind Embryonen in PBS bei 4 ° C gelagert werden, bis abgebildet - EGFP-Fluoreszenzintensität wird weniger aufgelöst nach etwa einer Woche, aber die Morphologie (wie im Hellfeld aus gesehen) ist viel länger erhalten.
- Bereiten Sie den Embryo, indem zuerst ein Auge mit einem geschärften Wolfram Nadelbefestigung. Um den Anschluss des Augengewebes ersten Cut schneiden Sie dann die Muskeln, geschnitten und schließlich den Sehnerv das Auge zu verdrängen. (Hinweis: Wenn die Abbildung beide Seiten gewünscht, beide Augen entfernen.)
- Sobald das Auge entfernt wird, montieren Sie den Embryo auf einem Deckglas mit einem Rückgang von 3% Methylcellulose. Ausrichten der Embryo, so dass die Seite mit dem Auge entfernt wird, mit Blick auf das Deckglas und ist so nah an die Glas wie möglich. Decken den gesamten Embryo mit methylcellulose, um ein Austrocknen zu verhindern, während der Bildgebung.
- Bild der montierte Embryo sofort mit einem inversen konfokalen Mikroskop mit einem hochwertigen Plan Apo 20x Objektiv (numerische Apertur = 0,75 oder besser) ausgestattet. Diese Konfiguration ist bevorzugt, ein nicht-invertiertes Mikroskop, das Anordnen der Embryo zwischen zwei Glasflächen, und Pressen des Embryos vor dem oberen Glas erfordern würde.
- Sammeln optische Schnitte in Schritten von 1 um mit einem mittleren oder großen Blendeneinstellung. Größeren Schritten von 2,5 &mgr; m können ebenfalls verwendet werden, aber es kann schwieriger sein, um die räumliche Ordnung der kleineren Objekte zu bestimmen. Kleine Öffnungen erzeugen schärfere Detail, aber die längeren Scans erforderlich ist, kann EGFP bleichen und auch die Tiefe der Bildgebung in den Embryo, die erreicht werden kann, zu begrenzen. Konfokales Mikroskop ermöglicht Abbildungs etwa auf halbem Weg durch einen Embryo.
- Wenn Bildgebung des gesamten Fisch gewünscht ist, entfernen Sie beide Augen von Anfang an (siehe Hinweis in Schritt 3.2), drehen Sie den Embryo nach imaging der einen Seite und wiederholen Sie die Schritte von 2,3 bis 2,5 für die Gegenseite.
3. 3D-Rekonstruktion der embryonalen Zebrafisch Cerebrovasculature
- Verwenden Sie den Fidschi-Verteilung 3 von Open-Source-ImageJ (http://fiji.sc), die für die 3D-Renderings optimiert ist kostenlos und mit PC-, Mac-und Linux-Computern kompatibel.
- Import konfokalen Stapeln nach Fidschi, indem Sie auf Plugins> LOCI> BioFormats Importeur 9 wählen Sie dann die konfokale Datei, zB name.ids für Nikon Stapel (2A). Wählen Sie Ansicht Stack mit Hyperstack, Farbmodus: Graustufen, automatische Skalierung überprüfen, überprüfen aufgeteilt Kanäle.
- Diese Auswahl wird vier separaten Kanal-Panels zu öffnen; für EGFP nur einer benötigt werden, in der Regel die dritte nach unten. Schließen Sie die anderen drei Platten (rot, blau und alpha) so dass die 16-Bit-Bild mit einem langen Namen, gefolgt von C = 1 (Abbildung 2A).
- Stellen Schwelle durch Scannen wenn das Bild mit der Bildlauf tab entlang der Unterseite, eine Scheibe, die die Region oder die Struktur von Interesse ist zu finden, dann gehen dem Bild> Anpassen> Schwellenwert (Abbildung 2C).
- In dem Panel, das kommt, schieben Sie die obere Leiste (Schwarzwert) nach links, so dass die Struktur kann sehr gut über Hintergrund gesehen werden, und lassen den Boden Schieber (Weißwert), wo es ist (Abbildung 2D). Wählen Sie B & W, wählen Dunkler Hintergrund. Sie berechnen Threshold für jedes Bild wählen nicht, es sei denn andere Einstellungen erforderlich sind für jede Scheibe, wählen Schwarz Hintergrund. Dieser Prozess schafft eine neue 8-Bit-Bild.
- WARNUNG: Threshold kann nicht rückgängig gemacht werden oder in ImageJ gespeichert, so dass die konfokale Stapel müssen jedes Mal eine Veränderung notwendig ist neu geladen werden. Notieren Sie sich die Nummern und probieren Sie verschiedene Einstellungen, bis das gewünschte Ergebnis erreicht ist.
- Zum Plugins> 3D Viewer> Schwellwert 0, Resampling Faktor 1 (am besten) oder 2 (gut), deaktivieren Sie die roten und blauen Farbfelder, um eine grüne 3D-Ausgabe zu machen - sonst ist es will produzieren einen weißen Rendering - wählen Sie Apply (nicht Auto) (2E).
- Drehen, drehen und zoomen Sie das 3D-Bild mit der Maus und Tastatursteuerung (2F).
- Speichern von Standbildern an jedem Punkt mit der Option Capture im Menü. Die Größe des Bildfeld auf dem Bildschirm schreibt Pixelmaße des Bildes erzeugt, so, wenn ein Bild mit hoher Auflösung gewünscht Make die Box größer durch die untere rechte Ecke ziehen.
- Erstellen Sie ein 3D-Film Spinn über Ansicht> Aufnahme 360 Grad Drehung (2G). Rotation standardmäßig auf 2 Grad pro Schritt, aber es kann bis 5 Grad zum Beispiel, die viel kleinere Dateigrößen erstellen wird geändert, kann aber Ruckeln, um die Animation hinzuzufügen.
- Speichern Sie die Datei in einem von mehreren verfügbaren Formate für die spätere Betrachtung mit Media Player, das Hochladen auf das Internet oder die Verwendung in Powerpoint-Präsentationen. Die Open-Source-Media-Player, VLC ( http :/ / www.videolan.org / vlc / index.html), ist kostenfrei und verarbeitet diese Videos sehr gut.
Ergebnisse
3D-Rekonstruktion von Gefäßstrukturen bietet eine umfassende und visuell interessante Perspektive der Zebrafisch-Entwicklung. Abbildungen 1 und 2 zeigen die Methoden, wie sie in der Regel getan. Abbildung 3 zeigt mehrere Winkel von Gefäßstrukturen in einem 6 dpf Zebrafisch-Embryo, der EGFP in Endothelzellen exprimiert. Mit einem grün oder weiß es schwierig sein kann, um die Signalstärke zu schätzen wissen; Pseudo-Färbung liefern Bildintensität aus einer Look-up-Tabelle und ermöglicht eine bessere Tiefenwahrnehmung, wenn Strukturen überlappen. Ein Beispiel einer Pseudo-farbige 3D-Bild des Gefäßsystems in einem 6 dpf Zebrafisch ist in Fig. 4 vorgesehen. Können Fluoreszenz-Bildgebung von lebenden Embryonen verwendet werden, um physiologische Merkmale, Augen-und Körperbewegung gehören zu studieren, und die Herzaktivität. Fig. 3 und 4 zeigen, mit diesen Methoden erhalten repräsentative Ergebnisse mit Hilfe der transgenen Zebrafischlinie beschrieben. Imaging Auflösung hängt von Mikroskop Eigenschaften, aber die Helligkeit des EGFP-Signal ist ausreichend für eine gute Bildqualität mit den meisten kommerziellen Systemen. Wiederaufbau und Rendering von 3D-Darstellungen ist konsistent und Optionen innerhalb dieser Open-Source-Software bieten durchweg gute Ergebnisse.
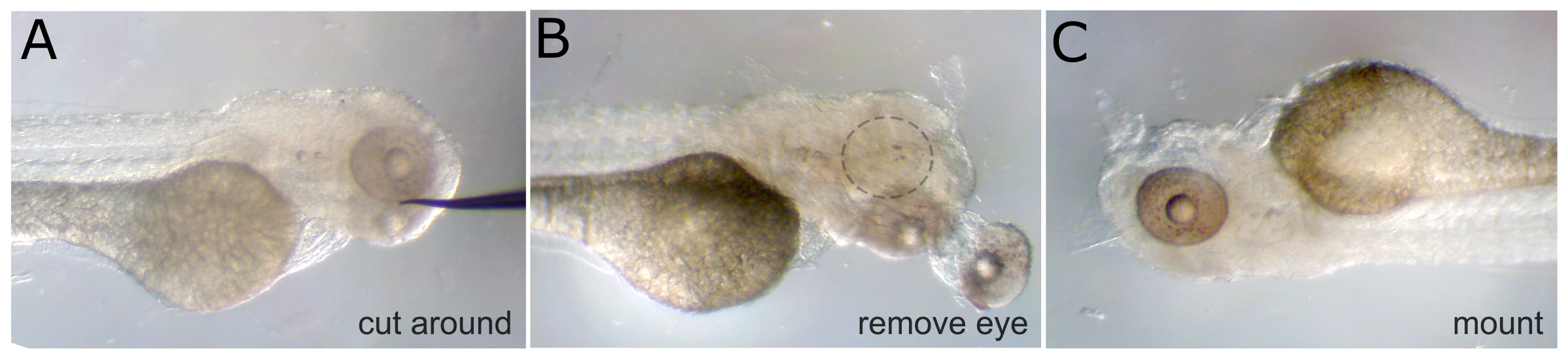
Abbildung 1. Augenentfernung. A) Eine feste 3 dpf Embryo mit einer Wolfram Bedarf positioniert neben dem Auge. Das Gewebe wird um das Auge von dieser Position. B geschnitten) Das Auge ist fällt aus und die zugrunde liegenden Augenmuskeln und Sehnerv geschnitten werden. Die leere Augenhöhle ist mit gestrichelten Kreis angedeutet. C) Das gleiche Embryo wird umgedreht und mit Methyl-Cellulose-montiert, mit dem intakten Auge nach oben. hres.jpg "target =" _blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
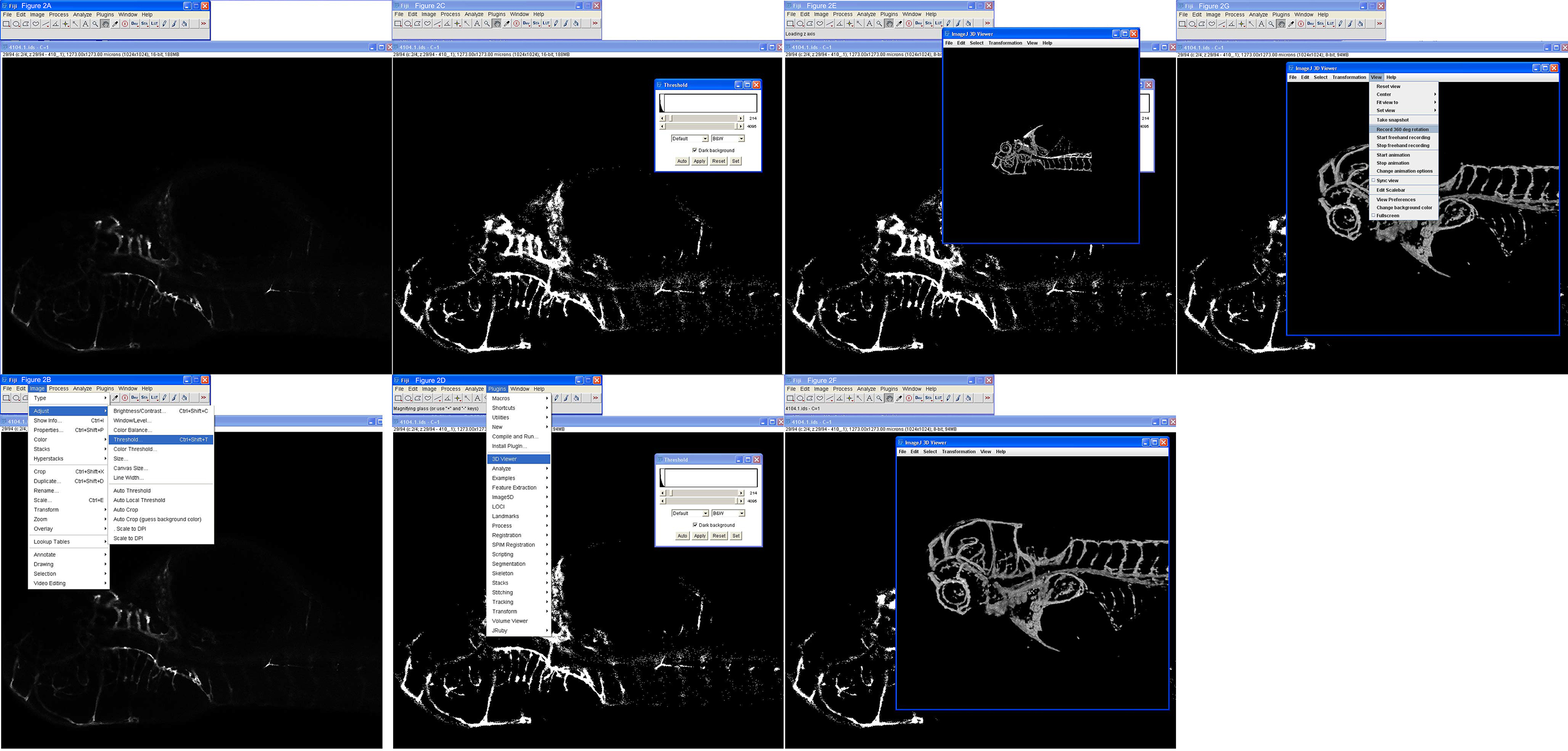
2. Schritt-für-Schritt-3D-Rekonstruktion eines konfokalen Bildstapels. A) Öffnen Sie die Datei (4104.1.ids) in Fidschi mit Plugins> LOCI> Bioformat an. B) Nach der Feststellung ein Stück mit dem interessierenden Bereich auswählen geladen ist, wird Schwelleneinstellung wie gezeigt. C) ausgewählt wird Threshold auf 214 mit dem oben angepasst Schieberegler und gelten gewählt. D) 3D-Viewer wird aufgerufen, wie dargestellt. E) Die 3D-Rekonstruktion eines Zebrafisches mit dem Auge intakt, zur Orientierung. F) Das Bild wurde gezoomt und gedreht. G) eine 360-Grad-Drehung Film gezeigt hergestellt wird, wie dargestellt. res.jpg "target =" _blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Perspektiven aus 3D-Rekonstruktion. A) Medial Sicht von 6 dpf Embryo mit 10-fach Objektiv abgebildet wird, ist Mund auf der rechten Seite, nicht Kiemen in den Mund. B) Seiten des gleichen Embryos ist Note Flosse eine Schleife in der Mitte. C) Gleiche Embryo mit 20x-Objektiv abgebildet wird, medialen Perspektive, Anmerkung Kiemenauflösung. D) Seitliche Sicht der 20x-Objektiv-Bildgebung. Die Flosse ist am rechten Rand des Panels. E) Antero-medial von 20x-Objektiv Bildgebung, Anmerkung Kiemen in den Mund. F) Abdomen des gleichen Embryos mit einem 20x-Objektiv, Kopf nach rechts abgebildet. Hinweis Gefäß auf dem Dottersack unten rechts.jove.com/files/ftp_upload/50417/50417fig3highres.jpg "target =" _blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
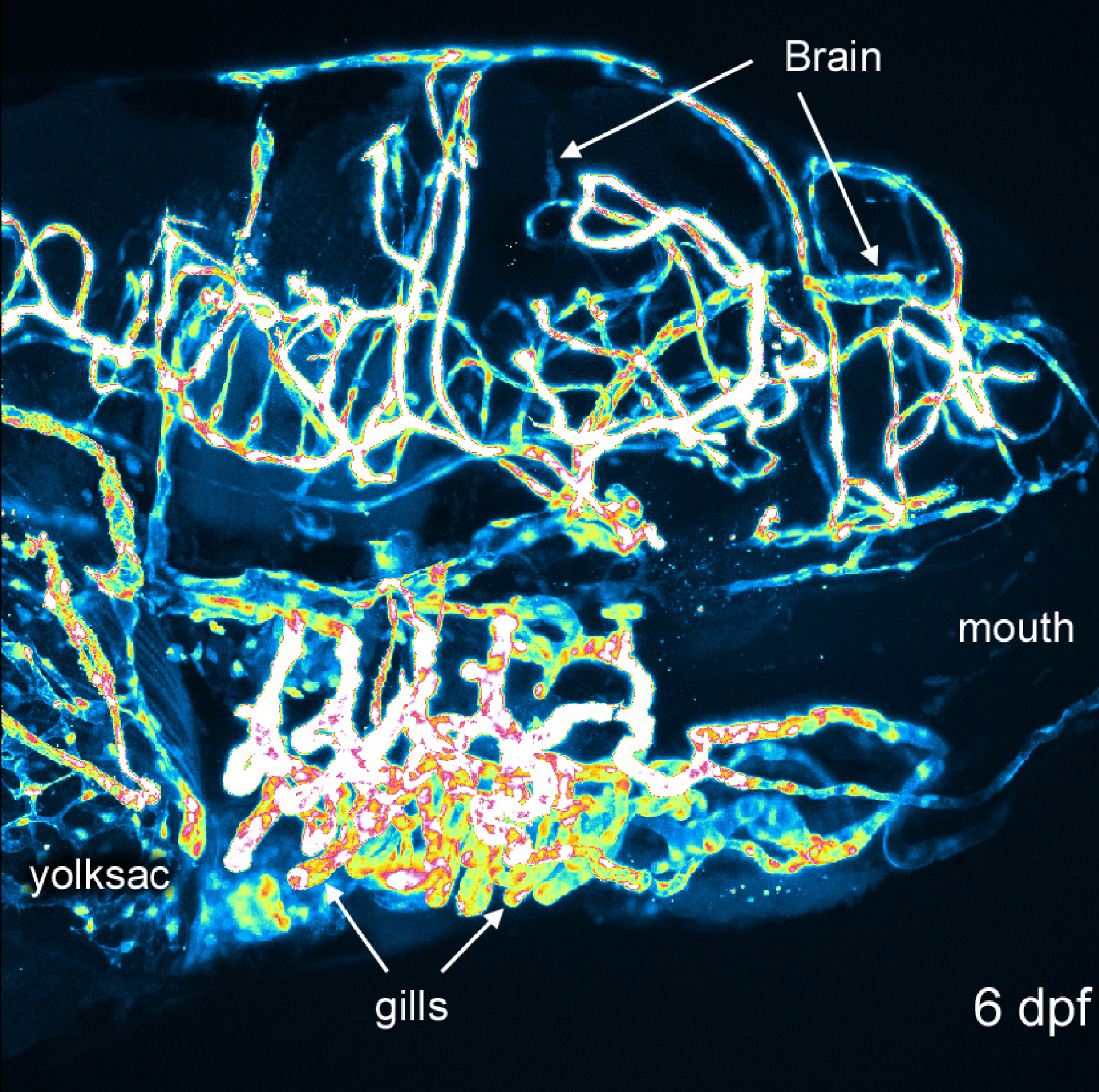
Abbildung 4. Unterschiede in der Intensität 6 dpf Embryo. Bild von einem 6 dpf Rekonstruktion mit Pseudo Look-Up-Tabelle für Signalintensität. Mund-, Hirn, Kiemen und Dottersack sind zur Orientierung gekennzeichnet. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
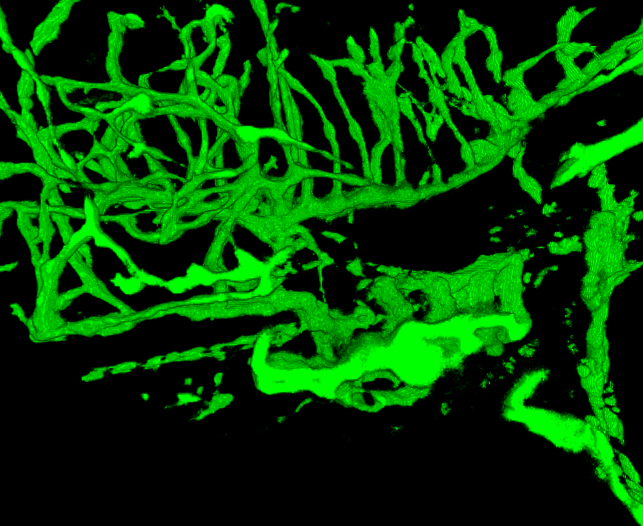
Abbildung 5. Film des rekonstruierten Gefäßsystem in einem 4 dpf Zebrafisch. Der Fisch wurde auf 2,5 um abgebildet. Die Bilder warenAbbilden von einer Hälfte des Embryos. Vergleichen vaskulären Strukturen mit Strukturen in einer GSI-behandelten Zebrafisch in Abbildung 6 vorgesehen. Beachten Sie die geringere Dichte der Blutgefäße im Kopf und größeren Kiemen. (Siehe "Zfish_spin.avi" ergänzende Datei unter Downloads)
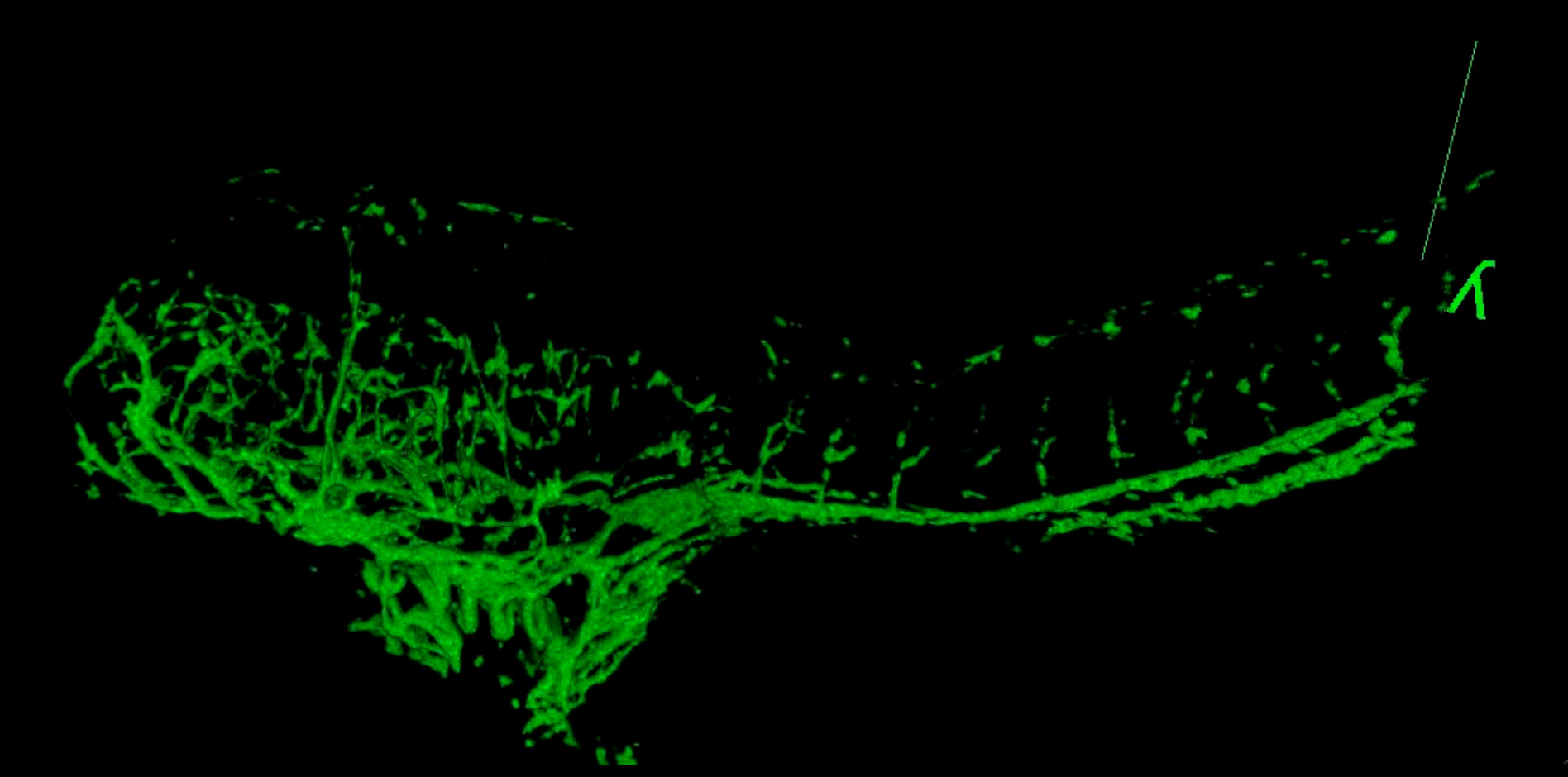
Abbildung 6. 3D Movie des Gefäßsystems in einer GSI-behandelten Embryo bei 4 dpf. Der Fisch wurde auf 2,5 um durch von lateral nach Mittellinie abgebildet. Vergleichen Gefäßstrukturen mit der Steuerung 4 dpf Fisch in Abbildung 5 dargestellt. Die gewölbte Rückseite und kleinere Größe typisch in Embryonen mit dieser Chemikalie behandelt. (Siehe "GSI-treated_4dpf_fish.avi" ergänzende Datei unter Downloads)
Diskussion
Die hier beschriebenen Methoden bieten eine Grundlage für die visuelle Untersuchungen des Gefäßsystems bei der Entwicklung von Zebrafisch. Lebende Exemplare können verwendet werden, um physiologische Parameter, wie die Herzfrequenz und die Herzschlagvolumen zu beurteilen, während feste Proben für hochauflösende konfokale Bildgebung. Drosophila und C eingesetzt werden elegans ermöglichen Ganzkörper-Bildgebung, aber Zebrafisch sind Wirbeltiere und ein nützliches Modell für Wirbeltiergewebe, einschließlich einer Endothelzellen ausgekleidet Gefäßsystem. Diese Studien können erhebliche transgenen Linien und genomische Ressourcen aus dem Zebrafisch-Forschung zu integrieren. 3D-Rekonstruktion und Wiedergabe von konfokalen Bildern aus embryonalen Zebrafisch, wie hier beschrieben, ermöglichen einen systembiologischen Ansatz, um Gefäßverzweigung und Blutgefäßdichte, die nicht mit größeren Tiermodellen, wie Ratten und Mäusen ist möglich. Ferner ist, wie Zebrafisch Amnioten entwickeln in einer modifizierbaren Umwelt (E3-Puffer), wo man leicht hinzufügen chemicals, die bestimmte Enzyme oder andere Prozesse, die Gefäßentwicklung beeinflussen zu hemmen. Die Konzentration und der Zeitpunkt der Lieferung kann chemisch verändert werden, so dass die Forscher die Feinabstimmung Behandlungsbedingungen.
1. Änderungen und Fehlersuche
Modifikationen dieses Systems können transgene Linien, die EGFP Zebrafisch oder andere fluoreszierende Proteine exprimieren, in einer Vielzahl von Gewebe, Organ oder einer Region spezifische Muster 10 zu integrieren. Ferner Analyse der neovaskulären Änderungen im Zebrafisch Retina wurde kürzlich veröffentlicht 5. Probleme mit Pigmentierung bei älteren Embryonen und erwachsenen Zebrafisch kann durch Kreuzung mit transgenen Linien, die Skala Pigmente oder Netzhautpigment produzieren nicht kompensiert werden. Probleme mit verminderter Fluoreszenz typischerweise vor unangemessenen Bedingungen Fixierung führen. Paraformaldehyd (4%) für 1 Tag ist optimal, aber stärker Fixiermittel, wie Glutaraldehyd, Osmiumtetroxid oder Alkohol,zerstören EGFP Fluoreszenz. Nach der Fixierung sollte Embryonen in PBS bei 4 ° C aufbewahrt werden und immer vor direkter Sonneneinstrahlung geschützt.
2. Einschränkungen dieser Technik
Die Qualität und Auflösung der 3D-Renderings mit diesem Protokoll erzeugt, hängt von der Qualität der Bilder erzeugt. Lichtdurchlässigkeit durch diese Embryonen zu der Mitte Sagittalebene mit einem Standard-Konfokalmikroskop beschränkt. Dieser Aspekt der Bild begrenzt die Tiefe der Bildgebung bei älteren Embryonen und Erwachsene, aber mehr erweiterte Multi-Photonen-Mikroskopie-Systeme ermöglichen für die Bildgebung in größeren Tiefen.
3. Bedeutung in Bezug auf bestehenden Methoden
Dieses Protokoll stellt einen Ansatz für die Analyse von Blutgefäßnetze auf Systemebene, die eine ganze Tier integrieren können. Frühere Darstellungen solcher Daten oft angeführte Reihe von Bildern zusammen gelegt, aber 3D-Rendering bietet eine bessere Auflösung der räumlichen Beziehungenhungen beteiligt.
4. Zukünftige Anwendungen
Neue Entwicklungen in der Bildgebung und Gewebeverarbeitung bieten viele neue Anwendungen für diese Methoden, die zählen können machen älteren Embryonen oder Erwachsene transparent 14.11. Verbesserte Transparenz Gewebepenetration deutlich erhöhen durch konfokale und Multiphotonen-Laser. Ferner ist, wie die Geschwindigkeit der Kameras und Photomultiplier-Röhren zu erhöhen kann es bald möglich sein wird, um 3D-Renderings von Fischen in Echtzeit zu erzeugen, die eine 4. Dimension Analyse.
5. Kritische Schritte
Ein entscheidender Schritt in diesem Protokoll ist die Vorbereitung für die Bildgebung, die die ordnungsgemäße Fixierung beinhaltet. Imaging sollte nach der Fixierung mit hohen Qualitätszielen, die die besten numerischen Aperturen zur Verfügung haben so schnell wie möglich durchgeführt werden. Auflösung ist abhängig von der Abbildungssystem verwendet werden, sind so hoch, Qualitätssysteme in der Regel besser. Generieren von 3D-Renderings ist speicherintensivfür so neuere, High-End-Computer mit einer großen Menge an Speicher und gute Grafik-Prozessoren empfohlen.
Die hier beschriebene optische System ist für die Biologie transgenen Zebrafisch, das EGFP in vaskulären Endothelzellen exprimieren optimiert, wenn diese Verfahren auf die GFP-transgenen Embryos oder andere fluoreszierende Proteine exprimieren, in Populationen von Neuronen, Muskeln, Drüsen oder einer beliebigen Anzahl von anpassen anderen Zellen. Der große Vorteil bei der Arbeit mit diesem System ist die Möglichkeit, zu jeder Zeit während dieser Entwicklungsphase zu studieren, was in der gesamten Embryo, in fest-und / oder lebenden Tieren.
Offenlegungen
Es gibt nichts zu offenbaren.
Danksagungen
Die Autoren bedanken sich Vergangenheit und Gegenwart Mitglieder unseres Labors, die diese Techniken entwickeln geholfen. Teilfinanzierung durch einen Zuschuss aus dem California Institute for Regenerative Medicine / CIRM (RN1-00538) DE zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| N – Phenylthiourea | Alfa Aesar, catalog #41972 | 0.2 M in E3 buffer, kept at 4 °C | |
| E3 buffer | Sigma | 5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2, 0.33 mM MgSO4 | |
| Confocal microscope | Nikon | D-EclipseC1 on a Nikon TE-2000U | |
| Glass bottom dishes | Mat-Tek | ||
| GSI IX/DAPT | N-[N-(3,5-Difluorophenacetyl-L-alanyl)]-S-phenylglycinet-butyl ester EMD Biosciences | ||
| 24 well plates | Becton-Dickinson, cat# 351147 | BD Falcon | |
| Transfer pipettes | VWR, cat #414004-001 | VWR disposable transfer pipettes | |
| Methyl-cellulose | Alfa Aesar, cat#43146 | 3% in E3 buffer | |
| NRD 4/6 Fish food | Brine Shrimp Direct | Dried | |
| Brine shrimp | Brine Shrimp Direct | Live | |
| Tungsten wire | Small Parts # TW-016-60 | 0.016” OD | |
| Tricaine | VWR # 101107-950 | Tricaine methanesulfonate 250 mg/L in E3 buffer |
Referenzen
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Annu Rev Genet. 46, 397-418 (2012).
- Westerfield, M. . The Zebrafish Book. , (2007).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Cameron, D. J., et al. Alzheimer's-related peptide amyloid-β plays a conserved role in angiogenesis. PLoS ONE. 7, (2012).
- Cunvong, K., Huffmire, D., Ethell, D. W., Cameron, D. J. Amyloid-β increases capillary bed density in the adult zebrafish retina. Invest Ophthalmol Vis Sci. 54, 1516-1521 (2013).
- Jin, S. W., Beis, D., Mitchell, T., Chen, J. N., Stainier, D. Y. Cellular and molecular analyses of vascular tube and lumen formation in zebrafish. Development. 132, 5199-5209 (2005).
- Lawrence, C. The husbandry of zebrafish (Danio rerio): a review. Aquaculture. 269, 1-20 (2007).
- Hagedorn, M., Kleinhans, F. W., Artemov, D., Pilatus, U. Characterization of a major permeability barrier in the zebrafish embryo. Biol Reprod. 59, 1240-1250 (1998).
- Schmid, B., Schindelin, J., Cardona, A., Longair, M., Heisenberg, M. A high-level 3D visualization API for Java and ImageJ. BMC Bioinformatics. 11, 274 (2010).
- Opitz, R., et al. Transgenic zebrafish illuminate the dynamics of thyroid morphogenesis and its relationship to cardiovascular development. Dev Biol. 372, 203-216 (2012).
- Gleave, J. A., et al. Neuroanatomical phenotyping of the mouse brain with three-dimensional autofluorescence imaging. Physiol Genomics. 44, 778-785 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497, 332-337 (2013).
- Markaki, Y., Smeets, D., Cremer, M., Schermelleh, L. Fluorescence in situ hybridization applications for super-resolution 3D structured illumination microscopy. Methods Mol Biol. 950, 43-64 (2013).
- Walter, T. J., Sparks, E. E., Huppert, S. S. 3-dimensional resin casting and imaging of mouse portal vein or intrahepatic bile duct system. J Vis Exp. 68, e4272 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten