Method Article
Isolierung und Immunfärbung Lymphozyten und dendritische Zellen aus Murine Peyer-Plaques
In diesem Artikel
Zusammenfassung
Es gibt ein wachsendes Interesse für das Verständnis der immunologischen Funktionen von bestimmten Subpopulationen von Zellen in Peyer-Plaques (PP), die primären induktiven Seiten des Darm-assoziierten lymphatischen Gewebe. Hier beschreiben wir parallele Protokolle zur Herstellung PP Einzelzelle Zubereitungen für die durchflusszytometrische Analyse und PP Kryoschnitten für Immunfärbung.
Zusammenfassung
Peyer-Plaques (PP) sind integraler Bestandteil der Darm-assoziierten lymphatischen Gewebe (GALT) und spielen eine zentrale Rolle in der intestinalen Immunüberwachung und Homöostase. Teilchenförmigen Antigene und Mikroben im Darmlumen werden kontinuierlich von PP M Zellen im Follikel-assoziierten Epithel (FAE) abgetastet und transportiert zu einer darunterliegenden Netz von dendritischen Zellen (DCs), Makrophagen und Lymphozyten. In diesem Artikel beschreiben wir, Protokolle, in denen murine PPs sind (i) dissoziiert in einzelne Zellsuspensionen und einer Durchflusszytometrie und (ii) für Kryoschneiden und Immunfärbung vorbereitet. Für Durchflusszytometrie, sind PPs mechanisch dissoziiert und dann durch 70 um Membranen zu Einzelzellsuspensionen frei von Epithelzellen und Großabfallfördereinrichtung erzeugen. Beginnend mit 20-25 PPs (von vier Mäusen), ergibt dies eine schnelle und reproduzierbare Methode eine Bevölkerung von> 2,5 x 10 6 Zellen mit> 90% der Lebensfähigkeit der Zellen. Für Kryoschneiden, frischely isolierten PPs werden in Optimal Cutting Temperature (OCT)-Medium, Snap-in flüssigem Stickstoff schockgefroren und anschließend geschnitten mit einem cryomicrotome eingetaucht. Gewebeschnitte (5-12 um) sind luftgetrocknet, fixiert mit Aceton oder Methanol, und dann zu Immunmarkierung unterziehen.
Einleitung
Peyer-Plaques (PP) sind makroskopische Aggregate der organisierten lymphatischen Follikel in der kleinen Darm von Menschen und Mäusen (Abbildung 1) und bilden die primären Standorten, an denen mukosalen Immunantworten gegen diätetische Antigene, symbiotischer Bakterien, mikrobielle Pathogene und orale Impfstoffe ausgelöst werden 1-4. Im Gegensatz zu anderen peripheren lymphatischen Gewebe wie den Mesenteriallymphknoten fehlt PPs afferenten Lymphgefäße. Als solche adaptive Immunantworten in PPs werden in Reaktion auf Antigene aus dem Darmlumen abgeleitet angetrieben. Die Abtastung wird die luminale Antigene durch den Follikel-assoziierten Epithel (FAE), die sowohl aus Enterozyten und Antigen-Sampling-Zellen als Zellen bekannt M besteht bewerkstelligt. Unterhalb des FAE im subepithelialen Kuppel (SED) Region liegt ein Netz von dendritischen Zellen (DCs) mit Makrophagen, B-Zellen und CD4 + T-Zellen 5-9 vermischt. Im Kern jedes PP lymphatischen follicle sind follikulären dendritischen Zellen (FDC) und einem B-Zell-reiche zentrales Keimzentrum, durch T-Zell-reichen Zonen interfollikulären flankiert. Antigen Abtasten durch PPs führt zur Entwicklung von IgA + B-Zellen und CD4 + Plasmablasten Effektorzellen und Gedächtniszellen dass Saatgut der umgebende Lamina propria und bereitzustellen Immunität gegenüber einem breiten Spektrum an mukosalen Eindringlinge.
Sezieren die komplexen immunologischen Ereignissen mit Antigen Probenahme, Aufbereitung und Präsentation in PPs verbunden ist eine gewaltige Aufgabe, wenn man bedenkt, dass PP-Zellen nur einen winzigen Bruchteil der gesamten lymphatischen Zellen in der Darmschleimhaut bilden. Um in der in-vitro-Charakterisierung der Zellen in diesem Umfeld zu erleichtern, bieten wir ein Protokoll für die Vorbereitung insgesamt Maus PP-Zellen für die durchflusszytometrische und funktionelle Analyse, sowie ein Protokoll für die Vorbereitung PP Kryoschnitten für Immunfluoreszenz und Immunhistologie. Unser Protokoll für die Isolierung, Charakterisierung und Immunfärbung von mouse PP-Zellen ist an sich nicht neu, wie die Tatsache, dass es zahlreiche Hinweise aus mehr als 25 Jahren, dass diese Techniken zu nennen 5,6,9-11 belegt. Vielmehr bietet unser Protokoll eine optimierte (und visuelle)-Methode für Ermittler sammeln PPs für die erste Zeit. Die Techniken, die wir beschreiben, sind leicht zu beherrschen und leicht nachgeben große Anzahl von Zellen mit> 90% der Lebensfähigkeit der Zellen. Die Kryoschneiden-Protokoll liefert reproduzierbare Schnittserien ideal für Immunfluoreszenzfärbung und konfokale Bildgebung eignet. Darüber hinaus ergänzt unser Protokoll zwei anderen kürzlich JoVE Artikel. Das erste, von Fukuda et al, beschreibt die Verwendung von ligierten ilealen Schleife Assays um die Aufnahme von pathogenen Bakterien, die durch M PP Zellen 12 zu beurteilen. Die andere, von Geem und Kollegen, beschreibt die Isolierung und Charakterisierung von DCs und Makrophagen aus der Maus Darmschleimhaut, sondern schließt ausdrücklich PPs aus ihrer Analyse 13.
Protokoll
Die Tiere wurden unter konventionellen, specific pathogen-freien Bedingungen untergebracht und wurden in voller Übereinstimmung mit Institutional Tier des Wadsworth Center Care und Use Committee (IACUC) Richtlinien behandelt.
Ein. Schlundsonde
- (Optional) Gavage Mausstamm der Wahl mit Antigen oder Mikroben von Interesse mit einem 22 G x1.5-in. blunt-end Fütterung Nadel (Popper Scientific, New Hyde Park, NY). Liefermengen nicht überschreiten sollte 400 ul pro Maus.
2. Isolierung von PP Cells für die Durchflusszytometrie
- Einschläfern Mäuse durch CO 2 Ersticken nach institutionellen Pflege der Tiere und die Nutzung Ausschuss (IACUC) Richtlinien.
- Reinigen Sie die Bauch mit 70% Ethanol oder betadine vor der Operation. Durchführen einer Standard-Laparotomie, die einen einzelnen (1 cm) unter Verwendung chirurgischer Qualität Einschnitt Scheren entlang der Mittellinie Anfang etwa 1,5 cm von der Basis der dem Brustkorb verbunden ist. Setzen Sie das proitoneal Hohlraum und Identifizierung der Blinddarm. Snip das Terminal Dünndarm bei der Ileum-cecal Kreuzung und entfernen Sie vorsichtig den Darm in seiner Gesamtheit. Darauf, nicht das Darmgewebe überstreckt, während es aus der Bauchhöhle entfernt wird.
- Legen Sie den Dünndarm auf einem Bett aus feuchtem Küchenpapier oder Kimwipes. Befeuchten Sie den Dünndarm vorsichtig mit Kochsalzlösung, um Gewebe Austrocknung zu verhindern. Visuell identifizieren einzelnen PPs auf die anti-mesenterialen Seite des Darms (Abbildung 1). Typischerweise hat ein einziges Maus 5 zu 10 sichtbaren PPs die gleichmäßig aus dem Duodenum (proximal) an Ileum (distalen) verteilt. Im Durchschnitt werden vier Mäuse Ausbeute 23 PPs.
- Mit gebogenen chirurgischen Schere vorsichtig Verbrauchsteuern einzelnen PPs und legen Sie sie in Balanced Salt kalten Hanks Solution (HBSS). Hinweis, sollte die Schere curve-Seite platziert werden bis knapp oberhalb der PP und dann sanft auf das Gewebe aufgebracht. Excise nur die PP (nicht umlieng Gewebe) und Transfer zum kaltem HBSS.
Hinweis: Alle Inkubationen und Zentrifugationsschritte ab diesem Zeitpunkt in Abschnitt 2 bei 4 erfolgen ° C, um die Zellviabilität zu bewahren. - Übertragen PPs in 5 ml Spleen Dissoziation Medium und Inkubation für 15-20 min bei 37 ° C unter kräftigem Schütteln bei 250 Umdrehungen pro Minute. Längere Inkubationszeit wird sich negativ auf die Lebensfähigkeit der Zellen.
- Um eine einzelne Zellsuspension, erfolgt PPs auf einem sterilen (autoklaviert) 70 um Nylonnetz Zellsieb erzeugen und zwangsweise mahlen das Gewebe in das Netz mit Hilfe der Basis eines Kolbens aus einem 1 ml-Spritze. Alternativ Sandwich PPs zwischen zwei frosted sterile Objektträger aus Glas (autoklaviert in Umschläge) und schonend zu mahlen Geweben mit einer hin-und herbewegt. Verwenden Sie eine sterile Pipette, um die Zellsuspension in ein 5 ml-Falcon-Röhrchen übertragen.
- Hinzufügen EDTA bis zu einer Endkonzentration von 1 mM zu der Zellsuspension. Inkubieren auf einer Wippe5 min bei Raumtemperatur.
- Dekantieren Zellsuspension durch einen zweiten 70 um Zellsieb zu entfernen alle verbleibenden zellulären Aggregaten oder Gewebereste. Sammeln Sie Zellen in einer 15 oder 50 ml konischen Röhrchen.
- Betreff Zellen sanfte Zentrifugation (5 min bei 500 xg). Dekantieren Überstand und resuspendieren Zellen in Strömungsrichtung Puffer, der Phosphat-gepufferte Kochsalzlösung (PBS) mit 1% fötalem Kälberserum (FCS) ist.
- Um die Zellzahl und Lebensfähigkeit zu bestimmen, zu verdünnen Zellen 01.10 in Trypanblau und Sichtprüfung Zellen mit einem Lichtmikroskop und ein Hämozytometer. Alternativ kann ein Gräfin Zellenzähler (Invitrogen) oder ein ähnliches Instrument verwendet, um automatisch aufzuzählen Zellzahlen und Lebensfähigkeit werden.
Beginnend mit 20-25 PPs, sollte dieses Protokoll Ausbeute> 2,5 x 10 6 Zellen insgesamt. Dies entspricht ~ 0,8-1,2 x 10 6 Zellen pro Maus.
Antibody Labeling der Zellen für die Durchflusszytometrie
- Verzichten Zellen (10 5 pro Vertiefung) in die Vertiefungen einer 96-well Rundboden Platten.
- Betreff Platte sanfte Zentrifugation (5 min bei 1.000 xg) und dekantieren durch vorsichtiges Umdrehen der Platte.
- Die Zellen in Fc Blockpuffer und inkubieren auf Eis für 15 min. Zwar gibt es eine Anzahl von kommerziell erhältlichen Fc Blockpuffer (zB Ratten-Anti-Maus-CD16/CD32, BD Biosciences) sind, verwenden wir einfach verbrauchte Medium aus einer Ratten-B-Zell-Hybridom (ATCC 2.4.G2), die einen monoklonalen IgG 1 absondert gegen murine Fcy-Rezeptoren für diesen Schritt.
- Betreff Platte sanfte Zentrifugation (5 min bei 1.000 xg) wie oben, und dekantieren Überstand durch vorsichtiges Umdrehen der Platte.
- Hinzufügen fluorophorkonjugierten Antikörper direkt an Zellsuspensionen an gewünschten Verdünnung und Inkubation auf Eis für 30 min unter ständigem Schaukelstuhl.
- Betreff Platte sanfte Zentrifugation (5 min bei 1.000 xg), und dekantierenÜberstand durch vorsichtiges Umdrehen der Platte.
- Waschen der Zellen mit 100 ul Flusspuffer.
- Zentrifuge Platte bei 1.000 xg für 5 min und dekantieren durch vorsichtiges Umdrehen der Platte.
- Die Zellen 400 ul Fixation Puffer, der von 300 ul der Strömung Puffer und 100 ul 1% Paraformaldehyd in PHEM Puffer (60 mM PIPES, 25 mM HEPES, 10 mM EGTA, 4 mM MgCl 2 bei pH 6) besteht.
- Gegenstand Zellen Durchflusszytometrie unter Verwendung eines FACSCalibur oder gleichwertig. Analyse der Ergebnisse mit Cell Quest Pro Software Version 5.2.
3. Herstellung von PP Kryoschnitte
- Im Vorfeld des Gewebes Sammlung hinzuzufügen Optimal Cutting Temperature (OCT)-Verbindung zu 7x7x5 mm Kunststoff-Basis Formen. Bereiten auch einen Pool von flüssigem Stickstoff (> 750 ml) in einem Dewar oder Eiskübel.
- Euthanize Maus und führen eine laparotamy, wie oben beschrieben. Entfernen Darm und auf feuchten Papiertüchern.
- Aufisolieren PPs für cyrosectioning, schneiden 0,5 cm quer Segmenten des Dünndarms mit einer einzigen PP und Transfer Gewebe bis zu einer Petrischale mit PBS. Vorsichtig spülen Lumen dieser Segmente mit PBS, um unerwünschte fäkale Verschmutzungen zu entfernen.
- Zeigen Darmgewebe Segmente vertikal innerhalb Bodenformen enthalten Oktober Tauchen der Formen in flüssigem Stickstoff und erlauben Gewebe vollständig zu erstarren (1-2 min). Die Farbe des OCT wird von klar bis weiß wechseln, wenn das Gewebe vollständig gefroren ist. Für eine allmähliche Abkühlung (z. B. zu reduzieren Rissbildung des OCT), Hinweis tauchen Form in einem Bad von Isopentan mit flüssigem Stickstoff Dämpfe gekühlt:. Tragen Sie geeignete Schutzbrille bei der Arbeit mit flüssigem Stickstoff.
- Entfernen gefroren Bodenform aus dem flüssigen Stickstoff mit einer Pinzette und erlauben die Form bei Raumtemperatur gerade lang genug ist (~ 10-15 sec) erwärmen, damit sich die Ränder der OCT-Block zu erweichen. Um dann den gefrorenen Block Oktober ausdie Form, Invertzucker der Form und drücken Sie sanft auf den Rücken, um den Block auf ein sauberes 4 x 4 cm Stück Aluminiumfolie auszuwerfen. Unmittelbar wickeln Sie das Gewebe in der Folie und in einer markierten Probe Tasche in flüssigem Stickstoff oder mit Trockeneis gelagert. Alternativ zu übertragen Gewebe in einem Gefrierschrank (<-20 ° C). Verwenden Sie das Gewebe innerhalb einer Woche, sonst werden die Blöcke spröde mit dem Alter.
Kryoschneiden
- Kryoschnitt das Gewebe mit Hilfe eines Leica CM3050S cryomicrotome oder gleichwertig. Die Kammer Temperatur auf der Kryostat sollte bis -21 ° C eingestellt werden
- Bemühen Sie sich um Abschnitte, die 12-14 um dick sind.
- Sammeln Sie Schnitte auf Fisher SuperFrost Plus (oder gleichwertig) Objektträger aus Glas und Sichtprüfung mit einem Standard-Lichtmikroskop geringer Stärke. Wenn mehrere Abschnitte auf einer Folie gesammelt werden, sicherzustellen, dass sie gemeinsam für nachgeschaltete Färbung Anwendungen geclustert.
- Shop trutscht er bei Raumtemperatur in einer Diashow box und im Idealfall nutzen sie innerhalb von ein paar Tagen.
Antibody Labeling der Kryoschnitte und konfokale Mikroskopie Analyse
- Objektträger in Aceton (oder Methanol) in Gewebefärbung jar oder Racks für 2 min. Längerer Inkubation kann Gewebe vom Schlitten zu lösen.
- Übertragen Folien neue Küvette überführen und 3 x waschen mit PBS-T (1X PBS mit 0,05% Tween-20) für 3 min je.
- Umkreisen Sie die Abschnitte mit einem ImmEdge hydrophoben Stift. Dadurch wird sichergestellt, daß Reagenzien und Antikörper zu diesem Bereich werden während Inkubationen beschränkt bleiben.
- Die Objektträger in Blockpuffer (2% Ziegenserum in PBS) für 30 min bei 37 ° C in einer feuchten Kammer, vor Licht geschützt.
- Die Objektträger mit Fc-Block-Puffer (siehe oben) für 10 min bei 37 ° C.
- Dip Slides in PBS-T und trocken Gegend um Abschnitte mit Kimwipes oder andere saugfähige Gewebe.Achten Sie darauf, die tatsächlichen Gewebeschnitten berühren.
- Overlay Gewebeschnitte mit primärer Antikörperlösung, Inkubation 30 min bei 37 ° C in einer befeuchteten Kammer. Primärantikörper wird typischerweise in Blockpuffer zu einer Endkonzentration von 20 ug / ml verdünnt. Die Verwendung von direkt-markierten primären Antikörper ist wünschenswert, da so viele wie drei Antikörper auch direkt bei diesem Schritt kombiniert werden. Direkt-markierten Antikörpern auch die Notwendigkeit für zusätzliche Antikörperinkubation Schritte.
- Waschen Sie die Slides 3 mal (5 min jeweils) durch Eintauchen in PBS.
- Falls erforderlich, inkubieren mit relevanten Sekundärantikörper für 30 min bei 37 ° C in einer feuchten Kammer.
- Waschen Sie die Slides 3 mal (5 min jeweils) durch Eintauchen in PBS.
- Die Objektträger 4 min in 1% Paraformaldehyd in PHEM Puffer, wie oben beschrieben.
- Objektträger mit PBS für 1 min.
- Dry Umgebung Abschnitte mit Kimwipes oder andere absorbierenent Gewebe. Achten Sie darauf, die tatsächlichen Gewebeschnitten berühren. Mit einer Pipette oder Pipette vorsichtig einen Tropfen verlängern Gold-Eindeckmedium direkt auf den Abschnitt. Tragen Sie eine Deckglas auf dem Eindeckmedium kümmern, um Blasen zu vermeiden. Verwenden Löschpapier, um überschüssiges Eindeckmedium absorbieren.
- Seal Deckgläsern auf Objektträger mit kommerziellen Nagellack und an der Luft trocknen.
- Anzeigen Dias mit einem Leica TCS SP5 oder gleichwertig konfokalen Mikroskop.
Ergebnisse
Die durchflusszytometrische Analyse von monodispersen Suspensionen von insgesamt PP Zellen zeigt eine klare Unterscheidung zwischen guten und schlechten Zellpräparaten. In guten Zellpräparationen mit über 80% Lebensfähigkeit zeigen die überwiegende Mehrzahl der Zellen mit hoher Vorwärtsstreuung (FSC), ein Indikator für eine hohe Zellvolumen und Low-Side-Scatter (SSC), ein Indikator für niedrige Zelle Granularität (Abbildung 2A). Bei diesem Experiment haben wir auch absichtlich eine "schlechte Zellpräparat" hergestellt durch Inkubieren PP Zellen während der Isolierungsschritte bei Raumtemperatur (statt auf Eis) und in dem letzten Schritt, Inkubieren von Zellen mit PBS plus 1% FCS (statt PHEM puffern). In diesen Armen Zellpräparationen weisen die Mehrzahl der Zellen günstig FSC und SSC hohen und sind außerhalb der angegebenen Gate R1 (2B). Diese Zellen werden wahrscheinlich Apoptose und / oder Nekrose.
Abbildung 3 zeigt die Verwendung eines Cocktails von bis zu vier different Fluorophor-konjugierten monoklonalen Antikörpern, unter einer Vielzahl von Zelltypen in PP Einzelzellsuspensionen diskriminieren. Markierung mit Cluster of Differentiation (CD) Marker CD19 und B220 zeigen, dass B-Zellen ~ 60% des gattergesteuerten PP Zellpopulation (3A) zu bilden. Spezifische T-Zell-Subpopulationen kann leicht durch Doppelmarkierung mit Antikörpern gegen CD3 und CD4 (3B) oder CD3 und CD8 (3C) aufgezählt werden. CD4 + und CD8 +-T-Zellen darstellen ~ ~ 23% und 9%, jeweils der gesamten PP Zellen. DCs Teilmengen markierten CD11c + (3D) und CD103 + (nicht gezeigt) kann auch durch dieses Verfahren aufgezählt werden. CD11c + DCs tragen zu etwa 8% der gesamten Population gated, was etwa 10.000 DCs pro PP ist. Dies stimmt exakt mit der Anzahl der von anderen DCs 14 beobachtet.
Unter der Bevölkerung der CD11c + Zellen etwa 4,7% waren doppelt positiv für B220 +. Ähnliche Ergebnisse werden erhalten, wenn PP Zellen aus C57B / 6 Mäuse (3E) werden gesammelt.
"Poor" Zellpräparationen können hoch irreführenden Ergebnissen führen, vor allem, weil tote oder sterbende Zellen, Antikörper unspezifisch binden neigen. Wie in 4 gezeigt ist, die Population von Zellen, die sowohl für die B-Zell-Marker (B220) und den T-Zell-Marker (CD3, Feld A; CD4, Feld B) positiv färben kann durch mehr als 3-fache zwischen einer guten und variieren bad cell Vorbereitung. Abbildung 4 zeigt einen überproportionalen Anteil der B220 + und CD3 + Doppel-positiven Zellen (Panel A), sowie B220 + B-Zellen und CD4 + T-Zellen doppelt-positiven Zellen (Panel B) in armen Zellpräparaten. Wie oben erwähnt, die relativen Unterschiede in B und T-Zellzahlen im Gut gegen schlechte ist wahrscheinlich auf die unspezifische Bindung von Antikörpern sterbenden Zellen.
Unser Protokoll zeigt auch, dass Maus PP Kryoschnitten zugänglich sind histopathologische Analyse sowie Immunomarkierung. Abbildung 5 vergleicht H & E-Färbung der Maus PPs Paraffin (Platten A, B) und Gefrierschnitten (Panel C). Während die Paraffinschnitten mehr Auflösung auf zellulärer Ebene, wenn sie von H & E gefärbt bieten, sind die hellen und dunklen Zonen der PP Keimzentren leichter abgegrenzt in Kryoschnitt Abschnitte (5A-C). H & E-gefärbten Kryoschnitten sind nützlich für Seite-an-Seite-Vergleich mit immunmarkierten Kryoschnitten. Eine typische PP Kryoschnitt mit Anti-CD3-Antikörper angefärbt, um die T-Zellen, Anti-CD11c-Antikörper beschriften zu DCs und anti-B220-Antikörper zu markieren B-Zellen zu markieren, ist in 6 gezeigt.

Abbildung 1. Maus Peyer'schen patches. Das Bild eines frisch herausgeschnitten Maus Dünndarms mit drei sichtbaren PPs (weiße Pfeile). Die PPs erscheinen als Blister-ähnlichen Strukturen (5 x 5 mm) auf der Anti-mesenterialen Seite des Darmserosa.
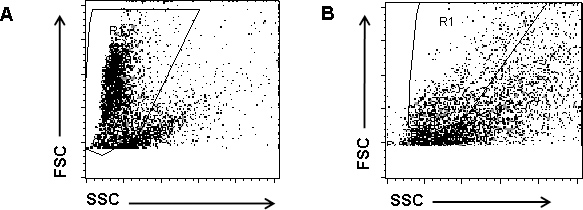
Abbildung 2. Insgesamt PP-Zellen mittels Durchflusszytometrie analysiert. Eine monodisperse Suspension von insgesamt PP Zellen wurde auf Durchflusszytometrie unter Verwendung eines BD FACSCallibur unterzogen. (A) Beispiel für eine gute Zelle Vorbereitung. Die überwiegende Mehrheit der Zellen zeigen hoher Vorwärtsstreuung (FSC), ein Indikator für eine hohe Zellvolumen und Low-Side-Scatter (SSC), ein Indikator für niedrige Zelle Granularität. Diese Zellen sind boxed in R1. Zellen mit niedriger und hoher FSC SSC, außerhalb der Gate-R1 befindet, werden als toten oder sterbenden Zellen. (B) Beispiel eines armen Zellpräparat, in der die Mehrzahl der Zellen vor dem TorR1 aufgrund der niedrigen FSC und hohe SSC.
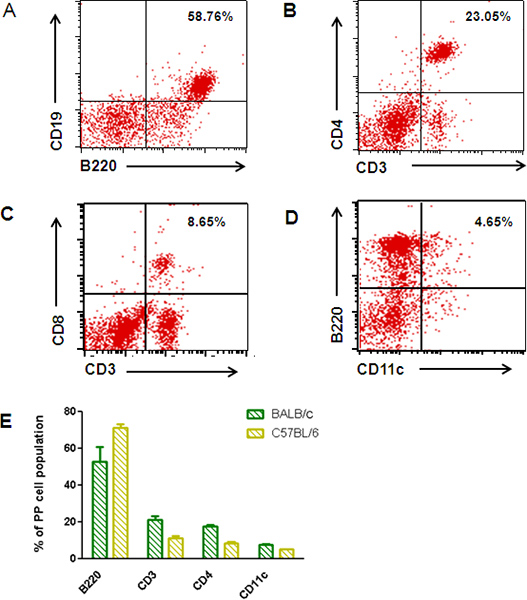
Abbildung 3. Repräsentative Durchflusszytometrieanalyse von PP-Lymphozyten. Monodisperse Suspensionen von Zellen, die mit insgesamt PP fluorophorkonjugierten primären Antikörpern inkubiert und dann auf Durchflußzytometrie unterzogen. (A) CD19 und B220 Etikettierung von PP-B-Zellen. (BC) Doppel-Markierung von insgesamt Zellpopulationen mit CD3 und CD4 (B) oder CD8 (C) zum Aufzählen spezifischen T-Zell Untergruppen. (D) Doppel-Markierung von insgesamt Zellpopulationen für B220 (B-Zell-Marker) und CD11c (DC-Marker). (E) Vergleichen B220, CD3 , CD4 und CD11c Färbung auf PP Zellen von BALB / c und C57B / 6 Mäusen.

Abbildung 4. Irreführende Durchflusszytometrie Daten als Folge von schlechter PP Zellpräparaten. Good (linkes Bild) und schlechte (rechte Felder) PP Zellpräparationen wurden mit (A) Antikörpern gefärbt B220 und CD3 auf B-und T-Zell-Populationen oder (B)-Antikörpern zu unterscheiden bis B220 und CD4 an B-Zellen aus einer Untergruppe von T-Zellen zu differenzieren. Generell gibt es sehr wenige Zellen von Zellen, die für B220 und CD3 oder CD4-positiven Fleck, wie in den linken Platten gezeigt. Im Gegensatz dazu in armen Zellpräparationen doppelt positiven Zellen bilden fast 20% der gesamten Zellen. Siehe Text für weitere Informationen darüber, was unter einem "schlechten" Zelle Vorbereitung.

Abbildung 5. Repräsentative H & E-gefärbten PP Abschnitte. Paraffin eingebetteten Abschnitte (A, B) oder Kryoschnitten (C) des PP ilealens wurden mit H & E gefärbt und durch Lichtmikroskopie sichtbar gemacht. beachte, dass die hellen und dunklen Zonen der Lymphfollikel leicht in den Kryoschnitten abgegrenzt, um den Paraffinschnitt verglichen. Abkürzungen: V, zottige, FAE, Follikel-assoziierten Epithel; SED, sub-epithelialen Kuppel, LF, lymphoide Follikel.
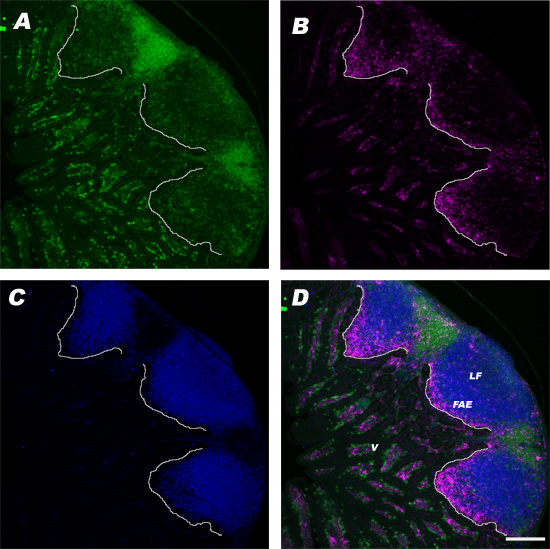
Abbildung 6. Immunfluoreszenz Kennzeichnung murine PP Kryoschnitten. Frisch geschnittene Gewebeschnitten von einem einzigen Mausklick PP wurden luftgetrocknet, Aceton-fixierten und gefärbt mit (A) FITC-konjugierten Anti-CD3-Antikörper, die T-Zellen in den inter-follikulären Regionen kennzeichnen und Lamina propria, (B) PE-konjugierten Anti-CD11c-Antikörper zu markieren DCs in der SED, und (C) APC-konjugiertem anti-B220-Antikörper gegen B-Zellen zu markieren (D) o Verbundmaterial.f Bilder in Platten AC generiert mit Fiji-Software. Maßstab ist ~ 100 um.
Diskussion
In diesem Artikel, wir haben parallele Protokolle zur Herstellung PP Einzelzelle Zubereitungen für die durchflusszytometrische und Funktionsanalyse und Kryoschnitten zur Immunfärbung vorgesehen. Beide Methoden sind sehr gut reproduzierbar und ohne weiteres zugänglich, vorausgesetzt ein Durchflußzytometer und Kryostat zur Verfügung. Erstmals Ermittler es sei darauf hingewiesen, dass, wenn im Vergleich zur Milz, insgesamt Zellausbeuten von PPs relativ mager sind. Dennoch, das Protokoll skizzieren wir in der Regel Renditen zwischen 0,8-1,2 x 10 6 insgesamt PP Zellen aus einem einzigen Mausklick. Scale-up möglich ist, obwohl wir in der Regel nicht-Pool mehr als 20-25 PPs, weil nach unserer Erfahrung tritt Aggregation und Zellausbeuten (und Lebensfähigkeit) Rückgang stark. Auf der anderen Seite haben wir nicht empfehlen, mit weniger als 15 PPs für dieses Protokoll, eine kritische Masse notwendig ist, um erfolgreich zu tragen, die Zellen durch das gesamte Verfahren zur Isolierung. Wenn maximalen Lebensfähigkeit der Zellen ist eine Priorität für nachgeschaltete funktionalenAssays, empfiehlt es sich, eine kleine Probe von isolierten Zellen Propidiumjodidfärbung unterzogen werden, um für eine genauere Torsteuern des lebensfähigen Pool von Zellen aus der gesamten Zellpopulation PP ermöglichen. Abschließend sei darauf hingewiesen, dass unser Verfahren zugänglich Zellsortierung Anwendungen, wenn eine bestimmte Zell-Untergruppe für adoptive Übertragung oder in vitro Analyse, zum Beispiel erwünscht ist ist.
Die Sammlung von PPs für Kryoschneiden ist relativ einfach, obwohl die eigentliche Schneiden der PP Gewebe schwierig sein kann. Es ist zwingend notwendig, dass zum Beispiel PP Gewebe richtig orientiert in Formen (dh senkrecht zu der Basis der Form), um sicherzustellen, dass die wahre Querschnitte erhalten werden, sind. Wir schlagen Snap-Gefrieren PP Geweben und dann Unterziehen der Kryoschnitte zum Präzipitieren Fixative wie Aceton oder Methanol zu Antikörperreaktivität ("Antigenität") zu erhalten, obwohl Präzipitieren Fixative Ergebnis einer Abnahme der gesamten zellulären und subzellulären Resolution. Wenn die Bewahrung Antigenität nicht ein besonderes Anliegen, dann empfehlen wir die Verwendung der Vernetzung Fixative wie Paraformaldehyd (PFA), die eine bessere Konservierung der zellulären und subzellulären Strukturen. Tatsächlich kann PFA verwendet, um Gewebe vor Kryoschneiden beheben. Einfach eintauchen frisch herausgeschnitten PPs in reichlichen Mengen von 4% PFA für> 2 Stunden, Waschen mit PBS Gewebe um überschüssiges Fixiermittel entfernen, äquilibrieren Gewebe in Saccharose (15%), falls gewünscht, und dann in OCT eingebettet, wie oben beschrieben. Das Gewebe kann dann kryogeschnitten, sondern muss mit Glycin-Lösung (0,1 M in PBS für 15 min) blockiert werden, um verbliebene reaktive PFA vor der Immunfärbung quenchen.
Da wir die Protokolle für Immunofluoreszenz Kennzeichnung PP Kryoschnitten beschrieben wurden, sind diese gleichen Abschnitte zugänglich Immunhistochemie (IHC) mit handelsüblichen IHC Kits (zB Vector Labs, Burlingame, CA). Für IHC, ist es unerlässlich, eine Peroxidase zu blockieren oder QuEnc gehörenhing Schritt in das Protokoll, als endogene Peroxidasen weit verbreitet in der Darmschleimhaut sind. Andere haben darauf hingewiesen, dass für die Immunhistochemie, Herzdurchblutungsbilddaten der Mäuse mit 4% Paraformaldehyd in PBS Gewebekonservierung verbessert.
Zusammenfassend haben wir parallel und ergänzend Protokolle für quantitative und funktionale Analyse von murinen PP Zellen, einschließlich Lymphozyten und DCs zur Verfügung gestellt. Die Herstellung von Einzelzellsuspensionen ermöglicht quantitativen und funktionellen in vitro-Analyse der wichtige Zelltypen in den PP, während Immunmarkierung von Kryoschnitten enthält Informationen hinsichtlich der Lokalisierung von bestimmten Zelltypen, sowie Zell-Zell-Interaktionen, die in situ existieren. Die wichtigste Einschränkung dieser beiden Ansätze ist, dass weder "real time" Visualisierung von PP Zell-Zell-Wechselwirkungen darstellt. Für den Augenblick wenigstens, haben PPs bewährt unempfindlich gegen intravital Bildgebung, eine Technik, die revolutionierte das Verständnis von Lymphozyten dynamisch hatcs in peripheren Lymphknoten. Bis die technischen Barrieren begrenzen intravital Bildgebung PPs überwunden werden, die Protokolle in diesem Artikel für die Vorbereitung PP einzelne Zelle Vorbereitungen für durchflusszytometrische und funktionale Analyse und PP Kryoschnitten für Immunfärbung umrissen wird das wichtigste Mittel zur Erforschung und das Verständnis der immunologischen Funktionen von bestimmten Sub bleiben -Populationen von Zellen in PPs, die primären induktiven Seiten des Darm-assoziierten lymphatischen Gewebe.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Renjie Song (Wadsworth Zentrum Durchflusszytometrie Core) für die Unterstützung bei Zellanalyse und Helen Johnson (Wadsworth Zentrum Tier Histopathologie Core) für die Herstellung von Paraffinschnitten. Wir danken Dr. Richard A. Cole (Wadsworth Zentrum Light Microscopy Core) für die Unterstützung bei der konfokalen Mikroskopie und Bild-Sammlung. Wir möchten Andy Bentley (Wadsworth Center Foto und Illustration) für die Unterstützung mit Animationen zu bestätigen.
MDJ wird von der Life Sciences Research Foundation, Howard Hughes Medical Institute (HHMI) Fellowship unterstützt. SA wird von einem Wadsworth Center-Health Research Inc. intramuralen Postdoc-Stipendium unterstützt. Diese Arbeit wurde zum Teil durch NIH Zuschüsse HD061916 und GM082978 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Artikel | Firma | Cat. # | Kommentare (optional) |
| Oktober Compound | Tissue-Tek | 4583 | |
| 7x7x5 mm Bodenform | Fisherbrand | 22-363-552 | |
| ImmEdge Pen | Vector Labs | H-4000 | |
| Superfrost Plus Objektträger | Thermo Scientific | 4951 | |
| Edge-Rite Klinge | Thermo Scientific | 4280L | |
| Anti-Maus CD11c-PE | eBioscience | 17-0114-82 | |
| Anti-Mouse CD45R/B220-APC | BD Pharmigen | 553092 | |
| Anti-Maus CD3-FITC | BD Pharmigen | 561798 | |
| Anti-Maus CD4-PE | BD Pharmigen | 553652 | |
| Anti-Mouse CD8-PE | BD Pharmigen | 553032 | |
| Anti-Mouse CD19-PerCP | BioLegend | 115531 | |
| Hanks balanced salt solution (HBSS) ohne Phenolrot | Fisher Scientific | 14175-079 | |
| 70 um Zellsieb | BD Falcon | 352350 | |
| Spleen Dissoziation Medium | Stem Cell Technologies | 7915 | |
| Ziegenserum | Invitrogen | 16210-072 | |
| FC-Baustein | ATCC 2.4.G2 | HB-197 | Supes von Zelllinie 2.4.G2 erhalten |
| Curved Scissor | FST | 14061-09 | |
| Kryostat | Leica | 3050S | |
| FACS Calibur | BD | ||
| Gräfin Cell Counter | Invitrogen | ||
| Hematoxylin | Richard Allan | 7211 | |
| Eosin | Richard Allan | 71304 | |
| Formalin | Starplex Scientific | 3661 | |
Tabelle 1. Reagenzien und Ausrüstung in dieser Studie verwendet. |
Referenzen
- Mantis, N. J., Rol, N., Corthesy, B. Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut. Mucosal. Immunol. 4, 603-611 (2011).
- Neutra, M., Mantis, N., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissue. Nature Immunology. 2, 1004-1009 (2001).
- Rescigno, M., Sabatino, A. D. i. Dendritic cells in intestinal homeostasis and disease. J. Clin. Invest. 119, 2441-2450 (2009).
- Suzuki, K., Kawamoto, S., Maruya, M., Fagarasan, S. GALT: organization and dynamics leading to IgA synthesis. Adv. Immunol. 107, 153-185 (2010).
- Iwasaki, A., Kelsall, B. L. Localization of distinct Peyer's patch dendritic cell subsets and their recruitment by chemokines macrophage inflammatory protein (MIP)-3alpha, MIP-3beta, and secondary lymphoid organ chemokine. Journal of Experimental Medicine. 191, 1381-1394 (2000).
- Iwasaki, A. Mucosal dendritic cells. Annu. Rev. Immunol. 25, 381-418 (2007).
- Lelouard, H., Fallet, M., de Bovis, B., Meresse, S., Gorvel, J. P. Peyer's Patch Dendritic Cells Sample Antigens by Extending Dendrites Through M Cell-Specific Transcellular Pores. Gastroenterology. 42, 592-601 (2011).
- Lelouard, H., et al. Pathogenic bacteria and dead cells are internalized by a unique subset of Peyer's patch dendritic cells that express lysozyme. Gastroenterology. 138, 173-184 (2010).
- Shreedhar, V. K., Kelsall, B. L., Neutra, M. R. Cholera toxin induces migration of dendritic cells from the subepithelial dome region to T- and B-cell areas of Peyer's patches. Infect. Immun. 71, 504-509 (2003).
- Favre, L., Spertini, F., Corthesy, B. Secretory IgA possesses intrinsic modulatory properties stimulating mucosal and systemic immune responses. J. Immunol. 175, 2793-2800 (2005).
- Kelsall, B. L., Strober, W. Distinct populations of dendritic cells are present in the subepithelial dome and T cell regions of the murine Peyer's patch. J. Exp. Med. 183, 237-247 (1996).
- Fukuda, S., Hase, K., Ohno, H. Application of a Mouse Ligated Peyer's Patch Intestinal Loop Assay to Evaluate Bacterial Uptake by M cells. J. Vis. Exp. (58), e3225 (2011).
- Geem, D., Medina-Contreras, O., Kim, W., Huang, C. S., Denning, T. L. Isolation and Characterization of Dendritic Cells and Macrophages from the Mouse Intestine. J. Vis. Exp. (63), e4040 (2012).
- Lopez-Guerrero, D. V., et al. Rotavirus infection activates dendritic cells from Peyer's patches in adult mice. J. Virol. 84, 1856-1866 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten