Method Article
Überwachen von Änderungen in der intrazellulären Calcium-Konzentration und Synaptic Wirksamkeit in der Muschel
In diesem Artikel
Zusammenfassung
Wir zeigen, wie Veränderungen in der intrazellulären freien Calciumkonzentration und synaptische Wirksamkeit gleichzeitig in einem Ganglion Herstellung überwachenden Aplysia. Wir Bild intrazellulärem Calcium unter Verwendung eines fluoreszierenden Farbstoffs, Calcium Orange, und induzieren und zu überwachen synaptischen Übertragung mit scharfen (intrazellulären) Elektroden.
Zusammenfassung
Es wurde vorgeschlagen, dass Änderungen in intrazellulärem Calcium die Induktion einer Reihe von wichtigen Formen der synaptischen Plastizität (zB homosynaptische Erleichterung) 1 vermitteln. Diese Hypothesen lassen sich durch gleichzeitiges Überwachen von Änderungen der intrazellulären Calcium-und Umbauten in der synaptischen Wirksamkeit getestet werden. Wir zeigen, wie dies durch die Kombination von Calcium-Imaging mit intrazellulären Aufnahme Techniken erreicht werden kann. Unsere Experimente sind in einer bukkalen Ganglienzellen der Mollusken Aplysia californica durchgeführt. Dieses Präparat hat eine Reihe von vorteilhaften Merkmalen experimentell: Ganglia leicht aus Aplysia entfernt werden und Experimente verwendet adulten Neuronen, die normale synaptische Verbindungen herzustellen und haben eine normale Ionenkanal Verteilung. Aufgrund der niedrigen Stoffwechsel des Tieres und den relativ niedrigen Temperaturen (14-16 ° C), die natürlich für Aplysia sind, sind die Vorbereitungen für längere Zeit stabil. ent "> Um Änderungen in der intrazellulären freien Calcium wir die Zelle impermeante Version von Calcium Orange 2, die leicht 'geladen' in einem Neuron über Iontophorese ist verwenden. erkennen Wenn diese langwellige Fluoreszenz-Farbstoff bindet an Kalzium, Fluoreszenzintensität steigt. Calcium Orange hat schnelle kinetische Eigenschaften 3 und im Gegensatz ratiometrische Farbstoffe (beispielsweise Fura 2), erfordert keine Filterrad zur Bildgebung. Es ist ziemlich stabil und weniger Foto phototoxische als andere Farbstoffe (zB Fluo-3) 2,4. Wie alle nicht-ratiometrische Farbstoffe, Calcium orange relativen Änderungen der Kalziumkonzentration anzeigt. Aber weil es nicht möglich ist, um Veränderungen in Farbstoffkonzentration durch Belastung und Diffusion, kann es nicht zur absoluten kalibrierten Calciumkonzentrationen bereitzustellen.
Ein aufrechter, feste Phase, zusammengesetzten Mikroskop wurde Bildes Neuronen mit einer CCD-Kamera in der Lage ist die Aufnahme etwa 30 Bildern pro Sekunde verwendet. In Aplysia diese zeitliche Auflösungist mehr als ausreichend, um auch nur einen einzigen Dorn induzierte Veränderung der intrazellulären Calcium-Konzentration zu detektieren. Sharp Elektroden gleichzeitig verwendet zu induzieren und aufzuzeichnen synaptischen Übertragung in identifizierten prä-und postsynaptischen Neuronen. Am Ende eines jeden Prozesses vereint ein benutzerdefiniertes Skript Elektrophysiologie und Bildgebung Daten. Um eine korrekte Synchronisation zu gewährleisten verwenden wir einen Lichtimpuls aus einer LED in den Kamera-Anschluss des Mikroskops montiert. Manipulation von präsynaptischen Kalziumspiegel (zB über intrazelluläre EGTA Injektion) ermöglicht es uns, spezifische Hypothesen über die Rolle der intrazellulären Calcium bei der Vermittlung verschiedener Formen von Plastizität zu testen.
Protokoll
Ein. Vorbereitung
- Das Tier zu betäuben durch Einspritzen 75-100 ml isotonischer Magnesiumchloridlösung. Die Aplysia verwenden wir für die Bildgebung sind in der Regel 150-200 Gramm und werden von Marinus Scientific erhalten.
- Merken die narkotisierten Tier zu einem Wachs bedeckt Gericht. Spritzennadeln funktionieren gut für diesen Zweck, sterile Techniken sind nicht erforderlich. Mit grober Pinzette und Standard-Schere einen Einschnitt in das Tier den Fuß und setzen die bukkalen Masse. Suchen Sie die bukkale Ganglion. Mit Feder Schere und feinen Pinzette vorsichtig kostenlos das Ganglion, indem alle bukkalen Nerven.
- Entfernen Sie das Ganglion und legen Sie sie in einem Sylgard beschichtete Schale mit künstlichem Meerwasser. Legen Sie ein paar Insekten Stifte durch die bukkalen Nerven das Ganglion stabilisieren. Desheath die bukkale Ganglion mit ultrafeinen Pinzette und Schere Feder, um so die Neuronen für intrazelluläre Aufnahme freizulegen. Dann wieder Pin das Ganglion mit etwa 15 fein Insekt (minutien) Pins. Das Ganglion müssen fest an ihrem Platz gehalten werden, da jede Bewegung wird während der Bildgebung problematisch.
2. Bereiten Elektroden
- Ziehen Sie Elektroden mit Glas Kapillarrohr mit Filament (zB WPI TW100F-4) und einen Abzieher. Einstellungen sollte individuell festgelegt werden, um Elektroden der erforderlichen Widerstand zu erzeugen. Wenn mit 3 M KAc gefüllt (Kaliumacetat) unserer Elektrodenwiderstand beträgt im allgemeinen etwa 10 MOhm, wenn die Elektroden zu abgeschrägt werden, oder etwa 5 MOhm wenn die Abschrägung Schritt ausgelassen sind.
- Füllen eines Satzes von Elektroden mit einer Lösung, die 3 M KAc/30 mM KCl mit einer Spritze und Nadel Mikrofilters. Diese Elektroden werden für die Elektrophysiologie verwendet werden.
- Füllen eines zweiten Satzes von Elektroden mit dem Calcium-Indikator-Farbstoff durch Eintauchen des hinteren Endes der Elektrode in Farbstoff zuvor rekonstituiert mit ca. 40 ul destilliertes Wasser für 500 &mgr; g Farbstoff. Wenn die Spitze der Elektrode gefüllt ist, zurück zu füllen etwa 1/4 Zolldes Endes der Elektrode mit 200 mM KCl um einen guten elektrischen Kontakt zu gewährleisten.
- Es ist vorteilhaft, die Elektroden Fase, wie dies erleichtert Farbstoffinjektion und reduziert die Beschädigung durch mehrfache Durchdringungen Membran durchgeführt. Wir verwenden ein benutzerdefiniertes Beveler die einen Strom von eine Salzwasser / Aluminiumoxidpulver Suspension erzeugt. Die Elektrode wird in einer Halterung montiert ist und ihre Spitze tritt in den Strom an einer 45 °-Winkel. Elektrodenwiderstand wird kontinuierlich überwacht und die Abschrägung beendet, wenn der Widerstand erreicht etwa 5 MOhm für KAc gefüllten Elektroden. Die Farbstoff gefüllten Elektroden für eine gleiche Zeitdauer abgeschrägt und haben typischerweise Widerstände von 15-20 MOhm.
3. Laden des Calcium-Indikatorfarbstoff
- Legen Sie die auf der Grundlage einer Elektrophysiologie rig und visuell suchen Sie die präsynaptischen Neuron von Interesse. Viele unserer Experimente sind mit einem identifizierten sensorischen Neuronen während der Fütterung, B21 5, 6 genutzt getan. Die relativ fest position, Größe (~ 100 um) und längliche Form der B21 die soma machen es leicht zu finden.
- Aufzuspießen das Neuron von Interesse mit einer Elektrode mit dem Calcium-Indikator-Farbstoff. B21 kann die Identität durch Aufspießen der postsynaptischen Neuron B8 überprüft werden. Depolarisation B21 mit ~ 8 nA Strom auslösen Spikes und Ergebnis bei der Erleichterung PSPs in B8 7.
- Inject Farbstoff in der präsynaptischen Neuron von Interesse, indem hyperpolarisierenden Impulse (typischerweise -15 nA, 1 Hz, 75% ED) für etwa 30 Minuten. Wenn Farbstoffbeladung erfolgreich ist, wird des Neurons Soma Erwerb eine schwache rosa Farbe. Entfernen der farbstoffhaltigen Elektrode durch langsames Herausziehen aus dem Neuron.
- Hinterlegen Zubereitungen für etwa 30 Minuten, damit der Farbstoff in die feinen Prozesse synaptischen Kontakt herzustellen mit Folger Neuronen diffundieren.
4. Calcium Imaging und elektrophysiologische Recording
- Legen Sie die Vorbereitung auf die Bildgebung MicroscOPE. Die Schale mit der Vorbereitung auf einem Kühltisch mit Stücken von Permagum Dichtschnur, die im Gegensatz Ton, bleibt klebrig, wenn feucht gehalten werden. Die feste Stage-Mikroskop konzentriert, indem das Ziel. Die Bühne bleibt stationär, welche ermöglicht Befestigung angebrachten Magneten Manipulatoren. Da die hohe Vergrößerung macht Vibrationen (insbesondere seitliche Bewegung) ein Problem, sollte die gesamte bildgebende Einrichtung auf einer Schwingungsisolierung Plattform platziert werden.
- Aufspießen präsynaptischen und postsynaptischen Neuronen mit Elektroden, die normale Elektrolyt-Lösung.
- Wählen Sie einen Filter Block geeignet Bild Calcium Orange (Anregung 549 nm, Emission 576 nm) 8 und stellen Sie die Kamera. Wissenschaftlichste CCD-Kameras kann der Untersucher eine Teilmenge der CCD-Zellen, die ausgelesen werden wählen. Darüber hinaus können die Zellen kombiniert (klassierten) werden. Auswählen einer kleineren Teilmenge erhöht die Geschwindigkeit, während Binning erhöht die Empfindlichkeit. Diese beiden Einstellungen, zusammen mit der Belichtungszeit, zu bestimmendie Frame-Rate, dh wie viele Bilder Sie pro Sekunde erfasst werden. Geeignete Einstellungen wird Bild eine Fläche von 580 x 350 um 2 mit 500 x 300 Pixel (mit einem 10x-Objektiv und einem 0,5-Kamera-Adapter). Fügen Neutralfilter zum Lichtweg, um die Beleuchtungsstärke auf die minimale Menge, die korrekte Belichtung mit einer Belichtungszeit <25 ms bietet einzustellen. Diese Einstellungen sollten in einer Bildrate von ca. 30 Hz führen - was in Aplysia ist schnell genug, um Bild single spike evozierte Calcium Veränderungen. Schließlich schließen Feldblende so dass nur der abgebildeten Fläche beleuchtet wird.
- In der Imaging-Software markieren des Neurons Regionen, die Sie messen möchten. Im Elements AR-Software wird dies in der "Time Measurement" Abschnitt, indem Regions of Interest (ROI) durchgeführt. B21 ein bipolarer Neuron und frühere Arbeiten haben gezeigt, dass ihre seitliche Prozess kontaktiert den postsynaptischen Neuron von Interesse 9. Wir in der Regel Bild primären, sekundären und tertiären branches des seitlichen Verfahrens, indem ein ROI über jeden Teil des Neurons. Eine zusätzliche ROI neben dem Farbstoff gefüllt Neuron wird gemessen, um einen Hintergrund-Wert, der von allen anderen später Datenpunkten subtrahiert wird bereitzustellen.
- Weisen Sie den Elektrophysiologie Akquisition (in diesen Experimenten Spike II) für ein Trigger-Signal von der "frame Auslese"-Signal der Kamera vorgesehen warten. Starten Sie die Bildaufnahme (Elements AR); Spike II wird nun startet die Aufnahme automatisch, wenn die Kamera nimmt seinen ersten Frame. Sie können auch ein TTL-Ausgang des Power 1401, kurz auf eine LED in der Mikroskop-Kamera-Anschluss montiert einzuschalten. Dies wird ein Signal, um anschließend zu synchronisieren bildgebende und elektrophysiologische Daten.
- Stimulieren das präsynaptische Neuron durch Injizieren einer Reihe von kurzen Stromimpulsen depolarisierende bei der gewünschten Frequenz. Es ist wichtig, jeden Impuls zu überwachen (z. B. mit einem Reiz ausgelöst Oszilloskop), um zu bestimmen, ob ein Aktionspotential successf istully erzeugt. Während Calcium Orange ist sehr photo-stabil im Vergleich zu anderen Farben, ist es eine gute Idee, eine kontrollierte Studie ohne Stimulation aufnehmen, um zu überprüfen, wie viel Farbbleichung auftritt.
- In Experimenten, in denen intrazelluläre Kalziumkonzentration manipuliert wird ein Arzneimittel, wie EGTA in das präsynaptische Neuron eingeführt und die Stimulation und Datenerfassung oben beschriebenen Schritte werden wiederholt.
5. Analyse von repräsentativen Daten
- Exportieren Sie die Bilddaten (die Liste der gemessenen Intensitätswerte für jede ROI), indem Sie ihn in eine Textdatei. Ein benutzerdefiniertes Skript in Spike II kann dann importieren Sie die Textdatei. Dieses Skript normalisiert auch die Werte mit den einzelnen Sonde Bereich, und subtrahiert den Wert des Hintergrunds Sonde. Die Datenpunkte werden dann neben den elektrophysiologischen Daten als "virtuelle RealWave" Kanal aufgetragen. Der "Kanal Prozess / Timeshift-Funktion" in Spike II wird verwendet, um genau ausrichten Bilddaten points, mit dem LED-Signal als Referenz.
- Um Werte als prozentuale Veränderung zu erhalten, analysiert die Bilddaten durch Berechnung der relativen Änderung in der Fluoreszenz als dF / F o = (FF o) / F o. F o die Fluoreszenzpegel kurz vor der Stimulus und F die Fluoreszenz während der Stimulus.
6. Repräsentative Ergebnisse

Abbildung 1. Insgesamt Schema des Experiments. Die Experimente werden in einem Ganglion Vorbereitung der Aplysia durchgeführt. Veränderungen der intrazellulären Calcium werden mit einem fluoreszierenden Farbstoff, der iontophoretisch in das präsynaptische Neuron eingeführt wird abgebildet. Prä-und postsynaptischen Neuronen werden dann mit scharfen Elektroden aufgespießt, so dass die synaptische Übertragung kann induziert und überwacht werden.
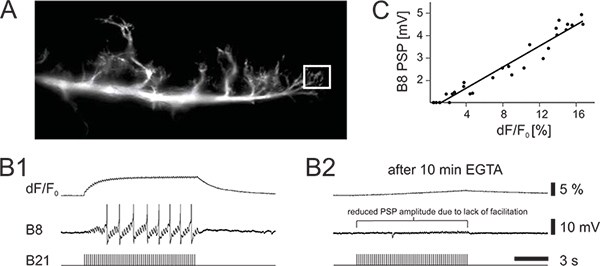
Abbildung 2. Calcium imaging und intrazelluläre Aufnahme von identifizierten Neuronen in der bukkalen Ganglion Aplysia. (A) Foto des abgebildeten Seitenarm des Neurons B21. Die Box gibt den gemessenen Bereich von Interesse. (B1) Intrazelluläre Stimulation der B21 erinnert Aktionspotentiale (untere Kurve) und die Erleichterung postsynaptischen Potentiale (PSPs) in der postsynaptischen Follower Neuron B8 (mittlere Spur), was es auch Feuer Aktionspotentiale. Erhöhungen der präsynaptischen Calcium Fluoreszenz sind in der oberen Kurve dargestellt. (B2) Effekt der präsynaptischen EGTA auf homosynaptische Erleichterung. EGTA wurde intrazellulär in B21 ~ 15 Minuten vor intrazelluläre Stimulation injiziert. Es wird vermutet, dass EGTA ein langsam wirkendes Calciumchelator, die bei niedrigen Konzentrationen ist nicht schnell genug auf die synaptische Transmission zu unterdrücken. Beachten Sie die Reduzierung der weit verbreiteten Kalzium-Signal und die entsprechende Abnahme der PSP Amplitude. (C) Die PSP Amplitude korreliert mit der präsynaptischen Calcium Signal. Klicken Sie hier für eine größere Abbildung zu sehen .
Diskussion
Wir demonstrieren Techniken, die verwendet werden, um gleichzeitig zu überwachen die intrazelluläre Calciumkonzentration und Beurteilung der Wirksamkeit der synaptischen Übertragung kann. Diese Techniken sind nützlich, um zu bestimmen, wie verschiedene Formen von kurzfristigen Plastizität vermittelt werden.
Das Abbildungssystem wird mit einem Fluoreszenzmikroskop und CCD-Kamera durchgeführt wird. Diese Anforderungen an die Ausrüstung sind relativ bescheiden, wenn die meisten der funktionellen Bildgebung set-ups verglichen. Die Technik ist einfach und leicht zu erlernen. Während Bildgebung mit einer CCD-Kamera ermöglicht die Visualisierung einer großen Fläche mit guter zeitlicher Auflösung, wird die räumliche Auflösung begrenzt. Es ist daher eine nützliche Technik für Testen von Hypothesen über die Rolle der relativ weit verbreitet oder 'Hintergrund' steigt der intrazellulären Calcium. Um die räumliche Auflösung und Dynamik Studie Calcium Stacheln zu verbessern, ein Laser-Scanning-Konfokalmikroskop, oder eine Zwei-Photonen-Mikroskop und das Calcium-Indikator Calcium Green I konntemit nur geringfügigen Änderungen des Protokolls 10 verwendet werden.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
A PHS Grant (MH51393) unterstützt diese Arbeit. Einige der Aplysia wir werden von den nationalen Ressource für Aplysia der University of Miami unter Grant RR10294 vom National Center for Research Resources, NIH zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent Name | Firma | Katalog-Nummer | Kommentar |
| Calcium orange | Invitrogen | C-3013 | |
| EGTA | Sigma | E-4378 | |
| Calcium Kalibrierpuffer Kit | Invitrogen | C-3008MP | zum Testen der Empfindlichkeit und den Dynamikbereich des Signals |
| Magnesiumchloridhexahydrat | Sigma | M0250 | verwendet in 0,33 M Lösung Tier zu betäuben |
Tabelle 1. Reagenzien verwendet.
| Ausrüstung Name | Firma | Kommentar |
| FN-1 aufrecht Fluoreszenzmikroskop | Nikon Instruments | mit Narishige ITS-FN1 Bühne |
| NMN-21 Manipulatoren | Narishige | montiert auf der Bühne mit Magneten |
| CoolSNAP HQ 2-CCD-Kamera | Photometrics | |
| NIS Elementen AR (Version 3.22) | Nikon Instruments | Imaging-Software verwendet werden, um Fluoreszenz-Daten zu erfassen |
| 10X/0.3w Plan Fluor Ziel | Nikon Instruments | Dieses Wasser Immersionslinse hat einen sehr langen Arbeitstag Abstand von 3,5 mm |
| X-Cite 120 PC Metallhalogenidlampe | EXFO | verwendet für die Fluoreszenz-Bildgebung |
| LS-DWL Halogenlampe | Sumica | |
| ET-CY3 Filter-Set | Chroma Technology | ; |
| Macht 1401 A / D-Wandler | Cambridge Electronic Design | Probenahme wurde bei 3 kHz getan |
| Spike II (Version 7.07) | Cambridge Electronic Design | Software zur Elektrophysiologie Daten erfassen |
| SEC-10 LX-Verstärker | NPI-Elektronik | verwendet mit einem 10X Headstage |
| Modell 410 Verstärker | Brownlee Präzision | zum Verstärken und Filtern des Signals |
| WS-4 | minus k Technologie | Schwingungsisolierung für die Bildgebung |
| Kühltisch | Maßarbeit | Messingplatte durch welche Eiswasser mit einer variablen Rate gepumpt |
Tabelle 2. Ausrüstung verwendet.
Referenzen
- Zucker, R. S., Regehr, W. G. Short-term synaptic plasticity. Annu. Rev. Physiol. 64, 355-405 (2002).
- Eberhard, M., Erne, P. Calcium binding to fluorescent calcium indicators: Calcium green, calcium orange and calcium crimson. Biochem. Biophysical Res. Comm. 180, 209-215 (1991).
- Escobar, A. L., Velez, P., Kim, A. M., Cifuentes, F., Fill, M., Vergata, J. L. Kinetic properties of DM-nitrophen and calcium indicators: rapid transient response to flash photolysis. Eur. J. Physiol. 434, 615-631 (1997).
- Ivanov, A. I., Calabrese, R. L. Modulation of spike-mediated synaptic transmission by presynaptic background Ca2+ in leech heart interneurons. J. Neurosci. 23, 1206-1218 (2003).
- Rosen, S. C., Miller, M. W., Evans, C. G., Cropper, E. C., Kupfermann, I. Diverse synaptic connections between peptidergic radula mechanoafferent neurons and neurons in the feeding system of Aplysia. J. Neurophysiol. 83, 1605-1620 (2000).
- Ludwar, B. C. h., Evans, C. G., Jing, J., Cropper, E. C. Two distinct mechanisms mediate potentiating effects of depolarization on synaptic transmission. J. Neurophysiol. 102, 1976-1983 (2009).
- Evans, C. G., Ludwar, B. C. h., Askansas, J., Cropper, E. C. Effect of holding potential on the dynamics of homosynaptic facilitation. J. Neurosci. 31, 11039-11043 (2011).
- Haugland, R. P. . The Handbook. , (2005).
- Borovikov, D., Evans, C. G., Jing, J., Rosen, S. C., Cropper, E. C. A proprioceptive role for an exteroceptive mechanoafferent neuron in Aplysia. J. Neurosci. 20, 1990-2002 (2000).
- Goldberg, J. H., Yuste, R. Chapter 38: A practical guide: Two-photon calcium imaging of spines and dendrites. Imaging in Neuroscience and Development. , (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten