Method Article
Die Messung linksventrikulärer Druck in der späten embryonalen und neugeborenen Mäusen
In diesem Artikel
Zusammenfassung
Messen Drucks der linken Herzkammer (LV) in der embryonalen und neugeborenen Mäusen beschrieben. Der Druck wird durch Einführen einer Nadel mit einem Fluid gefüllten Wandler in der LV unter Ultraschallführung gemessen. Es ist darauf zu normaler Herzfunktion während des experimentellen Protokolls zu halten.
Zusammenfassung
Der Blutdruck steigt deutlich während der embryonalen und postnatalen Entwicklung bei Wirbeltieren. Bei der Maus ist der Blutfluss erste nachweisbare rund embryonalen Tag (E) 8.5 1. Systolischer linksventrikulärer (LV) Druck ist bei 2 mmHg und 11 mmHg E9.5 an E14.5 2. An diesen mittleren Embryonalstadien ist der LV deutlich sichtbar durch die Brustwand für invasive Druckmessungen, da die Rippen und die Haut noch nicht voll entwickelt sind. Zwischen E14.5 und Geburt (etwa E21) bildgebende Verfahren zu verwenden, um die LV ansehen zu können. Nach der Geburt, des mittleren arteriellen Druck steigt von 30 bis 70 mmHg aus postnatalen Tag (P) 2 - 35 3. Jenseits von P20, kann arteriellen Druck mit Solid-State-Katheter (dh Millar oder Scisense) gemessen werden. Bevor P20, sind diese Katheter zu groß für die Entwicklung der Maus Arterien und arteriellen Druck zu messen mit benutzerdefinierten gezogen Kunststoff-Katheter an Flüssigkeit gefüllte Druckaufnehmern 3 oder Glasmikropipetten att werdenschmerzte zu Servo null Druckaufnehmer 4.
Unsere jüngsten Arbeiten hat gezeigt, dass der größte Anstieg des Blutdrucks während der späten embryonalen zu frühen postnatalen Phase bei Mäusen 5-7 auftritt. Dieser große Anstieg des Blutdrucks kann glatter Muskelzellen (SMC) Phänotyp bei der Entwicklung von Arterien beeinflussen und steuern wichtige Mechanotransduktion Veranstaltungen. In der menschlichen Krankheit, wo die mechanischen Eigenschaften zu entwickeln Arterien, die durch Defekte in Proteinen der extrazellulären Matrix (dh Marfan-Syndrom 8 und supravalvuläre Aortenstenose 9) gefährdet sind die rasanten Veränderungen im Blutdruck kann während dieser Frist zu Krankheits-Phänotyp und Schwere durch Veränderungen in der Mechanotransduktion beitragen Signale. Daher ist es wichtig, dass die Veränderungen des Blutdrucks während der späten embryonalen und neonatalen Zeiträume in Mausmodellen menschlicher Erkrankungen zu messen.
Wir beschreiben eine Methode zur Messung LV Druck im spätenembryonalen (E18) und der frühen postnatalen (P1 - 20) Mäusen. Eine Nadel, die an einem mit Flüssigkeit gefüllten Druckwandler in der LV unter Ultraschallführung eingefügt. Es wird darauf geachtet, um normale Herzfunktion während der experimentellen Protokoll halten, besonders für die embryonale Mäuse. Repräsentative Daten präsentiert und Einschränkungen des Protokolls diskutiert.
Protokoll
1. Ultraschall-und Drucksystem
- Entlang der Ultraschall-System nach den Anweisungen des Herstellers (Vevo 770 VisualSonics). Füllen Sie den geeigneten Sonde (Alter E18 - Modell P7 = 708, Alter> = P7 Modell 707B) mit destilliertem Wasser und eine Verbindung mit dem Ultraschall-System. Legen Sie die Sonde in den einstellbaren Stand auf der ungefähren Orientierung notwendig, um eine lange LV-Achs-Ansicht für eine Maus auf dem Imaging-Plattform montiert, so dass der LV Spitze in Richtung der Injektion Arm gerichtet ist zu erhalten.
- Das Drucksystem aus einem mit Flüssigkeit gefüllten Druckwandler, Brückenverstärker, Datenerfassung und Datenerfassungssoftware (LabChart). Die Anschlüsse bestehen aus Drei-Wege-Hähne, Schläuche, Luer-Locks und Schlauchtüllen. Ein 20 ml Spritze mit 10% heparinisierter Kochsalzlösung zum Spülen an einem Ende aufgefüllt. Das andere Ende wird mit einer Nadel und einer 3 ml Spritze Körper zur Verwendung als Gehäuse, um die Nadel in der Rohrleitung Injektionsarms (Abbildung 1) zu halten modifiziert.
- Kalibrieren Sie den Druckwandlersystem mit einem Manometer.
- Montieren der Nadel Schlauch und dem Gehäuse in der Injektionsarms des Ultraschallsystems. Klemmen Sie den Druckaufnehmer in einem Ring-Stand auf der ungefähren Höhe des Imaging-Plattform. Befestigen Sie eine entsprechende Nadel für die Altersgruppe der Maus (Alter E18 - P3 = 30G, Alter> P3 = 25G) an der Nadel Schlauch. Kleinere Nadeln erhalten verstopft zu erleichtern, sind schwieriger zu durch die Brustwand voranzubringen, und eine langsamere Reaktionszeit. Daher ist die größte Größe, die Nadel in der LV Lumen passt für jedes Alter.
- Legen Sie einen Berg von Ultraschall-Gel auf dem Imaging-Plattform und vorsichtig eine Linie mit der Sonde mit dem verstellbaren Ständer, so dass die Nadel direkt in das Gel vorangetrieben werden unter dem Zentrum des Imaging-Sonde (Abbildung 2). Die Nadel muss weit genug unter die Sonde sein, um nicht durchlöchern die Sondenabdeckung, aber nahe genug, um innerhalb der Sonde Schärfentiefe sein. Falls erforderlich, kann die Nadel von Hand gebogen werden, so dass es in th bleibte richtige Flugzeug während seiner Reise.
- Aufrechterhaltung der Ausrichtung, die Nadel zurückziehen und heben Sie die Imaging-Sonde, um eine Maus auf dem Imaging-Plattform platzieren. Spülen Sie die Nadel nicht mit einer Gel, das die Spitze eingegangen ist, zu beseitigen.
2. Maus-Vorbereitung
- Alle Methoden in diesem Protokoll haben gezeigt, von der Institutional Animal Care und Use Committee genehmigt worden. Anesthetize eine zeitgesteuerte schwangere Mutter (E18) oder neugeborenen Mäusen (P1 - 20) durch kontinuierliches Einatmen von 1,5% Isofluran. Schläuche lassen sich in einem Standard-Nasenkonus eingefügt werden, um den kleinen Kopf eines frühen neonatalen Maus (P1 - 15) unterzubringen.
- Sichern Sie die Maus an den Imaging-Plattform des Ultraschall-System in einer Rückenlage mit der Position LV Spitze in Richtung des Injektionsarm. Für Schwangere gelten Ultraschall-Gel auf die Herzfrequenz mit der beiliegenden EKG-Detektor überwacht und legen Sie die rektale Thermometer zur Regelung der Körpertemperatur. Neugeborene Mäuse sind zu klein foder diese Detektoren, so Herzfrequenz während der Druckmessungen überwacht und die Körpertemperatur wird mit einem externen Wärmelampe gehalten.
- Entfernen Sie Haare aus dem Bauch der schwangeren Mutter oder der Brust des jungen Maus mit einer Enthaarungscreme. Neugeborenen Mäusen (P1 - 10) benötigen keine Haarentfernung.
- Für schwangere Mütter, schnitt den Bauch mit Dissektion und einer gebogenen Pinzette. Externalisieren ein Uterushorn und auf Gaze angefeuchtet mit warmer Kochsalzlösung. Sorgfältig zu manipulieren, einen Embryo in die richtige Position, um eine parasternal langen Achse des LV mit der Ultraschallsonde zu erhalten. Messen Sie den Druck in allen Embryonen auf dieser Seite vor Externalisierung der anderen Uterushorn. Halten alle Embryonen und den Bauch der Mutter feucht periodische Zugabe von warmer Kochsalzlösung.
3. Druckmessung
- Ort vorgewärmt, entgastem Ultraschall-Gel auf die embryonalen oder neonatalen Maus. Neugeborenen Mäusen, die nicht gewesen sein depilierter sollte eine kleine Menge Ultraschallgel Verreiben auf der Brust, bevor das restliche Ultraschallgel angelegt wird, um Kopplung zu verbessern. Senken Sie die Imaging-Sonde und stellen Sie den Winkel des Imaging-Plattform, um eine optimale LV parasternal langen Achse zu erhalten. Verstellen Sie nicht die Winkel der Sonde, weil die Nadel Ausrichtung gehen verloren.
- Unter Beobachtung der LV Bild auf dem Ultraschall-Bildschirm langsam vorwärts, bis es die Nadel in der Nähe der Unterseite der Sonde ist. Stellen Sie die Nadel und Sonde können, falls erforderlich, um eine Ausrichtung Verschiebungen zu korrigieren. Vorsichtig spülen Sie die Nadel mit Kochsalzlösung. Starten Sie die Aufnahme von Daten und Null Druck den Druckwandler mit dem LabChart Software. Der Wandler driftet mit der Temperatur und der Position, so ist es wichtig, um es genau auf Null vor jeder Messung in jeder Maus.
- Langsam Die Nadel, bis sie am Rand des Ultraschall-Bild zu sehen ist, aber noch nicht im LV. Stellen Sie die Nadel können, falls erforderlich, um die LV an der gewünschtenApex. Stellen Sie die Sonde Position, falls nötig, um ein klares Bild der Nadel aufrecht zu erhalten. Schieben Sie die Nadel in den LV-Lumen (Abbildung 3), während die Aufzeichnung von Druckdaten und die Überwachung der Nadel Lage auf dem Ultraschallbild. Der Beginn der pulsatilen Aufnahmen aus dem Druckwandler bestätigt die Position innerhalb der LV Lumen (4).
- Wenn die Nadel scheint in der LV-Lumen sein, aber Druck-Aufnahmen sind nicht pulsatilen, bündig mit einem leichten Schlag auf den Kolben der Spritze, bis nur ein Druckanstieg detektiert wird (ca. 5 - 10 l Volumen). Diese sollten jedoch keine Clogs, die verhindert werden kann eine genaue Ablesung. Wenn Druckablesungen noch nicht pulsierend, kann die Nadel über oder unter dem korrekten Ebene liegen und nicht in den LV Lumen eingeführt werden. Ziehen Sie die Nadel, spülen mit Kochsalzlösung, und vorher noch einmal. Wenn pulsatile Lesungen immer noch nicht erhalten werden, gehen Sie zum nächsten Maus. Verwenden Sie eine neue Nadel für jede Maus.
- Erfolgreiche Druckwerte können von 75% erzielt werdendie embryonalen und neugeborenen Mäusen versucht. Lesungen sollten 5 - 10 Minuten je und die Druckdaten für eine Maus sollte nicht im Lieferumfang enthalten, wenn die Herzfrequenz signifikant verschieden sind als erwartet werden (Abbildung 5A). Die Herzfrequenz hat einen signifikanten Effekt auf Herz-Kreislauf-Maßnahmen und veränderte Herzfrequenz sind bezeichnend für Herzbeschwerden. Embryonale Not tritt in der Regel 1 bis 1,5 Stunden nach der ersten Externalisierung der Gebärmutter, ist so wichtig, Geschwindigkeit zur Messung von Drücken in einem ganzen Wurf.
4. Repräsentative Ergebnisse
Alle Ergebnisse gelten für C57BL6J Mäusen. Ein Bild von der Nadel in der LV Lumen für einen P1 Maus in 3 gezeigt. Die Nadel ist notwendig zum Durchstechen der Brustwand und Zugang zu dem kleinen LV Lumen, aber es erhöht die Reaktionszeit des Drucksystems. Wenn eine ungefähre Schritt Druckanstieg manuell auf das System angewendet, ist die Zeit bis 67% der maximalen Druck erreicht 0,067 sichc mit dem Schlauch nur (wahrscheinlich Hinweis auf die tatsächliche Zeit, den Druck Schritt gelten), 0,105 Sekunden mit einer 25 G-Nadel und 0,529 Sekunden mit einer 30 G-Nadel. Die Verzögerung bei Erreichen der maximalen Druck in den Kurven vollständig in 4A und 4C ersichtlich ist. Obwohl die Reaktionszeit ist langsamer mit der 30G Nadel wird die Wellenform besser auf den embryonalen und frühen neonatalen Stadien gefangen genommen, weil die Herzfrequenz steigt mit dem Alter bei Mäusen 5. Trotz dieser Einschränkung kann der systolische Druck unter der Annahme berechnet, dass die wahre LV diastolischen (Mindest-) Druck Null ist, und der systolische (maximale) LV Druck ist zwei mal die mittlere LV Druck von den Lesungen im Steady State (4B und 4D bestimmt ) 6. Es wird allgemein angenommen, dass der systolische LV und arteriellen Drücke gleich sind. Die gemessenen Herzfrequenzen und berechnet LV Drücke für verschiedene Altersstufen zwischen E18 und P14 sind in Abbildung 5 dargestellt.

Abbildung 1. Das Bild des Druckaufnehmers mit angeschlossenem Drei-Wege-Hähne, männlich (M) und weiblichen (F) Luer-Lock-Anschlüsse, Schlauchtüllen, Schläuche, Spritzen und Nadeln.

Abbildung 2. Das Bild des bis die Nadel mit der Imaging-Sonde (A) ausrichten gesetzt. Abbildungssystem Plattform ist so gedreht, dass der LV Spitze des Maus vor der Injektion Arm. Die Sonde wird in dem verstellbaren Ständer in der ungefähren Orientierung notwendig angebracht, um eine LV langen Achse Bild zu erhalten. Die Nadel Schlauch Gehäuse in der Einspritzleitung Arm montiert. Die Nadel wird in einem Haufen Ultraschallgel auf der Imaging-Plattform, um den richtigen Winkel und vertikale und horizontale Position in Bezug auf die Abbildungssonde (B) zu bestimmen vorgeschoben.
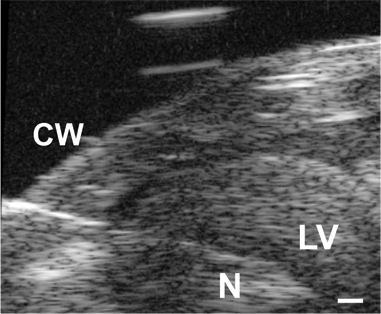
Abbildung 3. Das Bild der Nadel (N) vorangetrieben durch die Brustwand (CW) undin den LV Lumen in einem P1-Maus. Maßstabsbalken = 0,1 mm.

4. Beispiel pulsierenden Druckablesungen, wenn die Nadel die LV eines E18 (A) und P14 (C) Mauscursor. Es gibt eine Verzögerung im Erreichen eines stationären Zustand durch die Reaktionszeit des Systems mit der Nadel befestigt ist. Zoom Blick auf die Messwerte in einem stabilen Zustand in B und D. Beachten Sie, dass die Mindest-E18 LV Druck nahe Null sind dargestellt, aber die volle Wellenform von Null bis zum maximalen Druck kann nicht bei den höheren Herzfrequenzen von P14 Mäusen aufgenommen werden. Die mittlere Drücke werden aus den stationären Messungen gemessen und es wird angenommen, dass systolischer Druck = 2 x gemessenen mittleren Druck.

Bild 5 gemessen Herzfrequenz (A) und berechnet systolischen Druck LV (B) für E18 -. P14 Mäusen. N = 7 für E18, 5 für P1, P3 für 22, 23 für P7 und P14 für 16 7.5.
Diskussion
Das Protokoll hier vorgestellten stellt ein Verfahren zum Messen LV Druck in späten und frühen embryonalen neugeborenen Mäusen. Die wichtigste Einschränkung dieses Protokolls ist die zeitliche Auflösung des Drucksystems. Das Drucksignal wird gedämpft, da es von der LV bewegt sich durch die Nadel an den Wandler, und nur der mittlere Druck-Werte aufgezeichnet werden können. Die Dämpfung kann mit der größten Nadel möglich minimiert werden, sondern muss die Nadel innerhalb des LV Lumen für verschiedene alte Mäuse passen. Da der diastolische Druck als Null angenähert werden kann, kann der LV und folglich arteriellen systolischen Druck der mittleren LV-Druck Messungen ermittelt werden. Obwohl zusätzliche arterielle Variablen wäre ideal (dh Pulsdruck), bietet der systolische Druck wertvolle Informationen über die Kräfte auf das Herz-und Herz-Kreislauf-System während der Maus-Entwicklung ausgeübt. Die Vorteile dieses Protokoll sind die Leichtigkeit, Schnelligkeit und Wiederholbarkeit der Messungen für hohe throughput Vergleich verschiedener Genotypen Maus oder Behandlungsprotokolle. Durch die Messung des systolischen Drucks an kritischen Entwicklungsphasen, können wir beginnen, das Zusammenspiel von mechanischen Kräften und der daraus resultierenden Herz-und Herz-Kreislauf-Struktur und Funktion in der menschlichen Krankheit zu verstehen.
Solid-State-Katheter als Goldstandard für Druckmessungen und haben eine überlegene zeitliche Auflösung im Vergleich zu mit Flüssigkeit gefüllten Wandler. Die Standardgrößen für Solid-State-Maus-Katheter sind 1.0F (0,33 mm, Millar), 1.2F (0,4 mm, Scisense) oder 1.4F (0,47 mm, Millar). Wir erhalten gute arteriellen Druckwerte bei Mäusen älter als P21 mit dem 1.2F Scisense Katheter und P30 Mäusen mit dem 1.4F Millar-Katheter. Wir haben die 1.0F Millar Katheter in P14 Mäusen ausprobiert, aber nicht bekommen konsequente arteriellen Druck Lesungen. In P21 Mäusen, verglichen wir unsere systolischen LV Druckmessungen mit arteriellen Druck von einem 1.2F Scisense Katheter. Der errechnete systolische LV BlutDruck (67 ± 5 mmHg) für alle Mäuse durchweg niedriger als der systolische Blutdruck (87 ± 9 mmHg) und wurde sehr nahe bei der mittleren arteriellen Druck (65 ± 8 mm Hg) mit dem Festkörper-Katheter gemessen schließen, aber beide Katheter identifiziert signifikante Unterschiede zwischen den Genotypen 5. Aus diesem Grund empfehlen wir die beschriebenen LV-Druck-Methode nur für E18 bis P20 Mäusen. Gezogen Kunststoff-Katheter können, um mit Flüssigkeit gefüllte Drucksensoren angebracht werden und vorangetrieben durch die Halsschlagader zu erhalten arteriellen Druckmessung 3. Aber dieses System immer noch nur Datensätze bedeuten Druckmessungen und in unseren Händen war zeitaufwändiger und hatten eine höhere Ausfallrate als die LV Druckmessungen hier vorgestellt. Servo-Null-Druck-Systeme (World Precision Instruments) haben eine höhere Auflösung für die Messung kleiner Drücke und haben eine bessere zeitliche Auflösung 4. Allerdings erfordern Servo-Null-Systeme nicht leitenden Mikropipetten, in der Regel glEsel, zum Einsetzen in der Messstelle, die nicht durch die Brustwand älterer Mäuse vorgeschoben werden kann.
Betäubende Wirkung muss bei der Extrapolation dieser Druckmessungen, wach zu Mäusen werden. Es hat sich gezeigt, dass Isofluran die beste Wahl für kardiovaskuläre Effekte minimiert 10 ist und wenn alle Mäuse mit dem gleichen Verfahren sind Vergleiche zwischen verschiedenen Gruppen gültig ist. Die embryonalen und neugeborenen Mäusen sind zu klein für den Standard-EKG-und Temperaturfühler auf dem Imaging-Plattform. Die Herzfrequenz muss in den Druck-Aufnahmen und durch Visualisierung des schlagenden LV auf dem Ultraschall-Bildschirm überwacht werden. Alle Mäuse, die sehr langsame Herzfrequenz zeigen können Herzbeschwerden sein und sollte nicht in der Druck-Analyse einbezogen werden. Die Mäuse müssen warm gehalten werden und embryonale Mäuse müssen feucht gehalten werden während des experimentellen Protokolls. Andere Forscher haben Methoden entwickelt, um die Embryonen in warmen physiologischen Salin eintauchene in der gesamten Imaging-Periode 11, aber wir haben herausgefunden, dass eine Wärmelampe und regelmäßige Anwendung von warmen Kochsalzlösung aus, um gesunde Embryonen mit den erwarteten Herzfrequenz während der kurzen experimentellen Zeitraum aufrechterhalten können. Solange Belichtungszeit auf etwa eine Stunde gehalten wird, haben wir nicht signifikante Variabilität zwischen dem ersten und dem letzten gemessenen Embryo beobachtet, aber die Messungen müssen schnell durchgeführt werden, um Daten auf einer ganzen Wurf zu sammeln.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde finanziert, zum Teil durch Zuschüsse NIH HL087653 und HL105314. Einige der Methoden wurden im Labor von Dr. Robert Mecham an der Washington University School of Medicine entwickelt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz / Ausrüstung | Firma | Katalog-Nummer | Kommentare |
| Hochauflösende Ultraschall-System | VisualSonics | Vevo 770 | Oder anderen geeigneten Ultraschall-System |
| Hochfrequenz-Ultraschall-Sonden | VisualSonics | 708 und 707B | |
| Imaging-Plattform und Injektionsarm | VisualSonics | Imaging Station 2 | Mit EKG und Temperatur Regelung der Plattform |
| Druckaufnehmer | AD Instruments | MLT 844 | |
| Brückenverstärker | AD Instruments | ML221 | |
| Datenerfassungssystem | AD Instruments | ML866 | |
| Daten-Recording-Software | AD Instruments | LabChart | |
| Ring stehen und klemmen | Verschiedene Anbieter | Um Druckaufnehmer während der Messungen halten | |
| 3-Wege-Hähne mit Luer-Anschlüsse, Steckerverriegelungselement | Cole Parmer | 30600-02 | |
| 1/16 "ID Tygon-Schlauch | Cole Parmer | 06408 | |
| Männliche und weibliche Luer w / 1/16 "Schlauchtülle | Cole Parmer | 45510-50 45510-00 | |
| 24 "-Schlauch mit männlichen und weiblichen Luer an jedem Ende | Cole Parmer | 30600-60 | |
| 3 und 10-ml-Spritzen | BD Biosciences | ||
| 30 und 25G Nadeln | BD Biosciences | 1,5 Zoll in der Länge | |
| Big Ben Manometer | Riester | 1456-100 | |
| Saline | Verschiedene Anbieter | ||
| Heparin | Verschiedene Anbieter | ||
| Ultraschallgel | Parker | Aquasonic 100 | |
| Haar-Entferner Lotion | Nair |
Referenzen
- Ji, R. P. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circ. Res. 92 (2), 133-135 (2003).
- Ishiwata, T., Nakazawa, M., Pu, W. T., Tevosian, S. G., Izumo, S. Developmental changes in ventricular diastolic function correlate with changes in ventricular myoarchitecture in normal mouse embryos. Circ. Res. 93 (9), 857-865 (2003).
- Huang, Y., Guo, X., Kassab, G. S. Axial nonuniformity of geometric and mechanical properties of mouse aorta is increased during postnatal growth. Am. J. Physiol. Heart Circ. Physiol. 290 (2), H657-H664 (2006).
- Ishii, T., Kuwaki, T., Masuda, Y., Fukuda, Y. Postnatal development of blood pressure and baroreflex in mice. Auton. Neurosci. 94 (1-2), 34-41 (2001).
- Le, V. P., Knutsen, R. H., Mecham, R. P., Wagenseil, J. E. Decreased aortic diameter and compliance precedes blood pressure increases in postnatal development of elastin-insufficient mice. Am. J. Physiol. Heart Circ. Physiol. , (2011).
- Wagenseil, J. E. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ. Res. 104 (10), 1217-1224 (2009).
- Wagenseil, J. E. The importance of elastin to aortic development in mice. Am. J. Physiol. Heart Circ. Physiol. 299 (2), H257-H264 (2010).
- Ramirez, F., Sakai, L. Y., Rifkin, D. B., Dietz, H. C. Extracellular microfibrils in development and disease. Cell. Mol. Life Sci. 64 (18), 2437-2446 (2007).
- Li, D. Y. Elastin point mutations cause an obstructive vascular disease, supravalvular aortic stenosis. Hum. Mol. Genet. 6 (7), 1021-1028 (1997).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., Ross, J. Jr Impact of anesthesia on cardiac function during echocardiography in mice. Am. J. Physiol. Heart Circ. Physiol. 282 (6), H2134-H2140 (2002).
- Phoon, C. K. Imaging tools for the developmental biologist: ultrasound biomicroscopy of mouse embryonic development. Pediatr. Res. 60 (1), 14-21 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten