Method Article
Herstellung von mikrostrukturierten Hydrogele für Neural Kultur-Systeme mit Dynamic Mask Projektion Photolithographie
In diesem Artikel
Zusammenfassung
Einfache Techniken für die schnelle Herstellung von mikrostrukturierten neuronalen Kultur-Systeme mit Hilfe eines digitalen Mikrospiegel für die dynamische Maske Projektion Lithographie auf regelmäßige Zellkultursubstraten beschrieben. Diese Kultur-Systeme können mehr Vertreter des natürlichen biologischen Architektur, und die beschriebenen Techniken könnten für zahlreiche Anwendungen angepasst werden.
Zusammenfassung
Zunehmend werden gemusterte Zellkultur-Umgebungen zu einer relevanten Technik, um zelluläre Eigenschaften zu studieren, und viele Forscher glauben an die Notwendigkeit für 3D-Umgebungen, um in vitro-Experimenten, die besser in vivo Qualitäten 1-3 Mimik darstellen. Studien in Bereichen wie der Krebsforschung 4, Neural Engineering 5, Herzphysiologie 6 und Zell-Matrix-Interaktionen 7,8 haben gezeigt, das Verhalten der Zelle unterscheidet sich wesentlich von traditionellen Monolayerkulturen und 3D-Konstruktionen.
Hydrogele sind als 3D-Umgebungen aufgrund ihrer Vielfalt, Vielseitigkeit und die Fähigkeit, maßgeschneiderte molekulare Zusammensetzung durch Funktionalisierung 9-12 verwendet. Zahlreiche Techniken existieren für die Erstellung von Konstrukten als Zell-unterstützenden Matrizen, einschließlich Elektrospinnen 13, Elastomer-Stempel 14, Inkjet-Druck 15, additive Photostrukturierungsverfahren 16, statische Photomaske Projektions-Lithografie 17 und dynamische Maske Mikrostereolithographie 18. Leider beinhalten diese Verfahren mehrere Produktionsschritte und / oder Geräte nicht ohne weiteres zu herkömmlichen Zell-und Gewebekultur-Methoden. Die Technik in diesem Protokoll verwendeten passt die beiden letztgenannten Methoden, mit Hilfe eines digitalen Mikrospiegel (DMD), um dynamische Photomasken für die Vernetzung von geometrisch bestimmten Poly-(Ethylenglykol) (PEG)-Hydrogele, durch UV-initiierte radikalische Polymerisation induziert erstellen. Die daraus resultierende "2.5D"-Strukturen bieten eine eingeschränkte 3D-Umgebung für neuronale Wachstum. Wir beschäftigen ein Dual-Hydrogel-Ansatz, bei dem PEG dient als Zell-restriktiven Region liefern Struktur einer ansonsten formlose, aber Zell-permissive selbst organisierenden Gel entweder Puramatrix oder Agarose hergestellt. Der Prozess ist eine schnelle einfache Schritt Fabrikation, die in hohem Maße reproduzierbar und leicht angepasst für den Einsatz mit konventionellen Zellkultur-Methoden und Substraten.
Ganze Gewebe Explantate wie embryonalen Spinalganglien (DRG), können in das duale Hydrogel-Konstrukte für experimentelle Tests wie Neuritenwachstum integriert werden. Darüber hinaus können dissoziierten Zellen in der photovernetzbaren oder selbst Polymerisation Hydrogel verkapselt werden, oder selektiv auf die durchlässige Trägermembran mit Zell-restriktiven Photostrukturierungsverfahren eingehalten werden. Mit der DMD, haben wir Hydrogel-Konstrukte bis ~ 1 mm dick, aber dünner Film (<200 um) PEG-Strukturen wurden durch Sauerstoff Abschrecken der radikalischen Polymerisationsreaktion begrenzt. Daraufhin haben wir eine Technik entwickelt, unter Verwendung einer Schicht von Öl über die Polymerisation Flüssigkeit, die dünn PEG-Struktur Polymerisation erlaubt.
In diesem Protokoll, beschreiben wir die rasche Erstellung von 3D-Hydrogel-Systeme zur Herstellung von mikrostrukturierten neuronalen Zell-und Gewebekulturen. Die Dual-Hydrogel-Konstrukte zeigten hier vertreten vielseitig in-vitro-Modellen, die nützlich für Studien im Bereich der Neurowissenschaften mit Überleben der Zelle, Migration und / oder Neuritenwachstum und-richtlinien können. Außerdem ist, wie das Protokoll kann für viele Arten von Hydrogelen und Zellen arbeiten, sind die potenziellen Anwendungen sowohl vielfältig und umfangreich.
Protokoll
1. DMD-Setup
- Die DMD Bord, UV-Lichtleiter (mit Kollimator) und 4x Objektiv sind alle senkrecht auf einer Schwingungsisolierung Tisch montiert.
- Das UV-Licht führen sollte so eingestellt sein, dass das Licht den Spiegel Array trifft in einem Winkel von 45 ° gegenüber der Ebene der Spiegel, und 24 ° unterhalb der Ebene der Spiegel (Abbildung 1).
- Das Objektiv ist so montiert, dass der Abstand von der DMD auf das Objektiv der Brennweite mit dem Objektiv verbunden entspricht.
- Eine inverse Mikroskop unter dem Objektiv, so dass das gebündelte Licht von der DMD reflektiert wird, kann sichtbar gemacht werden durch das Mikroskop gelegt. Der Abstand vom Objektiv, um die Polymerisation Oberfläche sollte ungefähr dem Arbeitsabstand des Objektivs entspricht. Die Bühne auf dem Mikroskop kann dann verwendet werden, um diesen Abstand anzupassen, um fein Fokus des Bildes werden. Dieser Abstand kann je nach der gewählten Polymerisationstemperatur Oberfläche.
2. Dual-Hydrogel-Konstrukte für das Tissue Explantation Kulturen
A. DRG Explantation Haftung
- Streichen Sie die Wände des 6-well Kollagen beschichteten Zellkultur-Einsätze (Corning) mit Regen-X, wobei darauf zu achten die Membran selbst zu vermeiden. (Alternativ kann auch eine hydrophobe Barriere Stift verwendet werden.)
- Hydrate Einsätze über Nacht mit 1,5 ml Haftung Medium in einem Brutschrank bei 37 ° C und 5% CO 2. Adhesion Medium Neurobasalmedium mit 10% fötalem Rinderserum, 1% Penicillin / Streptomycin, 0,5 mM L-Glutamin und 20 pg / mL NGF.
- Ernte embryonalen Spinalganglien (DRG) von E-15 Rattenbabys. DRG sollte auf Kollagen beschichtet 6-well-Einsätze beschichtet werden, so viele wie vier pro Einsatz.
- Inkubieren Einsätze für 2 Stunden bis zur DRG Einhaltung der Membran zu ermöglichen.
B. Dynamische Maske Photopolymerisation
Eine digitale Mikrospiegel (DMD) ist ein 1024 x 768 Array einzelner Spiegel, ähnlich wie in der Projektion Fernsehgeräte, die selektiv reflektiert das Licht auf Spiegel Position. Für unsere Zwecke ist der DMD zu Muster ultravioletten (UV) Licht auf photovernetzbaren Hydrogele verwendet, wodurch vorgebbare Hydrogel-Geometrien in eine einfache und schnelle Weise. Abbildung 1 zeigt den Aufbau des DMD-und UV-Licht-Pfad. Obwohl unsere DMD ist eine eigenständige Einheit, kann das Gerät auch für den Einsatz mit vielen vorhandenen Mikroskope integriert werden.
- Entfernen Sie alle überschüssige Flüssigkeit aus einfügen, und fügen Sie 500 ul der Polymerisationsmedium Inneren des Einsatzes. Polymerisation Medium enthält 10% PEG (MW 1000) und 0,5% Irgacure 2959 in Neurobasalmedium mit 20 ug / mL NGF und 1% Pen / Strep ergänzt aufgelöst.
- Den Einsatz unter dem DMD-Gerät auf einem Regen-X behandelt Glasträger.
- Legen Sie das entsprechende Schwarz-Weiß-Bild, das als "Fotomaske" auf dem DMD eingesetzt werden, durch den Einsatz der mitgelieferten ALP-3 grundlegenden GUI-Programm. Für unsere Zwecke war ein gabelnden Form gewählt, um für die Umsetzung der Neuriten Leitsysteme ermöglichen.
- Mit einem inversen Mikroskop zur Visualisierung, richten Sie das Gewebe Explantate mit den entsprechenden Speicherort auf der Photomaske mit einer sichtbaren Lichtquelle reflektieren die DMD.
- Schalten Sie das sichtbare Lichtquelle für die UV-Lichtquelle, und beleuchten die PEG-Lösung bis Vernetzung ausreichend ist. (Für den gegebenen Bedingungen und 5,0 Watt / cm 2 trifft auf den DMD, Vernetzung kann in weniger als 55 Sekunden abgeschlossen sein.) Wiederholen Sie für alle vier DRG an dem Einsatz.
- Wash jeder Einsatz dreimal mit sterilem DPBS und 1% Pen-Strep.
- Fügen Sie 1,5 ml Wachstumsmedium unter der Zellkultur-Einsätzen, und lassen Sie sie in einen Inkubator für 30 Minuten ausgleichen. Growth Medium Neurobasalmedium mit 2% B-27, 1% Pen / Strep, 0,5 mM L-Glutamin und 20 pg / mL NGF.
C. Secondary Hydrogel
Puramatrix
- Für neuronale Anwendungen, beträgt 1% Puramatrix nach den Anweisungen des Herstellers zu 0,15% in sterilem H 2 O verdünnt und ergänzt mit 1 pg / mL löslich Laminin.
- Alle überschüssige Medien müssen von der PEG Hohlräume, die die DRG Explantate enthalten, mit einem sterilen Wattestäbchen, Kimwipe oder Mikropipette entfernt werden.
- Puramatrix ist es, die PEG Hohlräume mit einer Mikropipette zugesetzt, um den leeren Raum ohne überzulaufen füllen. Je nach Porenvolumen, typischerweise ~ 1 ul pro Konstrukt verwendet wird.
- Puramatrix beginnt der Prozess der Selbstorganisation sofort bei Kontakt mit einer physiologischen Kochsalzlösung, dh die geschwollenen PEG, aber 1,5 ml Wachstumsmedium wird unter dem Einsatz aufgenommen und in den Inkubator für eine Stunde auf insgesamt Gelierung zu gewährleisten.
- Zunächst Puramatrix leicht sauer ist, so verändern die Medien nach einer Stunde, damit der pH-Wert ins Gleichgewicht.
- Medien Veränderungen sind etwa alle 48 Stunden erforderlich. Achten Sie darauf, dass alle Medienaufgenommen unter dem Einsatz, um die Integrität der mechanisch schwach Puramatrix schützen.
Agarose
- Für neuronale Anwendungen ist Agarose auf eine 1% ige Lösung in Wachstumsmedium verdünnt und in einem 60 ° C Wasserbad, bis die Agarose vollständig gelöst hat (~ 1 h). Die Lösung wird dann mit 1 pg / mL löslich Laminin ergänzt.
- Alle überschüssige Medien müssen von der PEG Hohlräume entfernt werden.
- Agarose ist die PEG Hohlräume hinzugefügt, um den leeren Raum ohne überzulaufen füllen. Je nach Umfang der Leere, in der Regel ca. 1 mL pro Konstrukt wird verwendet.
- 1,5 ml Wachstumsmedium vorgekühlte (8 ° C) in einer 6-Well-Platte und die Agarose mit Einsätzen an den gekühlten Medien überführt und im Kühlschrank bei 8 ° C für mindestens 3 Minuten auf Agarose zu ermöglichen Gel.
- Schließlich sind die Einsätze auf 1,5 mL vorgewärmtes Nährmedium (37 ° C) überführt und im Brutschrank bei 37 ° C, mit den Medien erforderlichen Änderungen alle 48 Stunden.
3. Dual-Hydrogel 3D-Zell-Encapsulation
Dual-Hydrogel-Verkapselung ist angebracht, wenn mit jeder sich selbst organisierenden Gel. Die photovernetzbaren Gel, in diesem Fall PEG, dient als strukturelle Unterstützung für die geometrische Darstellung des sich selbst organisierenden Gel, zum Beispiel Puramatrix oder Agarose. Einige der Methoden, insbesondere die Art des Gels und die Wahl der Photomaske, wird auf den jeweils gewünschten Anwendung ab.
- Legen Sie eine entsprechende Maske auf dem DMD. Für unsere Anwendung das Überleben der Zelle, wir haben einfach eine zylindrische Präsentation Puramatrix in der Bildgebung von Zellen zu unterstützen. Forscher studieren Zellsignalisierung interessiert sein könnte in einem Kompartiment Geometrie für die Verbreitung von chemotaktischen Molekülen ermöglichen. Zusätzlich wurde eine grobe Annäherung an eine Arterie dargestellt, um mögliche Anwendung Blutgefäß Forschung zu vertreten.
- Behandeln Sie die Wände aus einem Polyester Zellkultureinsatzes mit Regen-X und unter DMD auf Regen-X beschichtete Folie.
- Add 500 ul der Polymerisation Medium, um die Einlage. Induce PEG Vernetzung durch Bestrahlung mit UV-Licht für 55 Sekunden.
- Wash dreimal mit sterilem DPBS und 1% Pen-Strep.
- Entfernen Sie alle überschüssige Medien aus dem PEG Hohlräume.
- Spin down Zellen in die gewünschte Dichte zu einem Pellet. Es muss darauf geachtet, alle Mittel aus dem Zellpellet vor dem Mischen zu entfernen, da Puramatrix beginnt self-assembly sofort bei Kontakt mit einer Salzlösung werden. Suspend die Zellen im Inneren 0,15% Puramatrix in sterilem H 2 O verdünnt mit 10% Saccharose.
- Spritzen Sie die Puramatrix / Zelle / Saccharose-Gemisch im Inneren Hohlräume in PEG.
- Fügen Sie 1,5 ml Wachstumsmedium unter dem Einsatz, und lassen Sie Gel in Inkubator für 1 Stunde.
- Ändern Medien nach einer Stunde, und ~ alle 48 Stunden danach.
4. Einzel-Hydrogel 3D-Zell-Encapsulation
Ein einziger Hydrogel Kapselung wäre angemessen für jede Situation, wo die Zellen im Inneren kann ein photovernetzbaren Hydrogel untersucht werden.
- Legen Sie eine entsprechende Maske auf dem DMD. Für das Überleben der Zelle Studien haben wir wieder wählte eine grundlegende runde Maske, um einen Zylinder darstellen. Masken ähnlich wie in Methode 4 gezeigt werden konnte wieder für die entsprechende Forschung Feld angelegt werden.
- Gönnen ein Polyester Zellkultureinsatzes mit Regen-X und unter DMD auf Regen-X beschichtete Folie.
- Zellen bei jeder gewünschten Konzentration kann direkt an die 10% PEG-Lösung zugegeben werden, gut mischen, um eine homogene Verteilung zu gewährleisten.
- Add 500 ul der Polymerisation Medium, um die Einlage. Induce PEG Vernetzung durch Bestrahlung mit UV-Licht für 55 Sekunden.
- Wash dreimal mit sterilem DPBS und 1% Pen-Strep.
- Füllen Sie mit Nährmedium sowohl unterhalb als auch auf der Oberseite des Einsatzes, ändert sich jeden ~ 2 Tage.
5. Thin Film Hydrogel-Polymerisation
- Legen Sie eine entsprechende Maske auf dem DMD.
- Gönnen eine Kollagen-beschichtete Polyester-Zellkultur-Einsatz mit Regen-X, und am Regen-X beschichtete Folie.
- Ausreichend Polymerisationsmedium gerade bedeckt den Boden des Einsatzes (~ 250-300 ul für 6-Well-Platte-Einsätze). Lassen Sie die Medien, um den Einsatz Membran für 30-45 Minuten bei Raumtemperatur durchziehen.
- Entfernen Sie überschüssiges Polymerisationsmedium aus dem Einsatz mit einer Mikropipette oder Kimwipe. Fügen Sie eine ausreichende Menge an UV-transparent Öl vollständig bedecken den Boden des Einsatzes. Lassen Sie die Einlage für 15-30 Minuten bei Raumtemperatur stehen lassen, lange genug für die Öl zu einer deutlichen Schicht über dem Polymerisationsmedium Sättigung des Einsatzes Membran bilden.
- Den Einsatz und schieben Sie unter der DMD. Induce PEG Vernetzung durch Bestrahlung mit UV-Licht. Aufgrund der geringen Dicke der PEG-Schicht kann die Vernetzung in weniger als 15 Sekunden bei 5,0 Watt / cm 2 trifft auf den DMD abgeschlossen sein.
- Waschen Sie die Einlage dreimal mit sterilem DPBS und 1% Pen-Strep. (Wenn das Fortbestehen eines öligen Rückstandes ist ein Anliegen, können Sie ein mildes Reinigungsmittel wie Tween 20 (1%) auf den Waschpuffer hinzugefügt werden.)
- Bewahren Sie den Einsatz in einer 6-well Gewebekulturplatte. Add Wachstum mittel-bis suspendierten Zellen, in der gewünschten Konzentration und Pipette ein ausreichendes Volumen der Zellsuspension in der Zellkultur einfügen, um die gewünschte Zelldichte zu erhalten. Dann fügen Sie genug Wachstumsmedium unter dem Einsatz vollständig zu erhalten Lebensfähigkeit der Zellen (~ 1,5 mL).
- Nach 48 Stunden vergangen sind, waschen Sie die Einlage dreimal mit sterilem DPBS und 1% Pen-Strep keine unadhered Zellen zu entfernen. Ändern Medien etwa einmal alle 48 Stunden.
6. Repräsentative Ergebnisse
Beispiele für Dual-Hydrogel-Konstrukten, die DRG Explantate werden in Abbildung 2 dargestellt. Beachten Sie, dass zelluläre Migration und Neuriten Erweiterung der Zelle permissive Region des dualen Hydrogel-Konstrukt ist begrenzt. Abbildung 3 zeigt dissoziierten Zellen ähnlich im Dual-Hydrogel-Konstrukte gekapselt. Aufgrund der dynamischen Natur des DMD Photomaske ist die Geometrie für Kapselung nur durch die Abmessungen und die Auflösung der Optik beschränkt. Verkapselung von Zellen wurde auch in einem einzigen photopolymerisierbaren Hydrogel, PEG möglich ist, und eine Live / Dead Lebensfähigkeit Test wurde durchgeführt, wie in Abbildung 4 zeigt. Encapsulation in PEG ist nur als Beispiel gemeint, wie PEG stellt kein ideales Umfeld für Nervenzellen. Daher ist die Lebensfähigkeit der Zellen in unserem PEG-Konstrukte realisiert verständlicherweise gering. Schließlich werden Beispiele zur Nutzung dünne PEG-Filme als gemusterte restriktive Schicht für die Zelladhäsion auf Zellkultur-Einsätzen in Abbildung 5 dargestellt. Darüber hinaus werden Beispiele für mögliche "schlechte" Ergebnisse in Abbildung 6 angeboten.
Die Ergebnisse stellen nur einen kleinen Bruchteil der möglichen Anwendungen der Methoden in unserem Labor entwickelt. Sie sollen die Benutzerfreundlichkeit und Vielseitigkeit und die Lebensfähigkeit unseres Ansatzes zu demonstrieren, und könnte als "proof of principle" behandelt werden, für die Forscher ihre eigenen möglichen Anpassungen zu entwickeln.

Abbildung 1. Schematische Darstellung der Lichtweg für die Photolithographie verwendet. Kleines Bild: Das UV-Licht beleuchtet die DMD in einem Winkel von 45 ° und 24 ° unterhalb der Ebene des Spiegels Array.

Abbildung 2. Labeled Wachstum und die Vermehrung in DRG mit Dual-Hydrogel-Konstrukte. AD) Bilder porträtieren polymerisiert PEG-Konstrukte (grau) mit Neuriten mit Beta III Tubulin (grün), DAPI gefärbten Zellkerne (blau) gekennzeichnet. Die DRG Explantate werden in Puramatrix enthalten und befindet sich in der kreisförmigen Bereiche des Musters, mit Neuriten wachsen in Richtung der Bifurkation (s).

Abbildung 3. Dual-Hydrogel-Konstrukten, die Zellen mit Calcein AM, ein Live-Zell-Marker, nach 48 Stunden in Wachstumsmedium gekennzeichnet. AD) Verschiedene PEG Formen, mit Puramatrix mit dissoziierten DRG-Neuronen (~ 5x10 3 Zellen / ml) gefüllt.

Abbildung 4. Einzel-Hydrogel-Konstrukt, das lebende Zellen mit Calcein AM (grün) und toten Zellen mit Ethidium Homodimer-1 (rot) nach 24 Stunden in Wachstumsmedium beschriftet (5x10 3 Zellen / ml) markiert.
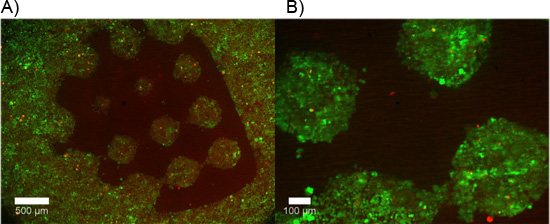
Abbildung 5. Zelle restriktive PEG als dünner Film mit einer "Testbild", um selektiv haften dissoziierten Zellen, die Kollagen-beschichtete Membran durchlässiger unterstützt polymerisiert. A, B) Lebende Zellen werden nach 48 Stunden mit Calcein AM (grün) gekennzeichnet, während tote Zellen mit Ethidium Homodimer-1 (rot) gekennzeichnet sind. Minimal Zelladhäsion tritt in den Bereich mit der dünnen PEG-Film.

Abbildung 6. Repräsentative Bilder unerwünschten Ergebnissen führen. A) Teilweise Polymerisation von PEG, was zu einem unbrauchbaren PEG konstruieren. Unsachgemäße Polymerisation kann durch die Anwesenheit eines Meniskus in der Pre-Polymer-Medium, unzureichende Mengen an Polymerisationsmedium, unzureichende UV-Bestrahlung oder unsachgemäße Brennpunkt der Optik auftreten. B) Bild porträtiert polymerisiert PEG-Konstrukte (grau) mit Neuriten mit Beta III Tubulin (grün), DAPI gefärbten Zellkerne (blau) gekennzeichnet. Die Neuriten konnten außerhalb der gemusterten PEG-Kanäle wachsen. Dies geschieht häufig in der Bedingung, dass Puramatrix Overflows auf dem PEG Teil während der Injektion.
Diskussion
Das hier beschriebene Verfahren kann von jedem Forscher, die einfache und reproduzierbare Zellkultur-Systeme verwendet werden. Theoretisch aufgrund der Vielzahl von photopolymerisierbare Hydrogele zur Verfügung, könnte der Umgebung zugeschnitten für den Einsatz mit jedem Zelltyp, darunter ganze Gewebe Explantate zu ermöglichen. Darüber hinaus ermöglicht die Dual-Hydrogel-System für verbesserte räumliche Steuerung in der Präsentation der Selbst-Polymerisation von Hydrogelen, die zu amorphen Formen auf ihren eigenen neigen. Die daraus resultierende "2.5D" mikrostrukturierten Hydrogel-Konstrukte bieten eine 3D-Matrix für neuronale Wachstum in einem 2D-Konfiguration, die praktische mikroskopische Auswertung ermöglicht vorgestellt. Der Untergrund, auf dem die Gele polymerisiert werden kann auch variiert werden, was eine größere Kontrolle in experimentellen Designs. Unsere Methoden sind für die Verwendung mit Zellkultur durchlässig unterstützt optimiert, da haben wir eine verbesserte Rentabilität (Abbildung 4) im Vergleich zur Polymerisation auf Glasplättchen (Daten nicht gezeigt). Jedoch können auch andere Polymerisation Flächen werden eher für unterschiedliche Anwendungen: Fertigung auf Glasplättchen in der Mikrofluidik Experimente oder Zellverbandes Formationen, zum Beispiel verwendet.
Unsere Erfahrungen mit diesen Systemen Kultur hat zur Identifizierung von potenziellen Problembereichen geführt. Erstens sind sorgfältige Techniken erforderlich, um die Sterilität der Konstrukte zu erhalten. Aufgrund der sperrigen Natur des DMD-Setup, ist es schwierig, Polymerisation Schritte unter sterilen Bedingungen arbeiten. Zur Bekämpfung dieses Problems ist die Spülschritt in den beschriebenen Methoden hilfreich, und Antibiotika sollten in allen Medien verwendet werden. Darüber hinaus ist die endgültige Dicke und Form der polymerisierten konstruieren stark abhängig von der Flüssigkeit Verhalten der Pre-Polymer-Mischung, und das Vorhandensein eines Meniskus kann in Gel-Konstrukte, die zu dünn oder unvollständig polymerisiert (Abbildung 6) sind das Ergebnis. Zwei Schritte können unternommen werden, um die Bildung eines Meniskus in der Zellkultur-Einsätze zu minimieren. Für dicke Hydrogele (> 200 Mikrometer), eine einfache Beschichtung von Regen-X um die Innenwand des Einsatzes ist ausreichend. Doch wie kurz erwähnt, für dünne Konstrukte (<200 um) beschrieben, ist eine Ölschicht erforderlich, um beide zu minimieren des Meniskus und negieren Sauerstoff Abschrecken der radikalischen Polymerisation. Resolution wurde festgestellt, dass abhängig von der Dicke, mit einer Abnahme der Strukturgröße mit immer dickeren Gelen realisiert. Die Auflösung variiert je nachdem, ob die Funktion ein positives oder negatives Relief dargestellt in dem Hydrogel. Allerdings erzielten wir eine ausreichende Auflösung für Konstrukte mit minimalen Strukturbreiten in der Größenordnung von ~ 100 pm nur mit Mikroskop-Objektive als Fokussieroptik.
Unsere Experimente haben gezeigt, dass die Dual-Hydrogel-Konstrukte beschrieben hier eine hervorragende Basis für die Bildung von grundlegenden In-vitro-Modelle von Neuritenwachstum und Beratung zu vertreten. Die Mikrostrukturierung verwendete Technik ist eine Anpassung der bestehenden Methoden 18,19, aber unser Set-up betonte ein einfach zu bedienendes Design implementieren und wurde für die Produktion von Dual-Hydrogel-Konstrukte auf Zellkultur-Einsätze optimiert, Zellkultur-Inserts wurden von entscheidender Bedeutung für die Verbesserung der Lebensfähigkeit der Zellen sowie als Vernetzer rund zuvor anhaftendem Gewebe Explantate. Der Umfang der Ergebnisse wird um die Interessen unserer Labor beschränkt, aber wir glauben, dass die Methoden in dieser Publikation beschrieben werden als nützlich erweisen, um Forscher auf der Suche nach einem relativ billig, schnell und einfach zu bedienen Methode für die Herstellung von 3D-Zellkultur Modelle.
Offenlegungen
Danksagungen
Die Autoren möchten an das Labor von Prof. Anthony Windebank für die gemeinsame Nutzung ihrer Expertise auf DRG Dissektion und Kultur zu danken, sowie Prof. Shaochen Chen für hilfreiche Diskussionen über die DMD-Setup. Diese Arbeit wurde teilweise durch Tulane University und Zuschüsse aus dem Louisiana Board of Regents finanziert (LEQSF [2009-10]-RD-A-18) und der NIH (NS065374).
Materialien
| Name | Company | Catalog Number | Comments |
| Digital Micromirror Device | Texas Instruments | DLPD4X00KIT | |
| Collagen Coated Transwell Permeable Support | Corning | 3491 | Also referred to as Cell Culture Insert in manuscript |
| Polyester Transwell Permable Support | Corning | 3412 | Also referred to as Cell Culture Insert in manuscript |
| Neurobasal Medium | Invitrogen | 21103-049 | |
| Fetal Bovine Serum | Invitrogen | 16000-036 | |
| L-glutamine | Invitrogen | 25030-164 | |
| Nerve Growth Factor | Invitrogen | 13257-019 | |
| Pen/Strep | Invitrogen | 15140-122 | |
| B-27 Supplement | Invitrogen | 17504-044 | |
| DPBS | Invitrogen | 14190-250 | |
| Puramatrix | BD Biosciences | 354250 | |
| PEG 1000 | Polysciences, Inc. | 15178 | |
| Irgacure 2959 | Ciba Specialty Chemicals | 0298913AB | |
| Oil | Have used both canola oil and silicon oil | Needs to be UV transparent, and minimize +/- meniscus formation | |
| OmniCure Series 1000 | EXFO | ||
| Rain-X |
Referenzen
- Abbott, A. Cell culture: biology's new dimension. Nature. 424, 870-872 (2003).
- Schindler, M. Living in three dimensions: 3D nanostructured environments for cell culture and regenerative medicine. Cell Biochem Biophys. 45, 215-227 (2006).
- Maltman, D. J., Przyborski, S. A. Developments in three-dimensional cell culture technology aimed at improving the accuracy of in vitro analyses. Biochemical Society Transactions. 38, 1072-1075 (2010).
- Smalley, K. S., Lioni, M., Herlyn, M. Life isn't flat: taking cancer biology to the next dimension. In Vitro Cell Dev Biol Anim. 42, 8-9 (2006).
- Irons, H. R. Three-dimensional neural constructs: a novel platform for neurophysiological investigation. Journal of Neural Engineering. 5, 333-341 (2008).
- Bursac, N. Cultivation in rotating bioreactors promotes maintenance of cardiac myocyte electrophysiology and molecular properties. Tissue Eng. 9, 1243-1253 (2003).
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294, 1708-1712 (2001).
- Cushing, M. C., Anseth, K. S. Materials science. Hydrogel cell cultures. Science. 316, 1133-1134 (2007).
- Kloxin, A. M., Kasko, A. M., Salinas, C. N., Anseth, K. S. Photodegradable hydrogels for dynamic tuning of physical and chemical properties. Science. 324, 59-63 (2009).
- Geckil, H., Xu, F., Zhang, X., Moon, S., Demirci, U. Engineering hydrogels as extracellular matrix mimics. Nanomedicine (Lond). 5, 469-484 (2010).
- Luo, Y., Shoichet, M. S. A photolabile hydrogel for guided three-dimensional cell growth and migration. Nature Materials. 3, 249-253 (2004).
- Wylie, R. G., Shoichet, M. S. Two-photon micropatterning of amines within an agarose hydrogel. Journal of Materials Chemistry. 18, 2716-2721 (2008).
- Ji, Y. Electrospun three-dimensional hyaluronic acid nanofibrous scaffolds. Biomaterials. 27, 3782-3792 (2006).
- Moeller, H. C., Mian, M. K., Shrivastava, S., Chung, B. G., Khademhosseini, A. A microwell array system for stem cell culture. Biomaterials. 29, 752-763 (2008).
- Xu, T. Viability and electrophysiology of neural cell structures generated by the inkjet printing method. Biomaterials. 27, 3580-3588 (2006).
- Liu Tsang, V. Fabrication of 3D hepatic tissues by additive photopatterning of cellular hydrogels. FASEB J. 21, 790-801 (2007).
- Beebe, D. J. Microfluidic tectonics: A comprehensive construction platform for microfluidic systems. Proceedings of the National Academy of Sciences of the United States of America. 97, 13488-13493 (2000).
- Lu, Y., Mapili, G., Suhali, G., Chen, S. C., Roy, K. A digital micro-mirror device-based system for the microfabrication of complex, spatially patterned tissue engineering scaffolds. Journal of Biomedical Materials Research Part A. 77, 396-405 (2006).
- Naiser, T., Mai, T., Michel, W., Ott, A. Versatile maskless microscope projection photolithography system and its application in light-directed fabrication of DNA microarrays. Review of Scientific Instruments. 77, 063711-063711 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten