Method Article
解剖、固定和可视化 果蝇 蛹
摘要
本方案详细介绍了果 蝇 蛹固定组织的制备和可视化。它可用于完整或受伤的组织,并保留组织的原始结构。解剖、固定和染色的步骤在本文中均有介绍。
摘要
果蝇黑腹蛹在过程中几天不动,在此期间它们发展出具有薄透明成虫外皮的新身体。它们的不动性和透明度使其成为体内实时成像实验的理想选择。许多研究都集中在蛹的背上皮单层上,因为它的可接近性和相对较大的尺寸。除了研究上皮力学和发育外,骨骼一直是研究伤口愈合的理想组织。受伤后,整个上皮修复过程可以通过6-12小时的实时成像来捕获。尽管notum在实时成像中很受欢迎,但很少有已发表的研究使用固定的notum样本。固定和染色是几乎所有其他果蝇组织的常用方法,利用了简单细胞染色和抗体的大量库。然而,蛹是脆弱的,从体内取出后容易卷曲和变形,因此很难补充现场成像。该协议为固定和染色蛹提供了一种简单的方法,无论是完整的还是在激光损伤后。使用这种技术,将蛹的腹侧粘在盖玻片上以固定蛹,并且仔细地去除,固定和染色公瘤。上皮套安装在载玻片上或两个盖玻片之间,以方便从组织的背侧或腹侧进行成像。
引言
在过去的十年中, 黑腹果蝇 的蛹越来越多地用于实时成像研究,因为该动物既不动又具有透明的角质层,在此阶段具有透明的角质层1,2,3,4,5,6,7。然而,蛹的解剖和固定具有挑战性,因此很难用抗体和细胞染色来补充活体成像研究。这项工作的总体目标是创建一种可重复的方案,用于解剖和固定蛹,以便在新的或先前的活体成像样品上进行抗体和细胞染色。
当幼虫开始时,表皮从幼虫角质层中拉出,形成坚硬的蛹病例8。分解幼虫身体计划,并制定新的成年身体计划。在此期间,蛹是不动的,使其成为实时成像的理想选择。一种常见的成像组织是蛹,一种在背胸部形成的成体单层上皮。经过简单的解剖以去除蛹病例9后,可以在视觉上访问notum。然后可以安装整个动物,并且可以对notum进行数小时或数天的实时成像,使其成为研究发育,体内平衡和受伤后上皮细胞行为的理想组织10,11,12,13,14。然而,切屑和修复是具有挑战性的,因为它是脆弱的,并且覆盖着疏水的薄透明的成人角质层。这种疏水性角质层使其在从身体其他部位移除时容易在水溶液中卷曲。因此,Notum解剖和固定的报道很少,并且解剖通常没有描述15,16,17,18。如果文献中没有详细的方案, 果蝇 研究人员很难用蛹染色来补充活体成像。
该技术旨在可重复地解剖和修复先前已实时成像的样本,包括那些被激光打伤的样本。由于活体成像需要切除蛹病例,因此这种解剖技术首先切除蛹前病例,这与以前在蛹病例4,19,20内固定或一分为二的方案不同。骨是一种脆弱的组织,受伤可能会加剧其脆弱性。因此,为了支持这种脆弱的组织,将鼻孔的外皮(上皮和附着的透明成人角质层)以及头部和腹部的一部分从蛹的其余部分解剖出来,同时始终浸没在水环境中。这种方法降低了组织卷曲和不可用的可能性。该技术早在受伤后30分钟(图1E-H)和受伤后3小时(图1I-L)就成功地染色了受伤的Notum组织。该方案有望在结核发育或伤口修复期间有效。目前的技术将有助于希望将蛹的实时成像能力与大量可用的免疫组化试剂相结合的研究人员。
研究方案
果 蝇(果蝇)在标准玉米粉 - 糖蜜培养基上维持在25°C。这些研究是在EGFP标记的组蛋白H2A蛹(w[*];P{w+mC=His2Av-EGFP.C}2/SM6a).这些苍蝇是从公共库存中心获得的(见 材料表)。
1. 蛹固定
- 将2"双面胶带条涂在显微镜载玻片上。
- 在25°C升高的小瓶中识别白色预疻,并使用标记物指示它们在小瓶外的位置。将小瓶返回25°C。
注意:白色前疸的特征在于它们的不动,白色和刺状的呼吸器。这些在铵形成(APF)或P1 8阶段后0-1小时形成。 - 12-15小时后,使用解剖镜小心地取出3-4个指示的蛹(不弹出它们),并将它们收集在胶带旁边的显微镜载玻片上。
注意:蛹现在是P5阶段,在蛹的前端8可以看到一个切开的头囊。 - 将蛹至少相距一个宽度放在胶带上,腹侧向下。
- 将一滴胶水放在石蜡膜上(见 材料表)或离心管盖中。将0.1-10μL移液器吸头(无移液器)的末端浸入粘合剂胶水滴中。在距离角落1 cm x 1 cm的24 mm x 60 mm(1.5厚度)盖玻片上点击移液器尖端两次,形成一条粘合胶线〜1/2的蛹长度。
- 预设一个0.2-2 μL (P2) 移液器至2 μL,将一个200 μL (P200)移液器预设为200 μL,并用吸头安装,以便它们准备好填充1x PBS + 0.1 mM Ca2 +,这将在接触时迅速固化粘合剂胶水。
- 在头部侧面附近插入镊子(见 材料表),然后轻轻地将镊子从前9到后9处取下。尽可能多地去除箱子。用一对钝镊子抓住蛹发育中的腿,小心翼翼地将蛹从箱子中拉出。
注意:蛹腹侧部分的小破裂不会对此过程有害。 - 将蛹放在盖玻片的角落。
- 用钝镊子抓住后腹部或发育中的翅膀处的蛹,抬起,并将蛹的腹侧向下放入粘合胶中。
- 用2μL 1x PBS + 0.1mM Ca2 +快速填充P2 移液器,并将其保持在空气中,排出刚好足以在尖端形成小气泡(0.25-0.5μL)。
- 将溶液的小气泡触摸到胸部底部蛹的一侧,然后在另一侧重复。
注意:这将固化少量的胶粘剂胶水以将蛹固定到位。通常,不会使用所有解决方案。 - 用200μL1x PBS + 0.1mM Ca2 +填充P200移液器,然后将移液器的尖端放在胸部并排出内容物以完全浸没蛹。胶水的其余部分将立即固化。
- 除去约100μLPBS溶液,因此在立即进行下一步之前,蛹几乎不被淹没。
注意:对于未上弦的样品,请从步骤1.1开始。对于受伤的部分解剖样本,从步骤1.5开始。 通过 激光消融进行创设在前面已经描述过14,21。固定、解剖和安装步骤需要使用解剖显微镜进行。
2. 剖析公积
- 抓住一对显微解剖剪刀,将手柄的一侧支撑在惯用手的食指和中指上,因此惯用手的拇指施加切割力(图2A,B)。
- 将剪刀的颈部与非惯用手的中指相对稳定,同时用非惯用手的无名指支撑盖玻片。
- 在背腹中部剪一截,形成一个小孔,~0.2-0.5毫米。一些血淋巴液通常会溢出,是违规的良好指标。
- 从后部到前部穿过外皮,进行0.5-0.75毫米的小切口,包围背侧组织以将其隔离。为了创建尽可能平坦的组织,避免切割过腹侧;只有胸部的背侧"圆顶"应该与头部和腹部的一小部分一起移除。
- 重复蛹另一侧的后部到前部切口。
- 如有必要,旋转解剖阶段,以便通过头部进行干净切割。
注意:在这个阶段,背外皮或蛹的其余部分将被分离。如果它看起来是分开的,但不容易移动,那么在notum下方的几个切口可以帮助将其移开。 - 向盖玻片中心添加约200μL的1x PBS,并通过轻轻地将移液器尖端从新液滴拖过盖玻片到原始液滴,将其连接到原始解剖液滴。
- 使用一对钝镊子,轻轻地将隔离的公孔推或拖动到盖玻片的中心并旋转,使内侧朝上。切勿从液滴中取出组织。
注意:必须将胶结移离原始解剖部位,以避免粘合剂胶水的任何残留物在以后的成像过程中遮挡样品。 - 用钝镊子按住鼻梁,按压腹部或头部部分。使用一对锋利的镊子和/或从200μL移液管中轻轻排出1x PBS,去除任何剩余的脂肪体,肌肉带或血淋巴(如果存在),以完全暴露单层上皮,使最终染色更均匀。解剖的notum应如图 3A所示。
- 组织清洁后,使用200μL移液管尽可能多地去除PBS溶液(以及碎屑和蛹的腹侧部分),用解剖仪进行监测以避免吸入公腔。
- 一旦大部分液体被去除,使用吸收性组织仔细擦去粘合剂胶水和蛹的其余部分,以及残留在盖玻片上的任何其他碎屑。
注意:如果盖玻片上残留着一些胶水,只要它比背侧组织本身薄,就不会造成问题。 - 加入150-200μL4%PFA(在1x PBS中),并在室温下固定20分钟。根据解剖速度,在第一个蛹固定期间可以解剖1个或多个蛹。
- 取出PFA并用1x PBS更换,以清洗一次公仔30秒。
- 如果继续进行抗体染色,则在1x PBS或1x PBST(补充文件1)中进行5分钟洗涤(3次),以渗透组织(如果抗原是细胞内)。
- 将样品在1x PBS + 0.02%NaN3 中在加湿室中过夜,或者如果计划染色组织,则在封闭溶液中孵育过夜(补充文件1)。
3. 染色
注意:要使用抗体或细胞染色剂进行染色,请按照以下步骤操作。-不得从溶液中取出套管,因为这可能会导致组织卷曲。因此,调整染色方案以完全在盖玻片上进行,并保持在加湿室中超过5分钟的任何步骤。在解剖显微镜下监测样品有助于防止在洗涤过程中意外抽吸组织。
- 为了可视化细胞边界,在200μL抗FasIII原代小鼠IgG2a抗体(参见 材料表)中以1:8浓度在封闭缓冲液+ 0.02%NaN3 中稀释在4°C下孵育过夜。
- 在室温下用200μL1x PBS + 0.02%NaN 3洗涤1小时,洗出多余的一抗(3 次)。
- 在封闭缓冲液+ 0.02%NaN 3中用200μL浓度的1:200浓度抗小鼠IgGa2在封闭缓冲液+ 0.02%NaN3 中进行二抗孵育2小时。
- 在室温下用200μL1x PBS + 0.02%NaN 3洗涤1小时,洗出多余的二抗(3 次)。
- 为了可视化细胞核,将样品在1μg/ mL的DAPI中孵育45分钟,以使染色剂有足够的时间穿透肌肉条带;固定在含有DAPI的安装介质中对这种组织无效。
- 在室温下每次洗涤,用200μL的1x PBS + 0.02%NaN3 洗涤5分钟,然后用200μL1x PBS + 0.02%NaN3 在4°C下过夜,或立即安装。
4. 安装和可视化公积木
- 染色后,准备一个新的24×60盖玻片(顶部)与支撑。
注意:由于公仔是圆顶形的,因此将其完全压扁会导致组织扭曲。在两个盖玻片之间创建间隙可使公仔保持其正常形状。 - 通过使用由22 x 22盖玻片(厚度为0,〜100μm厚)制成的垫片,形成约200μm的间隙,相距约1厘米,并在顶部中间粘合指甲油。
- 要粘附,请将垫片放在顶部,并在垫片的远端边缘涂上一层薄薄的指甲油。让其干燥。
注意:只使用薄而流淌的指甲油;厚指甲油会在盖玻片和上衣之间增加不必要的额外空间。 - 从样品中取出尽可能多的水溶液。
- 立即将两滴(约100μL)防褪色贴样介质(见 材料表)涂在样品上。
- 如有必要,使用干净、锋利的镊子将镊子定位在防褪色安装介质液滴的中心。
- 将带有顶盖的盖玻片放在~10 x 40 mm的支撑物上,例如一块薄泡沫(从盖玻片盒内的包装材料中切下),以提升样品,使其不会粘附在工作表面上。
- 在解剖仪下,将顶部缓慢降低到样品上。一旦防褪色安装介质与顶部相遇,轻轻释放并允许毛细管作用将顶部向下拉动。
注:在最初的几秒钟内,可以对盖玻片位置进行微小的调整,而不会损坏公环。 - 将另一块泡沫放在顶部,并使用标准显微镜载玻片作为砝码,在样品盖玻片,顶部和垫片之间轻轻哄起防褪色安装介质。
- 5-10分钟后,使用吸收性组织通过轻轻触摸盖玻片的边缘来吸走任何多余的防褪色安装介质。
- 轻轻地将指甲油涂抹在盖玻片的每个角落,将它们粘在一起。干燥后,涂上盖玻片的所有边缘以进行密封。避免首先涂覆所有边缘,因为这通常会移动盖玻片并损坏背侧组织。
- 在荧光显微镜下通过背侧和/或腹侧观察孔隙(参见 材料表)。
结果
所提出的技术在未卷绕的notum上效果很好(图1A-D),允许研究组织的发育和稳态,例如,多倍体机械感觉刚毛细胞18的形成,或上皮细胞10的后流的前部。该方案也适用于激光消融的膜(图1E-L),其中细胞对损伤的反应可以用内源性荧光团(如Histone2-EGFP)实时分析(图1B,F,J)。使用免疫组织化学染色后(步骤3)可以揭示许多特征,例如标记细胞边界的Fasciclin III(图1C,G,K)。此外,诸如DAPI(图1A,E,I)之类的定量染色剂可用于评估DNA含量的变化,包括伤口诱导的多倍体22。
目前的方案特别有益,因为它可以在长期的实时成像实验后使用。由于蛹是不动的,它们可以成像数小时(图4A,B)。重要的是,该方案不会在解剖后对伤口上皮的整体结构或形态引起相当大的变化(图4B,C)。因此,可以长期对组织内的特征进行成像,然后使用免疫组织化学或细胞染色进一步研究。
由于不透明度,组织内部深处的成像是复杂的,果蝇被涂在蜡质角质层8中,使得深度成像更加困难。然而,使用这种技术,可以在两个盖玻片之间放置一个解剖的面夹,从而允许从任何一侧对上皮单层进行成像:通过角质层的顶端(图5A-D)和/或面向体腔的上皮基底侧(图5E-H)。这些不同的视图非常适合可视化组织内的不同结构。例如,顶端视图是可视化位于角质层正下方的上皮细胞边界和细胞核的理想选择(图5A-D)。在基础视图下,这些顶端信号不太明显(图5E-H)。然而,在伤口边缘观察到基底结构(图5J,L黄色,白色箭头)。这些基底结构要亮得多,因为基底视图的遮挡比顶视图的遮挡要少。
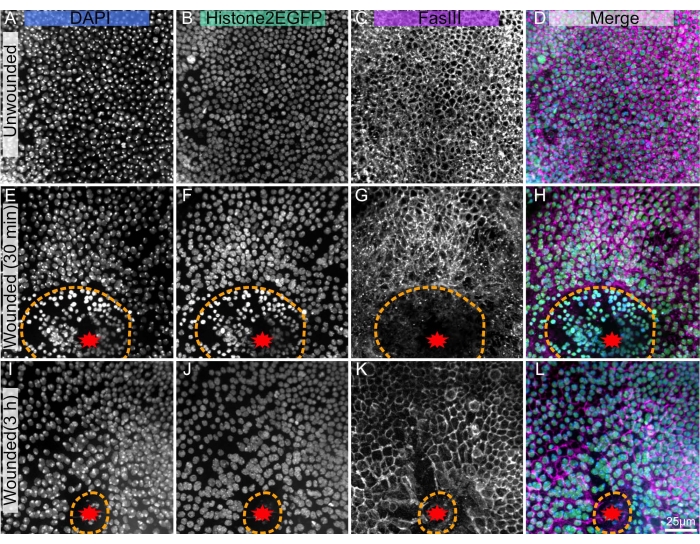
图1:解剖,固定和染色的果蝇蛹(A-D)未愈合的notum。(E-H),激光消融后30分钟受伤的notum。(I-L)激光消融术后3小时受伤。(A,E,I)DAPI染色显示细胞核。(B,F,J)用于实时成像的转基因组蛋白2-EGFP在固定和染色后可见。(C,G,K)抗FasIII抗体表明抗体染色剂在固定的notum上效果良好。(D,H,L)合并的图像。使用旋转圆盘显微镜用40x物镜捕获图像,用0.3μm Z切片显示Z堆叠的最大强度投影。A-D 表示 263 个 Z 切片。E-H 表示 195 个切片。I-L 表示 53 个 Z 切片。橙色虚线表示伤口边缘。L的比例尺为25μm,适用于A-L。请点击此处查看此图的大图。
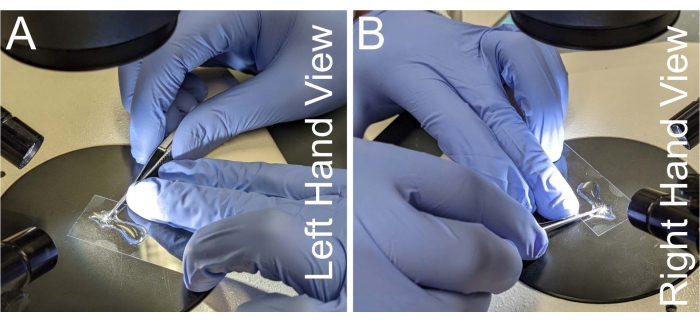
图 2:用于解剖的手部位置。(A-B) 握住显微切割剪刀的手部位置的左视图和右视图。为了防止手抖动,剪刀的脖子放在非惯用手的中指上。剪刀需要与显微镜载玻片平行,以避免骨筋组织的翘曲。请点击此处查看此图的大图。

图3:正确解剖的结节 与卷曲的结麻 (A)解剖和清洁后的蛹,解剖和清洁后未卷曲并准备固定。(B)从1x PBS中取出后,蛹蜷蜷在自身上,因此无法使用。 请点击此处查看此图的大图。

图 4:固定前和固定后的图像大致相似。 在细胞核中表达组蛋白2-EGFP的蛹在细胞核中成像(A)活体,(B)在激光消融后3小时成像。(C)按照协议中提到的对notum进行检索,解剖和修复,并在修复后重新成像。伤口部位标有红色星号。使用旋转盘显微镜用40x物镜捕获图像,每0.3μm采集Z切片。显示34个Z切片术前(A)、48个Z切片术后3 h(B)和103个Z切片解剖、固定和染色后(C)的最大强度投射。C中的比例尺为25μm,适用于A-C。 请点击此处查看此图的大图。

图 5:对受伤的顶端和基底侧进行成像。所有面板中都显示了相同的受伤的蛹。伤口上标有红色星号。橙色虚线表示伤口边缘。(A-D)从顶端通过角质层对公尺进行成像。(E-H)从基底内侧对公仔进行成像。(I-L)顶部面板显示顶端的X-Z图像,顶端朝上,上皮片由白色三角形指定。橙色线表示 X-Y 切片的顶端-基底平面,如下图所示。在下部面板中,橙色线显示上述 X-Z 图像的平面。(I)顶端成像的notum - 顶端切片。顶部 X-Z 视图显示了顶端上皮片(白色三角形)的精确成像。此视图等效于实时图像处理视图。(J)顶端成像的notum - 基底切片,部分被顶端组织阻塞。用黄色箭头(可能的肌肉带)和白色箭头(可能的血细胞)表示的其他组织在基底侧可见。(K)基底成像的notum - 顶端切片,部分被基底组织和伤口结痂(黑暗的中心区域)阻塞。(L)基底成像的notum - 基底切片。此视图最能显示用黄色和白色箭头表示的基部组织。A,E:DAPI染色,B,F:组蛋白EGFP,C,G:FasIII染色。用旋转圆盘显微镜用20倍物镜捕获图像。每0.9μm取一次Z切片。A-D 显示 19 个切片的最大强度投影。E-H 表示 17 个切片的最大强度投影。D、H、L 中的 25 μm 比例尺分别适用于 A-D、E-H、I-L。请点击此处查看此图的大图。
补充文件1:溶液和缓冲液的制备。 详细介绍了以下解决方案的配方:1xPBS,1x PBST,封闭溶液和多聚甲醛固定剂。 请点击此处下载此文件。
讨论
关键步骤
优化三个步骤将大大提高该协议的成功率。首先,在步骤1.5中,将胶水涂在盖玻片上。如果加入过多的胶水,蛹会被一层厚厚的凝固胶水所缠绕,使解剖变得不可能,如果它覆盖在结膜本身,胶水会遮挡样品中的光线。其次,在步骤2.3-2.6中,确保仅移除顶端的顶部圆顶,排除尽可能多的侧组织。如果包括,侧组织在安装过程中会被压缩,并导致公网的中间向内弯曲,通常将其放置在高数值孔径物镜的工作距离之外。第三,在清洁步骤2.9期间,必须格外小心,不要损坏单层上皮。如果组织有很大一部分缺失或无法检测到信号,则此步骤可能是罪魁祸首。
故障 排除
问题1:安装后,蛹在解剖过程中从双面胶带中脱落。这是一个常见问题,特别是对于初学者。最好的补救措施是确保蛹壳的外部完全干燥/没有食物残渣。用一对钝镊子去除食物,让盒子风干10-15分钟将有助于粘附在胶带上。或者,在解剖过程中,使用非惯用手和一对钝镊子将蛹压在胶带上。如果问题仍然存在,在外壳后端的底部涂抹一小滴5-10μL指甲油并使其变硬通常为最不严谨的蛹提供足够的粘附力。
问题 2:Notum 在步骤 2.3 中崩溃,或者通过外表的初始突破不顺利。如果外皮难以破坏,则固定步骤中可能粘附胶过多。将解剖的蛹放入较少的粘性胶水中将改善此问题。此外,确保显微切割剪刀锋利。钝剪刀将无法切入外皮,并倾向于使其向内塌陷。一旦血淋巴从蛹中溢出,请确保其中一个切割刀片可以进入蛹而不会导致蛹变形。如果蛹塌陷并且刀片没有进入蛹,请继续剪裁,直到刀片进入蛹。
问题 3:在步骤 2.4 中,剪刀会夹住或拖动外皮。如果剪刀开始抓住或拖曳外皮,通常有助于切换到蛹的另一侧并继续"松开"外皮。进一步钝化显微切割剪刀会使外皮难以实现干净切割,必须使用削尖的剪刀。
问题4:样品在染色过程中被意外吸出(步骤3.1-3.6)。解剖的notum很难看到,因为它是透明的。在盖玻片下方放置深蓝色或黑色的纸张以提供对比度可能会有所帮助(旧的移液器吸头架架架效果很好。此外,所有溶液更换都可以在解剖显微镜下进行。
问题 5:未检测到信号/检测到零星信号。在排除了污渍特异性问题后,如果未检测到信号或信号不完整,则步骤2.9(清洁)可能是罪魁祸首。缺失或斑片状信号可能源于清洁过程中上皮组织的损伤和去除。相反,如果不去除肌肉带/脂肪体细胞,信号差可能是由肌肉带/脂肪体细胞的闭塞引起的,因为它们可以限制污渍和抗体相对于周围组织扩散到公孔中。如果组织受损,在清洁过程中更温和是最好的解决方案。相反,如果污渍是可见的但斑块状的,建议增加专门用于清洁步骤的活力/时间,以尽可能多地去除肌肉和脂肪。此外,增加污渍持续时间可以通过更好的清洁来帮助解决这个问题。
问题6:在成像过程中,骨组织具有翘曲/皱纹的外观。组织的翘曲和皱纹来自两个来源。首先,在安装过程中压缩公仔会导致其弯曲和翘曲。最好的解决方案是尽可能多地去除侧组织,使圆顶尽可能短,并且可以安装在盖玻片垫片之间。其次,如果在解剖过程中将套管弯曲,则在安装过程中不会拉直该弯曲,因此在解剖过程中必须格外小心,以免翘曲鼻孔。当将外皮从蛹的其余部分切开时,耳蜗的意外弯曲是最常见的。将解剖剪刀与蛹成一定角度,而不是将它们作为蛹保持在样品平面中是很诱人的。然而,倾斜的剪刀会导致外皮在切割时向上弯曲,而不是保持平坦。
现有方法、限制和未来应用
Wang等人20 报道了一种类似的解剖方案,用于分离蛹上皮。这种技术要求蛹留在其外壳内,并用手术刀迅速一分为二。该协议与先前的实时成像样品不兼容,因为实时成像需要去除蛹壳的很大一部分。由于蛹缺乏强直性,病例外的蛹二分切术破坏了组织,激发了该协议的创建。这里详细介绍的技术允许分离和固定notum,并且可以用作各种其他方法的第一步,例如冷冻切片, 原位 杂交或电子显微镜。
此技术有一些限制。首先,解剖,固定和染色notum比在notum中活成像荧光标记的蛋白质更耗时,这只需要简单的解剖即可去除蛹壳9,23。其次,与其他果蝇组织的解剖相比,由于组织薄而脆弱和疏水性角质层,这种解剖更加困难。对于上果 蝇 中的蛋白质的简单可视化,固定胚胎,幼虫翼盘或卵巢的免疫组化更容易。然而,这种技术允许实时成像的强大功能与固定和染色相结合,使其成为一旦掌握的强大工具。
与现场成像相比,解剖/固定技术具有一些优势。基底(内部)结构可以用基底视图更好地解析(图5L,J)。最重要的是,活体成像仅限于必须通过基因提供的荧光团,通常需要冗长的遗传杂交方案。相反,本方案允许应用染色剂,免疫组织化学和其他需要解剖和固定的技术。这大大增加了在组织中探测的信号数量,同时可能缩短了获得实验结果的时间。
披露声明
作者没有什么可透露的。
致谢
作者要感谢M. Shane Hutson博士建立用于蛹损伤的激光消融系统,以及他对开发方案的贡献和反馈。这项工作得到了1R01GM130130对APM和M. Shane Hutson的支持。JW 由 2T32HD007502-21 提供支持。
材料
| Name | Company | Catalog Number | Comments |
| ½” Scotch Permanent Double-Sided tape | Scotch 3M | 665 | |
| 0.1-10 µL uTIP pipette tip | Biotix | M-0011-9FC | |
| 22 x 22 mm No. 0 thickness coverslips | Thomas Scientific | 1207Z28 | |
| 24 x 60 mm coverslip | Corning | 2980-246 | |
| 3M VetBond | 3M | 1469SB | Called "adhesive glue" in protocol |
| Anti-FasIII primary Mouse IgG2a | Developmental Studies Hybridoma Bank | 7G10 | |
| Calcium Chloride | Fisher Chemical | c79-500 | |
| Cy3-conjugated AffiniPure Goat Anti-Mouse IgG2a | Jackson ImmunoResearch | 115-165-206 | |
| DAPI | Sigma Aldrich | D9542-1mg | |
| Dumont #5 Fine Tip Forceps | Fine Science Tools | No. 11254-20 | |
| Dumont #5 Fine Tip Forceps: Blunt | Fine Science Tools | No. 11254-20 | Heavily used and unsharpened forceps, or dulled with a whetstone |
| Fisherbrand Double frosted microscope slides | Fisher Scientific | 22-034-486 | |
| Fluorescent Light Source | Lumencor | Celesta 90-10512 | |
| Fly Stock: EGFP-tagged Histone H2A | Bloomington Drosophila Stock Center | 24163 | |
| Fly Vial Foam Plugs "Flugs" | Genesee Scientific | 49-101 | |
| Humidified Chamber: Foil-wrapped small container lined with filter paper saturated with water | Cole-Parmer | 759075D | A great humidified chamber can be made from the styrofoam box containing Cole-Parmer cuvettes, 759075D, filled with 50 ml water. |
| KimWipe | KimTech | 34155 | Called "Absorbent Tissue" in protocol |
| Nikon Ti2 Eclipse | Nikon | Eclipse Ti2-E | |
| NIS Elements Software | Nikon | AR | |
| Parafilm | Pechiney Plastic Packaging | PM-996 | |
| Paraformaldehyde (PFA) 16% | Ted Pella, Inc | 18505 | |
| Plastic Vials | Genesee Scientific | 32-114 | |
| Sodium Azide (NaN3) | Fisher Scientific | 19038-1000 | |
| Stereo Microdissection Scope | Carl Zeiss | STEMI 2000 | |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | New or freshly sharpened scissors |
| Vecta Shield | Vector Laboratories | H-1000 | Called " antifade mounting medium" in protocol |
| Vecta Shield with DAPI | Vector Laboratories | H-1200 | Not ideal for pupal notum. |
| X-Light V2 Spinning Disc | Crest Optics | V2 L-FOV |
参考文献
- Valon, L., et al. Robustness of epithelial sealing is an emerging property of local ERK feedback driven by cell elimination. Developmental Cell. 56 (12), 1700-1711 (2021).
- Levayer, R., Dupont, C., Moreno, E. Tissue crowding induces caspase-dependent competition for space. Current Biology. 26 (5), 670-677 (2016).
- Couturier, L., et al. Regulation of cortical stability by RhoGEF3 in mitotic sensory organ precursor cells in Drosophila. Biology Open. 6 (12), 1851-1860 (2017).
- Couturier, L., Mazouni, K., Corson, F., Schweisguth, F. Regulation of Notch output dynamics via specific E(spl)-HLH factors during bristle patterning in Drosophila. Nature Communications. 10, 3486(2019).
- Fujisawa, Y., Shinoda, N., Chihara, T., Miura, M. ROS regulate caspase-dependent cell delamination without apoptosis in the drosophila pupal notum. iScience. 23, 101413(2020).
- Besson, C., et al. Planar cell polarity breaks the symmetry of par protein distribution prior to mitosis in drosophila sensory organ precursor cells. Current Biology. 25 (8), 1104-1110 (2015).
- Koto, A., Kuranaga, E., Miura, M. Apoptosis ensures spacing pattern formation of drosophila sensory organs. Current Biology. 21, 278-287 (2011).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. Journal of Embryology and Experimental Morphology. 66, 57-80 (1981).
- Moreira, C., Regan, J., Zaidman-Rémy, A., Jacinto, A., Prag, S. Drosophila hemocyte migration: an in vivo assay for directional cell migration. Methods in Molecular Biology. 769, Clifton, N.J. 249-260 (2011).
- Guirao, B., et al. Unified quantitative characterization of epithelial tissue development. Elife. 4, 08519(2015).
- Cristo, I., Carvalho, L., Ponte, S., Jacinto, A. Novel role for Grainy head in the regulation of cytoskeletal and junctional dynamics during epithelial repair. Journal of Cell Science. 131 (17), 213595(2018).
- Bellaïche, Y., Gho, M., Kaltschmidt, J. A., Brand, A. H., Schweisguth, F. Frizzled regulates localization of cell-fate determinants and mitotic spindle rotation during asymmetric cell division. Nature Cell Biology. 3 (1), 50-57 (2001).
- Shannon, E. K. Multiple mechanisms drive calcium signal dynamics around laser-induced epithelial wounds. Biophysical Journal. 113 (7), 1623-1635 (2017).
- O'Connor, J. T., et al. Proteolytic activation of Growth-blocking peptides triggers calcium responses through the GPCR Mthl10 during epithelial wound detection. Developmental Cell. 56 (15), 2160-2175 (2021).
- Hartenstein, V., Posakony, J. W. Development of adult sensilla on the wing and notum of Drosophila melanogaster. Development. 107 (2), 389-405 (1989).
- Yeh, E., Zhou, L., Rudzik, N., Boulianne, G. L. Neuralized functions cell autonomously to regulate Drosophila sense organ development. The EMBO Journal. 19 (17), 4827-4837 (2000).
- Loubéry, S., et al. Uninflatable and notch control the targeting of sara endosomes during asymmetric division. Current Biology. 24 (18), 2142-2148 (2014).
- Kawamori, A., Shimaji, K., Yamaguchi, M. Dynamics of endoreplication during Drosophila posterior scutellar macrochaete development. PLoS One. 7 (6), 38714(2012).
- Couturier, L., Schweisguth, F. Notch Signaling: Methods and Protocols. Bellen, H. J., Yamamoto, S. , Springer. New York. 79-86 (2014).
- Wang, W., Yoder, J. H. Drosophila pupal abdomen immunohistochemistry. Journal of Visualized Experiments. (56), e3139(2011).
- Kiehart, D. P., et al. Cell Biology (Third Edition). Celis, J. E., et al. , Academic Press. 87-103 (2006).
- Bailey, E. C., Dehn, A. S., Gjelsvik, K. J., Besen-McNally, R., Losick, V. P. A Drosophila model to study wound-induced polyploidization. Journal of Visualized Experiments. (160), e61252(2020).
- O’Connor, J. T., S, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protocols. , (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。