Method Article
大规模培育三维重建人类表皮
摘要
该协议描述了一种简单明了的方法,以可复制和稳健的方式培养三维重组的人类表皮。此外,它还特征了表皮屏障模型的结构-功能关系。还介绍了重组后的人类表皮对前燃刺激的生物学反应。
摘要
介绍了从新生儿原发性角质细胞重建的三维人类表皮模型。在此,描述了栽培过程和模型特征的协议。新生儿原发性角蛋白细胞被浸入渗透聚碳酸酯插入物上,播种三天后提升到空气液体接口。经过14天的刺激,在高钙培养介质中具有明确的生长因子和抗酸,模型完全分化。组织学分析揭示了一种完全分层的表皮,模仿了原生人类皮肤的形态。为了描述模型及其屏障功能、蛋白质水平和针对早期角蛋白分化(即角蛋白10)、晚期分化(即非曲霉素、洛里林和长丝蛋白)和组织粘附(即脱脂素1),通过免疫荧光进行评估。通过测量跨层电阻进一步评估组织屏障完整性。R经济构想 的人类表皮对发炎刺激(即脂糖和肿瘤坏死因子α)有反应,导致细胞因子释放增加(即血红素1α和血红素8)。该协议代表一种简单易行的体外方法,旨在培养 重建的 人类表皮,作为评估环境影响和广泛皮肤相关研究的工具。
引言
表皮是皮肤的最外层,位于人体与外部环境的直接界面上。其主要功能是提供保护和水化1。表皮作为防止外部制剂的有效物理屏障,防止身体过度缺水。这些皮肤功能主要取决于皮肤最外层的细胞排列、细胞间脂质2的组成和组织。表皮主要由角蛋白细胞组成,这些角蛋白细胞向上迁移到组织外侧并经历分化。有4-5个表皮层的特点是其分化阶段。从内部到外部,表皮层从可行的表皮开始,即地层基座(SB)、地层脊柱(SS)和地层颗粒(SG),到不可生存的最上层,即地层角膜(SC)3。基底层主要由增殖的角蛋白富含角蛋白细胞组成,在分化4时通过党团迁移。在角蛋白细胞成熟期间,蛋白质表达和结构发生各种变化。角蛋白细胞坚持通过形成脱烟体交汇点5。在SG中,启动了跛脚体的生成。它们由脂质前体和酶组成,对形成皮肤屏障功能至关重要。SG的特点是角蛋白颗粒在角蛋白细胞质中存在。在与SC的接口中,跛脚体的含量被挤出细胞间空间,非极性脂质(如脑酰、胆固醇和游脂酸)组织成堆积的拉米拉脂质双层,形成细胞外脂质基质7。在SC中,由于酶降解过程,细胞失去包括细胞核在内的所有细胞细胞,并采用扁平形态。它们被一个由交叉链接的蛋白质层构成的玉米化信封包围着,被称为角细胞8,9。脱硫体成分与玉米化信封交叉连接,形成角膜体,并将角细胞结合在一起。由此产生的上皮不断从干细胞中更新,周转时间约为5-6周10。角蛋白细胞的分化过程,导致一个完全分层的表皮,是关键形成皮肤11的屏障功能。
在受伤和炎症期间,角蛋白细胞诱导粘附分子和表面受体的变化,并通过细胞因子、化疗因子和抗菌肽12的分泌触发发炎反应。皮肤不仅是外源性物质的物理屏障:在接触病原体时,它也充当免疫传感器。此外,它还调节几种物质在其各层的扩散,如水含量,以保护人体免受脱水。皮肤也参与维生素D的合成,并具有各种其他代谢功能3,13,14。
为了评估外源性物质的不利影响,毒理学家几十年来一直依赖动物试验,但现在它不是首选的方法。动物模型除了对人类毒性的预测能力有限外,还涉及许多伦理问题。化妆品行业禁止动物试验,并建议在研究中遵循3R原则(即更换、减少和改进),导致基于体外方法15的替代测试方法的发展。第一个体外皮肤细胞模型已经在90年代被描述,一个令人印象深刻的发展,从简单的人类角蛋白细胞单一培养到完全分化表皮和全厚模型已经取得了16。如今,皮肤组织工程在制药和皮肤化妆品领域都越来越重要。在过去的二十年里,几家公司已经将三维(3D)重建的人类表皮(RhE)商业化,这些表皮是皮肤相关研究的标准化和可重复的工具。根据 OECD 皮肤刺激测试准则,接受多个商用 RhE 模型进行化学品体外皮肤测试17、18(即测试指南 43919)和皮肤腐蚀20(即测试指南 43121)。皮肤敏感性 22 (即 SENS-IS 检测) 的体外测试目前处于批准轨道,并处于同行评审23中。此外,还开发了许多其他检测方法,利用商用RhE模型,评估光毒性24,测试药物配方25,化妆品配方和活性成分26,研究皮肤屏障功能27,并测试生物反应环境压力源28,29,30,31。
除了市售的3D皮肤模型,多个研究小组已经开发出自己的RhEs 32,33,34,35,36,37。内部 RhEs 根据研究的目的为控制文化条件提供了优势。具体来说,研究人员可以选择用于重组其3D表皮模型的角蛋白细胞的类型和来源(即初级与不朽、新生儿与老年人、单一与随机捐赠者、性别、种族、个人生活习惯(如吸烟等)。他们有可能改变培养介质的组成,并纳入生长因子,维生素,或其他化合物,可以调节目标蛋白质或脂质的表达。通过内部RhEs,研究人员还可以研究生物反应和生物力学特性,作为3D模型分化状态的函数。除了这些直观的参数,还有不断的努力,以提高3D皮肤模型的复杂性,使他们更生理相关, 例如,通过添加其他表皮细胞类型(如黑色素细胞和免疫细胞)38,39,通过培养细胞细胞在纤维细胞填充胶原蛋白基质40,41,42之上,并通过包括血管网络43,44,45的组成部分。
虽然可以根据特定需求调整文化条件,但必须尊重一些参数,以确保 RhE 的质量和相关性。为了培养RhE组织,正常的人类表皮角蛋白细胞(NHEKs)被植入特定的渗透培养插入物中,其多孔合成膜将井分成两个隔间,即骨质疏导室和基底室。膜的孔隙度(即孔径为0.4μm)允许在基底隔间中形成细胞单层,没有细胞向基底插入侧迁移,并允许从玄武岩舱中含有的培养介质中喂养角蛋白细胞。在重建过程开始时,NHEK 在水下条件下培养数天,以便将其粘附在膜上。与用于NHEK二维培养的钙浓度相比,两个隔间的钙含量均有所提高,以减缓细胞的增殖,促进细胞的分化。表皮钙梯度对于调节屏障的形成和平衡47,48至关重要。高钙含量(即高达1.5mM)促进细胞间结的形成,并在终端分化49期间调节玉米化信封的形成。一旦角蛋白细胞在支撑膜上形成连续且紧密粘附的单层,就会去除附体隔间中的介质,并在空气-液体接口 (ALI) 继续培养过程,以刺激分层并建立表皮屏障50,51。特定的文化条件对于获得完全分层的上皮36至关重要。在ALI的重组过程中,玄武岩舱中的介质辅以角蛋白细胞生长因子(KGF)、胰岛素、钙和抗腐酸。抗坏酸在形成适当的SC脂质屏障方面起着重要作用,与原生人类皮肤52非常相似。在抗坏酸补充介质中生长的角蛋白细胞表现出一种分化表型,具有增强的角蛋白颗粒,以及组织细胞间脂质跛脚在角细胞52的间歇。这种补充对于通过增加玉米化信封含量和避免亲水抗氧化储存53,54耗尽来改善表皮屏障功能至关重要。KGF是表皮增殖和分化的重要准肾上腺介质,用于刺激NHEK55。
内部 RhEs 的主要缺点包括研究机构之间标准化的丧失以及劳动力强度和时间消耗的增加(与现成的商业模式相比,最多 3 周)。本文件的目的是解决这些缺点,为更大规模的生产打下基础。除了上述内部RhEs的优势外,目前的议定书还旨在减少组织内部和组织之间的变异性,减少污染风险,并简化栽培过程。
当前协议描述了使用新生儿 NHEK 培养 RhEs 的可重复和稳健的方法。此外,它显示了RhEs形态特征、屏障完整性和表皮分化特异性蛋白质表达的代表性结果。使用血氧林和黄素(H&E)染色和传输电子显微镜(TEM)检查了RhEs形态结构。为了评估屏障的完整性,测量了透皮电阻 (TEER) 和 Triton X-100 的暴露时间,以降低 50% 的组织生存能力 (ET50)。通过免疫荧光(IF)分析脱烟素结(即脱烟素1)的形成,以评估角蛋白细胞粘附。表皮结构蛋白(即非自愿蛋白、洛里林和长丝蛋白)的形成通过IF进行评估和检测。这些蛋白质参与形成围绕SC角细胞的高度交叉链接的蛋白质包络,因此是后期表皮分化56,57的重要标志。此外,IF还用于分析角蛋白10,一种在SS58早期分化细胞中诱导的蛋白质,存在于所有分化层中。最后,对RhE对催化刺激(即脂糖和肿瘤坏死因子α)的反应进行了调查。细胞培养介质使用酶相关免疫分析 (ELISA) 测量了血间素 1 阿尔法 (IL-1+) 和血间素 8 (IL-8) 的水平。
研究方案
在规划和执行任何涉及本议定书的研究活动之前,审查并遵守与使用人体组织或细胞有关的国家和国际道德考虑和条件。
注:本议定书的所有步骤都必须在不化条件下执行。生物安全 2 级做法是培养 Rhes 的最低要求。在处理本协议中描述的化学品/试剂时,必须采取一切必要的安全防范措施。
1. 细胞培养介质的准备
注:用于培养RhEs(表1)有三种不同类型的无血清培养介质:(一) 用于NHEK二元培养的低钙水平基底介质(60μM Ca2+):(二) 用于将NHEK播种到细胞培养插入系统的高钙水平(1.5 mM Ca2+)的水下介质:和 (iii) 高钙水平 (1.5 mM Ca2+)、抗焦酸和角蛋白细胞生长因子 (KGF) 的空气液体接口 (ALI) 介质。
| 中等 | 中等信息 | 所需数量 |
| 基础介质 | 角蛋白细胞生长介质 | 36 mL/24 井 |
| + 1% [v/v] 香港地质调查局 | ||
| + 1% [v/v] 100x 抗生素抗菌剂 | ||
| 淹没介质 | 角蛋白细胞生长介质 | 36 mL/24 井 |
| + 1% [v/v] 香港地质调查局 | ||
| + 1% [v/v] 100x 抗生素抗菌剂 | ||
| +1.5米卡2+ | ||
| 空气液体接口介质 | 角蛋白细胞生长介质 | 216 mL/24 井 |
| + 1% [v/v] 香港地质调查局 | ||
| + 1% [v/v] 100x 抗生素抗菌剂 | ||
| +1.5米卡2+ | ||
| +50微克/mL 抗酸 | ||
| +10 ng/mL 角蛋白细胞生长因子 |
表1。用于培养 RhEs 的不同文化媒体的汇总表。列表不同的文化媒体与补充。
- 准备基础介质。
- 补充一瓶500mL的角蛋白细胞生长介质(材料表),用5mL的人类角蛋白细胞生长补充剂(HKGS),以达到最终浓度0.2%[v/v]牛坑 0.2 ng/mL 人类重组表皮生长因子 (EGF), 0.18 μg/mL 氢皮质松, 5 μg/mL 牛转移林, 和 0.01μg/mL 重组人类胰岛素样生长因子 I (IGF-I)。
- 加入5mL的100x抗生素抗菌溶液,含有10,000单位/mL青霉素,10,000微克/mL链霉素,25微克/mL的氨基霉素B。
- 准备淹没介质。
- 用 5 mL 的 HKGS 补充一瓶 500 mL 的角蛋白细胞生长介质(材料表),以达到 0.2% [v/v] BPE 的最终浓度, 0.2 ng/mL 人类重组 EGF,0.18 微克/mL 氢皮质松,5 微克/mL 牛转移林,0.01 微克/mL 人类重组IGF-I。
- 添加5mL的100x抗生素抗菌溶液。
- 添加 5 mL 的 0.144 M CaCl2 (氯化钙) 库存溶液,以达到最终浓度 1.5 mM Ca2+。
注:钙浓度在淹没阶段已经增加,以刺激角蛋白细胞的分化,并启动分层过程49。
- 准备空气液体接口 (ALI) 介质。
- 补充一瓶500mL的角蛋白细胞生长介质(材料表)与5mL的HKGS,以达到最终浓度0.2%[v/v]BPE, 0.2 ng/mL 人类重组 EGF,0.18 微克/mL 氢皮质松,5 微克/mL 牛转移林,0.01 微克/mL 人类重组IGF-I。
- 添加5mL的100x抗生素抗菌溶液。
- 添加 5 mL 的 0.144 M CaCl2 库存解决方案,以达到 1.5 mM Ca2+的最终浓度。
- 加入 1 mL 的 25 毫克/mL 抗酸库存溶液,达到最终浓度为 50 微克/mL 抗协酸。
- 在磷酸盐缓冲盐水 (PBS) 库存溶液中加入 100μg/mL KGF 中的 50 μL,以达到 10 ng/mL KGF 的最终浓度。
注:由于抗酸对氧化敏感,建议使用稳定的抗曲酸衍生物,如二磷酸镁59 或L-阿斯科比酸2磷酸60。如果使用抗酸,建议在每次刷新前用抗酸新鲜补充ALI介质。
2. 国家文化
注:由于原发性人类角蛋白细胞在第四或第五段61时仍然具有升序性,因此第三段中的NHEK用于培养RhEs。由于原核细胞的灵敏度很高,因此应非常小心地处理它们。在任何时候小心和缓慢地管细胞悬浮是非常重要的,不要扰乱细胞的条件。
- 在37°C的水浴中,通过将小瓶的一部分浸入水中,用1 x10 6 低温保存的NHEK解冻小瓶。在水浴中孵化小瓶1-2分钟,直到只看到一小片冰。
注意:不要将整个小瓶浸入水浴中以避免污染。不要解冻细胞超过2分钟:这可以降低细胞的生存能力。在将管子转移到层压罩之前,先用 70% 的乙醇溶液擦拭小瓶。 - 通过上下管道2-3次,非常小心地补充细胞。将细胞悬架转移到两个T75烧瓶中,其中含有总计15mL的预热解冻介质,导致播种密度为6.7 x 104细胞/cm2。
注:对于前两段和冷冻保存的 NHEK 的解冻,根据供应商的建议使用细胞培养介质。 - 将烧瓶放入细胞培养孵化器(37 °C,5% CO2和 95% 相对湿度 (RH))。
- 大约 24 小时后,用基底介质替换解冻介质,从角蛋白细胞冷冻溶液中去除二甲基硫氧化物 (DMSO)。
- 每两天刷新一次基础介质。
- 经过4-6天的培养,细胞应在80%左右的汇流,并准备在插入物中播种,用于培养RhEs。
注:角蛋白细胞应增长到最大80%的汇合,以保持其增殖能力62。要解冻的细胞数量必须考虑几个参数,如细胞通过数、解冻时的细胞生存能力、播种效率以及加倍时间。
3. 培育国家健康与健康
注:此协议设计用于 24 井载波板格式。如果需要其他板格式(例如,12 井或 6 井格式),应考虑优化播种密度和中等体积。 图1 总结了RhE栽培的拟议时间表,并显示了种植条件。
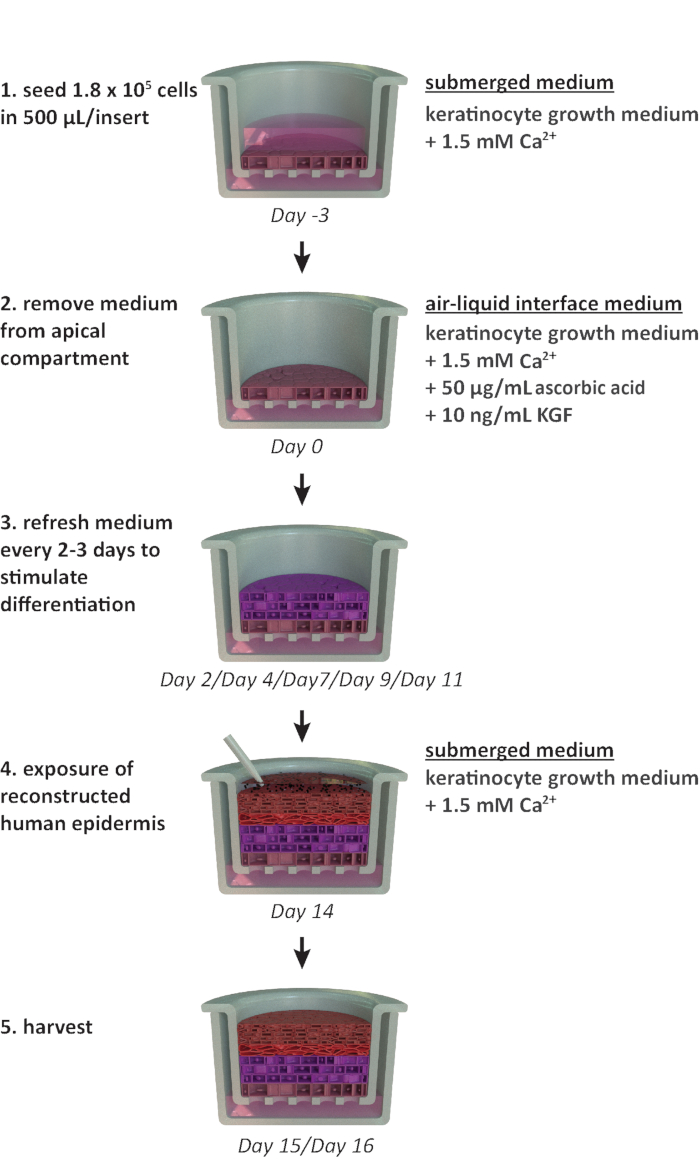
图1:重组协议的原理图时间表。RhE 模型制备、栽培过程和应用(接触化学物质)的演示。该计划包括适合每个步骤的细胞培养介质类型。请单击此处查看此图的较大版本。
- 预填充 24 井板与 1.5 mL 的水下介质,理想情况下使用分配器移液器。
- 从用于 NHEK 文化的 T75 烧瓶中去除基底介质。
- 通过在每个 T75 烧瓶中加入 5 mL 预热 PBS 来冲洗细胞。
- 从烧瓶中取出 PBS。
注意:这一步至关重要,因为介质中含有蛋白质和钙,可以抑制肌氨酸活性。 - 在每个 T75 烧瓶中加入 2-3 mL 预热 0.05% [v/v] 三聚氰胺/二胺二胺四乙酸 (EDTA)。确保试穿素溶液均匀分布在烧瓶的细胞培养区域。
注意:2 mL 音量基于上述 80% 的汇合。使用3 mL的烧瓶与更高的汇流。 - 将烧瓶放在细胞培养孵化器中4分钟(37°C,5%CO2和95%RH)。检查细胞是否以 10 倍的倍数使用显微镜分离。将烧瓶拍在手掌上,以帮助细胞从烧瓶表面释放。分离的细胞可以观察到圆润的细胞漂浮在尝试蛋白溶液中。
注意:不要在肌氨酸中孵育细胞超过6分钟。过度尝试可以损害细胞,降低其依从性63。 - 分离后,在每个 T75 烧瓶中加入等量(即 2-3 mL)预热的 trypsin 抑制剂。
- 将细胞悬架从烧瓶转移到离心管。
- 用 5 mL 预热 PBS 冲洗烧瓶,并将其转移到含有细胞悬架的离心管。
注意:通过检查显微镜下烧瓶中的残留细胞数量,确保收集大部分细胞。烧瓶表面应为 95% 空。如果不是这样,可以重复尝试化步骤(3.3-3.9)。但是,请注意,应避免再尝试。 - 以400 x g 的速度将收获的细胞离心5分钟。
- 小心丢弃大部分超自然,将大约 100-200 μL 留在管中。
注意:在此过程中不要吸气颗粒。 - 在低容量的水下介质中轻轻补充细胞颗粒,将移液器上下5-10次,以确保细胞均匀悬架。从小容量(即 500 μL)开始,以避免细胞聚合物的形成,并加起来每个初始 T75 烧瓶总共 1 mL 的淹没介质。
注意:用手指轻轻轻拂管子,小心地溶解超细剂中细胞颗粒的一部分。 - 使用尝试盘蓝色排除方法计算悬架中的细胞。
- 将 10 μL 的 0.4% [v/v] 试潘蓝色污渍和细胞悬浮率稀释为 10 μL 0.4% [v/v] 尝试潘蓝色污渍,以 10 μL 的细胞悬浮。将解决方案的 10 μL 添加到计数幻灯片中。将细胞悬架与尝试盘蓝色混合后立即测量细胞计数,因为尝试潘蓝色在暴露时间超过 1 分钟65后开始降低细胞生存能力。
警告:特里潘蓝被证明是一种潜在的突变,致病原和三原64。小心处理染料,按照当地实验室规定安全处置废物。
注:使用三潘蓝的另一种方法是无危险染料红素B66。
- 将 10 μL 的 0.4% [v/v] 试潘蓝色污渍和细胞悬浮率稀释为 10 μL 0.4% [v/v] 尝试潘蓝色污渍,以 10 μL 的细胞悬浮。将解决方案的 10 μL 添加到计数幻灯片中。将细胞悬架与尝试盘蓝色混合后立即测量细胞计数,因为尝试潘蓝色在暴露时间超过 1 分钟65后开始降低细胞生存能力。
- 通过添加等式 1 中显示的体积 V2,将细胞悬架与额外的浸入介质稀释,在淹没介质中达到 3.525 x10 5细胞/mL 的浓度:
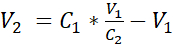
C1 = 计算在 3.12 中获得的细胞悬浮中的细胞浓度 (细胞/mL)
V 1 = 用于在3.12 (mL) 中恢复细胞颗粒的体积
C2 = 悬浮中的目标细胞浓度(即 3.525 x 105 细胞/mL)
V2 = 要添加的体积以达到目标细胞浓度 (mL)
注:推荐培养插件的表面积为0.47厘米2:因此,相应的播种密度为3.75×105细胞/厘米2。 - 执行第3.14步获得的稀释溶液的第二个单元格计数 (C 3)。使用方程 2 计算要播种到培养插入中的细胞悬架体积 (V4):

C3 = 悬浮中的目标细胞浓度(即 3.525 x 105 细胞/mL)
V3= 在培养插入中播种的细胞悬架的目标体积(即0.5 mL)
C4 = 在 3.14 获得的稀释悬浮中计算细胞浓度(细胞/mL)
V4= 在培养件插入中播种的细胞悬架的实际体积(mL) - 将 24 个单元培养物插入推荐载体板的最高位置,并将载体板转移到预填充的 24 井板(cf. 3.1)。
注意:将载体板转移到多井板时,确保插入膜和基底舱的水下介质之间不会出现气泡,因为这将影响细胞的喂养,并最终损害RhE的生存能力和形态。 - 将单元格悬架的确定音量 V4( 从方程 2)添加到每个插入。
注意:建议使用反向管道技术将细胞悬架精确分配给培养物插入物。
注意:在将细胞悬浮物分配到培养物插入时,确保不要损坏膜。预防措施是在不接触膜表面的情况下,沿插入系统壁分配细胞悬架。 - 播种后,在室温下孵育24井板10-15分钟,以克服边缘效应(即所有井67之间的温度分布不均匀)。在此期间不要移动板。
- 将板转移到细胞培养孵化器(37 °C,5%CO2和95%RH)。细胞在水下条件下保存三天。
注意:为了避免组织变异,播种后不要将板堆放在孵化器中,以确保每个插入物接收相同量的热量。三天后(即在ALI种植期间),可以堆叠板。
4. 空气-液体接口的培养
- 在细胞培养孵化器(37 °C、5%CO2和 95% RH)中孵化三天后,最好使用吸气系统和玻璃巴斯德移液器将浸入膜表面的细胞暴露在 ALI 中。
注:或者,也可以用手动微皮带从凹层舱中取出淹没介质。 - 用 1.5 mL 的新鲜预热 ALI 介质填充新的 24 井板,并将带文化插入的载体板转移到新的多井板中。
- 将多井板传回细胞培养孵化器(37 °C,5% CO2和 95% RH)。
- 每 2-3 天刷新一次 ALI 介质,为期 14 天。
- 分两步进行刷新:1) 准备包含 1.5 mL/井的新鲜预热 ALI 介质的新板,2) 将承运板转移到新板。
注意:在整个重组过程中,最好不要取下覆盖车厢板的盖子,以防止 RhEs 受到潜在污染。
注:ALI步骤对于分层表皮模型的发展至关重要,因为它允许角蛋白细胞68的终端分化。进入 ALI 后,需要对插入物进行可视控制,以检查是否有"泄漏组织":组织表面的中等液滴来自玄武岩舱。如果泄漏发生在 ALI 第 3 天,请在不接触组织表面的情况下轻轻地从培养物插入中取出介质。如果泄漏持续存在,建议丢弃泄漏组织,因为这表明 RhE 模型中没有正确的屏障形成。 - 在重组过程结束时,组织可以暴露在各种压力源中,以诱导氧化应激或炎症。同时,它们可以用化合物或化妆品成分进行治疗。注意:在接触/治疗期间,组织通常从 ALI D14 开始以水下介质保存。当组织预计长时间暴露/治疗(即 48-72 小时)时,建议 (i) 在 ALI 培养过程(如 D7-D9)的早期开始接触/治疗,以避免可行层变薄和 SC 变厚,以及 (ii) 在 ALI 介质中孵化组织,以继续刺激细胞增殖。
- 对于RhE采集,在感兴趣的时间点收集组织和细胞培养介质,用于组织学分析、生存能力检测、蛋白质/RNA提取和酶相关免疫吸收检测 (ELISAs)。
结果
以二元培养的 NHEK 显示具有一致多边形形状的传统形态 (图2A)。如上所述,NHEK 在达到约 80% 的汇合后被植入培养物中。使用 H&E 染色和 TEM 分析 RhE 的形态。在 ALI 工作 15 天后,根据其四个主要表皮层(SB、SS、SG 和 SC(图 2B)获得完全分层的组织。在 SB 层中,细胞具有柱形。从第二层向RhE的上层倾斜,NHEK根据细胞形态的变化(从SB层的柱状形状到SS层的旋转形状)进行区分。在 SG 层中,细胞具有更扁平的形状,并显示细胞质中的角蛋白颗粒 (KG),这些颗粒被表示为紫色点。其特征圆形和恒星形状由 H&E 图像上的白色箭头突出显示 (图 2C)。SC中的细胞是最终分化的,完全扁平化,缺乏细胞核。分层的RhEs的总体厚度为84.3±2.4微米,其SC厚度为19.6±3.2微米(图2D)。这些值可与报告的原生人类皮肤值相媲美,即分别为60-120 μm 和 10-20 μm。可行层的数量是6-7,这比本地人的皮肤要低,大约是7-1470。在重组协议(即7天、10天、13天和15天)的不同时间点对RhEs进行超结构分析,揭示了随着时间的长,角蛋白层数量增加的RhEs的玉米化过程(图2E)。在 ALI 工作 15 天后,RhE 组织的 SC 由大约 15-25 层组成,与报告的原生人皮肤(即 15-20 层)69层的价值相当。

图2:原发性角蛋白细胞和重建的 人类表皮。 (A) 在播种到插入物之前,对照原核细胞的相对比显微镜图像。比例尺是 50μm.(B-C) H&E 明亮的 RhE 现场显微镜图像。比例尺为 50μm(B)和 25μm(C)。(D) RhE 和 SC 厚度的量化(平均± SEM,n=3)。(E) 在 ALI 的 7 天、10 天、13 天和 15 天后传输 RhE 横截面的传输电子显微镜图像。比例栏为 4μm。请单击此处查看此图的较大版本。
根据其分化阶段,生长在3D中的NHEK根据其分化阶段显示不同的蛋白质表达特征。在RhEs中,使用IF染色确定用于早期角蛋白分化(即角蛋白10)、晚期角蛋白分化(即非曲霉素、洛里林和长丝蛋白)和角蛋白细胞粘附(即脱烟素1)的表达。非自愿表达似乎更主要地位于 SG 层中,因为它的表达是在分化过程中较早启动的(图 3D),而长丝蛋白和洛里林则表示在上层(图3B-C)中。喀拉丁10表达在所有可行的层中都被发现,除了SB层(图3E)。RhEs 显示功能性脱血结,如在可行的表皮层的细胞间空间(图 3F)中对脱烟素 1 的表达所示。最后,所有五个标记都表示并位于适当的表皮层,并转化为健康的表皮分化过程。

图3:重建的人类表皮的表皮分化、组织粘附和组织完整性。(B) 长丝蛋白 (FLG)、(C)洛里林 (LOR)、(D)非自愿 (INV)、(E)角蛋白 10 (K10) 和(F)脱烟素 1 (DSG-1) 的共聚焦荧光显微镜图像以洋红色表示。核染色 (DAPI) 以蓝色表示。比例栏是 25μm.请单击此处查看此图的更大版本。
通过评估组织可行性和完整性,对 RhE 模型的屏障特性进行了调查。组织完整性在15天后通过使用伏托姆计测量TEER来确定。2567± 415Ω.cm 2值记录的 RhEs 翻译形成连续屏障 (图4A)。这些值与 RhE 型号71、72、73、74的报告值相一而高。此外,细胞毒性参考化学品(即Triton X-100)所需的暴露时间,以减少50%(ET50)的组织生存能力,通过硫化物蓝色四佐利姆溴化物(MTT)检测确定。RhE 测得的 ET50值为 2.1 小时。此值属于其他 3D 表皮模型的接受范围,这些模型符合可靠预测刺激分类 (OECD 指南 439)19 的资格。

图4:重建的人类表皮的屏障特性。 (A) 用跨皮电阻测量的组织完整性(平均± SEM,n=6)。(B) ET50通过测量组织生存能力(即 MTT 检测)确定,在局部暴露于 78.3 μL 的 1% Triton X-100(平均± SEM,n=3)。
在已知的发炎刺激后,对RhEs的反应性进行了调查。使用100微克/毫升大肠杆菌脂糖(LPS)和40 ng/mL肿瘤坏死因子α(TNF-α)在基质隔间介质中加入刺激物,对RhEs进行系统治疗。经过24小时的刺激,细胞培养介质被收集起来。细胞毒性是使用乳酸脱氢酶(LDH)检测来测量的,与已知膜破坏剂Triton X-100洗涤剂(图5)的值进行比较。在与Triton X-100治疗的RhEs的LDH活动中显示显著增加(p <0.05,单向ANOVA,Dunnett的多重比较测试)。LPS和TNF-α治疗均显示没有细胞毒性。
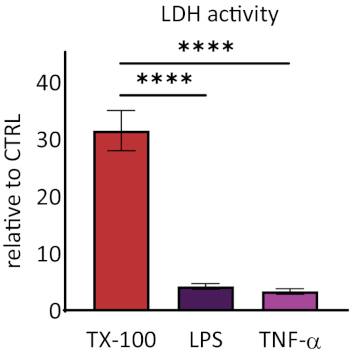
图5:通过乳酸脱氢酶(LDH)检测测量的细胞毒性。 数据以相对值呈现给控制、未经处理的组织(CTRL);平均± SEM, n=9 (特里顿 X-100), n=8 (LPS), n=3 (TNF-α).意义通过单向 ANOVA 测试,这是邓内特的多重比较测试。星号表示与 CTRL 相比在统计学上显著差异,**p < 0.0001)。请单击此处查看此图的较大版本。
使用 ELIS 对 RhE 介质中白细胞介质 1 阿尔法 (IL-1+) 和白细胞介质 8 (IL-8) 的释放进行量化。 图6 显示了RhEs在与LPS和TNF-α的挑战下发布的量化和相对IL-1+和IL-8。LPS 治疗导致 IL-8(9.6 ± 1.0 倍增加)和 IL-1+(2.7 ± 1.3 倍增加)的诱导释放具有统计学意义(p < 0.05,未修复的学生 T 测试)。TNF-α没有显著诱发IL-8释放,尽管观察到IL-8水平增加的趋势(2.3±0.8倍增加)。然而,TNF-α确实显著(p < 0.05,未修复的学生的 T 测试)触发 IL-1+ 版本(1.8 ± 0.5 倍增加)。

图6:重建的人类表皮中的预燃反应。IL-8浓度由RhE在与LPS(A)和TNF-α(B)的24小时挑战下释放。 数据表示为平均± SEM、n=8 (LPS)、n=3 (TNF-α)。(C) 与控制、未经处理的组织 (CTRL) ± SEM、n=8 (LPS)、n=3 (TNF-α) 相比,数据表示为相对值的均值。IL-1®释放的浓度在24小时挑战与LPS(D)和TNF-α(E)。数据表示为平均± SEM、n=8 (LPS)、n=3 (TNF-α)。(F) 与 CTRL ± SEM、n=4 (LPS)、n=3 (TNF-α)相比,数据表示为相对值的平均值。未修好的学生 T 测试测试了意义。星号表示与 CTRL 相比具有统计学意义的差异,*p < 0.05,***p < 0.0001)。请单击此处查看此图的较大版本。
讨论
在制药和皮肤化妆品领域,RhEs被广泛用作筛选工具,36、75、76、77、78。虽然几家公司已经将此类RhEs商业化,但它们仍然成本高昂,并限制了根据需要改变种植参数以解决新的研究问题的可能性。本文以可靠可靠的方式描述了内部 RhEs 的生产过程,并详细描述了获得的组织,以确认该模型作为动物测试的替代方法的相关性。
协议中的某些步骤对于确保适当的角蛋白细胞分化和 RhE 可重复性至关重要。这可以通过利用最佳细胞、中等类型和培养条件来实现。在提议的RhE模型中,新生儿NHEK因缺乏抗原性暴露而选择,而成人NHEK则选择。此外,角蛋白细胞仅限于白种人族裔,以避免物种间的变异。主要角蛋白细胞通常用于其区分和分层的能力79.它们可以通过商业或内部隔离成人皮肤获得80.聚碳酸酯膜上细胞系(即HaCaT)的培养表明分化失败,并显示出合成屏障形成所必需的脂质的能力受损81.然而,包括不同的文化矩阵,如水凝胶,胶原蛋白,纤维蛋白和球形培养物,导致3D皮肤模型的成功开发78,82,83,84,85,86.不朽的细胞系,N/TERT,已被证明适合RhEs的发展35.主要角蛋白细胞在第四或第五段时仍然具有扩散性61因此,目前的议定书包括在其第三段中使用角蛋白细胞。De Vuyst等人已经证明细胞播种密度很重要,需要足够(即≥2.5x105 细胞/厘米2)确保基底舱的介质不会扩散到顶棚。播种密度不足(即, < 2.5x105 细胞/厘米2)可能导致无法形成适当的屏障,这表现为介质从玄武岩扩散到顶层隔间,导致淹没而不是ALI文化条件62.无血清角蛋白细胞生长介质(参见 材料表)优先用于可重复性目的,因为它提供了与化学定义介质配合使用的优势,并降低了污染风险。这种介质的钙浓度较低(即60μM),因此刺激角蛋白细胞的增殖87.从RhE培养的第一步开始,提高钙浓度(即1.5m),有利于角蛋白分化和皮肤屏障形成和平衡49.此外,ALI介质还辅以抗坏酸,这已证明对SC脂质的形成和促进分化至关重要52,53,54.ALI介质还含有KGF,这是一个由成纤维细胞分泌的生长因子,可以与角蛋白细胞转膜受体结合,激活后在分化和伤口修复方面具有双重作用55,88.重要的是在特定的时间间隔刷新ALI介质,为RhEs提供源源不断的新鲜营养物质。使用载波板系统对于更大规模地培养 RhE 至关重要(即 24 个插入/板)。它提供了节省时间、降低污染风险的优点,并为引入人为错误留出的空间较小。它还提供了在大量媒体(即 1.5 mL)中培养 RhEs 的可能性,从而减少了所需的 ALI 媒体刷新次数。此外,它提供了将一整盘插入物转移到具有新鲜介质的板中的可能性,避免单独与插入物接触或揭开板盖。
RhE 模型存在若干应注意的局限性。在原生人类皮肤中,基底层角蛋白细胞的增殖与SC中角细胞的分离(即去挤压)之间存在平衡89.然而,在体外,脱压不发生。因此,角细胞仍然附着在RhE上,形成一个在生理上不太相关的厚SC。因此,RhEs 的培养时间跨度有限。此外,这个RhE模型简单明了,因为它由单一的细胞类型,即角蛋白细胞组成,这是表皮最丰富的细胞类型。然而,表皮中还有其他细胞类型,如黑色素细胞、树突状细胞(即兰格汉斯细胞)、T细胞(如CD8)+ 细胞),和默克尔细胞13.为了提高皮肤模型的生理相关性,研究人员通过添加黑色素细胞使皮肤模型更加复杂38 ,免疫细胞39,或患者衍生的细胞90.人们应该记住,人类皮肤模型的屏障特性与原生人皮肤不同,因为SC脂质成分明显不同,屏障渗透性较高 91,92,93,94,95.然而,一些研究已经报告了在缺氧下培养人类皮肤模型的屏障特性的变化96 或相对湿度降低97,皮肤基质与奇托桑的调制98,并在培养介质中自由脂肪酸的改变99.此外,在简单和复杂的RhEs中,文化条件和中等组成可以调节以模拟病理特征。通过挑战模型与细胞因子,一个异常的形态100 基因和蛋白质表达水平的变化可以确定,通常观察到在常见的皮肤疾病,如特异性皮炎和牛皮病35,101,102,103,104,105.在启动3D模型的重组过程之前,在角蛋白细胞中隔离特定基因是另一种用来模仿皮肤疾病特征和研究新的治疗方法的方法106,107.除了仅对表皮层建模外,皮肤隔间还可以通过在 RhE 重组前将成纤维细胞嵌入胶原蛋白基质中,使其在生理上更具相关性,并适合衰老和伤口愈合相关研究,从而包含在模型中(即命名的人类皮肤等价物或全厚模型)中108,109,110.此外,肿瘤球体已被添加到人类皮肤等价物,以研究黑色素瘤进展111,112.皮肤模型领域的最新进展是生物打印和片上皮肤。多个研究小组最近成功地开发出(可渗透的)生物印花皮肤等价物45,113,114.拟议的协议利用了 24 井格式和承运板,避免了单独处理插入。然而,研究规模仍然相当有限,缺乏自动化。通过实现生物打印或片上皮肤的使用,较小的皮肤模型可用于更自动化的流程和更大规模的流程。
本协议中描述的 RhE 与已经开发且具有良好特征的商业表皮模型具有多种相似之处。形态分析表明,虽然建议的RhE模型中可行的层数低于原生人皮肤(即6-7与7-14),但它可与EpiDerm RhE模型(即8-12)70的层数相媲美。与表皮、EpiSkin 和皮肤伦理模型类似,上 RhE 层显示了密集包装的角细胞层28的篮子编织模式。此外,TEM 分析显示,拟议的 RhE 模型中的 SC 层数(即 15-25)与 EpiDerm(即 16-25)70的数目相当。总体而言,建议的RhE模型展示了与其他商业化表皮模型类似的结构,模仿了本地人类表皮。TEER 测量的组织完整性与商用 RhE 模型(即 3000-5600 Ω.cm2)71、72、73和其他内部 RhE(即约 5000 Ω.cm2)74,115 之间。建议的 RhE 模型显示差异很大,差异化和组织粘附标记的存在和正确定位就说明了这一点。此外,拟议的RhE模型表明对发炎刺激(即LPS和TNF-α)有反应。
最后,目前的议定书展示了如何以可靠的方式和规模生产RhEs,以满足学术和私营机构研究人员的需求。建议的RhE模型显示与其他现有商业模型具有相似的形态、表皮分化和生物反应能力。当需要访问相关的皮肤模型时,它为制药和皮肤化妆品领域提供了替代工具。
披露声明
马克·埃曼和贝内代塔·佩特拉卡是比利时陶氏硅胶公司的员工。所有其他作者都没有什么可透露的。
致谢
根据玛丽·斯考多夫斯卡-居里赠款,欧洲联盟的Horizhos20研究和创新方案与赠款协议第765602资助这项工作。所有作者都感谢阿道夫·默克尔基金会和费拉拉大学的支持,并感激地感谢比利时陶氏硅胶公司。米格尔·斯普奇-卡尔瓦尔博士因准备RhE栽培过程的图形图像而得到认可。作者感谢芭芭拉·德拉斯勒博士、佛朗哥·塞尔韦拉蒂博士和阿涅斯·泰西尔博士的技术支持和讨论。
材料
| Name | Company | Catalog Number | Comments |
| Acetic acid | Sigma Aldrich | A6283 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Antibiotic-antimycotic (100x) | Thermo Fisher Scientific (Gibco) | 15240062 | |
| Aqueous Eosin Y solution | Sigma Aldrich | HT110280 | Acidify Eosin solution with 1 mL acetic acid per 100 mL. |
| Calcium chloride (CaCl2) | Sigma Aldrich or Merck | C8106 or 1.02378.0500 | Prepare a stock solution of 0.144 M, filter sterilize and store aliquots at -20 °C. It is recommended to prepare new aliquots every 6 months. |
| DAPI | Roche | 10236276001 | Prepare a stock at 100 μg/mL and store aliquots at -20 °C. Working conditon is 1 μg/mL. |
| Entellan mounting medium | Merck | 1.07960.0500 | Mounting medium for H&E staining. |
| EpiLife medium (referred to as keratinocyte growth medium) | Thermo Fisher Scientific (Gibco) | MEPI500CA | Contains 0.06 mM of Ca2+. |
| Ethanol absolute | Any supplier | N/A | |
| Formalin 10% | Leica Biosystems | 3800770 | |
| Human keratinocytes growth supplement (HKGS) (100x) | Thermo Fisher Scientific (Gibco) | S0015 | To reach final concentrations of 0.2% [v/v] BPE, 0.2 ng/mL human recombinant EGF, 0.18 μg/mL hydrocortisone,5 μg/mL bovine transferrin, and 0.01 µg/mL human recombinant insulin-like growth factor-I. |
| Isopropanol | Biosolve B.V. | 0016264102BS | |
| Kaiser's glycerol gelatine, phenol-free | Merck | 1.08635.0100 | Mounting medium for IF staining. |
| Keratinocyte growth factor (KGF) | R&D Systems | 251-KG-050 | Reconstitute KGF protein at 100 μg/mL in sterile 0.1% [w/v] BSA in PBS. Prepare aliquots and store at -20°C. |
| Lactate dehydrogenase (LDH) assay kit | Roche | 4744926001 | |
| L-ascorbic acid 2-phosphate sesquimagnesium salt hydrate | Sigma-Aldrich | A8960 | Prepare a stock solution of 25 mg/mL, filter sterilize and store aliquots at -20°C. It is recommended to prepare new aliquots every 6 months. Store in the dark. |
| Lipopolysaccharide (LPS), E.coli strain O55:B5 | Sigma-Aldrich | L4524 | Prepare a stock of 1 mg/mL in sterile PBS and store aliquots at -20 °C. Working concentration is 100 μg/mL. |
| Mayer’s Haematoxylin | Sigma-Aldrich | MHS80 | |
| Normal human epidermal keratinocytes (NHEKs) | Lonza | 00192906 | Human primary keratinocytes isolated from neonatal foreskin, pooled from at least three donors. |
| Phosphate-buffered saline | Thermo Fisher Scientific (Gibco) | 10010056 or 10010-015 | Reference numbers can vary between countries. |
| Recombinant tumor necrosis factor alpha (TNF-α) | ImmunoTools | 11344483 | Prepare a stock of 100 μg/mL in sterile ultrapure water. Working concentration is 40 ng/mL |
| Sterile ultrapure water | Any supplier | N/A | |
| Thiazolyl Blue Tetrazolium Bromide (MTT) | Sigma-Aldrich | M5655 | Prepare a stock of 5 mg/mL MTT in sterile PBS. Working concentration is 1 mg/mL. |
| Triton X-100 | Sigma-Aldrich | 93426 | |
| Trypan blue (0.4% [v/v]) | Any supplier | N/A | |
| Trypsin inhibitor | Thermo Fisher Scientific (Gibco) | R007100 | |
| Trypsin/EDTA (0.05% [v/v]) | Thermo Fisher Scientific (Gibco) | 25300054 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Xylene | Sigma-Aldrich | 214736 | |
| Goat Anti-Mouse IgG H&L (Alexa Fluor 488) | Abcam | Ab150113 | |
| Tri-sodium citrate dihydrate | Merck | 1.06448.0500 | For antigen retrieval buffer for IF staining. |
| Goat Anti-Rabbit IgG H&L (Dylight 488) | Agrisera | AS09 633 | |
| Filaggrin Mouse antibody | BioTechne (Novus Biologicals) | NBP2-53243 | |
| Involucrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP2-33742 | |
| Keratin 10 Mouse antibody | BioTechne (Novus Biologicals) | NBP2-32962 | |
| Desmoglein-1 Mouse antibody | BioTechne (Novus Biologicals) | MAB944 | |
| Loricrin Rabbit antibody | BioTechne (Novus Biologicals) | NBP1-33610 |
参考文献
- Alberts, B., Johnson, A., Lewis, J. Molecular Biology of the Cell. 4th edition. Antioxidants & Redox Signaling. , (2002).
- Pouillot, A., Dayan, N., Polla, A. S., Polla, L. L., Polla, B. S. The stratum corneum: a double paradox. Journal of Cosmetic Dermatology. 7 (2), 143-148 (2008).
- Moore, K. L., Dalley, A. F. Clinically Orientated Anatomy. , (2010).
- Barthel, R., Aberdam, D. Epidermal stem cells. Journal of the European Academy of Dermatology and Venereology. 19 (4), 405-413 (2005).
- Green, K. J., Simpson, C. L. Desmosomes: new perspectives on a classic. Journal of Investigative Dermatology. 127 (11), 2499-2515 (2007).
- Feingold, K. R. Lamellar bodies: the key to cutaneous barrier function. Journal of Investigative Dermatology. 132 (8), 1951-1953 (2012).
- Elias, M. P., Feingold, K. R., Fartasch, M. The epidermal lamellar body as a multifunctional secretory organelle. Skin Barrier. , 261-272 (2006).
- Tobin, D. J. Biochemistry of human skin-our brain on the outside. Chemical society reviews. 35 (1), 52-67 (2006).
- Bouwstra, J. A., Ponec, M. The skin barrier in healthy and diseased state. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (12), 2080-2095 (2006).
- Weinstein, G. D., McCullough, J. L., Ross, P. Cell proliferation in normal epidermis. Journal of Investigative Dermatology. 82 (6), 623-628 (1984).
- Madison, K. C. Barrier function of the skin: "la raison d'être" of the epidermis. Journal of Investigative Dermatology. 121 (2), 231-241 (2003).
- Suter, M. M., et al. The keratinocyte in epidermal renewal and defence. Veterinary Dermatology. 20 (5-6), 515-532 (2009).
- McLafferty, E., Hendry, C. The integumentary system: anatomy, physiology and function of skin. Nursing Standard. 27 (7), 35-43 (2012).
- Monteiro-Riviere, N. A. Toxicology of the skin. , (2010).
- Dellambra, E., Odorisio, T., D'Arcangelo, D., Failla, C. M., Facchiano, A. Non-animal models in dermatological research. ALTEX. 36 (2), 177-202 (2019).
- Gordon, S., et al. Non-animal models of epithelial barriers (skin, intestine and lung) in research, industrial applications and regulatory toxicology. Altex. 32 (4), 327-378 (2015).
- Kandárová, H., et al. The EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests - An assessment of the performance of the optimised test. Alternatives to laboratory animals : ATLA. 33 (4), 351-367 (2005).
- Kandárová, H., et al. Assessment of the skin irritation potential of chemicals by using the SkinEthic reconstructed human epidermal model and the common skin irritation protocol evaluated in the ECVAM skin irritation validation study. Alternatives to laboratory animals : ATLA. 34 (4), 393-406 (2006).
- OECD. Test No. 439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method. OECD. , (2019).
- Alépée, N., Grandidier, M. H., Cotovio, J. Sub-categorisation of skin corrosive chemicals by the EpiSkinTM reconstructed human epidermis skin corrosion test method according to UN GHS: Revision of OECD Test Guideline 431. Toxicology in Vitro. 28 (2), 131-145 (2014).
- OECD. Test No. 431: In vitro skin corrosion: reconstructed human epidermis (RHE) test method. OECD. , (2019).
- Mehling, A., et al. In vitro RHE skin sensitisation assays: applicability to challenging substances. Regulatory Toxicology and Pharmacology. 108, 104473(2019).
- SENS-IS | EURL ECVAM - TSAR. , Available from: https://tsar.jrc.ec.europa.eu/test-method/tm2011-11 (2020).
- Lelièvre, D., et al. The episkin phototoxicity assay (EPA): development of an in vitro tiered strategy using 17 reference chemicals to predict phototoxic potency. Toxicology in Vitro. 21 (6), 977-995 (2007).
- Flaten, G. E., et al. In vitro skin models as a tool in optimization of drug formulation. European Journal of Pharmaceutical Sciences. 75, 10-24 (2015).
- Pellevoisin, C., Bouez, C., Cotovio, J. Cosmetic industry requirements regarding skin models for cosmetic testing. Skin Tissue Models. , 3-37 (2018).
- Niehues, H., et al. 3D skin models for 3R research: the potential of 3D reconstructed skin models to study skin barrier function. Experimental Dermatology. 27 (5), 501-511 (2018).
- Netzlaff, F., Lehr, C. -M., Wertz, P. W., Schaefer, U. F. The human epidermis models EpiSkin®, SkinEthic® and EpiDerm®: An evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity, and substance transport. European Journal of Pharmaceutics and Biopharmaceutics. 60 (2), 167-178 (2005).
- Prieux, R., Eeman, M., Rothen-Rutishauser, B., Valacchi, G. Mimicking cigarette smoke exposure to assess cutaneous toxicity. Toxicology in Vitro. 62, 104664(2020).
- Petracca, B., Rothen-Rutishauser, B., Valacchi, G., Eeman, M. Bench approaches to study the detrimental cutaneous impact of troposperic ozone. Journal of Exposure Science and Environmental Epidemiology. 31, 137-148 (2021).
- Dijkhoff, I. M., et al. Impact of airborne particulate matter on skin: a systematic review from epidemiology to in vitro studies. Particle and fibre toxicology. 17 (1), 35(2020).
- El Ghalbzouri, A., Siamari, R., Willemze, R., Ponec, M. Leiden reconstructed human epidermal model as a tool for the evaluation of the skin corrosion and irritation potential according to the ECVAM guidelines. Toxicology in Vitro. 22 (5), 1311-1320 (2008).
- Chacón, M., et al. Development of an in-house reconstructed human epidermis model as an alternative method in skin corrosion assessment. Toxicology in Vitro. 65, 104779(2020).
- Pedrosa, T. doN., et al. A new reconstructed human epidermis for in vitro skin irritation testing. Toxicology in Vitro. 42, 31-37 (2017).
- Smits, J. P. H., et al. Immortalized N/TERT keratinocytes as an alternative cell source in 3D human epidermal models. Scientific Reports. 7 (1), 11838(2017).
- Poumay, Y., Coquette, A. Modelling the human epidermis in vitro: tools for basic and applied research. Archives of dermatological research. 298 (8), 361-369 (2007).
- Rikken, G., Niehues, H., van den Bogaard, E. H. Organotypic 3D skin models: human epidermal equivalent cultures from primary keratinocytes and immortalized keratinocyte cell lines. Methods in Molecular Biology. 2154, 45-61 (2020).
- Duval, C., et al. Human skin model containing melanocytes: essential role of keratinocyte growth factor for constitutive pigmentation-functional response to α-melanocyte stimulating hormone and forskolin. Tissue engineering. Part C, Methods. 18 (12), 947-957 (2012).
- Hutter, V., Kirton, S. B., Chau, D. Y. S. Immunocompetent human in vitro skin models. Skin Tissue Models. , 353-373 (2018).
- Kinsner, A., Lesiak-Cyganowska, E., Śladowski, D. In vitro reconstruction of full thickness human skin on a composite collagen material. Cell and Tissue Banking. 2 (3), 165-171 (2001).
- Black, A. F., Bouez, C., Perrier, E., Schlotmann, K., Chapuis, F., Damour, O. Optimization and characterization of an engineered human skin equivalent. Tissue Engineering. 11 (5-6), 723-733 (2005).
- Reijnders, C. M. A., et al. Development of a full-thickness human skin equivalent in vitro model derived from TERT-immortalized keratinocytes and fibroblasts. Tissue Engineering. Part A. 21 (17-18), 2448-2459 (2015).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering - In vivo and in vitro applications. Advanced Drug Delivery Reviews. 63 (4-5), 352-366 (2011).
- Mathes, S. H., Ruffner, H., Graf-Hausner, U. The use of skin models in drug development. Advanced Drug Delivery Reviews. 69-70, 81-102 (2014).
- Kim, B. S., Gao, G., Kim, J. Y., Cho, D. 3D cell printing of perfusable vascularized human skin equivalent composed of epidermis, dermis, and hypodermis for better structural recapitulation of native skin. Advanced Healthcare Materials. 8 (7), 1801019(2019).
- Pittelkow, M. R., Scott, R. E. New techniques for the in vitro culture of human skin keratinocytes and perspectives on their use for grafting of patients with extensive burns. Mayo Clinic Proceedings. 61 (10), 771-777 (1986).
- Elias, P. M., Ahn, S. K., Brown, B. E., Crumrine, D., Feingold, K. R. Origin of the epidermal calcium gradient: regulation by barrier status and role of active vs passive mechanisms. Journal of Investigative Dermatology. 119 (6), 1269-1274 (2002).
- Elias, P. M., et al. Modulations in epidermal calcium regulate the expression of differentiation-specific markers. Journal of Investigative Dermatology. 119 (5), 1128-1136 (2002).
- Lee, S. E., Lee, S. H. Skin barrier and calcium. Annals of Dermatology. 30 (3), 265-275 (2018).
- Prunieras, M., Regnier, M., Woodley, D. Methods for cultivation of keratinocytes with an air-liquid interface. Journal of Investigative Dermatology. 81, 28-33 (1983).
- Poumay, Y., et al. A simple reconstructed human epidermis: preparation of the culture model and utilization in in vitro studies. Archives of Dermatological Research. 296 (5), 203-211 (2004).
- Ponec, M., et al. The formation of competent barrier lipids in reconstructed human epidermis requires the presence of vitamin C. Journal of Investigative Dermatology. 109 (3), 348-355 (1997).
- Savini, I., et al. Characterization of keratinocyte differentiation induced by ascorbic acid: Protein kinase C involvement and vitamin C homeostasis. Journal of Investigative Dermatology. 118 (2), 372-379 (2002).
- Pasonen-Seppänen, S., et al. Vitamin C enhances differentiation of a continuous keratinocyte cell line (REK) into epidermis with normal stratum corneum ultrastructure and functional permeability barrier. Histochemistry and Cell Biology. 116 (4), 287-297 (2001).
- Beer, H. D., et al. Expression and function of keratinocyte growth factor and activin in skin morphogenesis and cutaneous wound repair. Journal of Investigative Dermatology Symposium Proceedings. 5 (1), 34-39 (2000).
- Steven, A. C., Bisher, M. E., Roop, D. R., Steinert, P. M. Biosynthetic pathways of filaggrin and loricrin--two major proteins expressed by terminally differentiated epidermal keratinocytes. Journal of structural biology. 104 (1-3), 150-162 (1990).
- Rice, R. H., Thacher, S. M. Involucrin: a constituent of cross-linked envelopes and marker of squamous maturation. Biology of the Integument. , 752-761 (1986).
- Elias, P. M., Barrier Feingold, K. R. Skin Barrier. , (2011).
- Marionnet, C., et al. Morphogenesis of dermal-epidermal junction in a model of reconstructed skin: beneficial effects of vitamin C. Experimental Dermatology. 15 (8), 625-633 (2006).
- Frikke-Schmidt, H., Lykkesfeldt, J. Keeping the intracellular vitamin C at a physiologically relevant level in endothelial cell culture. Analytical Biochemistry. 397 (1), 135-137 (2010).
- Castro-Muñozledo, F., Hernández-Quintero, M., Marsch-Moreno, M., Kuri-Harcuch, W. Cultivation, serial transfer, and differentiation of epidermal keratinocytes in serum-free medium. Biochemical and Biophysical Research Communications. 236 (1), 167-172 (1997).
- De Vuyst, E., et al. Reconstruction of normal and pathological human epidermis on polycarbonate filter. Epidermal Cells. Methods in Molecular Biology (Methods and Protocols. , 191-201 (2013).
- Chen, R. H., Zhu, J., Zhang, R. Z., Wang, S. Y., Li, Y. The tolerance of human epidermal cells to trypsinization in vitro. Cell and Tissue Banking. 21 (2), 257-264 (2020).
- Pohanish, R. P. Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens. 2, (2012).
- Tsaousis, K. T., et al. Time-dependent morphological alterations and viability of cultured human trabecular cells after exposure to Trypan blue. Clinical and Experimental Ophthalmology. 41 (5), 484-490 (2013).
- Kim, S. I., et al. Application of a non-hazardous vital dye for cell counting with automated cell counters. Analytical Biochemistry. 492, 8-12 (2016).
- Lundholt, B. K., Scudder, K. M., Pagliaro, L. A simple technique for reducing edge effect in cell-based assays. Journal of Biomolecular Screening. 8 (5), 566-570 (2003).
- Fartasch, M., Ponec, M. Improved barrier structure formation in air-exposed human keratinocyte culture systems. Journal of Investigative Dermatology. 102 (3), 366-374 (1994).
- Bouwstra, J. A., Honeywell-Nguyen, P. L., Gooris, G. S., Ponec, M. Structure of the skin barrier and its modulation by vesicular formulations. Progress in Lipid Research. 42 (1), 1-36 (2003).
- Ponec, M., Boelsma, E., Gibbs, S., Mommaas, M. Characterization of reconstructed skin models. Skin Pharmacology and Physiology. 15 (1), 4-17 (2002).
- Hubaux, R., Wauters, A., Chrétien, A., Poumay, Y., Salmon, M. Reconstructed human epidermis response to urban particulate matter activates multiple stress-related pathways and impacts the skin barrier function. 23th IFSCC Conference. , 125-134 (2017).
- Lin, Y. -C., et al. Testing method development and validation for in vitro skin irritation testing (SIT) by using reconstructed human epidermis (RhE) skin equivalent - EPiTRI®. Alternatives to Animal Testing. , 8-19 (2019).
- Alexander, F. A., Eggert, S., Wiest, J. Skin-on-a-chip: Transepithelial electrical resistance and extracellular acidification measurements through an automated air-liquid interface. Genes. 9 (2), 114(2018).
- van den Bogaard, E., et al. Perspective and consensus opinion: good practices for using organotypic skin and epidermal equivalents in experimental dermatology research. Journal of Investigative Dermatology. 141 (1), 203-205 (2021).
- Kandárová, H., Hayden, P., Klausner, M., Kubilus, J., Sheasgreen, J. An in vitro skin irritation test (SIT) using the EpiDerm reconstructed human epidermal (RHE) model. Journal of Visualized Experiments. (29), e1366(2009).
- Abd, E., et al. Skin models for the testing of transdermal drugs. Clinical pharmacology advances and applications. 8, 163-176 (2016).
- De Wever, B., Kurdykowski, S., Descargues, P. Human skin models for research applications in pharmacology and toxicology: introducing nativeSkin, the "missing link" bridging cell culture and/or reconstructed skin models and human clinical testing. Applied In Vitro Toxicology. 1 (1), 26-32 (2015).
- Klicks, J., von Molitor, E., Ertongur-Fauth, T., Rudolf, R., Hafner, M. In vitro skin three-dimensional models and their applications. Journal of Cellular Biotechnology. 3 (1), 21-39 (2017).
- Bernstam, L. I., Vaughan, F. L., Bernstein, I. A. Keratinocytes grown at the air-liquid interface. In Vitro Cellular and Developmental Biology - Animal. 22 (12), 695-705 (1986).
- Johansen, C. Generation and culturing of primary human keratinocytes from adult skin. Journal of Visualized Experiments. (130), e56863(2017).
- Boelsma, E., Verhoeven, M. C. H., Ponec, M. Reconstruction of a human skin equivalent using a spontaneously transformed keratinocyte cell line (HaCaT). Journal of Investigative Dermatology. 112 (4), 489-498 (1999).
- Zhao, X., et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering. Advanced Healthcare Materials. 5 (1), 108-118 (2016).
- Peura, M., et al. Paracrine factors from fibroblast aggregates in a fibrin-matrix carrier enhance keratinocyte viability and migration. Journal of Biomedical Materials Research. Part A. 95 (2), 658-664 (2010).
- Schoop, V. M., Mirancea, N., Fusenig, N. E. Epidermal organization and differentiation of HaCat keratinocytes in organotypic coculture with human dermal fibroblasts. Journal of Investigative Dermatology. 112 (3), 343-353 (1999).
- Lee, V., et al. Design and fabrication of human skin by three-dimensional bioprinting. Tissue engineering. Part C, Methods. 20 (6), 473-484 (2014).
- Alameda, J. P., et al. IKKα regulates the stratification and differentiation of the epidermis: Implications for skin cancer development. Oncotarget. 7 (47), 76779-76792 (2016).
- Bikle, D. D., Xie, Z., Tu, C. L. Calcium regulation of keratinocyte differentiation. Expert Review of Endocrinology and Metabolism. 7 (4), 461-472 (2012).
- Staiano-Coico, L., et al. Human keratinocyte growth factor effects in a porcine model of epidermal wound healing. Journal of Experimental Medicine. 178 (3), 865-878 (1993).
- Egelrud, T. Desquamation in the stratum corneum. Acta Dermato-Venereologica. 80, Supp 208 44-45 (2000).
- Jean, J., Lapointe, M., Soucy, J., Pouliot, R. Development of an in vitro psoriatic skin model by tissue engineering. Journal of Dermatological Science. 53 (1), 19-25 (2009).
- Lotte, C., Patouillet, C., Zanini, M., Messager, A., Roguet, R. Permeation and skin absorption: reproducibility of various industrial reconstructed human skin models. Skin Pharmacology and Applied Skin Physiology. 15, Suppl 1 18-30 (2002).
- Ponec, M., Weerheim, A., Lankhorst, P., Wertz, P. New acylceramide in native and reconstructed epidermis. Journal of Investigative Dermatology. 120 (4), 581-588 (2003).
- Thakoersing, V. S., et al. Unraveling barrier properties of three different in-house human skin equivalents. Tissue engineering. Part C, Methods. 18 (1), 1-11 (2012).
- Thakoersing, V. S., et al. presence of monounsaturated fatty acids in the stratum corneum of human skin equivalents. Journal of Investigative Dermatology. 133 (1), 59-67 (2013).
- Van Smeden, J., et al. Combined LC/MS-platform for analysis of all major stratum corneum lipids, and the profiling of skin substitutes. Biochimica et Biophysica Acta - Molecular and Cell Biology of Lipids. 1841 (1), 70-79 (2014).
- Mieremet, A., et al. Human skin equivalents cultured under hypoxia display enhanced epidermal morphogenesis and lipid barrier formation. Scientific Reports. 9 (1), 7811(2019).
- Mieremet, A., et al. Unravelling effects of relative humidity on lipid barrier formation in human skin equivalents. Archives of Dermatological Research. 311 (9), 679-689 (2019).
- Mieremet, A., Rietveld, M., Absalah, S., Van Smeden, J., Bouwstra, J. A., El Ghalbzouri, A. Improved epidermal barrier formation in human skin models by Chitosan modulated dermal matrices. PLoS ONE. 12 (3), 0174478(2017).
- Mieremet, A., et al. Contribution of palmitic acid to epidermal morphogenesis and lipid barrier formation in human skin equivalents. International Journal of Molecular Sciences. 20 (23), 6069(2019).
- Boniface, K., et al. IL-22 inhibits epidermal fifferentiation and induces proinflammatory gene expression and migration of human keratinocytes. The Journal of Immunology. 174 (6), 3695-3702 (2005).
- De Vuyst, E., Salmon, M., Evrard, C., Lambert de Rouvroit, C., Poumay, Y. Atopic dermatitis studies through in vitro models. Frontiers in Medicine. 4, 119(2017).
- Danso, M. O., et al. TNF-α and Th2 cytokines induce atopic dermatitis-like features on epidermal differentiation proteins and stratum corneum lipids in human skin equivalents. Journal of Investigative Dermatology. 134 (7), 1941-1950 (2014).
- Soboleva, A. G., Mezentsev, A., Zolotorenko, A., Bruskin, S., Pirusian, E. Three-dimensional skin models of psoriasis. Cells Tissues Organs. 199 (5-6), 301-310 (2014).
- Desmet, E., Ramadhas, A., Lambert, J., Gele, M. Van In vitro psoriasis models with focus on reconstructed skin models as promising tools in psoriasis research. Experimental Biology and Medicine. 242 (11), 1158-1169 (2017).
- Niehues, H., van den Bogaard, E. H. Past, present and future of in vitro 3D reconstructed inflammatory skin models to study psoriasis. Experimental Dermatology. 27 (5), 512-519 (2018).
- Pendaries, V., et al. Knockdown of filaggrin in a three-dimensional reconstructed human epidermis impairs keratinocyte differentiation. Journal of Investigative Dermatology. 134 (12), 2938-2946 (2014).
- Niehues, H., et al. Epidermal equivalents of filaggrin null keratinocytes do not show impaired skin barrier function. Journal of Allergy and Clinical Immunology. 139 (6), 1979-1981 (2017).
- Reuter, C., Walles, H., Groeber, F. Preparation of a three-dimensional full thickness skin equivalent. Methods in Molecular Biology. 1612, 191-198 (2017).
- Bataillon, M., et al. Characterization of a new reconstructed full thickness skin model, t-skinTM, and its application for investigations of anti-aging compounds. International Journal of Molecular Sciences. 20 (9), 2240(2019).
- Rossi, A., Appelt-Menzel, A., Kurdyn, S., Walles, H., Groeber, F. Generation of a three-dimensional full thickness skin equivalent and automated wounding. Journal of Visualized Experiments. (96), e52576(2015).
- Li, L., Fukunaga-Kalabis, M., Herlyn, M. The three-dimensional human skin reconstruct model: a tool to study normal skin and melanoma progression. Journal of Visualized Experiments. (54), e2937(2011).
- Müller, I., Kulms, D. A 3D organotypic melanoma spheroid skin model. Journal of Visualized Experiments. (135), e57500(2018).
- Wei, Z., et al. Two-dimensional cellular and three-dimensional bio-printed skin models to screen topical-use compounds for irritation potential. Frontiers in Bioengineering and Biotechnology. 8, 109(2020).
- Derr, K., et al. Fully three-dimensional bioprinted skin equivalent constructs with validated morphology and barrier function. Tissue Engineering - Part C: Methods. 25 (6), 334-343 (2019).
- Frankart, A., et al. Epidermal morphogenesis during progressive in vitro 3D reconstruction at the air-liquid interface. Experimental Dermatology. 21 (11), 871-875 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。