Method Article
在猪出血性心脏骤停模型中开发选择性主动脉弓灌注系统
摘要
该协议的目标是展示猪放血心脏骤停模型和专门构建的用于转化研究的选择性主动脉弓灌注回路。
摘要
出血占可能可预防的创伤死亡的大多数。人们对血管内复苏技术越来越感兴趣,例如用于心脏骤停患者的选择性主动脉弓灌注 (SAAP)。这涉及通过胸主动脉球囊导管对冠状动脉循环进行主动灌注,并即将进入临床应用。然而,该技术很复杂,需要在动物模型中进行改进,然后才能考虑人类使用。本文描述了一种使用定制 SAAP 系统治疗的失血性心脏骤停的大型动物模型。
对猪进行麻醉、器械检查并进行脾切除术,然后开始受控的对数放血。将动物肝素化,并将流出的血液收集在储液器中。一旦观察到心脏骤停,血液就通过体外回路泵入氧合器,然后通过放置在胸主动脉中的 10 Fr 球囊导管输送。
这导致自主循环 (ROSC) 恢复,如 ECG 和主动脉根部压力波形所示。该模型和随附的 SAAP 系统允许从失血性心脏骤停中实现标准化和可重复的恢复。
引言
出血占潜在可预防创伤死亡的大部分1。在失血的终末期,冠状动脉灌注减少,导致心脏骤停和死亡。目前的策略——静脉输血和心脏按摩——是无效的,因为它们没有解决冠状动脉灌注失败的问题。
SAAP 是一种基于导管的复苏技术,旨在通过将含氧复苏液和药物直接注入主动脉近端,灌注冠状动脉和脑循环来解决这个问题。有限的猪研究表明,在心室颤动和出血性心脏骤停后恢复心脏活动方面取得了有希望的结果 2,3,4。然而,SAAP 研究正在进行中,该技术仍处于临床前阶段。
SAAP 存在一些技术挑战。通过导管以精确的输注速率输送一定量的灌注液至关重要,目前没有市售的 FDA 批准的用于 SAAP 的导管。该技术需要一个特定的回路,该回路能够在 SAAP 期间有效地储存、充氧和输送灌注液。本研究的目的是提出一种创伤性无脉电活动 (PEA) 心脏骤停动物模型和定制的、可靠的 SAAP 系统,用于在放血动物研究中探索该工具。
研究方案
这项研究是在医学院教学设施(MSTF,马里兰大学,巴尔的摩,马里兰州,美国)进行的,该设施获得了美国实验动物科学协会的认可。该研究方案得到了当地机构动物护理和使用委员会的批准。
1. 动物选择和饲养
- 使用体重 60-80 公斤的成年雄性猪 (Sus Scrofa)。
- 到达动物设施后,每个笼子饲养一只动物,但能够与相邻笼子中的动物互动。
- 将动物安置至少 48 小时以确保适应环境。让动物自由饮水并喂食标准饮食,直到实验前一天晚上,此时应禁食动物以尽量减少插管期间误吸的风险。
- 定期监测动物,确认它们身体健康。
2. 全身麻醉的镇静和诱导
- 通过在耳朵尾部或臀肌中肌肉注射 Telazol (4-5 mg/kg)/甲苯噻嗪 (1.8-2.2 mg/kg) 来镇静动物,使其仍在其饲养区。
- 将动物从饲养区运送到手术室,并将其背卧放在手术台上。
- 将脉搏血氧仪探头放在动物的耳朵上,在动物的鼻子上戴上面罩,并在 100% O 2 中给予异氟醚, 直到下颌骨松弛,以诱导麻醉。
- 使用喉镜放置气管插管 (ET)。这应该通过张开下巴、拉出舌头、识别会厌、将喉镜尖端插入口咽并将会厌从软腭移位来实现。将 ET 管穿过声带 6-10 厘米,然后将其相对于动物头顶向下旋转。
- 用 10 cm3 的空气给 ET 袖带充气,用纱布扎带将 ET 管固定在动物的鼻子上,并听诊动物的胸部以确认管子的正确放置。
- 通过热湿交换器将 ET 管连接到机械呼吸机。
- 确认适当的机械呼吸机设置,以提供 30% 的吸入 O2 分数,潮气量为每公斤体重 7-10 mL,呼吸频率为 10-15 次呼吸/分钟,目标是呼气末 CO2 张力为 38-42 mmHg。
- 为了维持麻醉,请使用 1.5-3% 异氟醚。定期评估动物的呼吸参数。
3. 手术
- 手术部位消毒和准备
- 使用电动理发器去除剖腹手术切口和经皮穿刺部位覆盖的毛发。
- 用优碘擦洗所有切口部位和经皮穿刺部位,然后晾干。
- 在手术部位周围放置无菌窗帘,以保护无菌手术区域并防止污染。用订书钉将它们固定到位。
- 稍微弯曲前蹄和后蹄,并用绳子或胶带固定到位。
- 将心电图粘合电极放在右前肢、左前肢、右后肢和左后肢以及剑突上。将正确的 ECG 导联连接到粘合电极。
- 剖腹术
- 使用电烙术做一个 20 cm 的腹部中线切口。
- 使用电烙术解剖皮下组织和白线。使用剪刀在直视下进入腹膜腔。
- 脾切除术
- 切除脾脏以防止因放血而进行自体输血。
- 将脾送入中线伤口,用两个止血钳夹住肺门血管,并在止血钳之间横切。用 0 根丝带连接横断末端。
- 确定较深的短胃血管,放置两个止血钳,横切止血钳之间的血管,并用 0 丝结连接末端。
- 仔细检查结扎的血管以确保止血。结扎任何出血的血管。
- 原位检查脾脏,确保其被自由解剖并取出。
- 膀胱造口术
- 通过剖腹手术伤口输送膀胱。
- 在两个 DeBakey 夹之间抓住膀胱的腹侧部分,并使用剪刀切开 1 厘米的切口。
- 将抽吸导管插入开口,从膀胱中排出尿液。
- 将一根 14 Fr 导尿管放入膀胱。用 10 mL 生理盐水给导管球囊充气。
- 使用 3.0 尼龙缝合线放置钱包线缝合线,将导管固定在膀胱中,以防止尿液溢出。
- 将导管连接到收集袋。
- 使用 3'0 尼龙缝合线用连续缝合闭合剖腹手术伤口。
4. 仪表
注意: 有关连接 SAAP 电路的关键步骤,请参见 表 1 。
- 经皮血管通路
- 左右颈内静脉插管(图1)
- 使用超声 (US) 引导,可视化颈内静脉;它通常位于颈静脉沟中皮肤约 2-3 厘米深处。
- 用 18 G 针与皮肤成 45° 角放置刺穿皮肤,并在超声视力下将其引入静脉腔。将 0.035 英寸 Seldinger 导丝穿过针头。
- 取下针头,注意将导丝留在静脉腔中。
- 在导丝附近做一个 5 毫米的皮肤切口,然后将带有扩张器的 7 Fr 护套拧入导丝上方的静脉中。
- 拆下导丝和导引器,将护套留在原位。用 1.0 丝缝合线将护套缝合到皮肤上,将护套固定到位。
- 重复上述步骤以插管对侧颈内静脉。
注意:一个颈静脉鞘用于右心房压监测,另一个可用于给药,具体取决于研究方案。或者,颈外静脉可用于插管。
- 颈动脉插管(图 1)
- 在 US 引导下找到气管外侧的颈动脉。
- 用一根 18 G 针头与皮肤成 45° 角刺穿皮肤,在美国视力下将其引入动脉腔,将 0.035 英寸 Seldinger 导丝穿过针头。
- 取下针头,注意将导丝留在动脉腔中。
- 在导丝附近做一个 5 毫米的皮肤切口,然后用扩张器将 7 Fr 护套穿入导丝上方的动脉中。
- 拆下导丝和导引器,将护套留在原位。用 1.0 丝缝合线将护套缝合到皮肤上,将护套固定到位。
- 左右股动脉插管
- 按照超声引导在股管中找到正确的股动脉。
- 用 18 G 针以与皮肤成 45° 角穿刺皮肤,并在超声视力下将其引入动脉腔。将 0.035 英寸 Seldinger 导丝穿过针头。
- 取下针头,注意将导丝留在动脉腔中。
- 在电线附近做一个 10 毫米的皮肤切口。
- 将带有扩张器的 14 Fr 护套穿过导丝的动脉。
- 拆下导丝和导引器,将护套留在原位。用 1.0 丝缝合线将护套缝合到皮肤上,将护套固定到位。
- 对于左股动脉通路,使用 US 在股骨管中定位左股动脉。
- 用 18 G 针以 45° 角刺穿皮肤,并在 US 视力下将其引入动脉腔。将 90 厘米 0.035 英寸 Seldinger 导丝穿过针头。
- 取下针头,注意将导丝留在动脉腔中。
- 在电线附近做一个 10 毫米的皮肤切口。
- 将一根 18 厘米长的 15 Fr ECMO 套管穿过导丝进入动脉。
- 取下导丝和扩张器并夹住套管的远端以防止背部出血。
- 股静脉插管
- 按照 US 指南在股管中找到股静脉。
- 用 18 G 针以 45° 角刺穿皮肤,在美国视力下将其引入静脉腔,将 0.035 英寸 Seldinger 导丝穿过针头。
- 取下针头,注意将导丝留在静脉腔中。
- 在导丝附近做一个 5 毫米的皮肤切口,并将一根带有导引器的 9 Fr 中心静脉导管穿过导丝进入静脉。
- 拆下导丝和导引器,将导管留在原位。用 1.0 丝缝合线将线缝合到皮肤上,将线固定到位。
- 左右颈内静脉插管(图1)
- 经皮血管监测(图1)
- 主动脉根部压力
- 使用透视将微型测压计导管引入右颈动脉的 7 Fr 鞘中。
- 通过可视化数据收集屏幕上显示的主动脉压力波形,确认导管尖端位于主动脉弓中。
- 右心房压迫
- 使用透视将先前校准的微压计导管引入右颈内静脉的 7 Fr 鞘中。
- 通过观察数据收集屏幕上显示的压力波形,确认导管尖端在右心房的位置。
- 主动脉根部压力
5. 放血
- 准备设置
- 通过 IJV 护套的侧臂注射 15,000 IU 的普通肝素。
- 将放血管装入用于放血的蠕动泵的滚轮中。
- 使用标准 IV 管将管路的一端连接到回路储液器。
- 使用直耦合器和 2 英寸 1/4 英寸 ID 管段将放血泵管的另一端连接到股动脉中 15 Fr ECMO 套管的末端。
- 从 15 Fr 套管上取下夹子。
- 使用公式5 计算对数出血率区间。间隔长度和出血率取决于研究方案。

- 使用可编程的特定泵计算机软件 -PUMPTERM 根据协议设置所需的泵速。
- 使用标准以太网端口将计算机连接到可编程泵。一旦使用数字显示屏上显示的更新初始流量对受控泵进行编程,就可以将其与计算机断开连接。
- 泵控制放血
- 按下泵上的 START/STOP 按钮开始放血。
- 按照方案继续放血,直到 PEA 表现为主动脉压损失 (SBP <10 mmHg) 伴主动脉根部压力波形搏动丧失并伴有窦性心电图节律。
- 通过手动按下泵上的 START/STOP 按钮来停止放血。
6. SAAP
- SAAP 电路准备
- 使用带倒钩的 Y 型和直连接器以及 3/8 英寸 ID 管构建电路管,以包含再灌注肢、主灌注肢、SAAP 灌注肢和外周灌注肢(图 2)。用电缆扎带固定连接。
- 将近端管连接到储血器。
- 将管道连接到离心泵。
- 将管道连接到氧合器。
- 将氧合器插入氧合器上的氧气输注端口,使用标准氧气管将氧合器连接到氧气源。
- 将回路的主灌注肢体加载到蠕动泵头中。
- 通过旋转氧气瓶上的刻度盘,以 6 L/min 的速度输送氧气。
- 将 15,000 IU 的普通肝素加入回路储液器中。
- 确认回路的灌注肢被夹住,并且在放血过程中流出的血液被泵入储血器时,再灌注肢是打开的。按下 START/STOP 按钮激活 SAAP 回路中的离心泵,并以任意速率设置流量。这将使血液循环,防止凝血。
- 通过将球囊插入长度放在解剖标志的外部来标记球囊插入长度。目标是让球囊位于胸主动脉近端。
- 冲洗 SAAP 导管并确认它有一个 3 通旋塞阀连接到导管枢纽。
- 确认球囊已完全放气,并确认导管在球囊端口处有一个 2 通旋塞阀。
- 在 60 mL 注射器中预填充 0.1 mg 肾上腺素(1 mL)、10 mL 造影剂和 49 mL 生理盐水的溶液。该解决方案是主动脉瓣 (AV) 闭合推注,将在 SAAP 灌注前立即注射,以防止左心室逆行充盈。
- 用 15 mL 生理盐水/造影剂溶液 (1:1) 预填充另一个注射器。这将用于给导管球囊充气。
- 通过使用泵刻度盘上的"向上"和"向下"按钮手动编程泵,将 SAAP 回路中的蠕动泵设置为以动物体重的 10 mL/kg 的速率输送灌注液(含氧血液)。
- SAAP 交付
- 将 SAAP 导管插入股动脉的 14 Fr 护套中至先前确定的长度,将预装有 15 mL 生理盐水造影剂溶液的注射器连接到球囊端口(图 2)并注入注射器的体积以给球囊充气。
- 通过透视确认球囊的位置。
- 将 SAAP 灌注肢连接到 SAAP 导管,将外周灌注肢连接到静脉导管(图 3)。
- 通过将夹子施加在 SAAP 电路的再灌注端上来关闭它,然后通过取下夹子来打开灌注端(图 2)。
- 将先前预装的 60mL 注射器(带有 AV 闭合推注)连接到 SAAP 导管动脉腔处的三通旋塞阀的侧端口(图 3),然后快速手动注射注射器的整个体积,然后关闭注射器的侧端口。
- 立即打开动脉端口旋塞阀的末端端口。
- 按下 RUN/STOP 按钮,启动 SAAP 回路中的蠕动泵。
- 60 秒后,按下 RUN/STOP 按钮停止蠕动泵。
- 通过从 SAAP 球囊端口吸出整个体积来放气 SAAP 球囊。
- 用导管动脉腔处的旋塞阀关闭流向导管的流量。
- 评估 SBP 和 ECG 节律。
注意:如果在开始 SAAP SBP < 90 mmHg 后 2 分钟后,可以通过 SAAP 输注多达 7 次 200 mL 肝素化流出的血液或预先购买的柠檬酸盐全血,以维持 SBP >90 mmHg。- 如果储存的血液用于 SAAP,则必须与葡萄糖酸钙共同输注以防止柠檬酸盐钙在心肌中结合。在 SAAP 灌注之前,使用连接到连接到 SAAP 导管的 3 通旋塞阀侧端口的注射器注射葡萄糖酸钙。每个填充的 RBC 单位使用 1 克葡萄糖酸钙,每个全血单位使用 3 克葡萄糖酸钙5.
- 如果动物出现心室颤动或室性心动过速,请尝试通过在胸骨和心尖上放置桨来尝试除颤,并在人员许可后与动物接触。
- 继续通风,在施加电击之前立即断开压力传感器与信号调节装置的连接 - 在施加电击后立即重新连接这些传感器。
- 使用双相除颤器从 150 J 开始进行电击,然后重新评估心律长达 1 分钟。如果存在室性心动过速或颤动,在每次电击后评估 1 分钟的心律评估后,在 200 J 时最多再进行两次电击。
注意: 此处使用的除颤算法适用于双相除颤器,单相除颤器通常需要较少的能量。如果发现其他心律 - 心房颤动、PEA 等。不应尝试除颤,应根据特定的研究方案对动物进行治疗。
7. 外周灌注
注意:根据研究方案,在成功进行 SAAP 复苏后,可以使用 SAAP 回路继续在外周进行进一步的容量置换。
- 夹住主灌注肢的 SAAP 灌注肢。
- 确认 SAAP 回路的外周灌注肢在股静脉中连接到导管的侧臂,并且旋塞阀和管道是开放的。
- 确保 SAAP 储液器中有适当的复苏液和容量。
- 确保 SAAP 电路的再循环肢被夹紧。
- 通过在蠕动泵上设置适当的流量设置,根据方案需要注入流体。
8. 安乐死
- 在实验结束时,通过将 >2 mmol/kg 氯化钾注射到中央静脉中对动物实施安乐死,并等待 1 分钟的心脏停搏。
结果
基线时主动脉根部血压为 83/58 mmHg,放血时逐渐降至 0-10 mmHg。在无脉电活动 (PEA) 开始后,进行 SAAP,在此期间,在 SAAP 持续时间内收缩压迅速升高至 120 mmHg(图4)。在 SAAP 停止和主动脉球囊放气后,BSP 降至约 60 mmHg,但在 SAAP 后期间,它再次逐渐增加至基线水平,有几个峰值代表静脉液体推注(箭头)。

图 1:展示了猪中用于数据收集和监控的访问点的图表。 放置在左侧颈内静脉 (IJV) 中的 7 Fr 鞘可用于药物输送,具体取决于方案需要。右侧 IJV 中的 7 Fr 护套允许将压力传感器放置在右心房中,右颈动脉中的 7 Fr 护套允许将压力传感器放置在主动脉弓中。 请单击此处查看此图的较大版本。
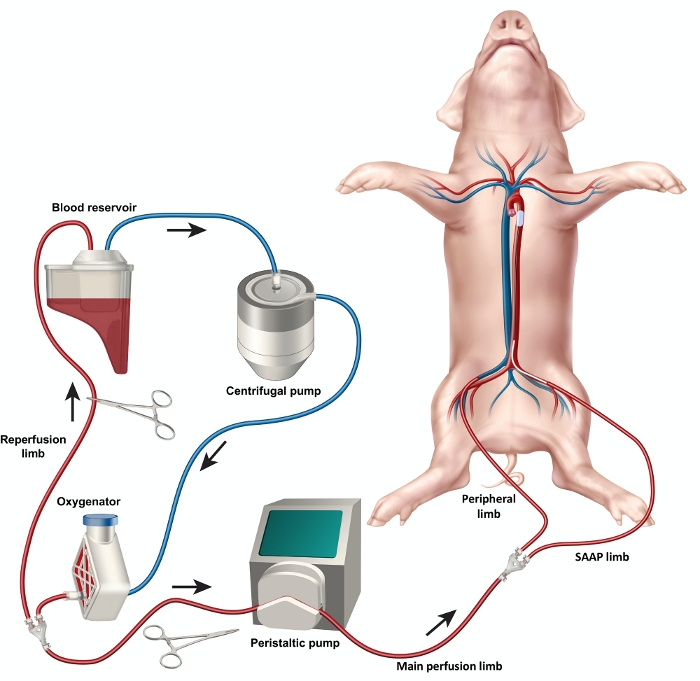
图 2:SAAP 电路示意图,展示了电路元件的设置,包括储血器、氧合器、离心泵和蠕动泵,以及再灌注肢、主灌注肢、SAAP 肢和外周肢。 *未显示放血管 请点击这里查看此图的放大版本。
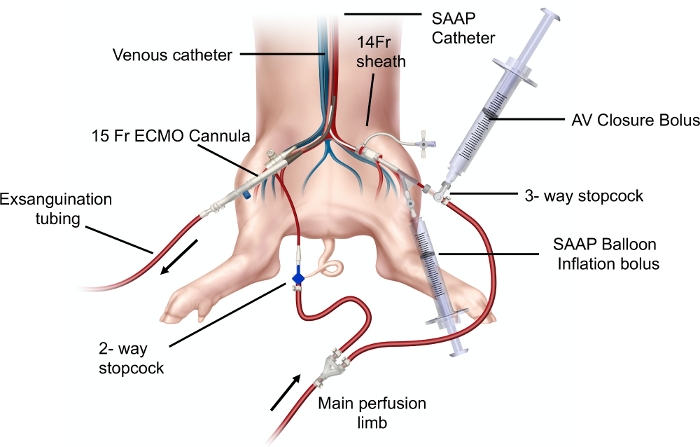
图 3:展示 SAAP 电路元件的图表:SAAP 灌注肢体和外周灌注肢体,经皮通路和猪模型中设置的 SAAP 导管。 主动脉瓣 (AV) 闭合推注和 SAAP 球囊充气推注注射器被证明连接到 SAAP 导管中的相应端口。放置在右股动脉中的 15 Fr ECMO 插管连接到放血管。 请单击此处查看此图的较大版本。
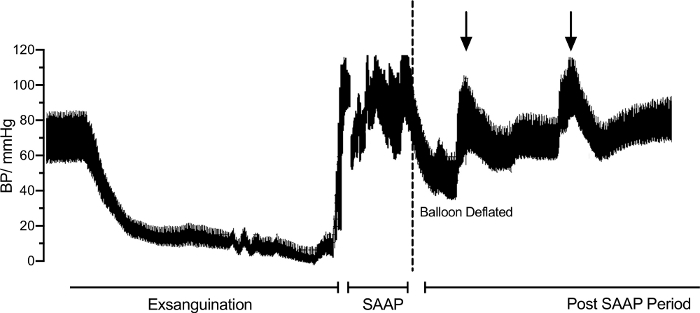
图 4:整个放血过程中、心脏骤停后选择性主动脉弓灌注 (SAAP) 和 SAAP 后主动脉根部血压 (BP) 的趋势。 虚线显示 SAAP 球囊放气后 SBP 显着暂时降低。 请单击此处查看此图的较大版本。
| 关键步骤 | 关键组件 | |
| 使用带倒钩的 Y 和直连接器构建电路管,以包含再灌注肢、主灌注肢、SAAP 灌注肢和外周灌注肢(图 1) | 3/8" 内径管,倒钩连接器 | |
| 用电缆扎带固定连接器 | 电缆扎带 | |
| 将近端管连接到储液槽 | 储血器 | |
| 将管道连接到离心泵 | 离心泵 | |
| 将管道连接到氧合器 | 肺 | |
| 将氧合器连接到氧气源 | 氧气源、燃气管 | |
| 将管道装入蠕动泵头 | 蠕动泵 | |
| 将 SAAP 灌注肢连接到 SAAP 导管,将外周灌注肢连接到静脉导管(图 2) | SAAP 导管 静脉导管 3 通和 2 通旋塞阀 | |
表 1:构建 SAAP 电路的关键步骤和组件。
讨论
充足的灌注液氧合是 SAAP12 的一项关键能力。我们使用与储液器集成的过滤器。过滤器通过标准氧气管连接到氧气瓶。氧气流量以 6 L/min 的速度输送到氧合器。回路中的离心泵推动血液,血液通过氧合器过滤。可以通过对回路灌注端的样本进行血气分析来确认足够的氧合。使用该模型进行实验期间进行的血气样本证实氧合充足,结果为:pO2 746 mmHg,sO2 100.0%,FO2Hbe 99.2%。必须使用 SAAP 回路实现足够的灌注才能获得 ROSC。Manning 及其同事证明,每分钟 10 mL/kg 体重的流速是提高冠状动脉灌注压 (CPP) 并导致 ROSC6 的最佳流速。研究还表明,导致灌注液过多的较高流速可能导致心脏超负荷或肺水肿3。回路泵必须有足够的功率,不仅可以通过 3/8 英寸内径的管输送灌注液,还可以通过 SAAP 导管相对较长且较窄的管腔输送灌注液,该管腔长 81 厘米,内径为 10 Fr。我们发现,在这种情况下,单独的离心泵无法提供足够的流量,因此在回路中加入了蠕动泵。在 SAAP 中加入主动脉内肾上腺素已被证明会导致更快的 ROSC2。这最好在 SAAP 灌注之前立即进行,可以通过连接到SAAP导管主动脉腔的三通旋塞阀注射小剂量(0.2-0.5 mg)来实现(图 2)并用 SAAP 灌注冲洗。SAAP 导管本身是整个设备的关键元件。然而,目前尚无市售 FDA 批准的用于执行 SAAP 的导管。我们使用了一种原型导管,其内径为 10 Fr,外径为 13 Fr,在尖端附近包含一个柔顺性球囊,可容纳高达 50 mL 的体积。导管有两个端口:一个球囊端口和一个动脉腔端口,这两个端口都可以容纳标准的 IV 管连接器。
该系统的局限性包括需要校准血液设备。大多数商用非临床级泵都经过水校准,鉴于血液具有不同的粘度,这可能会导致不同的血流动力学行为。构建 SAAP 回路中描述的设备不是无菌的,在考虑生存研究时应考虑这一点。由于猪和人类的解剖学和生理相容性,猪模型已广泛用于创伤和心血管研究。但是,确实存在一些可能影响结果的差异,在应用此模型时应考虑这些差异。该电路由 3/8 英寸 ID(内径)管组成,没有表面涂层;然而,在收集库中加入普通肝素并结合回路内的血液再循环似乎可以降低血栓形成的风险。虽然外伤患者可表现为凝血病7,但全身肝素化是禁忌的,应考虑抗血栓形成措施,如管道涂层,用于临床级应用。然而,对于非存活的动物研究,该模型可以安全地应用。需要肝素化进行全身肝素化以防止回路血栓形成,这可能会造成重大限制,具体取决于研究方案。全身肝素化对心肌和神经损伤的可能影响尚未研究,不能排除作为混杂因素,在使用所述回路设计研究时应考虑。另一种方法是使用肝素粘合管。此外,模型中使用的全身抗凝药并未通过实验室测试正式确认,仅通过在回路中观察到没有血栓形成来验证。所应用的放血模型是一种快速放血。放血的速度和速度可能会对 SAAP 成功复苏后的生存率和代谢以及生理标志物产生影响。在设计基于放血模型的研究时,应考虑这一点。应进行进一步研究以充分阐明出血率和出血速度对复苏后获得和维持良好 ROSC 的能力的影响。
目前没有专门为提供 SAAP 而开发的商用电路。SAAP 回路必须具有以下功能:能够在没有血栓形成风险的情况下储存灌注液(血液)、充足的氧合以及以特定流速高效输送灌注液。在考虑将血液储存在回路中时,防止凝血至关重要,即使时间很短。虽然市售的临床用回路管具有表面涂层以防止血小板粘附,但这种类型的管子设计为一次性使用,抗血栓涂层通常在大约 14 天后失效8。Barnard、Hoops 及其同事 9,10 构建了改进的回路,他们利用了一个 3 L 储液罐、一个蠕动泵和一个带有 HLS-7 回路的 Cardiohelp 系统——通常用于 ECMO。然而,临床级电路元件价格昂贵,成本在 30,000.00 美元到 130,000.00 美元之间,具体取决于制造商(美敦力和云顶,个人通信,2020 年 4 月 14 日)。此外,由于这些电路元件不是专门为 SAAP 设计的,因此它们仍然需要一些修改,以及蠕动泵等附加设备。这里的电路成本要低得多,为 13,500.00 美元,其中泵占大部分。
目前的报告提出了一个创伤性 PEA 失血性心脏骤停的猪模型和一个可以有效提供 SAAP 的特殊电路(图 1)。本研究中使用的控制性放血模型利用了对数趋势,最初出血速度很快,然后逐渐减慢至平台期。该模型的开发是为了提供可重复的出血,它反映了由于低血压引起的出血率降低,以及由此产生的生理性后遗症。该算法可用于产生不同长度的出血到心脏骤停的对数率,具体取决于研究方案。SAAP 复苏已在创伤性和非创伤性心脏骤停的动物模型中显示出有希望的结果 2,3,4,11。该技术在新兴血管内复苏时代提供了一个有吸引力的辅助手段。在该技术被应用于临床领域之前,需要进一步的研究来进一步探索其在心脏骤停患者复苏中的有效性。目前所描述的 SAAP 电路是一种在专用电路可用之前研究该技术的经济高效且可靠的方法。对数非线性出血模型为研究创伤性 PEA 的复苏提供了一种可重复且可靠的模型。
所描述的方案中的关键步骤是相对快速的对数放血12 和 SAAP 复苏。使用可编程泵以对数方式进行放血,其中计算的出血率基于动物的体重每分钟减少。虽然这可以手动完成,但计算机控制的设计允许精确和更平滑的图案。为确保足够的流速,应使用足够口径的回路管和动脉通路插管进行放血。SAAP 技术需要集中精力连续执行多个快速任务,首先要确保回路做好充分准备,以快速手动输注房室闭合推注,以平稳快速地过渡到 SAAP 灌注。如果可以进行透视,在 SAAP 球囊和 AV 闭合推注中添加造影剂有助于观察初始灌注。但是,它不是强制性的,可以根据研究方案省略。
披露声明
JJ Morrison 是 Prytime Medical Inc. 的临床顾问委员会成员。所有其他作者都没有什么可披露的。
致谢
本文所表达的观点是作者的观点,不反映陆军/海军/空军部、国防部或美国政府的官方政策。
这项研究的资金由马里兰大学医学院获得。
材料
| Name | Company | Catalog Number | Comments |
| 3/8” ID tubing | Saint-Gobain | E-3603 | This tubing is used throughout the circuit. |
| 1/4" Tubing | Tygon | E-3603 | 2" segment for a connector between Exsanguination tubing and ECMO cannula |
| 2-way stopcocks | Harvard Apparatus | 72-2650 | standard stopcock |
| 3-way | Harvard Apparatus | 72-2658 | Standard stopcock |
| Barbed Connectors | Harvard Apparatus | 72-1587 | Y connectors |
| Barbed Connectors | Harvard Apparatus | 72-1575 | Straight connectors |
| Blood Reservoir | LivaNova | 50715 | This is sold together with the oxygenator |
| Cable ties | Commercial Electric | GT-200ST | Standard cable ties. |
| Centrifugal pump BVP-Z | ISMATEC | ISM 446 | Centrifugal Pump used for recirculation of blood |
| Controlled Peristaltic Dispensing Pump | New Era Pump Systems | NE-9000B | Peristaltic pump for Exsanguination |
| ECMO Cannula | Medtronic | 96570-015 | Exsanguination cannula |
| Gas tubing | AirLife | 1302 | Standard oxygen tubing |
| Oxygen source | AirGas | OX USP300 | Standard oxygen tank with flowmeter |
| Oxygenator | LivaNova | 50715 | This is sold together with the reservoir |
| Peristaltic pump 1 MCP | ISMATEC | ISM 405 | SAAP peristaltic pump |
| SAAP catheter | n/a | n/a | Proprietary catheter designed by Dr. Manning |
| Venous catheter | Teleflex | CDC-29903-1A | 9 French single lumen catheter |
参考文献
- Kauvar, D. S., Lefering, R., Wade, C. E. Impact of Hemorrhage on Trauma Outcome: An Overview of Epidemiology, Clinical Presentations, and Therapeutic Considerations. Journal of Trauma-Injury Infection. 60 (6), 3-11 (2006).
- Manning, J. E., et al. Selective aortic arch perfusion using serial infusions of perflubron emulsion. Academic Emergency Medicine. 4 (9), 883-890 (1997).
- Manning, J. E., et al. Selective aortic arch perfusion during cardiac arrest: a new resuscitation technique. Annals of Emergency Medicine. 21 (9), 1058-1065 (1992).
- Manning, J. E., et al. Selective aortic arch perfusion during cardiac arrest: enhanced resuscitation using oxygenated perflubron emulsion, with and without aortic arch epinephrine. Annals of Emergency Medicine. 29 (5), 580-587 (1997).
- Madurska, M. J., et al. The Cardiac Physiology Underpinning Exsanguination Cardiac Arrest. Shock. , (2020).
- Manning, J. E., et al. Selective aortic arch perfusion with hemoglobin-based oxygen carrier-201 for resuscitation from exsanguinating cardiac arrest in swine. Critical Care Medicine. 29 (11), 2067-2074 (2001).
- Madurska, M. J., Sachse, K. A., Jansen, J. O., Rasmussen, T. E., Morrison, J. J. Fibrinolysis in trauma: a review. European Journal of Trauma & Emergency Surgery. 44 (1), 35-44 (2018).
- Ontaneda, A., Annich, G. M. Novel Surfaces in Extracorporeal Membrane Oxygenation Circuits. Frontiers of Medicine (Lausanne). 5, 321(2018).
- Barnard, E. B. G., et al. A comparison of Selective Aortic Arch Perfusion and Resuscitative Endovascular Balloon Occlusion of the Aorta for the management of hemorrhage-induced traumatic cardiac arrest: A translational model in large swine. PLoS Medicine. 14 (7), 1002349(2017).
- Hoops, H. E., et al. Selective aortic arch perfusion with fresh whole blood or HBOC-201 reverses hemorrhage-induced traumatic cardiac arrest in a lethal model of noncompressible torso hemorrhage. Journal of Trauma and Acute Care Surgery. 87 (2), 263-273 (2019).
- Manning, J. E., Ross, J. D., McCurdy, S. L., True, N. A. Aortic Hemostasis and Resuscitation: Preliminary Experiments Using Selective Aortic Arch Perfusion With Oxygenated Blood and Intra-aortic Calcium Coadministration in a Model of Hemorrhage-induced Traumatic Cardiac Arrest. Academic Emergency Medicine. 23 (2), 208-212 (2016).
- Frankel, D. A. Z., et al. Physiologic response to hemorrhagic shock depends on rate and means of hemorrhage. Journal of Surgical Research. 143 (2), 276-280 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。