Method Article
纳米等离子体增强散射和低放大显微镜成像对肿瘤衍生外质体的定量
摘要
由于缺乏快速准确的定量方法, 病细胞外衍生的病性和恶性细胞生物标志物的临床翻译受到阻碍。本报告描述了使用低放大暗场显微镜图像来量化小体积血清或血浆样本中的特定外源亚型。
摘要
感染或恶性细胞经常分泌更多的外显子, 导致在循环中的疾病相关外显子的水平升高。这些外显子有可能成为疾病诊断的生物标志物, 并监测疾病进展和治疗反应。然而, 大多数外显子分析程序需要外显子分离和纯化步骤, 这通常是耗时和劳动密集型的, 因此在临床环境中的效用有限。本报告描述了一个快速的程序来分析特定的生物标志物外膜外膜, 而不需要单独的分离和纯化步骤。在这种方法中, 外显子体被外细胞特异性抗体捕获在滑块表面, 然后与特定于疾病的纳米粒子共轭抗体探针杂交。通过对结合纳米粒子的低放大暗场显微镜 (LMDFM) 图像的分析, 确定了结合纳米粒子的目标外显子群的丰度。这种方法可以很容易地用于研究和临床应用, 以分析膜相关的外源生物标志物与疾病。
引言
外质体从大多数细胞类型中释放出来, 并在细胞间通信中发挥着关键作用, 包括与各种疾病有关的病理生理过程, 因为它们可以是特定组织或细胞类型的家园, 并含有各种核酸, 蛋白质和脂质, 反映其来源细胞, 并能对其接受细胞1,2,3,4产生调节作用。外质体通常在疾病状态下在较高的水平上分泌, 可以与相邻和遥远的细胞相互作用, 在循环中以及包括唾液、尿液、胰腺和胆汁在内的大多数其他体液中发现的浓度相对较高果汁和支气管肺泡灌洗液5,6,7, 8,9, 10, 11.人体体液中外显子体的丰富和稳定, 加上其信息丰富的性质, 使其成为疾病诊断和治疗监测的理想生物标志物。
这包括肿瘤衍生的外显子体 (TDEs), 其中包含肿瘤特有或选择性的因素, 可作为疾病的生物标志物, 包括肿瘤相关的突变等位基因。TDEs 可以参与肿瘤微环境的重塑, 促进肿瘤的发展和转移, 调节抗肿瘤反应12。TDE 分泌的增加是大多数癌症的常见表型, 肿瘤微环境的几个特征, 包括缺氧、酸性 pH 值和炎症, 已知会促进外溶酶分泌。令人惊讶的是, 考虑到分泌外显子体的细胞数量, 总外体细胞水平的增加本身就能起到癌症生物标志物的作用。例如, 最近的一项研究发现, 胆汁汁中的 ev 总浓度以100% 准确的方式鉴别胆总管狭窄患者的恶性和非恶性7。使用包括血浆在内的其他体液的研究也发现了类似的结果。然而, 由于可能会受到学科变异的影响, 以及其他混淆因素, 大多数研究将外质体作为疾病生物标志物进行调查, 其重点是检测有选择地与 TDEs 相关的生物标志物, 而不是总外质数字。
然而, 将外显子生物标志物转化为临床实践仍然具有挑战性, 因为大多数报告的外显子检测方法需要耗时和劳动密集型的隔离程序13。目前流行的外植体分离方法包括超离心、密度梯度、大小排除、共沉淀、亲和力捕获和微流体分离方法。超离心是 "金标准" 方法, 最常用于外相分离, 但这一方法非常耗时, 会导致外染色体损伤和外膜聚类, 并产生被污染的外染色体样品。蛋白质、脂蛋白和其他因素, 可以影响随后的分析14。大多数外显子分离方法, 包括超离心, 不能将外周细胞 (30–150 nm) 与微囊 (100–1000 nm) 和凋亡体 (100–5000 nm) 分离, 由于其大小, 微囊和凋亡体 (100–5000 nm) 产生于不同的机制, 具有不同的功能这些群体之间的重叠, 以及外显子种群的多样性15。需要新的方法来提高外显子检测的灵敏度和重现性, 方法是改善外显子检测的恢复, 同时减少外显子的损伤和污染, 尽管基于此类方法的任何检测也需要进行优化, 以实现这些检测适用于临床应用的转换。
最近的几项研究建议使用集成平台直接从体液中捕获和分析外显子。这些方法采用微流体、电动、亲和力捕获和其他各种外显子分离方法, 以及电化学、表面等离子体共振和其他检测捕获的外质体的方法。目前尚不清楚其中许多方法在临床环境中的可行性, 因为它们的复杂性、费用、低吞吐量或其他问题。
我们开发了一种快速而廉价的检测方法, 可用于对总外显子和特定外显子体亚型进行敏感和具体的定量, 包括与疾病相关的外显子体, 如 Tde, 它只需要少量的样本,采用适用于临床环境的简化工作流程。在此检测中, 幻灯片上涂有抗体, 这些抗体结合在外生体表面表达的特定于外体细胞或疾病特异性标记, 以便直接捕获小体积血浆中存在的目标外溶体或应用于油井上的血清样本。幻灯片。然后, 捕获的外质体与抗体共轭纳米粒子杂交, 该纳米颗粒识别这些外显子上感兴趣的生物标志物, 这些外观体可以是一般的外显子标记, 也可以是感兴趣的外质亚型特有的因素。然后使用暗场显微镜 (dfm) 采集这些样品井的图像, 并对其进行分析, 以测量在每个样品井6、16、17中捕获的纳米颗粒中的散射光。值得注意的是, 通过低放大倍率 DFM (LMDFM) 对整个样品进行成像, 可避免高放大度 DFM 分析在用户必须直接选择要捕获的字段以便进行后续图像分析时遇到选择偏差。LMDFM 图像分析受表面不规则性 (包括划痕和样品碎片) 光散射伪影的影响, 但使用我们开发的简单降噪算法可以在 NIH 图像分析程序上运行,ImageJ (https://imagej.nih.gov/ij/)。该算法首先应用输入轮廓阈值, 用于检测样本的边界, 以定义图像的区域, 供后续分析。然后将此等高线区域定义的区域拆分以分离图像的红色、蓝色和绿色通道中存在的信号, 并从红色通道中减去蓝色通道, 以消除表面伪影产生的信号和纳米棒的不均匀照明信号。
本文介绍了如何使用此检测快速量化血浆或血清样本中的总或特定外体细胞水平。
研究方案
1. 纳米粒子探针的制备
注: 此检测利用功能化的金纳米棒 (Anr; 25 纳米直径 x 71 nm 长) 与新曲维丁聚合物 (AV) 共价共轭, 并具有表面等离子体共振峰, 在 DFM 上产生红色 (641 纳米峰) 散射信号照明。
- 用 200μl pbs (ph 7.0) 三次清洗40μl 的 Onnr-av (2.56 x 10 11个颗粒), 通过离心和抽吸 (4°c 时 8, 500 x g 10分钟), 然后进行最后的离心和抽吸步骤, 之后将 Onr-av 颗粒悬浮.在 40μl PBS。
- 将此 aunr-av 悬浮液与10μl 生物素化抗体 (0.5 mg/mL) 混合, 用于感兴趣的外显子型表面的抗原和150μl 的 PBS, 然后在4°c 下使用混合器混合 2小时, 以使 neutravidin-botin 结合达到完成。
- 通过离心和抽吸 (4°c 时 6, 500 x 克) 三次清洗所产生的抗体共轭 Aunr (anr-igg), 然后将其悬浮在 200Μl PBS 中, 并在4°c 下储存, 直至使用.
注: 必须采用无菌技术和较短的储存时间, 以避免 Anr-igg 的污染和降解。最好在共轭24小时内使用抗体共轭主压。
2. 电动车捕捉幻灯片的准备
- 在 PBS 中稀释选定的外源捕获抗体 0.025 Mg/ml, 并将稀释液的 1Μlg/well 添加到多井蛋白阿塞尔滑梯上, 然后在加湿室中在37°c 孵育该幻灯片 1小时, 以便捕获抗体结合所产生的蛋白质 A/G 固定幻灯片。
- 通过 pbs 1μll 井的加入和抽吸, 将井中取出未结合的抗体, 并将其洗井三次, 然后在37°c 时将滑块在加湿室中孵育 2小时, 然后将滑口孵育至 b锁定任何剩余的蛋白质结合位点。
- 吸井清除封堵缓冲液, 通过 PBS 1μll 井的加入和抽吸三次洗井, 并立即使用堵塞的滑块进行外溶物捕获和分析。
3. 标准曲线制备
- 为了准确地量化特定外显子组亚型的绝对或相对丰度, 用户必须生成一个具有纯外显子群的标准曲线, 该曲线均匀地表达感兴趣的外源表面生物标志物。本研究分析了表达转移相关膜蛋白埃弗林 a2 受体的外显子的丰富程度, 该受体与胰腺癌分期和预后6,18 有关。
注: 人类胰腺癌细胞系 PANC-1 及其外显子表达这种蛋白质, 并使用从这个细胞系分离的外体细胞生成一个标准曲线, 以量化在复杂的外显子表达这种蛋白质的外体细胞的数量样品。 - 在37°c 无血清培养培养基中培养细胞 48小时, 使细胞在培养基中积累, 然后通过悬浮培养离心或直接从粘附细胞培养中吸入培养培养基来分离细胞培养上清液。
- 在 2000 x g离心收集的介质 30分钟, 以清除碎片并回收上清液。
- 通过具有适当容量的0.45μm 低蛋白结合过滤单元 (例如 250 mL 聚醚磺酮真空过滤单元) 过滤澄清培养上清液。
- 使用 100, 000 名义分子量限滤系统将所产生的滤液浓缩在 3200 x克, 达到250μl 的最终体积。从该滤清器中收集保留的体积, 然后用 200μl PBS 清洗滤清器, 并将该洗涤量与收集到的外样本体积结合起来。
- 将此样品以 21, 000 x克离心45分钟, 并仔细回收上清液, 注意不收集任何沉淀材料。
- 以 100, 000 x克的速度离心回收的上清液, 用3小时沉淀外质体。将上清液吸走, 在 100μl PBS 中收集外质颗粒。
- 如果在24小时内或-80°c 内使用, 则将产生的外压悬浮液存放在 4°c, 以便长期储存。
注: 不要将外显子样本重复冻融循环。 - 通过直接测量外质体数 (例如, 通过纳米粒子跟踪分析或可调谐电阻脉冲传感或通过微型双氯联音法测量外源裂解物的蛋白质浓度), 对混合后的外质悬浮液的一个博览会进行量化酸测定, 或等效方法, 作为近似的出去源数量)16,19。
- 生成一组连续稀释的外质细胞悬浮液, 以便将纳米颗粒信号与输入的外源数或蛋白质含量进行比较。
- 将每个外显子标准的1Μl 转移到检测板上的每个复制井。
注: 标准曲线可用于计算纳米粒子信号与外粒浓度之间的相关线斜率, 以 (1) 评估检测性能, (2) 确定实验样品中目标外质体的相对浓度。
4. 处理人血浆或血清样本
- 用标准方法收集血浆或血清样本, 并储存在-80°c, 直到需要进行外显子分析。在室温水浴中快速解冻样品。反复将解冻的样品倒置混合, 促进均匀悬浮。
注: 血清和血浆样本的结果可能不等同, 因为在凝血反应过程中有明显的外显子释放。 - 离心血浆或血清样品在 500 x 克为15分钟沉淀蛋白质聚集物和其他碎片。将血浆或血清样本的一个脂肪转移到新鲜的试管中, 加入 PBS 以产生1:1 稀释。根据需要, 通过温和的涡流或反转混合稀释后的样品。将每个血浆或血清悬浮液的1Μl 转移到检测板上的每个复制井。
5. 外显子捕获和检测
- 用1μll 井的外显子样品装入被阻塞的 EV 捕获滑块的井, 每个样品使用8个副本, 并在4°c 的加湿室中孵育滑块。吸入所有样品井, 然后加入1μl2 井的 PBS 清洗井, 并从加载的外生样品中去除未结合的外质和其他污染物。
- 用先前制备的 AuNR-IgG 悬浮液的1μlp 井 (见上文第1节) 加载样品井, 并在37°c 的加湿室中孵育滑块2小时。用搅拌机在 PBS 中吸气纳米颗粒溶液并清洗幻灯片, 辅以0.01% 的 Tween-20 (PBST) 10分钟, 然后使用旋转混合器用去离子水吸气和清洗所有样品井 10分钟, 并进行空气干燥, 以获得随后的 LMDFM 图像。
注: 分析间变异系数 (Cv) 是根据同一样本的8个复制项进行评估的。显示 Cv 和 gt;20% 的样本被认为不是信息丰富的, 如果有足够的样本, 应重复。
6. DFM 图像采集
- 使用安装了暗场冷凝器 (1.2 < NA < 1.4) 和4x 目标的显微镜上的数码相机, 在一致的照明下捕获图像, 以便在一致的照明下进行量化, 从而缩短曝光时间。
- 打开图像捕获软件。
注: 我们使用 nis 元素显微镜成像软件 (见材料表) 的协议, 下面描述的, 但可以使用另一个软件, 可以匹配其图像捕获参数。Nis 元素查看器成像软件是一个免费的独立程序, 用于查看包含分析、可视化和归档工具的图像文件和数据集。下面的参数也适用于带有自动对焦功能的显微镜和允许自动捕获多个图像并将其拼接成单个图像的自动舞台。 - 将幻灯片倒置在显微镜舞台上, 调整幻灯片位置, 并在滑块背面涂上一小滴浸入油, 冷凝器镜头与幻灯片接触。
- 单击软件界面中的实时按钮, 并根据高浓度标准很好地调整曝光时间, 以确保图像不饱和。
- 从 "获取"选项卡打开 "扫描大图像" 窗口, 并设置软件接口参数, 如下所示:宏图像光学 conf = 当前;目的: 2:10 x,扫描光学 conf = 电流, 目标: 2:10 x;缝合重叠= 20%;通过= 最优路径进行缝合。
- 选择"创建大图像"、 "在舞台移动过程中关闭活动快门"、"在每次捕获之前等待:20 毫秒"、 "开始时手动对焦" 和"每20个字段使用分步对焦"。这些设置将与扫描的图像一起保存。
- 移动显微镜阶段以定义目标扫描字段的左上角右下角限制。调整对焦以在显示器上实现清晰的图像, 并根据需要调整冷凝器设置和环境照明, 以最大限度地减少对焦图像中的任何照明不规则。
- 在软件中命名图像输出文件。单击 "扫描" 按钮, 允许显微镜扫描、创建和保存整个幻灯片的拼接图像。
- 使用您正在使用的图像捕获软件打开保存的图像, 并将其保存在半比例, 以便在 ImageJ 中的 DSM 插件上进行后续分析。
7. DFM 图像分析
- 下载 ImageJ 程序 (https://imagej.nih.gov/ij/)。使用 https://imagej.net/Plugins#Installing_plugins_manually 中列出的说明将 DSM 算法插件安装到 ImageJ 中。
- 打开 ImageJ 软件, 然后在 DSM 算法中设置以下输入参数:轮廓阈值 (ct) = 253.020,类型= 红色,中心刻度 (s) = 0.8,低 (lt)/高 (lt) 量化限制 =/High。
- 使用 imagej 打开第6.8 节中保存的图像。从 "插件" 选项卡中选择"dsm 扫描" 按钮, 然后根据打开的图像定义列数和行数。该程序可以识别检测区域, 并根据区域自动分析纳米粒子的散射强度。在 Dsm 扫描窗口中设置以下输入参数:重新调整百分比= 25,点直径 (以像素为单位) = 190–200,直径范围 = 32,增量直径 (以像素为单位) = 8, dsm 配置低限制= 0,高限制= 62,相邻距离 = 100,减去偏差= 0。
注: 纳米颗粒散射强度的结果反映了滑块上的结合外显子的数量。
结果
多孔蛋白 a 包膜滑块 (图 1a) 用抗 EphA2 抗体进行功能化, 然后专门从胰腺癌患者血清样本中采集 epa2 阳性外显子 (1Μl/well) 并孵育与抗 CD9 抗体结合的金纳米棒 (图 1 b)。利用 ImageJ 软件中的 DSM 插件对这些纳米粒子中散散的光的 DFM 图像进行了分析, 以量化每口井中的结合 Epa-2 阳性外显子。DSM 算法自动定义样品井的边界, 过滤工件中的噪声, 计算每个井的散射信号, 并输出此信息 (图 2)。DSM 算法强烈衰减样品中划痕或碎片产生的光散射伪影, 提高纳米粒子检测的灵敏度和重现性, 并可自动处理一批幻灯片图像以获得高吞吐量使用。该算法利用 ImageJ 命令和用户输入的参数来减去图像背景, 计算出每口井的散射信号, 并输出数据和图像文件 (图 3)。利用 ImageJ 宏程序的轮廓阈值函数, 利用捕获图像中的高强度井边界来定义感兴趣的区域。图像分析使用预定义的等高线阈值和图像参数来计算每口井的纳米粒子散射强度。
正如我们在以前的著作 (梁三人6的补充资料) 中所报道的, 从以透射电子显微镜和西方印迹为特征的 PANC-1 细胞培养物中分离出的外显子显示了其大小范围、形态和蛋白质标记与高纯度外相样品一致的表达式。使用与我们以前的工作相同的程序制备的 PANC-1 外显子在这里用于验证我们的 nPES 检测外显子体定量。该检测方法使用抗 EphA2 抗体从总外显子群中捕获大量外显子, 并利用抗体检测一般外显子蛋白 CD9, 以检测捕获的外显子体。使用连续稀释的 PANC-1 外显子样品获得的结果, 蛋白质浓度在0.24 至1.2Μμμl 之间, 在复制井中表现出良好的重现性 (图 4A), 散射反应与散射反应之间具有很强的线性关系。外显子蛋白浓度 (图 4b)。
为了证明这种方法的潜在应用, 对胰腺癌患者和非胰腺癌患者的血清样本进行了分析, 以检测表达与癌症相关的生物标志物 EphA2 的血清外显子体的丰度, 并使用抗 Epa2 抗体直接从血清和纳米颗粒中捕获与抗 CD9 抗体结合的靶向外显子, 以检测结合外显子。这一分析显示, 胰腺癌患者血清样本的 Epa2 + 外显子 (图 5) 水平明显高于对照组。
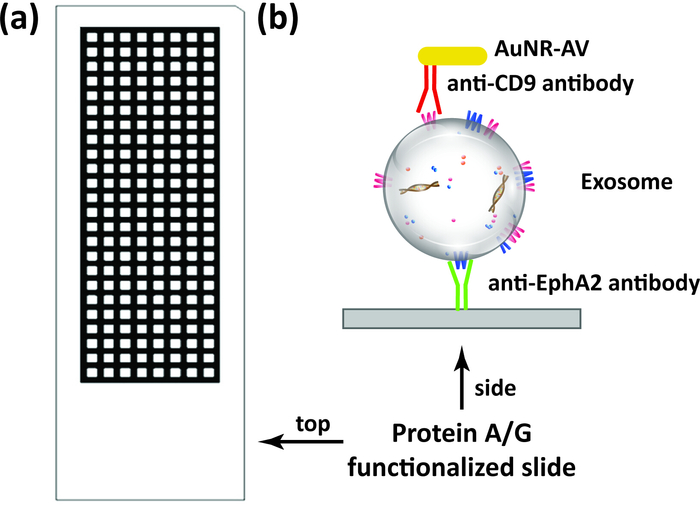
图 1: 超小型量化方案.(A) 本试验中使用的多井蛋白阿格滑块 (192 口井) 示意图。(B) 通过在与幻灯片结合的捕获抗体 (例如抗 epa2 抗体) 上的表面固定, 直接从样本中采集目标外显子, 包括血清和血浆, 然后用与检测方法结合的金纳米棒进行培养抗体 (如抗 CD9 抗体), 然后通过 DFM 图像分析进行分析。请点击这里查看此图的较大版本.

图 2: 将 dsm 算法应用于 LMDFM 图像进行外部量化.低放大图像使用 DSM 算法进行处理, 以消除由于划痕、混合空隙、碎片和不均匀的样品照明而产生的背景信号和信号伪影, 从而实现对金纳米信号的鲁棒检测。与外显子浓度相关。这一数字经 Sun, D. 等人许可进行了调整. 在低放大暗场远场图像中量化纳米粒子光散射的降噪方法。分析化学。88 (24), 12001-12005 (2016年)。版权所有 (2016) 美国化学学会。请点击这里查看此图的较大版本.

图 3: dsm 算法命令和输出的原理图.指示的步骤使用 ImageJ 中的本机命令, 所有输入参数都是根据通过图形用户界面进行实验的要求选择的。这一数字经 Sun, D. 等人许可进行了调整. 在低放大暗场远场图像中量化纳米粒子光散射的降噪方法。分析化学。88 (24), 12001-12005 (2016年)。版权所有 (2016) 美国化学学会。请点击这里查看此图的较大版本.

图 4: 代表 NPES LMDFM 图像和 dsm 输出数据.(A) npes 分析 panc-1 外显子浓度梯度的 lmdfm 图像, 以及 (b) 此幻灯片中的光信号和外相浓度的线性相关性 (从左到右: 0.24、0.24、0.24、0.24、1.20Μμμl列)。数据以平均值±SE, n增幅, 与皮尔逊相关系数 R2 = 0.99 和变异系数为每个浓度的复制 < 0.2。请点击这里查看此图的较大版本.
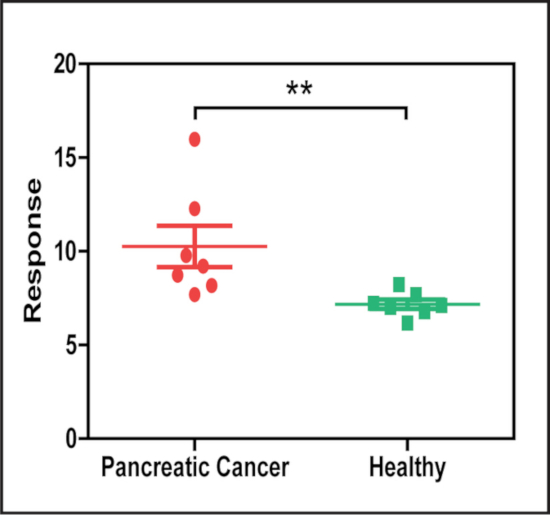
图 5:epa2+外显子体的 LMDFM 信号在血清中与胰腺癌和无胰腺癌患者不同.NPES 使用抗 Epa2 捕获抗体 (癌症相关抗体) 和抗 CD9 检测抗体 (一般外显子标记) 分析的血清样本在患者血清样本中的 Epa2 + 外体细胞浓度有显著差异。无胰腺癌 (N = 7 组)。通过曼恩-惠特尼 u 型试验 (双面 ), 结果以平均±se. * * p = 0.002 的形式出现。这一数字已从 [Sun, D. 等. al. 量化纳米粒子光散射的降噪方法在低放大暗场远场图像。分析化学。88 (24)、12001-12005 (2016年)]。请点击这里查看此图的较大版本.
讨论
外质体产生于外胚乳膜的调节入侵, 产生多个囊泡体, 这是一个特殊的内质子子集, 其中包含大量的内胚层囊泡, 与质膜融合后释放成熟外显子进入细胞外空间。由于这种生物发生途径, 外质体可以携带与膜分裂相关的膜结合因子, 这些膜与内共生膜以及多种不同类型的细胞质成分有关, 因此含有蛋白质、DNA。和各种 RNA 亚型 (Mrna, 微 Rna, 长非编码 Rna), 可以反映其起源细胞的表型 20.由于外显子体是由大多数 (如果不是所有的细胞类型) 分泌的, 可以表现出更多的分泌, 从病变或恶性细胞, 并积累在大多数体液外显子体是一个有希望的全面和系统的研究的主题, 作为一个有希望的最低限度的研究侵入性手段, 以检测特定的疾病状况, 并监测他们对治疗的反应21。
在大多数当前的外显子分析中, 需要进行外显子隔离是一个漫长而劳动密集型的过程, 它限制了具有潜在医学相关性的外细胞相关生物标志物的临床翻译。许多常见的分离方法 (超离心、尺寸排除、沉淀等) 由于其大小范围或范围内的重叠, 往往不能充分区分外显体 (30–100 nm) 和微囊 (100–1000 nm) 和凋亡体 (100–1000 nm)。物理特性或可能损害外显子的完整性15。目前正在制定新的方法, 可能会允许更快速的外部分析, 但不清楚在临床环境中实施其中许多平台的可行性如何。
在本报告中, 我们提出了一种新的方法, 允许基于纳米粒子的高通量外量量化使用低放大暗场显微镜图像。这种方法不需要外显子纯化、昂贵的专用设备或新颖的技术专长, 因此在大多数研究和临床环境中都应易于快速翻译。当将检测结果与标准曲线进行比较时, 我们的检测可用于精确量化带有特定生物标志物的目标外显子群的浓度, 因为我们的结果显示出强烈的线性相关性 (R2 = 0.99)在光学响应和外显子浓度之间。为了证明这种方法的现实世界潜力, 我们提供了数据, 在这些数据中, 我们使用这种方法来量化从有和有非患者身上获得的血清样本中与胰腺癌相关的外源生物标志物的浓度胰腺癌。
在 LMDFM 中, 对整个样品井进行了成像, 以避免在高放大度 DFM 分析中发现的选择偏差, 用户必须直接选择样本字段进行捕获, 以便随后进行图像分析, 但容易受到表面光散射伪影的影响不规范, 包括划痕和样品碎片。使用 NIH 图像分析程序 imagej 上运行的 DSM 降噪算法, 可以减少此背景以检测目标外部源信号, 但仍需注意避免引入此类伪影, 这可能会降低的检测方法。
本分析中使用的材料:
从 Arrayit 公司 (AGMSM192BC) 购买了保存 1μl/well 的多井超蛋白质 a 幻灯片。纳米粒子是从 Nanopartz (C12-25-650-TN-DH-50-50-1,6.4 x10 12/ml) 中获得的。DFM 图像是用连接在尼康 Ti-Eclipse 显微镜上的尼康 DiR2 数码相机拍摄的, 光线一致, 曝光时间为半。本研究中使用的 PANC-1 细胞系是从美国类型的文化收藏中购买的。
披露声明
提交人声明, 他们没有相互竞争的经济利益。
致谢
这项工作主要得到亚利桑那州生物医学研究委员会 (ABRC) 青年调查员的研究资金的支持 (U01CA214254、R01HD090927、U01CA214254、R01AI113725 和 R21Al126361-01)。
材料
| Name | Company | Catalog Number | Comments |
| Eppendorf Repeater stream | Fisher Scientific | 05-401-040 | |
| Eppendorf Research plus | Eppendorf | 3120000011 | 0.1 – 2.5 µL, dark gray |
| Functionalized Gold Nanorods | Nanopartz | C12-25-650-TN-DIH-50-1 | In vitro neutravidin polymer functionalization |
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | |
| Incu-shaker 10L | Benchmark Scientific | H1010 | |
| Inverted Research Microscope | Nikon | Ti-DH | With Dark field condenser, DS-Ri2 camera, and Ti-SH-U universal holder, and motorized stage |
| NIS-Elements | Nikon | Microscope imaging software | |
| Phosphate Buffered Saline (1X) | GE Healthcare Life Sciences | SH30256.02 | HyClone |
| Protein A/G Treated Glass Substrate Slides | Arrayit Corp. | AGMSM192BC | Premium microarray substrate |
| Q500 Sonicator | Qsonica, LLC | Q500-110 | With standard probe (#4220) |
| Superblock blocking buffer | Thermo Scientific | ||
| TWEEN 20 | Sigma Life Sciences | 9005-64-5 |
参考文献
- Andaloussi S, E. L., Mager, I., Breakefield, X. O., Wood, M. J. Extracellular vesicles: biology and emerging therapeutic opportunities. Nature Reviews Drug Discovery. 12 (5), 347-357 (2013).
- Choi, D. S., Kim, D. K., Kim, Y. K., Gho, Y. S. Proteomics, transcriptomics and lipidomics of exosomes and ectosomes. Proteomics. 13 (10-11), 1554-1571 (2013).
- Schorey, J. S., Cheng, Y., Singh, P. P., Smith, V. L. Exosomes and other extracellular vesicles in host-pathogen interactions. EMBO Reports. 16 (1), 24-43 (2015).
- Hoshino, A., et al. Tumour exosome integrins determine organotropic metastasis. Nature. 527 (7578), 329-335 (2015).
- Zaborowski, M. P., Balaj, L., Breakefield, X. O., Lai, C. P. Extracellular Vesicles: Composition, Biological Relevance, and Methods of Study. Bioscience. 65 (8), 783-797 (2015).
- Liang, K., et al. Nanoplasmonic Quantification of Tumor-derived Extracellular Vesicles in Plasma Microsamples for Diagnosis and Treatment Monitoring. Nature Biomedical Engineering. 1, (2017).
- Severino, V., et al. Extracellular Vesicles in Bile as Markers of Malignant Biliary Stenoses. Gastroenterology. 153 (2), e498 495-504 (2017).
- Osteikoetxea, X., et al. Detection and proteomic characterization of extracellular vesicles in human pancreatic juice. Biochemical and Biophysical Research Communications. 499 (1), 37-43 (2018).
- Bulacio, R. P., Nosetto, E. C., Brandoni, A., Torres, A. M. Novel finding of caveolin-2 in apical membranes of proximal tubule and first detection of caveolin-2 in urine: A promising biomarker of renal disease. Journal of Cellular Biochemistry. , (2018).
- Nair, S., Tang, K. D., Kenny, L., Punyadeera, C. Salivary exosomes as potential biomarkers in cancer. Oral Oncology. 84, 31-40 (2018).
- Kim, J. E., et al. Diagnostic value of microRNAs derived from exosomes in bronchoalveolar lavage fluid of early-stage lung adenocarcinoma: A pilot study. Thoracic Cancer. 9 (8), 911-915 (2018).
- Boussadia, Z., et al. Acidic microenvironment plays a key role in human melanoma progression through a sustained exosome mediated transfer of clinically relevant metastatic molecules. Journal of Experimental & Clinical Cancer Research. 37 (1), 245(2018).
- An, M., Wu, J., Zhu, J., Lubman, D. M. Comparison of an Optimized Ultracentrifugation Method versus Size-Exclusion Chromatography for Isolation of Exosomes from Human Serum. Journal of Proteome Research. , (2018).
- Brenner, A. W., Su, G. H., Momen-Heravi, F. Isolation of Extracellular Vesicles for Cancer Diagnosis and Functional Studies. Methods in Molecular Biology. 1882, 229-237 (2019).
- Li, P., Kaslan, M., Lee, S. H., Yao, J., Gao, Z. Progress in Exosome Isolation Techniques. Theranostics. 7 (3), 789-804 (2017).
- Sun, D., et al. Noise Reduction Method for Quantifying Nanoparticle Light Scattering in Low Magnification Dark-Field Microscope Far-Field Images. Analytical Chemistry. 88 (24), 12001-12005 (2016).
- Sun, D., Hu, T. Y. A low cost mobile phone dark-field microscope for nanoparticle-based quantitative studies. Biosensors and Bioelectronics. 99, 513-518 (2018).
- Koshikawa, N., Minegishi, T., Kiyokawa, H., Seiki, M. Specific detection of soluble EphA2 fragments in blood as a new biomarker for pancreatic cancer. Cell Death & Disease. 8 (10), e3134(2017).
- Clayton, A., Turkes, A., Navabi, H., Mason, M. D., Tabi, Z. Induction of heat shock proteins in B-cell exosomes. Journal of Cell Science. 118 (Pt 16), 3631-3638 (2005).
- Henne, W. M., Buchkovich, N. J., Emr, S. D. The ESCRT pathway. Developmental Cell. 21 (1), 77-91 (2011).
- Panagiotara, A., Markou, A., Lianidou, E. S., Patrinos, G. P., Katsila, T. Exosomes: a cancer theranostics road map. Public Health Genomics. 20 (2), 116-125 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。