Method Article
开放补丁夹具移液器测量未搅拌边界层中的离子浓度: 流体流动对离子通道控制的启示
摘要
利用膜片钳记录, 从流体流动剪切力敏感性的角度研究了机械敏感离子通道。然而, 根据实验方案, 离子通道流体流动规律的结果可能是错误的。在这里, 我们提供了防止和纠正此类错误的方法, 并提供了理论依据。
摘要
流体流动是控制许多生理和病理过程的重要环境刺激, 如流体流动引起的血管扩张。虽然对流体流动剪切力的生物反应的分子机制尚不完全清楚, 但流体流动介导的离子通道门控调节可能会起重要作用。因此, 利用膜片钳技术研究了离子通道的流体流动/剪切力敏感性。然而, 根据实验协议, 数据的结果和解释可能是错误的。在这里, 我们提出了流体流动相关误差的实验和理论证据, 并提供了估计、预防和纠正这些误差的方法。用填充了 3m kcl 的开放式移液器测量了 ag/agcl 参考电极与沐浴液之间的结电位变化, 然后流体流动可将液体/金属结电位转移到约 7 mv。相反, 通过测量流体流动引起的电压变化, 我们估计了未搅拌边界层中的离子浓度。在静态条件下, 细胞膜表面与 ag/agcl 参考电极或离子通道入口相邻的实际离子浓度可达到流动条件下的约30%。在浴液和参考电极之间放置琼脂糖 3 m kcl 桥可能会防止结电位移动的问题。然而, 与细胞膜表面相邻的未搅拌层效应无法以这种方式固定。在这里, 我们提供了一种用开放的膜片钳移液器测量未搅拌边界层中的实际离子浓度的方法, 强调在研究流体流动诱导的离子电流调节时使用琼脂糖盐桥的重要性。因此, 这种新的方法考虑到了未搅拌边界层中离子的实际浓度, 可以为与离子通道流体剪切应力调节有关的实验设计和数据解释提供有益的见解。.
引言
流体流动是控制许多生理和病理过程的重要环境提示, 如流体流动引起的血管舒张和流体剪切力依赖血管重塑和发展1,2, 3,4,5。虽然对流体流动剪切力的生物反应的分子机制尚不完全清楚, 但人们认为, 流体流动介导的离子通道门控的调节可能会对流体流动引起的反应做出重要贡献5,6,7.,8. 例如, 在 ca2 +流体流入后, 内皮内整流 kir2.1 和 ca2 +激活 k+ (kca2.3, kcnn3) 通道被建议为流体的贡献流诱导的血管扩张6,7,8。因此, 利用膜片钳技术6、9、10对流体流动/剪切力敏感性进行了流体流动敏感性研究, 特别是机械激活或抑制通道。,11. 然而, 根据膜片钳记录过程中执行的实验协议, 离子通道流体流动规律数据的结果和解释可能是错误的 10、11.
在膜片夹具记录中, 流体流动引起的伪影的一个来源是浴液与 ag/agcl 参考电极11之间的结电位。考虑到沐浴液之间的化学反应, 一般认为沐浴液与 ag/agcl 电极之间的液体金属结电位是恒定的, 因为沐浴液的 cl浓度保持不变和 ag/agcl 电极为:
银 +cl-agcl + 电子 (e-) (公式1)
然而, 在洗浴液与 ag/agcl 参考电极 (公式 1) 之间的整体电化学反应从左到右的情况下, 与 ag agcl 基准相邻的沐浴液的 cl浓度电极 (未搅拌边界层 12,13, 14,15)可能比洗澡溶液的大部分要低得多, 除非确保足够的对流传输。使用旧的或不理想的 ag/agcl 电极, 而银的氯化不足, 可能会增加这种风险。事实上, 在参考电极上, 这种与流体流动相关的文物可以通过简单地在沐浴液和参考电极之间放置一个传统的琼脂盐桥来排除, 因为该文物是基于真实 cl-的改变。浓度与 ag/agcl 电极相邻11。本研究中提出的协议描述了如何防止与流动有关的结电位变化, 并测量未搅拌边界层中的实际离子浓度。
在沐浴液和 agarose agcl 参考电极之间放置琼脂糖 kcl 桥之后, 还需要考虑另一个关键因素: 就像参考 agsl-agcl 电极的作用就像 cl-电极一样, 离子通道也可以起到作用就像离子选择性电极在细胞外溶液和细胞内溶液之间通过膜离子通道的运动过程中, 在沐浴液和 ag/agcl 参考电极之间出现未搅拌边界层的情况。这意味着在解释流体流动对离子通道的调节时应谨慎行事。正如我们在前面的研究11中所讨论的, 离子通过存在电化学梯度的溶液的运动可以通过三种不同的机制发生: 扩散、迁移和对流, 其中扩散是运动由浓度梯度引起的迁移是由电梯度驱动的运动, 对流是流体流动的运动。在这三种传输机制中, 对流模式对离子11 (> 比通常的膜片钳设置下的扩散或迁移大 1, 000倍) 的运动贡献最大。这就形成了在不同的静态和流体流动条件下, 浴液与 ag/agcl 参考电极之间的结电位能非常大的理论基础11。
根据上述假设, 流体流动对离子通道电流的一些促进作用可以从膜表面通道入口附近的实际离子浓度的对流恢复中推断出来 (未搅拌边界层)10. 在这种情况体流动对离子通道电流的影响只是来自电化学事件 , 而不是离子通道门控的调节。此前, 巴里和他的同事们根据严格的理论考虑和实验证据, 也被称为未搅拌层或实验证据, 提出了类似的想法.运输编号效果。如果某些离子通道具有足够的单通道电导率和足够长的开放时间, 以提供足够的传输速率通过通道 (膜中的传输速率比未搅拌膜表面的传输速度更快), 则可能会产生边界层效应.因此, 对流相关的运输可以促进最终流体流动诱导的离子电流 10,12,13,14,15的促进。
在本研究中, 我们强调了在研究流体流动诱导的离子电流调节时使用琼脂或琼脂盐桥的重要性。我们还提供了一种测量与 ag/agcl 参考电极和膜离子通道相邻的未搅拌边界层中的实际离子浓度的方法。此外, 对流体流动诱导的离子通道电流调制 (即对流假设或未搅拌层传输数效应) 的理论解释, 可以为设计和解释对离子通道电流的研究提供有价值的见解。离子通道的剪切力调节。根据未搅拌边界层输运数效应, 我们预测, 通过流体流动可以促进所有类型的离子通道电流, 独立于其对流体流动剪切力的生物敏感性, 但前提是:离子通道具有足够的单通道电导率和较长的开时间。较高的离子通道电流密度可能会增加细胞膜表面的未搅拌边界层效应。
研究方案
所有实验都是根据 konkuk 大学的机构准则进行的。
1. 浴液与 ag/agcl 参考电极之间的琼脂糖盐桥
注: 琼脂糖 3m kcl 盐桥是按照前面所述的 12生产的, 变化不大。
- 桥梁的形成
- 弯曲火玻璃毛细管, 形成适当的 u 形。在记录大离子电流时, 毛细血管的内径应足够大, 以降低串联电阻。内径为2-5 毫米的管材通常是可以接受的。
- 琼脂糖 3m kcl 溶液的制备
- 准备100毫升的 3m kcl 溶液 (1 m 或2m 也是可以接受的)。
- 称重3克琼脂糖。
- 在90至100°c 的热板上溶解100毫升的 kcl 琼脂糖 (即3% 琼脂糖)。
- 用 3m kcl 琼脂糖装入桥梁
- 为了便于装载, 请将 u 形玻璃桥浸入琼脂-kcl 解决方案中。
注: 如果琼脂-kcl 溶液包含在一个较浅的宽容器中, 则很容易挖出玻璃桥。 - 让它们在室温 (rt) 下过夜, 让琼脂糖设置和硬化。
- 从 set/硬化的琼脂盐中仔细挖出装有琼脂糖 kcls 的玻璃桥。
- 为了便于装载, 请将 u 形玻璃桥浸入琼脂-kcl 解决方案中。
- 储桥
- 在宽颈瓶中准备足够的 3 m kcl 溶液的体积 (即500 毫升)。
- 将准备好的琼脂盐桥存放在冰箱里。
2. 流体流动剪切力在贴片夹紧室中的细胞中的应用
注: 膜片钳实验装置的示意图如图 1所示。
- 将装有洗浴液的容器 (体积和高度应该已经测量) 放在膜片夹紧室上方。
- 通过吸管将补丁夹紧室灌满洗浴溶液。
- 要阻止流体流动, 请将管道夹在容器一侧以阻止流体流动, 然后将管道夹在吸力侧, 同时停止吸力。这是 "静止" 控制条件。
- 要施加流体流动剪切力, 请同时打开容器上的两个管和吸力面。
- 在对细胞施加流体流动剪切力之前或之后, 测量以 ml/min 为单位的流速。
- 通过测量给定时间内流体体积的减少来计算流速。
- 从测量到的速度和浴池的几何 (结构) 来看, 应估计流体流动对电池施加的剪切力 (见讨论部分)。
- 或者, 要控制流量 (步骤 2.3-2.6), 请使用灌注泵。在这种情况下, 要小心确保恒定的流动, 而不是脉动的流动。
3. 通过沐浴液与 ag/agcl 参考电极之间的流体流动测量液-金属结合电位的变化 (图 3 a)
- 使用从现成产品中可以获得的 agarose agcl 电极或颗粒, 而不使用琼脂糖盐桥。
- 为洗浴室准备一个正常的生理盐盐盐盐 (例如, 143 mm ncl, 5.4 mm kcl, 0.33 mm nah 2 po 4, 5 mm mgcl 2, 1.8 mm cl 2, 1.8 mmcl 2, 11 mm d-葡萄糖; ph 调整到7.4 与 naoh).
- 在室内放置一个包含 3m kcl 溶液的贴片移液器, 以最大限度地减少移液器和沐浴溶液之间的连接电位移动。
- 将电压夹紧放大器固定到当前夹紧模式 ("i = 0" 或 "cc")。
- 在消除初始偏移电位后, 测量各种流量引起的电压变化。
- 为了验证电压的变化是否为液态/金属结电位, 请使用浴液与 agarose-salt 电极之间的琼脂盐桥重新检查流体流动对结电位的影响。
4. 静态条件下与 ag/agcl 电极相邻的非搅拌层中真实 cl-浓度的实验估计 (图 3b)
- 从步骤3的结果出发, 绘制结电位流量关系, 用上流体流量估计结电位偏移的最大值 (饱和) 值。
- 准备不同浓度的氯溶液 (即氯化钠的50、99、147、195和 288 mm)。
- 通过改变沐浴液中的 cl浓度, 绘制接合部电位 [cl-] 关系。请注意, 流体速率应保持不变, 并足够高 (> 30 mL/min), 以防止 cl浓度下降到相邻的 ag/agcl 参考电极。
- 从这两条关系曲线中, 从测量的结电位偏移中估计 cl浓度的变化。
结果
全细胞电压依赖性 l 型 ca2 +通道 (vdcc l) 记录在酶分散的大鼠肠系膜动脉肌细胞中, 如前面所述 11.动脉肌细胞在 nystatin 穿孔结构下用富含 cs 的移液溶液透析, 并采用二价无阳离子沐浴溶液, 以促进电流通过 vdccl11,16。在-70 mv 的保持电位下, 对 vdccl 电流进行了短暂的去极化电压坡道或电压步长。图 2a 显示了 vdccl中在没有流体流动 (5 ml% 或约 0.004 mss) 的情况下存在的有代表性的电流电压 (i-v) 关系, 用琼脂糖 kcl 桥记录。流体流动以与电压无关的方式略微增加了 vdccl电流。图 2b总结了流体流动对 vdccl 电流的促进作用。
流体流动对 vdccl电流的电压无关的促进是 vdccl对流体或剪切力的适当响应。在目前的实验装置中, 5 mlp/或大约0.004 液体流动据估计, 就剪切力而言, 约为 0.1 dyn\ cm 2 (见讨论)。然而, 当 agarose agcl 参考电极在没有琼脂糖 kcl 桥的情况下与沐浴流体直接连接时, 与静态下的 vdccl 电流相比,流体流动存在时的 i-v 关系向右移动条件 (图 2c和2d)。这导致了 vdccl电流在负电压下的抑制, 并在更偏振或正电位下促进了 vdccl电流。这说明了膜片夹具记录中流体流动引起的文物, 其中 i-v 关系的电压变化不是由于通道门控的修改, 而是实际上是由于沐浴液和 ag/agcl 之间的结点电位偏移造成的参考电极11。流体流动引起的结电位转移的直接证据如图 3所示。
根据步骤3测量了接合点电位变化。这些变化是由流体流动引起的, 是用一个充满 3m kcl 的开放移液器测量的, 如前面所述的11。采用充满 3m kcl 的开放式移液器, 可以最大限度地减小移液器与沐浴溶液之间的连接电位, 流体流动带来的潜在变化主要来自洗浴液和 ag/agcl 参考电极。如果在沐浴液和 agarose agcl 参考电极之间没有琼脂糖 3 m kcl 桥接, 流体流动以与流体流动速率相关的方式转移流体与 ag/agcl 电极之间的结电位 (图 3 a)。从结电位-流体流动关系中推断最大结电位变化为 ~ 7 mv (图 3 a, 底部)。相反, 当使用琼脂糖 3 m kcl 桥时, 流体流动不会改变沐浴流体与参考电极之间的结电位 (在图 3 a底部的图中总结)。
为了测量静态和流体流动条件下的浓度差异, 其中足够的对流作用模式是功能的, 我们研究了改变 cl 浓度对沐浴液- agcl 电极的影响根据步骤4的连接电位。增加 cl浓度以与浓度相关的方式移动结电位 (图 3b, 上图), 就像流体流动以速率相关的方式移动结电位一样。使用 kcl 琼脂糖桥, 防止了结电位以与 cl 浓度相关的方式发生变化 (图 3c), 表明浴液和参考电极之间发生了结电位变化,不在浴缸和移液器溶液之间。结电位 [cl-] 关系的半日志图显示在图 3b的下面板中。根据图 3b中的结果, 在结电位转移中的外推最大值 ~ 7 mv (如 图 3B) 表明, 与 ag/agcl 参考电极相邻的 cl 浓度下降到约70%。当流体流动不存在时, 散装沐浴液的平均浓度 (图 3b, 底部)。
在我们之前的研究中, 据报道, 在通道入口 10处通过对流恢复 (增加) [k+] 来促进流体流动来促进 kir2.1 电流。这一想法源于沐浴液和 ag/agcl 电极之间发生的现象, 因为 kir2.1 通道可以作为 k+电极发挥作用, 就像 ag/agcl 电极作为 cl电极发挥作用一样。图 4 a 和4 b示意图说明了这一想法。图 4c显示了流体流动诱导的 kir2.1 电流的促进的一个典型例子。在大鼠嗜碱性白血病 (rbl) 细胞中, 由0到-100 mv 的保持电位的超极化电压步长获得 kir2.1 电流。流体流动 (5 mlmin 或 0.004 m/) 的应用容易增加 kir2.1 电流 (图 4c)。流体流动的这种促进以前被认为不是通过细胞信号介导的, 而是由 k+离子对未搅拌边界层10 的对流传输的电化学效应介导的。
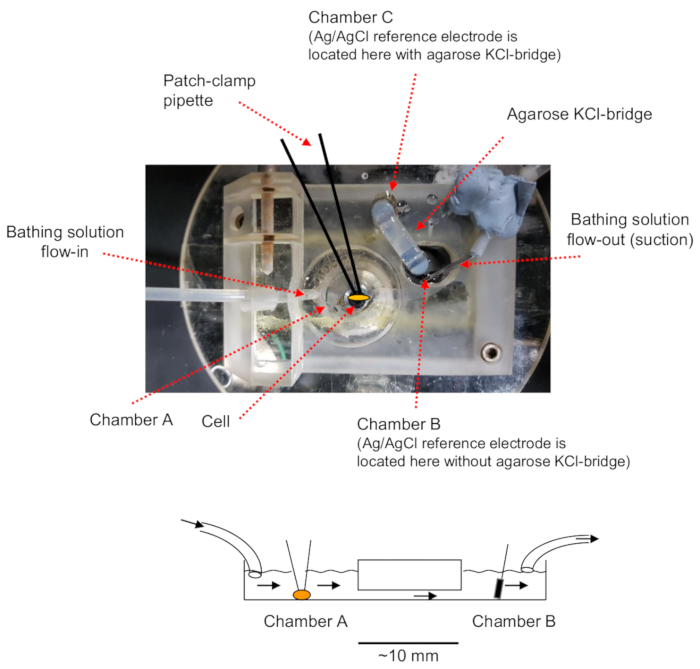
图 1: 示意图显示了在膜片钳记录中离子通道的流体流动调节的浴池设置.下面板是膜片夹紧室的侧面视图 (矢状部分)。总结了流体流动的路径和研究的细胞、电极和流体出口的位置。由于流体通过抽吸连续通过出口管抽出, 因此腔内流体的高度保持在相对恒定的水平。这一数字已从以前的出版物11中修改。请点击这里查看此图的较大版本.

图 2: 流体流动对 l 型电压依赖性 ca 2+通道 (vdccl) 电流的影响, 无论是否有琼脂糖 3 m kcl 桥。用 nystatin 穿孔膜片钳记录了酶分散的大鼠肠系膜动脉肌细胞中的 vdcc l 电流.以不含二价阳离子的 4.2 mm edta 的普通酪氨酸生理盐溶液作为沐浴液11。移液器溶液中含有 cscl, 140 mm;mgcl2, 1 mm;hpes, 5 mm;egta 0.05 mm;ph 值调整为7.2 与 csoh。(a 和 b)与琼脂糖 3m kl-桥梁。(a) vdccl电流和流体流动影响的代表性 i-v 关系. (b) 流体对 vdccl电流 i-v 关系的影响摘要. (c 和 d)没有琼脂糖 3m kcl 桥。(c) vdccl 电流的 i-v 关系。(d) 总结了在流体流动不存在和存在的情况下 vdccl电流峰值的i-v关系。用于获取 vdccl 电流的电压步长显示在图内图中。这一数字已从以前的出版物11中修改。请点击这里查看此图的较大版本.

图 3: 流体流动对沐浴流体与 ag/agcl 参考电极之间的液-金属结电位的影响, 以及从测量的结点对与参考电极相邻的未搅拌层中的实际 cl 浓度的估计潜在。(a) 有代表性的跟踪结点电位变化, 由于不同的流体流动速度 (上板)。这一数字已从以前的出版物11中修改。结电位-流体流量关系 (n = 5)。(b) 上板一块: 有代表性地记录因氯化钠溶液浓度不同而引起的结点电位变化。下面板: 结电位 [cl-] 关系 (n = 5) 的半日志图。红色的直线代表了最适合的一个修改的 nernste 方程的平衡电位与十倍斜率 49 mv。由于 na+的有限选择性, 与 cl--相比, 用于产生液/金属结电位, 在室的结电位 [cl-] 关系中产生了最适合的斜率值 49 mv, 而不是 58 mv。温度。根据 goldman-hogkin-katz电压方程, 49 mv 斜率表示 ag/agcl 参考电极的 cl 依赖性 (或选择性), 比另一个离子 (在本例中为 na+) > 95%。在 cl 浓度为 150 mm 的情况下 , 7 mv 的移动表明 cl 浓度下降了约 30%.(c) 利用 3m kcl 琼脂糖桥 (n = 3), 对氯化钠溶液中不同浓度的结点电位进行有代表性的追踪。请点击这里查看此图的较大版本.

图 4: 流体流动对流模型对离子电流通量期间开放通道附近离子浓度的影响示意图.(a) 在静电条件下, 电场溶液中离子的对流输运很少, 通过 k+选择性离子通道的 k+离子通量可能会导致在与电场相邻的微域中 k+浓度下降。通道入口。(b) 流体流动可以对流地恢复与明渠入口相邻的 k+浓度的降低。(c) 流体流动对内整流 kir2.1 通道电流的影响。流体流动立即增加了 kir2.1 电流。电压步长的形状显示在图插入中。使用高 k+沐浴和移液器解决方案记录了 kir2.1 电流。沐浴溶液: 148.4 mm kcl, 0.33 mm nah 2 po 4, 5m hepes, 0.5 mm mgcl2, 1.8 mm ccl 2, 11 mm d-葡萄糖;ph 值调整为7.4 与 naoh。移液器解决方案: 135 mm kcl, 5 mm ncl, 5 mm mg-atp, 10 mm hepes, 5 mm 乙基乙基 (2-氨基乙基)-n, n, n ', n ', n ',-四乙酸 (egta), ph 7.2 (与 koh 调整)。由于 rbl-2h3 细胞极易受到低渗透肿胀和随体激活的 cl电流的触发, 洗浴液中添加了 38 mm 蔗糖, 以调整渗透性并防止细胞肿胀。此外, 在移液液中添加了 cl通道阻滞剂 [4, 4 '-双硫氰酸-2, 2 '-静息磺酸 (dids, 30μm)], 以消除 cl电流的任何污染。c 小组已从以前的出版物10中修改。请点击这里查看此图的较大版本.
讨论
在本研究中, 我们展示了一种方法, 通过用填充高 kcl 的开放式膜片式夹钳确定液-金属连接电位, 测量与 ag/agcl 参考电极相邻的未搅拌层中的真实 cl 浓度浓度。当从静态向流体流动条件切换时, 边界层中 cl 浓度的变化会导致结电位的转移。只需在参考电极和沐浴液之间使用琼脂糖 kcl 桥, 即可防止膜片夹具记录过程中的 cl浓度相关错误或伪影。
除了强调琼脂或琼脂盐桥的重要性外, 该方法在估算未搅拌边界层中的实际离子浓度方面的另一个应用如下。由于等离子体离子通道可以作为离子选择性电极 (就像 ag/agcl 电极的功能类似于 cl-电极), 因此在细胞膜通道入口附近的未搅拌边界层中的实际离子浓度表面可以不同于散装流体的平均浓度。在临床环境下, 细胞膜附近的散装流体和未搅拌层之间的离子浓度差异是真实的情况, 应与流体流剪切力对通道门控的生物调制区分开来。不幸的是, 与 ag\ agcl 参考电极和沐浴液之间的未搅拌层效应不同, 在研究流体流动剪切力调节离子通道时, 不能固定细胞膜表面附近的未搅拌层效应。
然而, 考虑到未搅拌层中的实际离子浓度约为散装流体中的 70% (图 3), 我们可以对实验数据进行一些修正, 以区分离子通道的生物调制从 "未搅拌层效应的电化学现象"。在最近的一项研究中, 细胞膜表面未搅拌层中的实际离子浓度预计约为散装洗浴液平均浓度的70%。由于流体流动恢复了离子浓度的降低, 它促进了 kir2.1 电流独立于细胞信号10。在我们之前的研究中, 电流密度相当高 (2.5 am/2), 细胞外 k+浓度高, rbl 细胞10中的 kir2.1 表达较高。然而, 对于具有不同离子通道电流密度振幅的真实细胞膜, 细胞膜表面的未搅拌层效应可能在很大程度上取决于离子通道电流密度的振幅。此外, 这可能会导致一些离子通道电流 (特别是那些相对较低的电流密度) 对流体流动调节不敏感;虽然, 未搅拌层效应是电化学调节的, 而不是生物调节的。因此, 这可能会影响此处描述的技术。因此, 今后的研究应研究是否有可能开发出一种足以纠正实验结果的定量方法。
在图 3中, 我们观察到 ag/agcl 参考电极与沐浴液之间的液-金属结电位在很大程度上取决于 ag/agcl 电极的状况。事实上, 当 ag/agcl 电极在条件下是完美的, 由于流体流动, 结电位的变化是最小的 (没有显示数据)。然而, ag/agcl 电极的氯化不良导致结电位发生较大的变化。由于 ag/agcl 参考电极很容易受到各种外部刺激, 如紫外线和氧化应激, 因此始终建议使用琼脂或琼脂糖 kcl 桥。虽然在浴液和参考电极之间的流体流动会改变结电位, 但我们通过测量结点的移动, 成功地估计了未搅拌边界层中的实际离子浓度各种流体流量下的电位 (图 3 a和3A)。
步骤4中用于准备标准曲线以估计从连接电位移动到的未搅拌边界层中的实际 cl浓度的临界点是, 标准曲线应记录在足够的流速 (30 ml/在这个实验中最小)。虽然这种流速非常快 , 但在实际情况体越快 , 在边界层处的浓度下降越小 (图 3) 。此外, 开放的移液器必须充满高 kcl, 而不是普通的移液器溶液, 以便进行膜片夹具研究, 防止移液器和沐浴溶液之间的连接电位发生变化。
在膜片夹具设置中的剪切力可以从以下关系来估计 11:
= (6μq)/(bh2) (公式 2)
其中:是剪切应力 (n/cm2);μ是粘度 (0.001 n m/s为水在 20°C);q是流体流量 (m3/);b是室宽度 (m);h是室高度 (m)。当流体流量为 30 ml/min 时, 根据上述方程,图 1所示的补丁室中的剪切力估计为 ~ 0.75 dyn\ cm 2。与生理剪切力相比, 这是一个较低的剪切力水平;血管内皮细胞可承受高达 40 dyn/cm18,19的剪切力。因此, 如果离子通道对剪切力小于 0.75 dynncmcm 2 不敏感,我们可以通过设置控制条件来研究离子通道在排除未搅拌边界层效应后的流体流动剪切力敏感性至 0.75 dyn/cm2.然而, 包括 kir2.1 在内的一些离子通道似乎对剪切力敏感, 小于 0.75 dyn/cm2,3,4,5,6。
未搅拌层效应最初是巴里和同事1 2、1 3、1 4、1 5 的建议。在这里, 我们提供了一种方法来估计实际离子浓度的非搅拌层测量的变化, 连接电位与开放的膜片钳移液器。我们还建议, 这种未搅拌的边界层效应可能会导致流体流动引起的离子通道电流的调节, 并应在研究离子通道的流体流动-机械敏感性时加以考虑。然而, 基于这一假设, 可能会有人问, 如果未搅拌边界层效应是电化学而不是生物控制, 为什么某些离子通道电流对流体流动相关的调节不敏感。正如上面简要介绍的那样, 这可能是因为只有通过具有足够大的单通道电导率和足够长的开放时间的通道的离子电流才能通过流体流动得到促进。也就是说, 对于离子浓度与散装溶液中的平均浓度不同的未搅拌层的建立, 与水相14中的通量相比, 膜相的通量应该足够快.我们最近提出, 通过 kir2.1 通道的电流, 其电导率和开放时间足够高, 是通过流体流动机制, 通过对流恢复机制的离子浓度在未搅拌的边界层细胞膜表面11。
最后, 我们提出了一种用开放的膜片钳移液器测量与参考电极和细胞膜表面相邻的未搅拌边界层中离子浓度的方法。该方法不仅强调了琼脂糖 kcl 桥的重要性, 还为解释离子通道流体流动剪切力控制时的未搅拌层效应提供了一种方法。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了先锋研究中心方案 (2011-0027921)、基础科学研究项目 (2015r1001 a02036887 和 nrfa-2016r1a2b4014795) 的支持, 由科技部资助的韩国国家研究基金会& 未来规划, 并通过韩国卫生工业发展研究所 (khdi) 提供韩国卫生技术研发 & 开发项目赠款, 由大韩民国卫生 & 福利部 (hi15c1540) 资助。
材料
| Name | Company | Catalog Number | Comments |
| RC-11 open bath chamber | Warner instruments, USA | W4 64-0307 | |
| Ag/AgCl electrode pellet | World Precision Instruments, USA | EP1 | |
| Agarose | Sigma-aldrich, USA | A9793 | |
| Voltage-clamp amplifier | HEKA, Germany | EPC8 | |
| Voltage-clamp amplifier | Molecular Devices, USA | Axopatch 200B | |
| Liquid pump | KNF Flodos, Switzerland | FEM08 |
参考文献
- Gerhold, K. A., Schwartz, M. A. Ion Channels in Endothelial Responses to Fluid Shear Stress. Physiology (Bethesda). 31 (5), 359-369 (2016).
- Garcia-Roldan, J. L., Bevan, J. A. Flow-induced constriction and dilation of cerebral resistance arteries. Circulation Research. 66, 1445-1448 (1990).
- Langille, B. L., O’Donnell, F. Reductions in arterial diameter produced by chronic decreases in blood flow are endothelium-dependent. Science. 231, 405-407 (1986).
- Pohl, U., et al. Crucial role of endothelium in the vasodilator response to increased flow in vivo. Hypertension. 8, 37-44 (1986).
- Ranade, S. S., et al. a mechanically activated ion channel, is required for vascular development in mice. Proceedings of the National Academy of Sciences of the United States of America. 111, 10347-10352 (2014).
- Hoger, J. H., et al. Shear stress regulates the endothelial Kir2.1 ion channel. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7780-7785 (2002).
- Mendoza, S. A., et al. TRPV4-mediated endothelial Ca2+ influx and vasodilation in response to shear stress. American Journal of Physiology-Heart and Circulatory Physiology. 298, H466-H476 (2010).
- Brahler, S., et al. Genetic deficit of SK3 and IK1 channels disrupts the endothelium-derived hyperpolarizing factor vasodilator pathway and causes hypertension. Circulation. 119, 2323-2332 (2009).
- Lee, S., et al. Fluid pressure modulates L-type Ca2+ channel via enhancement of Ca2+-induced Ca2+ release in rat ventricular myocytes. American Journal of Physiology-Cell Physiology. 294, C966-C976 (2008).
- Kim, J. G., et al. Fluid flow facilitates inward rectifier K+ current by convectively restoring [K+] at the cell membrane surface. Scientific Report. 6, 39585 (2016).
- Park, S. W., et al. Effects of fluid flow on voltage-dependent calcium channels in rat vascular myocytes: fluid flow as a shear stress and a source of artifacts during patch-clamp studies. Biochemical and Biophysical Research Communications. 358 (4), 1021-1027 (2007).
- Barry, P. H., Hope, A. B. Electroosmosis in membranes: effects of unstirred layers and transport numbers. I. Theory. Biophysical Journal. 9 (5), 700-728 (1969).
- Barry, P. H., Hope, A. B. Electroosmosis in membranes: effects of unstirred layers and transport numbers. II. Experimental. Biophysical Journal. 9 (5), 729-757 (1969).
- Barry, P. H. Derivation of unstirred-layer transport number equations from the Nernst-Planck flux equations. Biophysical Journal. 74 (6), 2903-2905 (1998).
- Barry, P. H., Diamond, J. M. Effects of unstirred layers on membrane phenomena. Physiological Reviews. 64 (3), 763-872 (1984).
- Park, S. W., et al. Caveolar remodeling is a critical mechanotransduction mechanism of the stretch-induced L-type Ca2+ channel activation in vascular myocytes. Pflügers Archiv - European Journal of Physiology. 469 (5-6), 829-842 (2017).
- . A procedure for the formation of agar salt bridges Available from: https://www.warneronline.com/pdf/whitepapers/agar_bridges.pdf (2018)
- Cunningham, K. S., Gotlieb, A. I. The role of shear stress in the pathogenesis of atherosclerosis. Laboratory Investigation. 85 (1), 9-23 (2005).
- Resnick, N., et al. Fluid shear stress and the vascular endothelium: for better and for worse. Progress in Biophysics & Molecular Biology. 81 (3), 177-199 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。