Method Article
雄激素依赖性和去势抗性前列腺癌的荧光自体小鼠模型
摘要
本协议的目的是证明前列腺癌细胞内注射, 随后阉割。在临床相关的肿瘤微环境和免疫宿主的背景下, 应用雄激素依赖性和抗去势前列腺癌的原位前模型是研究该病的关键。
摘要
原位肿瘤模型是临床前前列腺癌研究的重要工具, 因为它在皮下和转基因小鼠模型中具有多种优势。与皮下肿瘤不同, 原位肿瘤包含更精确的临床血管、肿瘤微环境以及对多种疗法的反应。与基因工程鼠模型相比, 原位模型可以以较低的成本进行, 在更短的时间内, 涉及使用高度复杂和异构的老鼠或人类癌细胞系, 而不是单一的基因改变, 这些细胞线可以进行基因修饰, 比如表达成像剂。在这里, 我们提出了一个协议, 以外科注射荧光素酶-和 mCherry 表达小鼠前列腺癌细胞系到前前列腺叶。这些小鼠开发的原位肿瘤是无创监测的体内, 并进一步分析肿瘤体积, 体重, 小鼠生存和免疫浸润。此外, 原位瘤小鼠被手术阉割, 导致即刻肿瘤回归和随后复发, 代表去势抗前列腺癌。虽然需要技术技能来执行这一程序, 这种自体的原位模型的雄激素依赖性和去势抗前列腺癌是非常有用的所有调查员在该领域。
引言
据估计, 前列腺癌发病率最高 (161360 人), 并导致第三位男性癌症死亡 (84590 人) 在 2017年1。诊断时, 前列腺肿瘤是雄激素依赖性的, 并通过手术前列腺切除术、放疗和/或雄激素剥夺治疗 (ADT) 治疗, 但每种治疗都与多种主要疾病和并发症有关2,3,4,5,6,7,8,9,10. 尽管 ADT 后肿瘤消退, 几乎所有的肿瘤复发的抗去势前列腺癌 (CRPC)。在这个阶段, 批准的治疗包括多西紫杉醇, Sipuleucel 免疫疗法和抗雄激素小分子 enzalutamide 和阿比特龙, 但没有单独的治疗提供5.2 月以上的生存好处11,12,13,14,15,16,17. 因此, 男性在前列腺癌的各个阶段都需要改进的治疗方案和疾病的管理, 这是最好的临床前病建模是至关重要的。
通过正确的程序, 前列腺癌细胞系可以被外科灌输到小鼠前列腺, 导致自体或异种原位肿瘤的发展。原位肿瘤建模是所有肿瘤生物学和药物开发研究的理想选择, 它允许肿瘤的发展具有临床代表性的肿瘤微环境。先前的研究表明, 皮下 (南卡罗来纳州) 肿瘤有一个改变的肿瘤血管, 导致差异和较少的临床准确反应的抗血管生成疗法18,19。此外, 多项研究观察到, 在治疗同一细胞系时, 多化疗的疗效有所增加或减少, 这取决于它是被管理的是南卡罗来纳州还是原位, 后者最能代表人类所看到的癌症20,21,22。此外, 只有在结肠癌的原位模型, 但不是在南卡罗来纳州模型, 肿瘤产生了正确的降解酶诱导转移的23。最后, 随着免疫疗法继续出现在癌症治疗的前沿, 特别是因为他们还没有为前列腺癌提供显著的好处 24, 25, 自体的前临床模型, 准确的和在免疫的宿主中引流淋巴结是至关重要的。
有许多因素导致这些不一致的结果, 基于肿瘤部位。在不同的情况下, 癌细胞暴露于不同的组织特异内皮细胞和改变血管生成, 从而影响肿瘤的发展26,27。具有正确的原位肿瘤可用于临床相关的药物传递、缺氧条件和抗血管生成疗法的评价28。虽然基因工程模型 (宝石) 确实包含了准确的时间, 他们需要很长时期的育种, 高成本, 并往往基于操作的单一或少量的基因敲出或抗原超出临床相关水平。相比之下, 在原位肿瘤中使用的人或小鼠前列腺癌细胞系, 如人类肿瘤, 在单个细胞内和显示细胞间的异质性方面更具遗传学复杂性29,30。也不像宝石, 原位癌细胞系可以被设计来表达成像方式或增加或减少其他感兴趣的分子水平, 和体外和体内实验结果可以直接比较。原位肿瘤也可以从原发性患者衍生细胞中形成。在这里, 我们报告的方法, 执行前列腺内注射前列腺癌细胞, 形成原位雄激素依赖性肿瘤, 并在阉割后复发, 作为原位 CRPC。
研究方案
本议定书所概述的所有动物程序都将按照道德规定执行, 并获得适当的大学机构动物照料和使用委员会 (IACUC) 的批准。
1. 外科材料和癌细胞的制备
- 手术前, 用高压釜进行显微解剖剪刀、Graefe 钳、Graefe 组织钳、针钳、缝合刀, 以及适当数量的窗帘。用环氧乙烷气体杀菌50µL 注射器和28口径针头 (图 1C)。
- 在手术前一天, 在 RPMI 10 厘米的菜肴中培养的 c-myc 帽细胞补充了10% 胎牛血清 (血清) 和1% 青霉素/链霉素 (P/秒) 在37摄氏度 5% CO2孵化器。对于生物发光和/或荧光肿瘤的监测, 染293T 细胞与适当的载体和随后传感器的 c-myc 盖细胞与0.45 µm 过滤慢病毒北疆31。对细胞进行排序, 生成稳定的细胞系, 具有100% 转导阳性。
注: 在无菌条件下执行所有组织培养, 并验证所有细胞系均无支原体。本研究所用的小鼠前列腺癌细胞系, c-myc 帽32, 转基因稳定地表达萤火虫荧光素酶和 mCherry。c-myc-CaP 细胞系从c-myc-overexpressing 的 c-myc 鼠中分离出来, 这些细胞含有扩增雄激素受体 (AR), 这是雄激素依赖性的32 , 在小鼠阉割33后形成 CRPC 肿瘤。这项研究中的所有老鼠都是6-8 周大的雄性 FVB/新泽西州老鼠。可替代的小鼠前列腺癌细胞系可以与适当的遗传背景的老鼠, 以及人前列腺癌细胞系或原发性患者衍生的前列腺癌细胞 immunodeficient 小鼠。每个注射细胞的最佳数量应根据经验确定的替代细胞系。此外, 可利用替代成像方式来可视化肿瘤, 包括磁共振成像 (MRI), 正电子发射断层扫描 (PET), 或计算机断层扫描 (CT), 以及 GFP 作为替代 mCherry。 - 手术前一天晚上, 将胶基底膜基质和苯酚无红冰在4摄氏度解冻。
- 在手术当天, 通过用磷酸盐缓冲生理盐水 (PBS) 洗涤细胞, 并与0.25% 胰蛋白酶-EDTA 分离, 来收集电池。中和胰蛋白酶与 RPMI 10% 血清和 1% P/秒。
- 离心细胞在 400 x g 5 分钟。
- 用10毫升的 RPMI 清洗细胞, 不需要血清或 P/S。
- 计数单元格并并用重悬 PBS 中的单元格的浓度为6.67x10 7 单元格/mL (1×10 6 cells/15 µL)。
- 添加相同数量的胶, 以创建一个 1:1 PBS/胶细胞悬浮在最后浓度的 1×106 cells/30 µL, 并保持在冰上的细胞, 直到注射, 以防止凝固。
注: 在制备胶细胞悬浮液3小时内进行前列腺内注射。如果对5只老鼠进行前列腺内注射, 重复上述步骤, 准备一个新鲜的胶细胞悬浮液。
2. 手术前鼠标准备
注: 在大学动物设施的小鼠在手术前至少一周, 允许适当的适应和最小化动物压力。步骤 2.1-2.6 由外科医生助理执行。所有后续手术步骤是由外科医生使用无菌手套和外科工具, 无菌技术。
- 麻醉小鼠与异氟醚 (2-5% 用于感应通过室, 1-3% 为维护通过鼻锥)。通过脚趾夹紧反射的丢失验证完全诱导。
- 称小鼠并管理至少0.05 毫克/千克的止痛丁丙诺啡
注: 鼠标重量≥20 g 是成功的前列腺内注射的理想选择。 - 用眼膏润滑两眼, 防止角膜干燥。
- 剃掉腹部所有的皮毛。
- 用无菌的不附着垫和无菌酒精湿巾对腹部进行三轮的循环应用。让腹部干燥。
注: 在其余的手术过程中, 只有无菌手套和手术器械才能接触到灭菌的小鼠腹部。 - 在清洁手术显微镜的目标下, 直接将鼠标仰卧在加热垫上的干净表面上。
- 用不育的褶皱盖住老鼠腹部的小孔。
3. 前列腺内注射
注意: 在无菌条件下执行所有手术步骤。调整显微镜, 鼠标放置, 或任何其他无菌的对象必须由外科医生助理做。
- 执行大约1厘米外侧皮肤沿中线的腹部, 优于鸡和包皮腺体 (图 1D)。
- 在层间打开剪刀, 将外腹皮肤与内腹部肌组织之间的结缔组织分开。
- 在使用钳子提高肌组织以避免刺穿肠道或膀胱时, 执行类似的内腹部肌组织切口 (图 1D)。
- 找到双边精囊 (图 1A, 白色)/前前列腺裂片 (图 1A, 黑色), 通常为后, 侧, 稍优于膀胱 (图 1A, 黄色), 但这可能是不同的小鼠.前列腺前叶呈半透明状, 附着于白色精囊的较小曲率。
- 用 Graefe 组织钳轻轻地抬起精囊的尖端, 在不穿刺精囊的情况下在组织上产生张力 (图 1E)。
- 混合的 c-myc 帽胶解决方案由外邦人吹打 (由外科医生助理), 因为细胞可能有颗粒, 并慢慢地吸入30µL (1x106细胞) 到针, 以避免气泡。
- 小心地将针的斜角插入平行于前列腺前叶的长轴。慢慢地将30µL 注入到裂片中, 慢慢缩回针头以防止渗漏 (图 1F)。通过充血前列腺前叶 (图 1G) 验证是否有足够的注射。
- 小心地持有精囊, 并在小鼠外注射前列腺瓣大约三十年代, 以允许胶部分凝固在裂片内。在这段时间, 收集任何细胞溶液渗漏在腹部使用无菌的聚酯尖头涂抹器, 以防止非原位肿瘤的发展, 不施加压力的注射前列腺叶。
- 小心地返回精囊, 将前列腺注射到腹部, 不给叶施加压力。替换任何外在的组织。
- 连续缝合, 以 5-0 vicryl 可吸收的反切割针缝合闭合内腹部肌组织。
- 使用4-0 尼龙单丝不可吸收的反向切割针缝合, 执行中断缝线缝合外腹部皮肤。
注: 灭菌的9毫米主食也可以用来关闭外腹部皮肤。然而, 与缝合相比, 它们干扰任何后续的生物发光和荧光肿瘤成像信号。 - 清洁所有的工具与无菌的乙醇湿巾 (由外科助理打开), 并将其放置在玻璃珠消毒器三十年代. 在使用鼠标之前, 请允许这些工具晾干。
- 用无菌生理盐水冲洗注射器和针头 (由外科医生助理打开), 防止残留胶堵塞。
注: 外科医生助理应出席所有手术, 执行所有非灭菌的手术前的鼠标准备和手术后的鼠标护理, 以及混合的 c-myc 帽胶溶液注射前。为了尽量减少时间, 因为每个前列腺内小鼠手术需要20-30 分钟, 外科医生助理可以开始准备下一只老鼠, 因为外科医生正在缝合当前的老鼠。
4. 手术后鼠标护理
- 术后立即1毫克/千克镇痛 meloxicam, 24 小时, 48 小时。
- 允许老鼠在笼子里恢复, 没有被褥放在暖气垫的中间。在手术后对小鼠进行至少30分钟的监测, 直到他们恢复正常的运动和活动, 然后将它们放在笼子地板上有食物的干净笼子里。
- 进一步监测小鼠每天进行适当的伤口愈合, 体重, 美容和手术后的移动。在战斗的任何证据下, 把老鼠单独关进笼子里。
- 手术后14天内取出其余缝线。
5. 生物发光肿瘤影像学
- 准备无菌过滤的 Na+或 K+ D-荧光素, 如制造商所描述并受保护免受光照。
- 在 peritoneally 内注射小鼠10µL/克荧光素体重。
- 至少10分钟后, 图像小鼠与 IVIS 频谱成像系统, 如前所述34,35。
- 使用活体图像软件分析图像, 如前所述34,35。
注: IVIS 成像分析有助于确定前列腺内注射成功和肿瘤早期发育, 以规范实验组的肿瘤负担。然而, 根据生物发光或荧光信号的强度, 饱和度可能导致图像量化的高原, 尽管实际肿瘤的大小增加。因此, 在肿瘤生长的后期, IVIS 成像可能更有用, 以确定肿瘤的大小在成功的治疗, 而不是增加的图像饱和后的大小。
6. 肿瘤采集、肿瘤分析、生存终点
- 如果采集肿瘤进行分析, 人道弄死小鼠由 CO2暴露和继发性颈椎脱位, 或通过替代 IACUC 批准的方法, 并解剖肿瘤从腹部。肿瘤应位于前列腺原位。
注: 连接到前腹壁的肿瘤或在整个腹部的种子表明前列腺内注射不良或漏, 不应被认为是原位肿瘤。 - 权衡肿瘤。
- 计算肿瘤体积为π/6×L×W×H (L = 肿瘤最长轴的长度, W = 垂直宽度, H = 垂直高度)。
- 肿瘤可以通过组织学分析 (固定在10% 中性缓冲福尔马林), 流式细胞术 (创建单细胞悬浮), 蛋白质 (制备组织裂解物在马国贤缓冲), 或 RNA (立即放置组织在 RNAlater)。
- 为免疫学分析, 也收集前列腺肿瘤引流的对位主动脉淋巴结 (图 1B, 橙色) 和脾脏。
注意: 如果跟随老鼠生存, 这个模型的端点被定义为出血性腹腹水的出现36和/或者减少了移动、梳理和/或 piloerection37。生存分析小鼠接受术前和手术后镇痛 (协议步骤 2.2, 4.1), 必须定期监测。如果发生任何打斗, 应将小鼠分离成单独的笼子, 并应在上述任何终点读数出现时人道安乐死。
7. CRPC 模型的手术阉割
- CRPC 模型, 执行上述前列腺内注射协议 (协议步骤 1-5)。
- 至少一周后, 肿瘤发展后, 进行手术阉割通过灼烧, 如前所述的38。
- 通过生物发光成像监测肿瘤的回归和复发。去势后, 肿瘤的回归将发生在3天内, 肿瘤复发将发生在大约30天内, 代表 CRPC。
结果
在这篇手稿中, 我们手术注射的小鼠前列腺癌细胞线, c-myc 帽, 到前前列腺叶 (图 1A), 导致发展的原位前列腺肿瘤的临床相关的和正确的前列腺引流淋巴结 (图 1B)。这是使用显微解剖剪刀, Graefe 钳, Graefe 组织钳, 针持有人与缝合刀, 和一个50µL 注射器与28口径针 (图 1C)。在包皮腺体上方进行大约1厘米的中线腹部切口 (图 1D) 后, 一个精囊和连接的前前列腺叶位于和外部化 (图 1E) 和30µL (1x106细胞) 的一个1:1 PBS/胶细胞悬浮液注入前列腺 (图 1F), 最初是由充血的叶和缺乏泄漏 (图 1G) 来验证的。
为了监测原位肿瘤的生长, 我们稳定地转染了的 c-myc 帽细胞, 以表达萤火虫荧光素酶和 mCherry, 允许肿瘤后, 非侵入性的体内生物发光 (图 2A) 和荧光 (图2B) 分别。这种成像的一个限制是, 根据信号的强度, 成像量化可能饱和, 而肿瘤继续增加的大小。因此, 在高信号强度的情况下, 此体内成像对于最初将肿瘤负担规范化到实验组和以后在实验治疗后确定肿瘤大小方面更有用。还可以利用其他成像方式, 如小动物 MRI、PET 或 CT。
前列腺内注射术后30天腹部解剖了原位肿瘤 (图 3A)。原位肿瘤应位于前列腺前叶部位。肿瘤肿块在整个腹部或连接到前腹壁表明前列腺内注射不当和渗漏。使用适当的技术, 肿瘤体积 (图 3B) 和重量 (图 3C) 可以记录相对较小的标准错误。然而, 正如观察到的, 会有一些变异与小和大肿瘤肿块。因此, 初步使用前处理成像量化, 以平衡肿瘤负担的实验性武器是至关重要的所有实验。此外, 由于这些小鼠癌细胞被注射入免疫 FVB/新泽西州老鼠, 可通过免疫组化 (IHC) (或流式细胞术或其他技术) 对 CD3 T 细胞 (图 3D) (或其他免疫细胞类型) 进行分析。最后, 这个模型提供了一个客观的生存终点, 因为大的原发性肿瘤肿块导致出血性腹腹水36 (图 3E) 和/或减少移动, 梳理和/或 piloerection37。有时, 死亡也可能是由肿瘤生长阻断尿液输出引起的。
最后, 该模型可用于研究雄激素依赖性前列腺癌和 CRPC, 后者的预后较差, 需要新的治疗方案。在原位肿瘤发展后, 小鼠被手术阉割, 如前所述的38。由于这是第二个主要的生存手术, 必须给予额外的照顾, 以监测恢复和任何不良事件或并发症。去势后3天内, 强烈的肿瘤回归观察, 随后肿瘤复发约30天后, 代表 CRPC (图 4A)。CRPC 肿瘤可以解剖和分析组织学, 不显示任何神经内分泌分化, 因为他们保持高 AR 水平和阴性的神经内分泌标记, 突触素(图 4B)。

图 1: 前列腺前叶、引流淋巴结和前列腺内注射的代表性技术.(A)右侧前列腺前叶的图像 (黑色, *), 附右精囊 (白色), 右睾丸和脂肪垫 (绿色), 膀胱 (黄色), (B)双侧前列腺引流对位主动脉淋巴结 (橙色), (C)显微解剖剪刀, Graefe 钳, Graefe 组织钳, 针持有人与缝合刀, 50 µL 注射器与28口径针 (左向右), (D)中线切口, (E)精囊和前前列腺叶外化, (F), 前列腺内注射, 和(G)充血前列腺前叶。请单击此处查看此图的较大版本.
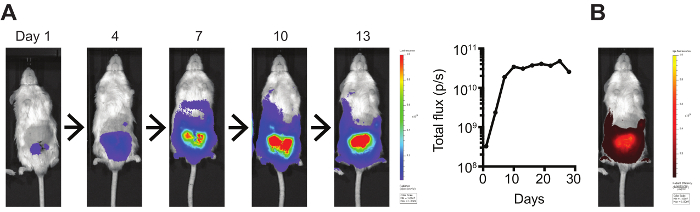
图 2:体内生物发光和荧光肿瘤成像.(A)荧光素酶-和(B) mCherry 表达原位 c-myc-CaP 肿瘤是用 IVIS 频谱成像系统进行成像的。生物发光通过总通量 (光子/s) 进行量化。请单击此处查看此图的较大版本.
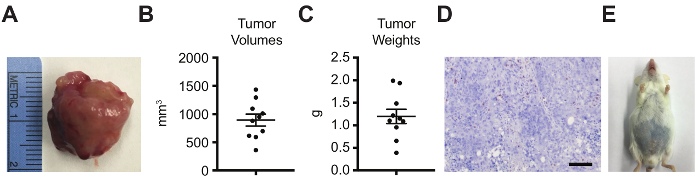
图 3: 肿瘤体积、重量、免疫浸润的组织学和生存率的原位肿瘤分析.在前列腺内注射后30天对原位肿瘤进行解剖, 并通过(A)总成像分析(B)肿瘤体积 (π/6×L×W×H;L = 肿瘤最长轴的长度, W = 垂直宽度, H = 垂直高度), (C)肿瘤重量, (D) CD3 IHC (鳞片 bar=100 µm) 和(E)生存, 以客观终点作为出血性腹部的外观腹水.(A-B)数据表示为平均值的标准误差的平均值。请单击此处查看此图的较大版本.
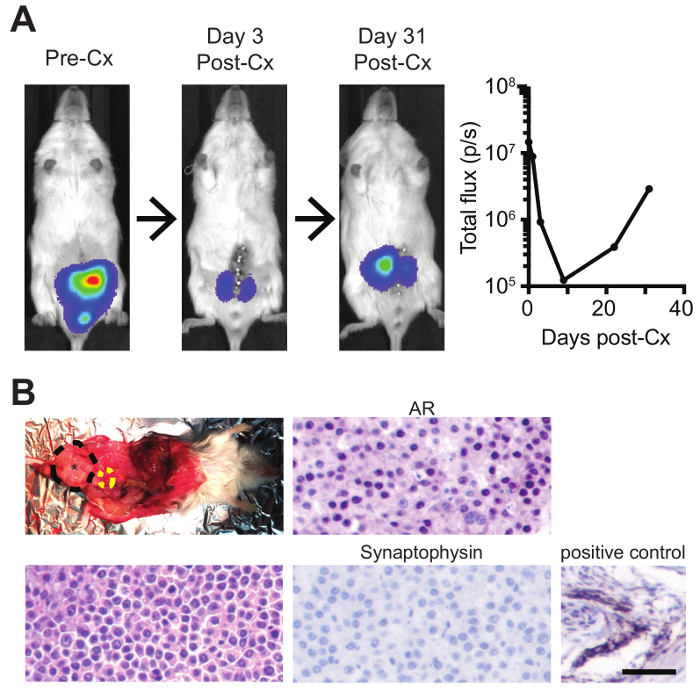
图 4: 前列腺内注射与随后的手术阉割, 以模拟雄激素依赖性前列腺癌和 CRPC.(A)具有原位荧光素酶表达肿瘤的小鼠通过生物荧光预处理和后阉割 (Cx) 进行成像, 并对(B)复发 CRPC 肿瘤进行解剖 (黑色 = 原位前列腺肿瘤; 黄色 = 膀胱) 并通过 H & 分析E, AR IHC, 和突触素 IHC (有阳性小鼠控制) (鳞片 bar=50 µm)。请单击此处查看此图的较大版本.
讨论
在这篇手稿中, 我们概述了执行前列腺癌细胞内注射手术的协议。我们利用雄激素依赖性和 c-myc overexpressing (c-myc 多表达被认为高达80-90% 的人前列腺癌39) 小鼠前列腺癌细胞系, c-myc-CaP, 最初被隔离的高 c-myc 鼠标32 ,33。该细胞系稳定转基因表达荧光素酶和 mCherry, 为非侵入性的体内生物发光和荧光肿瘤成像, 分别。此外, 在雄激素依赖性肿瘤发展后也进行了手术去势, 导致肿瘤的回归和复发。因此, 我们提供的细节, 以模型的雄激素依赖性前列腺癌和 CRPC 在免疫宿主。
将 c-myc 帽细胞注入小鼠前前列腺叶。小鼠前列腺包括前, 腹, 和侧前列腺裂片, 和人前列腺由一个外围区域, 过渡区, 和中央区在一个单一的裂片40。虽然以前的研究有解剖和组织学比较侧小鼠裂片到人的外围区域, 大多数前列腺癌的站点41, 并且前鼠裂片到人的中央区域42, 43, 最近和综合分析表明, 与腹叶相比, 前叶和侧叶显示密切相关的基因表达模式。44此外, 在宝石40的前叶中观察到前列腺癌的发展情况, 对于前列腺内的手术, 前叶允许注入必要体积的癌细胞溶液, 最小的渗漏和变异性。
使用南卡罗来纳州和转基因宝石癌模型有多种缺陷和局限性。在人工手术中生长的南卡罗来纳州肿瘤对化疗有不同的反应, 与同种细胞系和人类疾病的原位肿瘤相比,20,21,22。这可能是由于该肿瘤的血管改变, 如其对抗血管生成疗法的差异反应的例子18,19。相反, 原位肿瘤的发展与适当的, 引流淋巴结, 和血管, 可以进行小鼠细胞系, 从而也允许分析肿瘤免疫学和反应免疫疗法。
转基因宝石在免疫宿主中发育适当的肿瘤, 然而这些模型通常通过发展单一或少量基因改变的肿瘤来简单化人类癌症29。对 c-myc 和其他前列腺癌细胞系的分析显示, 它们包含的体细胞拷贝数的改变和染色体的改变比来自于 c-myc 的小鼠和其他宝石的肿瘤更大, 而它们的来源为29。此外, 宝石是有限的增加成本和时间所需的小鼠育种进行足够的权力实验。原位肿瘤模型可以克服这些局限性。人和小鼠前列腺癌细胞系包含许多与人类疾病相关的基因改变29, 而且像人类癌症一样, 在各个细胞之间也显示出很大的异质性30。原位小鼠自体肿瘤可以进行免疫学分析, 而原位人类异种肿瘤则允许对人类细胞的治疗进行分析。最后, 与宝石不同的是, 细胞线可以在注射前进行修改, 允许表达发光或荧光成像分子来监测肿瘤的生长, 使实验组中的肿瘤负担正常化, 监测对治疗的反应, 并术后应遵循肿瘤回归和 CRPC 复发。
该协议的关键步骤包括定位和外部的精囊和附加前前列腺叶不损害其他组织或穿刺精囊, 执行成功的前列腺内注射30µL 细胞悬浮无渗漏, 适当收集任何渗漏物, 防止整个腹部的非原位肿瘤发展。前列腺内注射的主要局限性是达到最小化小鼠肿瘤变异性所需的技术技能。这是特别重要的建模 CRPC, 这是增加的变量的手术阉割。prostatically 内注射和去势小鼠也必须密切跟踪恢复和不良事件, 因为他们已经经历了两个主要的生存手术。另一个限制是前列腺内注射的时间。这可以减少到最低20分钟, 和外科医生助理可以准备下一只老鼠, 因为目前的鼠标正在缝合。最后, 原位 c-myc 帽肿瘤是侵袭性的, 快速生长的肿瘤, 达到生存终点约46天 (和早在35天) 由于原发肿瘤肿块。需要较慢的肿瘤发展或长期治疗的研究应进行经验优化的初始注射细胞计数和治疗方案。与该肿瘤和宝石的局限性相比, 原位肿瘤模型的所有上述局限性都可以克服, 并且可以根据个体的实验需要对该协议进行额外的修改。
由于原位肿瘤模型涉及使用体外处理细胞, 这些细胞可以根据研究的需要进行修改。在这里, 我们修改这些细胞, 以稳定地表达荧光素酶和 mCherry 为体内肿瘤监测。我们还进行了 CRISPR-Cas9 的肿瘤抑制因子PTEN, 以产生一个更积极, 临床相关的细胞系, 增长更快的原位肿瘤 (手稿在审查)。由于原位肿瘤模型的优点, 研究雄激素依赖性前列腺癌和 CRPC 的能力, 以及表达成像方式或击倒或过度表达 tshr 选择基因的潜力, 这个协议作为一个宝贵的资源, 为所有前列腺癌的研究。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了国家卫生研究所的支持, Praveen Thumbikat (NIDDK R01 DK094898), Sarki Abdulkadir (美国癌症 R01 CA167966, R01 CA123484, P50 CA180995) 和乔纳森安克 (美国的 F30 CA203472)。
材料
| Name | Company | Catalog Number | Comments |
| Myc-CaP cell line | ATCC | CRL-3255 | Verify as mycoplasma-free before use |
| Micro-dissecting scissors | Roboz | RS-5910 | |
| Graege forceps | Roboz | RS-5135 | |
| Graefe tissue forceps | Roboz | RS-5150 | |
| Olsen-Hegar needle holder with suture cutters | FST | 12002-12 | |
| 50 µL Syringe 705 RN SYR | Hamilton | 7637-01 | Sterilize by ethylene oxide gas |
| 28-gauge Needles Small Hub RN | Hamilton | 7803-02 | Point style 4, Angle 45°, Length 0.75 in. Sterilized by ethylene oxide gas |
| RPMI | Gibco | 18875-093 | |
| FBS | Gibco | 10437-028 | |
| Pencillin/Streptomycin | Gibco | 15140-122 | |
| PBS | Gibco | 14190-144 | |
| 0.25% trypsin-EDTA | Gibco | 25200-056 | |
| Matrigel basement membrane matrix, phenol red-free, LDEV-free | Corning | 356237 | Thaw on ice in 4°C overnight before use |
| Isoflurane | Henry Schein | 11695-0500-2 | Acquired from Northwestern University Center for Comparative Medicine (CCM) |
| 26 5/8-gauge syringe | BD | 309597 | For meloxicam and buprenorphine injections |
| Buprenorphine hyrochloride 0.3 mg/mL | 12496-0757-5 | Controlled substance, acquired from Northwestern University CCM | |
| Ophthalmic ointment lubrication | Akron | 17478-162-35 | |
| Betadine surgical scrub (povidone-iodine, 7.5%) | Purdue Products | 67618-151-16 | |
| Sterile non-adhering pads | Moore Medical | 10775 | |
| Sterile alcohol wipes | Fisher Scientific | 22-363-750 | |
| Surgical microscope Stemi DV4 | Zeiss | ||
| Sterile polyester tipped applicators | Puritan | 25-806 1PD | |
| 5-0 vicryl absorbable reverse cutting needle sutures | eSutures | J493G | |
| 4-0 nylon monfilament non-absorbable reverse cutting needle sutures | eSutures | 699H | |
| Glass bead sterilizer | Fine Science Tools | 18000-45 | |
| Sterile saline 0.9% sodium chloride | Hospira | 0409-4888-02 | |
| Meloxicam (Eloxiject) 5 mg/mL | Henry Schein | 11695-6925-1 | Acquired from Northwestern University CCM |
| D-luciferin Firefly, sodium salt monohydrate | Goldbio | LUCNA | |
| IVIS Spectrum Imaging System | PerkinElmer | ||
| Cauery surgical pen | Bovie Medical Corporation | AA01 | |
| CD3ε antibody (clone 2GV6) | Ventana | 790-4341 | |
| Caliper | Fisher Scientific | 14-648-17 | |
| Androgen receptor antibody | Thermo Scientific | RB-9030-P1 | 1:500 staining dilution |
| Synaptophysin antibody (clone Z66) | Life Technologies | 18-0130 | 1:200 staining dilution |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer Statistics, 2017. CA-Cancer J Clin. 67 (1), 7-30 (2017).
- Alemozaffar, M., et al. Prediction of erectile function following treatment for prostate cancer. JAMA. 306 (11), 1205-1214 (2011).
- Alibhai, S. M., et al. 30-day mortality and major complications after radical prostatectomy: influence of age and comorbidity. J Natl Cancer I. 97 (20), 1525-1532 (2005).
- Chen, R. C., Clark, J. A., Talcott, J. A. Individualizing quality-of-life outcomes reporting: how localized prostate cancer treatments affect patients with different levels of baseline urinary, bowel, and sexual function. J Clin Oncol. 27 (24), 3916-3922 (2009).
- Kohutek, Z. A., et al. Long-Term Impact of Androgen-Deprivation Therapy on Cardiovascular Morbidity after Radiotherapy for Clinically Localized Prostate Cancer. Urology. , (2015).
- Murray, L., et al. Second primary cancers after radiation for prostate cancer: a systematic review of the clinical data and impact of treatment technique. Radiother Oncol. 110 (2), 213-228 (2014).
- Resnick, M. J., et al. Long-term functional outcomes after treatment for localized prostate cancer. N Engl J Med. 368 (5), 436-445 (2013).
- Shahinian, V. B., Kuo, Y. F., Freeman, J., Goodwin, J. S. Risk of fracture after androgen deprivation for prostate cancer. New Engl J Med. 352 (2), 154-164 (2005).
- Wilke, D. R., et al. Testosterone and erectile function recovery after radiotherapy and long-term androgen deprivation with luteinizing hormone-releasing hormone agonists. BJU Int. 97 (5), 963-968 (2006).
- Zhao, J., et al. Androgen deprivation therapy for prostate cancer is associated with cardiovascular morbidity and mortality: a meta-analysis of population-based observational studies. PLoS One. 9 (9), e107516 (2014).
- Berthold, D. R., et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer: updated survival in the TAX 327 study. J Clin Oncol. 26 (2), 242-245 (2008).
- Bono, J. S., et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet. 376 (9747), 1147-1154 (2010).
- Fizazi, K., et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol. 13 (10), 983-992 (2012).
- Kantoff, P. W., et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. New Engl J Med. 363 (5), 411-422 (2010).
- Parker, C., et al. Alpha emitter radium-223 and survival in metastatic prostate cancer. New Engl J Med. 369 (3), 213-223 (2013).
- Rathkopf, D. E., et al. Updated Interim Efficacy Analysis and Long-term Safety of Abiraterone Acetate in Metastatic Castration-resistant Prostate Cancer Patients Without Prior Chemotherapy (COU-AA-302). Eur Urol. 66 (5), 815-825 (2014).
- Scher, H. I., et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. New Engl J Med. 367 (13), 1187-1197 (2012).
- Field, S. B., et al. Differences in vascular response between primary and transplanted tumours. Brit J Cancer. 63 (5), 723-726 (1991).
- Cowen, S. E., Bibby, M. C., Double, J. A. Characterisation of the vasculature within a murine adenocarcinoma growing in different sites to evaluate the potential of vascular therapies. Acta Oncol. 34 (3), 357-360 (1995).
- Kuo, T. H., et al. Site-specific chemosensitivity of human small-cell lung carcinoma growing orthotopically compared to subcutaneously in SCID mice: the importance of orthotopic models to obtain relevant drug evaluation data. Anticancer Res. 13 (3), 627-630 (1993).
- Fidler, I. J., et al. Modulation of tumor cell response to chemotherapy by the organ environment. Cancer Meta Rev. 13 (2), 209-222 (1994).
- Wilmanns, C., et al. Modulation of Doxorubicin sensitivity and level of p-glycoprotein expression in human colon-carcinoma cells by ectopic and orthotopic environments in nude-mice. Int J Oncol. 3 (3), 413-422 (1993).
- Fidler, I. J. Orthotopic implantation of human colon carcinomas into nude mice provides a valuable model for the biology and therapy of metastasis. Cancer Meta Rev. 10 (3), 229-243 (1991).
- Kwon, E. D., et al. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol. 15 (7), 700-712 (2014).
- Topalian, S. L., et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. New Engl J Med. 366 (26), 2443-2454 (2012).
- Pasqualini, R., Ruoslahti, E. Organ targeting in vivo using phage display peptide libraries. Nature. 380 (6572), 364-366 (1996).
- Conway, E. M., Carmeliet, P. The diversity of endothelial cells: a challenge for therapeutic angiogenesis. Genome Biol. 5 (2), 207 (2004).
- Loi, M., et al. The use of the orthotopic model to validate antivascular therapies for cancer. Int J Dev Biol. 55 (4-5), 547-555 (2011).
- Bianchi-Frias, D., Hernandez, S. A., Coleman, R., Wu, H., Nelson, P. S. The landscape of somatic chromosomal copy number aberrations in GEM models of prostate carcinoma. Mol Cancer Res. 13 (2), 339-347 (2015).
- Pan, Y., et al. Characterization of chromosomal abnormalities in prostate cancer cell lines by spectral karyotyping. Cytogenet Cell Genet. 87 (3-4), 225-232 (1999).
- Wang, J., et al. Pim1 kinase synergizes with c-MYC to induce advanced prostate carcinoma. Oncogene. 29 (17), 2477-2487 (2010).
- Watson, P. A., et al. Context-dependent hormone-refractory progression revealed through characterization of a novel murine prostate cancer cell line. Cancer Res. 65 (24), 11565-11571 (2005).
- Ellis, L., Lehet, K., Ramakrishnan, S., Adelaiye, R., Pili, R. Development of a castrate resistant transplant tumor model of prostate cancer. Prostate. 72 (6), 587-591 (2012).
- Nunez-Cruz, S., Connolly, D. C., Scholler, N. An orthotopic model of serous ovarian cancer in immunocompetent mice for in vivo tumor imaging and monitoring of tumor immune responses. J Vis Exp. (45), (2010).
- Lim, E., Modi, K. D., Kim, J. In vivo bioluminescent imaging of mammary tumors using IVIS spectrum. J Vis Exp. (26), (2009).
- Ellis, L., Lehet, K., Ku, S., Azabdaftari, G., Pili, R. Generation of a syngeneic orthotopic transplant model of prostate cancer metastasis. Oncoscience. 1 (10), 609-613 (2014).
- Wallace, J. Humane endpoints and cancer research. ILAR J. 41 (2), 87-93 (2000).
- Valkenburg, K. C., Amend, S. R., Pienta, K. J. Murine Prostate Micro-dissection and Surgical Castration. J Vis Exp. (111), (2016).
- Koh, C. M., et al. MYC and Prostate Cancer. Genes Cancer. 1 (6), 617-628 (2010).
- Shappell, S. B., et al. Prostate pathology of genetically engineered mice: definitions and classification. The consensus report from the Bar Harbor meeting of the Mouse Models of Human Cancer Consortium Prostate Pathology Committee. Cancer Res. 64 (6), 2270-2305 (2004).
- McNeal, J. E., Redwine, E. A., Freiha, F. S., Stamey, T. A. Zonal distribution of prostatic adenocarcinoma. Correlation with histologic pattern and direction of spread. Am J Surg Pathol. 12 (12), 897-906 (1988).
- Price, D. Comparative Aspects of Development and Structure in the Prostate. Natl Cancer I Monogr. 12, 1-27 (1963).
- Roy-Burman, P., Wu, H., Powell, W. C., Hagenkord, J., Cohen, M. B. Genetically defined mouse models that mimic natural aspects of human prostate cancer development. Endocr-Relat Cancer. 11 (2), 225-254 (2004).
- Berquin, I. M., Min, Y., Wu, R., Wu, H., Chen, Y. Q. Expression signature of the mouse prostate. J Biol Chem. 280 (43), 36442-36451 (2005).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。