Method Article
一种新型生物反应器为不同的微生物群落的高密度栽培
摘要
A novel reactor design, coined a high density bioreactor (HDBR), is presented for the cultivation and study of high density microbial communities. Here, the HDBR is successfully applied in a photobioreactor (PBR) configuration for the study of nitrogen metabolism by a mixed high density algal community.
摘要
A novel reactor design, coined a high density bioreactor (HDBR), is presented for the cultivation and study of high density microbial communities. Past studies have evaluated the performance of the reactor for the removal of COD1 and nitrogen species2-4 by heterotrophic and chemoautotrophic bacteria, respectively. The HDBR design eliminates the requirement for external flocculation/sedimentation processes while still yielding effluent containing low suspended solids. In this study, the HDBR is applied as a photobioreactor (PBR) in order to characterize the nitrogen removal characteristics of an algae-based photosynthetic microbial community. As previously reported for this HDBR design, a stable biomass zone was established with a clear delineation between the biologically active portion of the reactor and the recycling reactor fluid, which resulted in a low suspended solid effluent. The algal community in the HDBR was observed to remove 18.4% of total nitrogen species in the influent. Varying NH4+ and NO3- concentrations in the feed did not have an effect on NH4+ removal (n=44, p=0.993 and n=44, p=0.610 respectively) while NH4+ feed concentration was found to be negatively related with NO3- removal (n=44, p=0.000) and NO3- feed concentration was found to be positively correlated with NO3- removal (n=44, p=0.000). Consistent removal of NH4+, combined with the accumulation of oxidized nitrogen species at high NH4+ fluxes indicates the presence of ammonia- and nitrite-oxidizing bacteria within the microbial community.
引言
城市废水通常治疗活性污泥法中,以减少悬浮固体(SS),生物需氧量(BOD),有机和无机氮和磷含量5,6。活性污泥处理,二次处理废水的装置,工作需要在一个曝气池填充有传入的废水和再循环的异养微生物的混合液的有机碳的氧化(通常称为活性污泥)5-7。该混合液,然后进入一个相当大的澄清器(沉淀池)其中污泥沉降更容易收集,要么被布置或再循环回到曝气池,而澄清,处理后的废水可以继续三级处理或消毒被释放到前受纳水体5-7。在辅助净化器的处理过的废水和固体(污泥)的高效分离为一个是正确功能所必需tewater处理系统,因为任何活性污泥不断超越澄清会增加废水5-8 BOD和SS。
对于二级处理的废水,其减少或消除需要大澄清罐,包括附装生长(生物膜)的反应器,膜生物反应器(MBR)的,与颗粒污泥的反应器有许多替代生物过程存在。在生物膜反应器中,形成生物膜,其中土壤微生物天然骨料和附上作为层在固体表面上,允许生物量保留和积累,而不需要一个澄清槽。生物膜反应器可分为三种类型:填充床反应器,流化床反应器,和生物转盘。填充床反应器,诸如滴滤器和生物塔,利用一个固定的固体生长表面5,6。流化床反应器(快堆)依赖于微生物的附着于颗粒,如砂,粒状活性炭(GAC),或玻璃珠,其通过高向上流速9,10保持悬浮状态。旋转生物反应器依赖于形成在安装于旋转轴媒体允许生物膜的生物膜被交替地暴露于空气和液体被治疗5,6。膜生物反应器使用的膜过滤单元,无论是在生物反应器(浸没配置)或经由再循环(侧流配置)5,11外部。该膜用于实现生物质和固体颗粒从处理后的液体11,12良好的分离。颗粒污泥反应器是上流式反应器中,速度13微生物极为致密,沉降颗粒的形成发生时,他们暴露在高肤浅的空气向上流动。
作为另一替代活性污泥法,一种新型的上流式反应器系统,现在被称为高密度生物反应器(卧床),为designeD和通过销售和Shieh(2006)建研究COD去除率由活性污泥从在低F / M条件合成废物流是已知会引起的沉降污泥差形成(即,膨胀污泥)1,7,14。所利用的卧床系统改性流化床反应器中,通常由一个上流式反应器和一个外部再循环罐的。流化床反应器一般操作与再循环流的流速足够高以保持生物膜生长基质悬浮但足够低以使生物膜覆盖的衬底被保留。不像流化床反应器中,卧床描述在销售和Shieh(2006)中使用相对低的循环物流的流速其中,随着外部通气,防止了反应器1内形成的生物量区的中断。随后的研究证明了这一点反应堆设计的能力,使用硝化/反硝化细菌3,4成功治疗了一系列的氮通量。在所有的螺栓IES的卧床内的稳定,生物质致密区的形成不再需要外部絮凝/沉淀工艺1-4。
正如我们在这里报告,使用卧床的生长致密培养物也已在光生物反应器(PBR)配置为藻类的培养试验。我们讨论的好处和这种新颖的反应器系统的藻类培养缺点及其潜在用于克服大的障碍与生物质收获(即,良好的固-液分离15,16)相关联的藻类生物燃料的商业化。以下协议描述了安装,启动,来自样品,并保持与藻类感兴趣的微生物群落的卧床所需的步骤。在异养和硝化/反硝化文化的启动和运行方案的变化也将被提及。最后,一般的优点,缺点,以及这种新型反应器设计未知数将突出显示。
研究方案
1.反应器组件
- 根据图 1中的示意性安排的反应器组成。
- 放置反应器(R)上的混合板,一个搅拌棒加入到反应器中。放置再循环罐(RT)的搅拌盘和反应器的旁边,以使罐的流出物(顶部)端口被引向实验室工作台的边缘。
- 将废液容器(W)再循环罐(RT)的流出物(顶部)端口下面。放置进料罐(FT)旁边的再循环罐(RT)。
注:料罐为5 L.总容量
- 固定反应器(R)抗倾倒用适当大小的支架和夹具。同样地,固定再循环罐(RT)以防止移动。
- 将氯丁橡胶蠕动泵管中循环(泵A)和饲料(泵B)泵头。请参阅材料表附加管道规格。安装泵头在泵驱动用螺钉proviDED与泵的驱动器。
- 泵A的管连接到反应器,并再循环罐的端口。插入泵B的管的端部进料罐和再循环罐。顶部反应器端口连接到循环罐与管道。适用夹具到管道在反应器端口。
注:光合社区可能从灯提供人工照明中受益。
2.制备储备溶液,进水/进料溶液和藻类孕育剂
- 制备矿物原液。以下添加到1L的量瓶中,用500ml去离子水:200克碳酸氢钠,40个克磷酸二氢钾,4克硫酸镁,4克氯化铁,4克氯化钙,1克氯化铜,1克钴六水氯化,1克氯化镍六水合物,1克硫酸锌七水合物。添加额外的400ml去离子水。涡流有力地促进盐溶解。继迪斯盐的olution,加去离子水使溶液的总体积达到1L。
- 制备氨原液。在1L容量瓶中,溶解38.214克氯化铵在约900毫升去离子水。溶解后,加去离子水使总体积达1000毫升
注:1 ml储备溶液稀释至1升产生一个10毫克的L -1 铵态氮溶液。 - 制备硝酸盐原液。在1L容量瓶中,溶解72.413克硝酸钾在约900毫升去离子水。溶解后,加去离子水使总体积达1000毫升
注:1 ml储备溶液稀释至1升产生一个10毫克的L -1 NO 3 - -N溶液。 - 准备饲料/进水的解决方案。为了使含有20毫克的L原料溶液-1 NH 4 + -N和20毫克的L -1 NO 3 - -N,稀释加入2mlmmonia原液和2ml硝酸原液至1L总体积。在稀释之前,添加0.5 ml的矿物溶液/ L的溶液正在取得。制备5升进水中总启动反应器中。
- 准备藻类接种。
- 收集的水的大体积(至少10升)从含藻类水体如河流或池塘。允许藻类留下不受干扰24小时的水样沉降。
- 倒出并丢弃清晰(非藻类含有)水在样品的顶部,样品瓶内留下浓缩的藻类悬浮液。组合来自所有样品的藻类悬浮液到一个容器中,并重复所述沉降和倾析的步骤。
- 测量所述浓缩试样中的生物量。
- 干纸真空过滤器(0.45微米MCE真空过滤器)和铝称量船O / N中已设置为103℃后,在干燥器降温为在室温30分钟测量共同的烘箱mbined过滤器的质量和重量的船。
- 真空过滤器20毫升浓藻液,并返回过滤器和权衡船烤箱烘干O / N。
- 测量过滤器的组合质量和称重舟。计算出浓缩的样品中生物量密度。
注:水样的总体积,调查将需要收集将取决于水源水体。
3.播种并启动反应堆
- 加将750ml进料溶液到反应器中。填再循环罐用500ml进料溶液。
- 使用长吸管轻轻添加包含反应器的底部附近1.5克藻类的接种悬浮液。允许接种物沉降到反应器的底部,确保此通过目视观察,进行到下一步骤之前。
- 一旦细胞已经解决,除去管夹,打开泵A以缓慢的流速(10革命ns(最小值)-1 /38毫升分钟-1)。空气截留在管道将被排出到反应器中。
注:加入750毫升反应器将阻止由泵干扰的任何生物量从离开反应器。挤压管,以确保所有的空气被排出。 - 逐渐进料溶液添加到再循环罐作为溶液泵入反应器。继续加入直到反应器和再循环罐是在容量和流出物开始退出经由顶部端口再循环罐。
注:进料溶液的体积要添加到再循环罐将随加入到反应器中的接种物的体积。 - 倒入剩余进料溶液到进料罐中。
- 设置循环泵(泵A)以19转分钟-1,建立72.5毫升分钟的回流量-1。观察藻类开始从反应器底部到放样。使用在反应器的灰度等级,确定藻类双向omass区域高度。确保高度是在进行到下一步之前,恒定。
- 打开混合板在非常低的速度;的1或2的设定是适当的启动。混合棒将有助于进一步放样生物量,但攻击性的混合会导致藻类离开反应器,进入再循环罐,和在流出物离开。设定搅拌速度在建立在反应器(图2A)内的一个明确的藻类边界所需的设置;藻类生物量区应在高度约10-15厘米。
- 观察藻插头和反应器流体之间的边界清楚后开始进料泵。设置泵25转分钟-1,确立为1.5ml min的流速-1。观察反应器中的流体出口的流出物端口由于重力和位移引起的传入流入流。
4.样品采集和分析
- 开展样品采集活动PRI或在反应器系统上执行维护。每天收集20毫升污水和进水样品。收集流出物试样从循环槽内。直接从进料罐收集流入样品。
- 真空过滤样品以去除悬浮之前存储和分析的固体。
- 存储的进水和出水样品在-20°C,直到进一步的分析。限制冻融循环样品进行的数量。如果需要的话,可将样品分成等分部分,以保持样品的完整性。
- 进行样品分析,硝酸盐,亚硝酸盐和氨使用标准技术17。
注意:利用离子色谱法(IC)的作者,以产生本文中所呈现的结果。请参阅材料表规范。
结果
该卧床被用于培养藻类超过进水氨和硝酸盐浓度的几种比例,同时保持在饲料中总含氮量在40毫克-NL -1。进水和出水样品的日常拍摄;生物质密度取样在各条件的开始和结束。在反应器的平均时间为3-5天达到稳态平衡条件改变之后。在宽范围的条件下流入一个独特的生物量区成立,所观察到的以前的研究( 图2)。在卧床的藻类培养中发现,除去平均总氮品种的18.4%的饲料(N = 44)研究。内的生物量区,总藻类生物量和生物量密度分别移到该研究过程中保持一致。
NH 4 +和NO 3的去除-绘制对NH 4 +和NO 3 - FE在图编组合物3。一个简单的线性回归模型被用来评估去除氮物质和所述饲料组合物18-20之间的关系的重要意义。处观察到的 NH 4 +和 NO 3的所有范围除去氨-组合物(图3A和图3B,分别)。无论是NH 4 +也不NO 3 -饲料成分影响了测试(N = 44,P = 0.993和n = 44,P = 0.610分别)的条件下除去NH 4 +的。另一方面,除去NO 3 -被认为是负的NH 4 +饲料组合物相关的(N = 44,P = 0.000)(图3C)和与NO 3正多样-进料组合物(44例,第= 0.000)(图3D)。
NO 3 - ,观察到累加(negatIVE去除)在反应器内的大部分流入组合物的(34选自44个样品)。 NO 3 -的去除仅观察到NH + 4进料浓度低于10mg -NL -1和NO 3 -的进料浓度均高于15毫克-NL -1。氧,这是正在通过曝气在外部再循环罐和由藻类加入反应器中,可以作为氨和亚硝酸氧化细菌(AOB和NOB,分别地)电子受体。如果有氧条件经由高的再循环流速在反应器内占据主导地位,细菌,可进行异化(异)反硝化将倾向于利用氧作为电子受体4。如果NO 3的速率-生产和输入从进料超过同化的编号为3的转换-有机氮或异化脱氮,NO 3 -可以accumula德反应器中。 NH + 4的除去NO 3和积累-表明AOB和NOB是在社区内本和活性藻类并不已知催化NH + 4的转化为NO 3 - 。这些结果表明,使用该反应器系统来研究氮气流的动态和动力学在混合藻类细菌群落的能力。
作者们成功地保持在这些HDBRs健康藻类群落一年多了。两个反应器崩溃,但是,自从这个项目开始出现,既是对严重改变进水组成的结果。第一个是氮物种比值的变化的结果与总氮磁通保持恒定; NH + 4是从进料消除和NO 3 -的浓度增加,以补偿。第二次坠机事件发生的cuttin的结果克由75%的总氮光通量,从40毫克-NL -1至10mg -NL -1(图4)。在两种情况下,生物量不同区域边界观察恶化超过两到三天用(图4)的急剧增加的悬浮固体中的流出物一致的过程。流出物悬浮固体的进料改变为反应器生物量损失(图4)后增加到最大值6天。崩溃悬浮后流出物中的固体仍然很高(约0.22克的SS L-1),并没有新的生物质被观察到积聚在反应器内,以防止在实验的继续。当前设计缺乏保留文化,如果他们不保持良好的絮凝的安全机构。

图1.原理图高密度生物反应器(卧床)(试验时o标)的反应器(R)是由的1000ml量筒与安装在100 ml的端口(软管倒钩,外径3/8")和1000 ml的水平。反应器的流体通过所述反应器使用蠕动泵循环甲(PA),进入在反应器的底部,并穿过生物量区(BZ)朝向顶部端口向上流动。流体离开反应器的顶部端口和被引导至再循环罐(RT)在重力作用下的逆转录是由600毫升玻璃烧杯中;它已经安装了两个端口,一个位于烧杯底部,另一个在500毫升标记反应器流体经由底部端口(和PA)返回到反应器流出物的叶子。通过对RT的顶部端口和反应器收集在废物容器(W)。扩散曝气设置在RT与使用一个曝气装置(A)的。曝气过程还驱动内的MV。蠕动泵B混合(PB)由含罐进料/进水(FT)至RT提供进水。 点击此处查看该图的放大版本。

图生物质/反应器流体分离的内高密度生物反应器(卧床)2.例子。图A显示了一个高密度的藻类群落(2.83克SS L-1)的头低位卧床中被培养。当光合微生物群落的沉降速度超过了反应器流体发生一个明显的界限。 B组显示由活性污泥在销售和Shieh(2006)1所讨论的循环条件下形成的微生物矩阵。图C显示酵母是对乙醇发酵,通过生产由葡萄糖的进水培养的(结果未公布)。在所有这三个反应器配置的新型反应器设计有eliminat编辑需要在反应器系统的独立澄清或沉淀的过程。 请点击此处查看该图的放大版本。
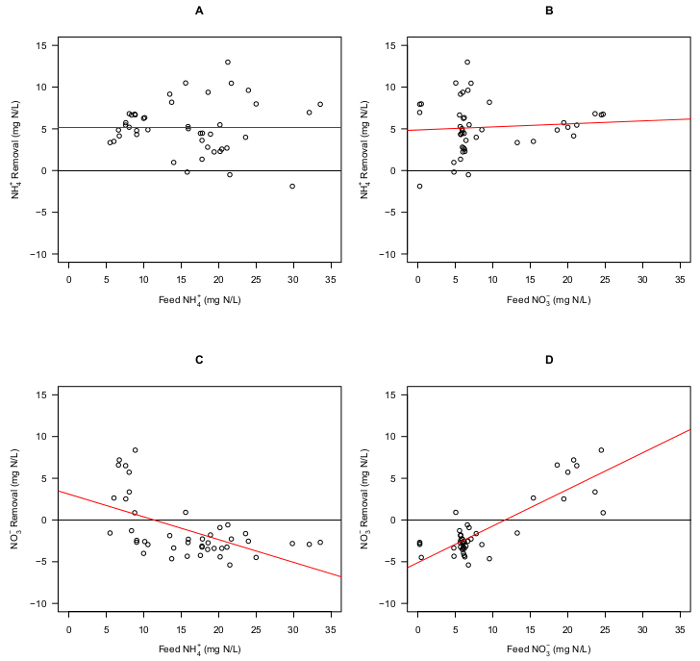
图3 图示的 NH 4 +和NO 3 -的 。去除率随进水组合物进水N浓度总保持在40毫克-NL -1在研究的持续时间。 (A)NH 4 +进料浓度绘制在去除NH 4 +的;没有显著影响(N = 44,P = 0.993)。 ( 二)NO 3 -进料浓度绘制在去除NH 4 +的;没有显著影响(N = 44,P = 0.610)。( 三)NO 3 -去除被认为是显著和负相关,NH 4 +进料浓度(N = 44,P = 0.000)。 (D)NO 3 -的去除显著正相关NO 3 -进料浓度(N = 44,P = 0.000)。请点击此处查看该图的放大版本 ,请点击这里查看这是一个更大的版本数字。

图4.在响应提高流出物的悬浮固体,以通过反应器显著降低氮气通量。进水氮含量从40毫克-NL下降-1至 2天之后,观察10毫克-NL -1(在0时间在该图中,也表示为垂直线)恶化的不同生物量区 。; 3天后生物量损失是很容易观察到。几天后,出水SS一个显著的增加,观察变化的颁布和6天后发生的最大出水SS后。 请点击此处查看该图的放大版本。

图5. 显微照片突出多孔絮结构和互锁丝状菌。两张显微照片显示出由异养细菌(活性污泥)所形成的多孔结构。丝状菌弥合絮凝物之间的空间,在该稳定的生物质区域联锁絮凝物。HREF ="https://www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/53443/53443fig5large.jpg"目标="_空白">点击此处查看该图的放大版本。
讨论
本节将首先解决可能的操作问题,以及使用不同的微生物群落所需要的协议变化的讨论。这种反应器设计的优点将讨论的,包括以管理控制氧通量的和在反应器内形成的高密度的絮凝物的能力。目前的挑战和调查可能的途径也将被提及。
协议的细微差别和变化
HDBRs种植不同类型的文化中的操作需要运营协议的微小变化,这取决于被调查的物种。充分的混合和扩展藻类生物量的区域是必要的,以增加所有絮凝物暴露于光,使光合作用。悬浮液在反应器内的藻类生物质是由反应器再循环率和混合杆速度的组合来驱动。应注意在选择的操作特性两者,使得存在的生物活性藻类生物体区和端口在反应器的顶部之间有足够的距离,如任何生物质离开该反应器容器可以通过再循环罐的顶部端口丢失在流出物中。如果生物量是观察留在流出物中,过滤器可以安装在再循环罐的顶部端口。的玻璃棉垫可作为一个过滤器。作为过滤累积生物量,将需要改变。如果一个过滤器时,悬浮物的样品必须取自过滤器下游除了再循环罐中以获得正确的质量平衡在反应器的流体;在过滤器中堆积的生物量,也必须考虑。根据与藻类和酵母的一些操作条件下,生物质区域不总是导致澄清的液体,即使在社区是健康的。在这些情况下,有显着的细胞上面的生物量区和再循环罐中的稀释悬浮液。我们hypothesizê,在已种植在卧床的藻类和酵母社区迄今不含有丝状菌为稳定的,联锁的生物量区在异养和硝化/反硝化细菌培养物(图5)所示。因此,如果目标是阻止细胞逃逸在流出物中,如与藻类和酵母的情况下,可能有必要在出水口使用的膜或过滤装置。
生物质干扰的意外源,它可以在卧床的固 - 液分离产生不利影响,是循环泵的输送管内的气泡的积累。这些气泡是曝气在再循环罐的产物。应注意,定期清除管内气体的任何累积。挤在流体流动的方向上的管道将加速这一过程,并还用于去除已成为固定到管的内部任何生物质。随着细胞在这些培养倾向于聚集成絮凝物,它们也从生物质释放区粘附和移的卧床的壁时有一种倾向。因此,如果调查发现生物量的粘附到反应器,并再循环罐的内壁上,就应该使用吸液管或消毒玻璃器皿刷干扰,并防止在反应器的壁上过度生物膜生长。
异时,微生物或硝化/反硝化细菌是感兴趣的社区上面描述的协议必须被修改。例如,4克异养微生物(测量为VSS),被用于接种的反应器中,所描述的销售和Shieh 1。在研究的氨和亚硝酸氧化细菌,2克富集的AOB / NOB被用作在附录中在Nootong和Shieh 2和Ramanathan等人 4所描述,并扩大在该手稿21。接种物的确切量以启动反应器可以变化,真正取决于可用的源接种物和反应器的实际体积的所用的量。为了防止生物质的干扰,用搅拌棒是使用这些垫形成的文化的时候气馁。
水力特性操纵
的卧床设计的主要优点是,以控制进料和再循环流率的彼此独立的能力。调查人员可以针对特定的负荷率,回收率,或回收比率。例如,在研究反应器性能利用活性污泥从合成废水取出的COD,循环比从3.5-21.5 1变化。利用自养硝化反应器中的最初的研究/反硝化细菌表明稳定的生物质的区域可以保持下的2.5-24.3 3的循环比。这些估算表明增加循环RA时要保守,没有遇到任何问题TIOS高达43在随访研究21。在高的循环比工作的能力,并且因此高的再循环率,是研究对于生物质区的稳定性和特性流体剪切的影响是有用的。在某些情况下,如藻类培养,建立和维持生物质的基质不作要求和高的再循环率和所需的比率,以协助藻列的悬浮液中。该反应器的设计是能够促进悬浮液通过高的再循环率(在本研究中49.3),辅助条件是调查人员都能够保持在反应器内的不同的生物质/流出接口。在情况下,再循环比率高,整个卧床系统的反应器中的水力特性表现得更类似于完全混合反应器(CMFR)比活塞流反应器(PFR),并因此允许研究者检查培养过的液压的频谱混合特性在单一系统中的循环流速一LSO起着助熔剂,传质,并在整个反应器中溶解的气态物质的分布的作用,如下所述。
从控制O 2通量和脱气在循环罐
在研究结合硝化/反硝化处理,溶解氧浓度,观察到很快耗尽的活性生物量区的最低部分为硝化进行2-4,并联以前COD去除率研究1;这可能表明,生物质流内的流动状态类似于一个PFR 1。与上生物量区变得缺氧,反硝化进行,导致从反应器流出2,3除去溶解的氮气。这些观察表明,外部曝气在再循环罐,并结合,以控制氧向上流罐的通量的能力相结合,通过操纵再循环的率,允许的氧梯度内絮凝物,并沿着生物质区的长度开发,允许需氧,厌氧和缺氧反应发生在一个单一的槽。由于许多反应进行生物处理依赖于或者氧被抑制,这种反应器允许一个更简单的方法来控制氧气质量速率为生物反应器;有可能实现更高效的通风措施。由于曝气污水处理能量最高成本之一,这可能有助于降低对各市22,23运营成本。
通过一个反应器的氧通量的控制,不仅是异养和化能自养细菌一个关注的问题。过量激发能量(EEE)是盈余的光能藻细胞暴露于和结果在氧(O 2)被减少到超氧(O 2 - )与来自光系统I或II(PSI和PSII)24分流过量的电子。超氧阴离子可引起significan牛逼的生理损伤藻系统。蜂窝框架的存在是为了检测和消除的 O 2 -前损坏,可能会发生细胞成分,但在高应力细胞活性氧(ROS)的仍可以形成24-28。通过控制循环率和在再循环罐的通气性,调查人员可能能够解决从过量氧和毒性它可以在藻类培养物诱导所产生的问题,并且可以进一步提高藻类的高密度培养物的生长,特别是在例其中辅助光被通过使用灯提供。
絮凝物和/或生物量区的形成导致多样的宏观和微观环境
其中一个这样的反应堆设计最独特的功能是消除一个澄清槽。我们假设一个在HDBRs取得的良好的固液分离可以归因于任何形成的高密度的絮凝物(即情况下与藻类),或形成絮凝物互锁和长丝状微生物(即稳定的,多孔基质的,与异养和硝化/反硝化培养物)1-4,7,16(图5)。絮体的形成和稳定性依赖于数量的物理,化学和生物因素7,13,29-31。事实上,絮凝物的形成是启动的首要目标,并取决于充分的混合(剪切力梯度)增加之间的悬浮孕育剂13,30也对产生化合物(絮凝剂公凝聚微生物的存在碰撞),允许细胞凝集31,32。在这些实验室规模的反应器中,我们已发现,充分混合进行絮凝可以实现或者由上流速度分布或混合装置,例如搅拌棒,位于反应器的底部。对于需要氧气文化,到外部再循环罐可以bË用作外部气体转移罐(无论是进行曝气或汽提气体,例如用于除去由光合作用反应产生的氧)。外部曝气的好处是它可以防止过量的混合以及气泡进入与絮凝物接触和破他们分开。在一些情况下,与形成了稳定的,多孔基质,当发现气泡进入反应器能找到破开的矩阵的部分或成为基质的部分内夹带导致它们的异养和硝化/反硝化培养浮到反应器的顶部。因此,外部气体转移罐的操作,以防止气泡通过循环管线进入反应器的关键是保持系统的良好固 - 液分离。
潜在的卧床方向
台式反应器研究,特别是那些集中PBRS,往往集中朝向收集动力学数据为特定的微BIAL种或社区1,3,4,33,34。历史上许多研究都在无菌或抗菌处理的藻类物质尽管对藻类和细菌群落35,36之间的种间相互作用的重要性,越来越多的证据做。混合培养的研究承诺以获得关于这些物种间的关系是如何工作的35-38新的和有见地的结论。混合培养的最近的研究已经扩大到包括与分子生物学工具,例如定量聚合酶链式反应(qPCR的)量化藻类和细菌生长速率33,34取样分析。宏基因组和metatranscriptomic分析已用来阐明如何藻类和细菌在两个工程化和自然生态系统39,40相互作用的进一步资料。除了在HDBRs的微生物培养物的分子生物学研究,显微镜研究检查的规模,结构和组织的絮凝物和的多孔生物基质生物区将提供促进良好的固液分离HDBRs能力,有价值的信息。
迄今为止,只有小范围的反应器体积和循环比已经使用了卧床的设计研究。这样,在扩大规模的应用反应堆性能是目前未知。每个被测试的反应器系统都小于2升体积和玻璃构成。作为这些反应器都没有现成的部件,必须由一个实验室玻璃器皿专家增加作为起始片必须仔细选择适当的壁厚(私人信件:K。卡拉罗,2014)玻璃反应器的尺寸可以是难以构成。大玻璃器皿也有被破碎或损坏与金属,塑料,混凝土或反应器相比的更高的风险。构建与金属或塑料的台式实验反应堆较大的可能是一种选择,但这种选项的可行性还有待调查。此外吨他使用的不透明或半透明的材料,可能会妨碍视觉观察所研究的反应器中,并会复杂化在一个PBR配置这些反应器的操作。
这份手稿概述了大会,启动和操作程序进行操作的高密度生物反应器(卧床)。以前的工作建立了HDBRs能力,删除这两个COD和利用异养和化能自养菌1-4个氮物种。在这里,作者展示HDBRs的高密度藻类社区的文化和能力,从合成废物流中除去氮物种。以下先前的观察,有稳定的生物质区域是由藻类,并将反应器的成功的操作,而不会澄清工艺形成,同时除去总氮物种从流入的18.4%达到了。氮物种之间的转换(NH + 4为NO 3 - )观察到,允许作者建议的AOB和NOB的存在和活性。从当前示范的该反应器设计为微生物的高密度培养,适用于各种环境和工业应用藻类和使用该卧床系统支持进一步使用之前的研究,以及研究和开发,在该手稿呈现的结果。
披露声明
The authors have nothing to disclose and declare that they have no competing financial interests.
致谢
The authors would like to acknowledge Aspen Walker at the University of Pennsylvania for her assistance in reactor maintenance and sample collection.
材料
| Name | Company | Catalog Number | Comments |
| Aeration stone | Alita | AS-3015C | |
| Aerator | Top Fin | Air-1000 | |
| Ammonium chloride | Sigma Aldrich | A9434 | |
| Anion analysis column | Shodex | IC SI-52 4E | |
| Beaker (600 ml) | Corning Pyrex | 1000-600 | Used as mixing vessel (MV). Addition of hose barbs at the bottom and 500 ml levels. Outside diameter of hose barbs 3/8". |
| Calcium chloride | Sigma Aldrich | C5670 | |
| Cation analysis column | Shodex | IC YS-50 | |
| Cobalt chloride hexahydrate | Sigma Aldrich | C8661 | |
| Copper chloride | Sigma Aldrich | 222011 | |
| Ferric chloride | Sigma Aldrich | 157740 | |
| Filter (vacuum) | Fisherbrand | 09-719-2E | 0.45 μm membrane filter, MCE, 47 mm diameter |
| Graduated cylinder (1,000 ml) | Corning Pyrex | 3025-1L | Used as reactor vessel (R). Addition of hose barbs at bottom, 500 ml, and 1 L levels. Outside diameter of hose barbs 3/8". |
| HPLC/IC | Shimadzu | Prominence | |
| Magnesium sulfate | Sigma Aldrich | M2643 | |
| Masterflex L/S variable speed drive | Masterflex | 07553-50 | Drive for recycle and feed pumps (2 needed) |
| Nickel chloride hexahydrate | Sigma Aldrich | N6136 | |
| Potassium nitrate | Sigma Aldrich | P8291 | |
| (Monobasic) Potassium phosphate | Sigma Aldrich | P5655 | |
| Pump head | Masterflex | 07018-20 | Recycle pump head |
| Pump head | Masterflex | 07013-20 | Feed pump head |
| Pump tubing | Masterflex | 6404-18 | Recycle pump tubing |
| Pump tubing | Masterflex | 6404-13 | Feed pump tubing |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Zinc sulfate heptahydrate | Sigma Aldrich | Z0251 |
参考文献
- Sales, C. M., Shieh, W. K. Performance of an aerobic/anaerobic hybrid bioreactor under the nitrogen deficient and low F/M conditions. Water Res. 40 (7), 1442-1448 (2006).
- Nootong, K. Performance and kinetic evaluations of a novel bioreactor system in the low-oxygen/low-fluid shear reaction environments. , University of Pennsylvania. 3225514(2006).
- Nootong, K., Shieh, W. K. Analysis of an upflow bioreactor system for nitrogen removal via autotrophic nitrification and denitrification. Bioresour Technol. 99 (14), 6292-6298 (2008).
- Ramanathan, G., Sales, C. M., Shieh, W. K. Simultaneous autotrophic denitrification and nitrification in a low-oxygen reaction environment. Water Sci Technol. 70 (4), 729-735 (2014).
- Rittmann, B. E., McCarty, P. L. Environmental Biotechnology: Principles and Applications. , McGraw-Hill Higher Education. (2001).
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. Wastewater Engineering: Treatment and Reuse. , 4th edn, McGraw-Hill Science/Engineering/Math. (2002).
- Palm, J. C., Jenkins, D., Parker, D. S. Relationship between Organic Loading, Dissolved-Oxygen Concentration and Sludge Settleability in the Completely-Mixed Activated-Sludge Process. Journal Water Pollution Control Federation. 52 (10), 2484-2506 (1980).
- Jenkins, D. Towards a Comprehensive Model of Activated-Sludge Bulking and Foaming. Water Science and Technology. 25 (6), 215-230 (1992).
- Shieh, W., Keenan, J. Ch. 5 Advances in Biochemical Engineering/Biotechnology. Bioproducts. 33, Springer. Berlin Heidelberg. 131-169 (1986).
- Shieh, W. K., Li, C. T. Performance and Kinetics of Aerated Fluidized-Bed Biofilm Reactor. Journal of Environmental Engineering-Asce. 115 (1), 65-79 (1989).
- Alvarez-Vazquez, H., Jefferson, B., Judd, S. J. Membrane bioreactors vs conventional biological treatment of landfill leachate: a brief review. Journal of Chemical Technology & Biotechnology. 79 (10), 1043-1049 (2004).
- Fenu, A., et al. Activated sludge model (ASM) based modelling of membrane bioreactor (MBR) processes: a critical review with special regard to MBR specificities. Water Res. 44 (15), 4272-4294 (2010).
- Liu, Y., Tay, J. H. The essential role of hydrodynamic shear force in the formation of biofilm and granular sludge. Water Res. 36 (7), 1653-1665 (2002).
- Chudoba, J., Grau, P., Ottová, V. Control of activated-sludge filamentous bulking-II. Selection of microorganisms by means of a selector. Water Research. 7 (10), 1389-1406 (1973).
- Christenson, L., Sims, R. Production and harvesting of microalgae for wastewater treatment, biofuels, and bioproducts. Biotechnol Adv. 29 (6), 686-702 (2011).
- Henderson, R., Parsons, S. A., Jefferson, B. The impact of algal properties and pre-oxidation on solid-liquid separation of algae. Water Res. 42 (8-9), 8-9 (2008).
- Jackson, P. E. Encyclopedia of Analytical Chemistry. Meyers, R. A. , John Wiley & Sons. Chichester UK. (2000).
- Wilkinson, G. N., Rogers, C. E. Symbolic descriptions of factorial models for analysis of variance. Applied Statistics. 22, 392-399 (1973).
- Chambers, J. M. Ch. 4. Statistical Models in S. Chambers, J. M., Hastie, T. J. , Wadsworth & Brooks/Cole. (1992).
- R Core Team. R: A Language and Environment for Statistical Computing. , R Foundation for Statistical Computing. Vienna, Austria. (2015).
- Ramanathan, G., Sales, C. M., Shieh, W. K. Apendix:Simultaneous autotrophic denitrification and nitrification in a low-oxygen reaction environment. Water Science & Technology. 70 (4), 729-735 (2014).
- Wastewater Management Fact Sheet - Energy Conservation. 832F06024, Environmental Protection Agency. Washington, DC. 1-7 (2006).
- Curtis, T. P. Ch 13. Environmental Biotechnology. Mitchell, R., Gu, J. D. , Wiley-Blackwell. (2010).
- Asada, K. THE WATER-WATER CYCLE IN CHLOROPLASTS: Scavenging of Active Oxygens and Dissipation of Excess Photons. Annu Rev Plant Physiol Plant Mol Biol. 50, 601-639 (1999).
- Mullineaux, P., Karpinski, S. Signal transduction in response to excess light: getting out of the chloroplast. Curr Opin Plant Biol. 5 (1), 43-48 (2002).
- Mallick, N., Mohn, F. H. Reactive oxygen species: response of algal cells. Journal of Plant Physiology. 157 (2), 183-193 (2000).
- Fridovich, I. Oxygen toxicity: a radical explanation. J Exp Biol. 201 ((Pt 8)), 1203-1209 (1998).
- Doyle, S. M., Diamond, M., McCabe, P. F. Chloroplast and reactive oxygen species involvement in apoptotic-like programmed cell death in Arabidopsis suspension cultures. J Exp Bot. 61 (2), 473-482 (2010).
- Eisma, D., et al. Suspended-matter particle size in some West-European estuaries; part II: A review on floc formation and break-up. Netherlands Journal of Sea Research. 28 (3), 215-220 (1991).
- Thomas, D. N., Judd, S. J., Fawcett, N. Flocculation modelling: A review. Water Research. 33 (7), 1579-1592 (1999).
- Harris, R. H., Mitchell, R. The role of polymers in microbial aggregation. Annu Rev Microbiol. 27, 27-50 (1973).
- Raszka, A., Chorvatova, M., Wanner, J. The role and significance of extracellular polymers in activated sludge. Part I: Literature review. Acta Hydrochimica Et Hydrobiologica. 34 (5), 411-424 (2006).
- Lakaniemi, A. M., Intihar, V. M., Tuovinen, O. H., Puhakka, J. A. Growth of Dunaliella tertiolecta and associated bacteria in photobioreactors. J Ind Microbiol Biotechnol. 39 (9), 1357-1365 (2012).
- Lakaniemi, A. M., Intihar, V. M., Tuovinen, O. H., Puhakka, J. A. Growth of Chlorella vulgaris and associated bacteria in photobioreactors. Microb Biotechnol. 5 (1), 69-78 (2012).
- Natrah, F. M. I., Bossier, P., Sorgeloos, P., Yusoff, F. M., Defoirdt, T. Significance of microalgal-bacterial interactions for aquaculture. Reviews in Aquaculture. 6 (1), 48-61 (2014).
- Dittami, S. M., Eveillard, D., Tonon, T. A metabolic approach to study algal-bacterial interactions in changing environments. Mol Ecol. 23 (7), 1656-1660 (2014).
- Watanabe, K., et al. Symbiotic association in Chlorella culture. FEMS Microbiol Ecol. 51 (2), 187-196 (2005).
- Burke, C., Thomas, T., Lewis, M., Steinberg, P., Kjelleberg, S. Composition, uniqueness and variability of the epiphytic bacterial community of the green alga Ulva australis. ISME J. 5 (4), 590-600 (2011).
- Krohn-Molt, I., et al. Metagenome survey of a multispecies and alga-associated biofilm revealed key elements of bacterial-algal interactions in photobioreactors. Appl Environ Microbiol. 79 (20), 6196-6206 (2013).
- Cooper, E. D., Bentlage, B., Gibbons, T. R., Bachvaroff, T. R., Delwiche, C. F. Metatranscriptome profiling of a harmful algal bloom. Harmful Algae. 37, 75-83 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。