Method Article
تحضير الأنسجة السليمة للتحليل المجهري لطبقة خلايا السويداء في بذور نبات الأرابيدوبسيس النامية والناضجة
In This Article
Summary
يصف هذا البروتوكول تحضير عينات سليمة من طبقة خلايا السويداء في بذور نبات الأرابيدوبسيس ثاليانا . لا تتطلب هذه الطريقة سوى معدات مختبرية شائعة ، مثل إبرة الحقن والملقط الدقيق ، وتتيح تصوير الخلايا الحية الفلورية عالية الدقة لخلايا السويداء في كل من البذور النامية والناضجة.
Abstract
في بذور نبات الأرابيدوبسيس ، تلعب السويداء ، وهي طبقة واحدة من الخلايا الحية الواقعة بين الجنين والخصية ، دورا مهما في تنظيم نضوج البذور وسكونها وإنباتها. يعد التحليل المجهري لخلايا السويداء السليمة أمرا ضروريا لفهم الوظائف الفسيولوجية للالسويداء على المستويين الخلوي والجزيئي. ومع ذلك ، كان تحضير العينة صعبا بسبب صغر حجم بذور نبات الأرابيدوبسيس وموقع طبقة خلية السويداء أسفل الخصية. توضح هذه المقالة بالتفصيل تحضير عينات طبقة خلايا السويداء السليمة المناسبة للمراقبة والتحليل المجهري في كل من البذور النامية والناضجة. تتيح هذه الطريقة مراقبة مساحات كبيرة والعديد من خلايا السويداء السليمة دون الحاجة إلى التثبيت أو التقطيع. بالإضافة إلى ذلك ، يستخدم البروتوكول معدات المختبرات القياسية فقط ، مثل إبر الحقن والملقط الدقيق والمجاهر المجسمة. يتيح هذا النهج بنجاح تصوير الخلايا الحية عالي الدقة لإشارات الفلورسنت ، مثل البروتين الفلوري الأخضر (GFP) ، في خلايا السويداء السليمة. تسمح هذه الطريقة بمراقبة التوطين داخل الخلايا وحركة البروتينات المختلفة ، بالإضافة إلى مورفولوجيا العضيات ، في خلايا السويداء لطفرات نبات الأرابيدوبسيس المختلفة. يساهم هذا البروتوكول في توضيح وظائف السويداء الجديدة ويوسع إمكانات الدراسات الخلوية والجزيئية لهذا النسيج الأساسي.
Introduction
نظرا لأن النباتات كائنات لاطئة ، فإن إنبات البذور هو حدث حاسم يحدد مصيرها. يتم تنظيم قرار الإنبات بشكل صارم من خلال العوامل الداخلية والبيئية ، مثل مستويات سكون البذور الأولية ، ودرجة الحرارة ، وشدة الضوء والطول الموجي ، وتركيز النيتروجين1،2،3،4،5،6. البذور لها هياكل معقدة تتكون من أنواع متعددة منالأنسجة 7. في بذور نبات الأرابيدوبسيس الجافة ، يحيط بالجنين ، الذي يتطور إلى شتلة ، بطبقة واحدة من السويداء والطبقات الخارجية ، الخصة. يتكون الخصية من طبقات متعددة من الخلايا الميتة ، بينما يظل الجنين والسويداء على قيد الحياة حتى في البذور الجافة. ينظر إلى السويداء بشكل شائع على أنه نسيج تخزين يوفر العناصر الغذائية لنمو الجنين ، وجنبا إلى جنب مع الخصية ، يمنح مقاومة ميكانيكية لنتوء الجذور8،9،10،11،12،13.
أظهرت العديد من الدراسات الحديثة أن السويداء يلعب دورا أساسيا في تنظيم إنبات البذور الأمثل14،15،16،17. على سبيل المثال ، يكتشف المستقبل الضوئي فيتوكروم B (PHYB) في خلايا السويداء إما الضوء الأحمر (R) أو الأحمر البعيد (FR) ، مما ينظم استجابات الإنبات15. يعمل السويداء أيضا كنسيج لاستشعار درجة الحرارة ، مما يثبط استجابات الإنبات تحت درجات حرارة عالية16. تعد مراقبة جودة السويداء أمرا بالغ الأهمية لإنبات البذور الأمثل ، لا سيما في البذور المخزنة على المدى الطويل17.
يعد تصوير الخلايا الحية ضروريا الآن لتوضيح الوظائف الفسيولوجية للذذناء. يسمح التحليل المجهري لخلايا السويداء السليمة التي تعبر عن البروتينات الموسومة بالفلورسنت بالتحقيق في الآليات الجزيئية التي ينظم السويداء من خلالها إنبات البذور. ومع ذلك ، فإن تحضير خلايا السويداء السليمة للمراقبة المجهرية يمثل تحديا ، لا سيما في بذور نبات الأرابيدوبسيس . يبلغ قطر البذور حوالي 0.4 مم ، والسويداء عبارة عن طبقة أحادية الخلية تقع بين الجنين والخصية ، مما يجعل التلاعب الدقيق أمرا صعبا. وبالتالي ، على الرغم من أدوارها الفسيولوجية المهمة ، نادرا ما لوحظ السويداء باستخدام تصوير الخلايا الحية.
تقدم هذه المقالة بروتوكولا للتحضير السريع لعينات طبقة خلايا السويداء السليمة المناسبة لتصوير الخلايا الحية في كل من البذور النامية والناضجة.
Protocol
في هذه الدراسة ، تم وضع إجراءين مختلفين لإعداد عينات طبقة خلايا السويداء الحية: أحدهما لتطوير البذور والآخر للبذور الناضجة. مطلوب طرق مختلفة قليلا اعتمادا على صلابة الخصة. تفاصيل الكواشف والمعدات المستخدمة مدرجة في جدول المواد.
1. تحضير عينات السويداء السليمة من البذور النامية
- مجموعة من السيليكات
- ازرع نباتات نبات الأرابيدوبسيس على التربة أو الصوف الصخري حتى تتفتح.
- ضع علامة على الزهور المفتوحة بالكامل بخيوط ملونة (0 أيام بعد الإزهار ، 0 DAF).
ملاحظة: تجنب استخدام الخيوط الخضراء أو الصفراء أو البنية لتمييز الزهور ، حيث يصعب تمييز هذه الألوان عن النباتات والسيليك النامية أو الناضجة. - اقطع السيليك النامية الملحوظة عند العنق (المشار إليه في الشكل 1 (1)) واجمعها في أنابيب سعة 1.5 مل.
ملاحظة: تطوير السيليقات من 12-16 DAF مناسب للتحضير باستخدام هذا البروتوكول.
- تشريح البذور النامية
ملاحظة: يجب تنفيذ الخطوات التالية على ورق الترشيح المبلل لحماية العينات من الجفاف. يجب أن تتم التلاعب تحت مجهر ستيريو.- افصل صماما (موضح في الشكل 1 (2)) من الريبلوخ (المشار إليه في الشكل 1 (1)) باستخدام ملقطين: أحدهما بأطراف سميكة للإمساك والآخر بأطراف حادة للتمزق).
- التقط البذور النامية برفق من السيليك باستخدام ملقط مع إغلاق الأطراف لتجنب إتلاف البذور (الشكل 1 (2)).
- أمسك البذرة بالملقط دون تحطيم البذرة ، اصنع ندبة بحجم 0.2 مم تقريبا على الخصية والسويداء المحيطة بالجنين باستخدام إبرة حقن (27 جم ، 0.40 مم × 19 مم) (الشكل 1 (3)).
ملاحظة: الموقع الأمثل لعمل الندبة هو عند تقاطع الفلقات والجذع. - ادفع الجنين للخارج عن طريق قرص البذرة بالملقط (الشكل 1 (4)). لا تسحق غلاف البذور الفارغ ، الذي يتكون من الخصية والسويداء ، وحاول الحفاظ على شكله الدائري.
- أدخل إبرة الحقن في غلاف البذور الفارغ عند الندبة ، واثقبها من الداخل إلى الخارج (الشكل 1 (5)).
- حافظ على الإبرة في مكانها ، وخدش سطح الخصية باستخدام ملقط مع إغلاق الأطراف ، وقم بقص جانب واحد من غلاف البذور الفارغ للسماح لها بالفتح (الشكل 1 (6)).
- افتح مغلف البذور الفارغ في ورقة باستخدام ملقط بأطراف حادة (الشكل 1 (7)). يجب الآن عزل العينة كصفيحة ثنائية الطبقة تتكون من طبقات السويداء والخصية (الشكل 1 (8)).
ملاحظة: إذا كانت العينة تميل إلى الالتفاف عند استخدام الماء كوسيط تركيب في الخطوة 3 أدناه، فقم بتقسيم عينة شكل الورقة إلى قطعتين. يمكن أيضا معالجة البذور التي يتم حصادها من السيليك عند حوالي 18 DAF (في هذه المرحلة ، تكون الخصية بنية اللون ولكنها لم تجف تماما بعد) باستخدام هذا البروتوكول ، على الرغم من أنه يجب شرب البذور لعدة دقائق قبل التحضير.
2. تحضير عينات السويداء السليمة من البذور الناضجة
- شرب البذور الناضجة
- أضف 1 مل من الماء المقطر المزدوج إلى أنبوب سعة 1.5 مل يحتوي على بذور نبات الأرابيدوبسيس الجافة.
- احتفظ بالبذور مشببة لمدة 40 دقيقة على الأقل في درجة حرارة الغرفة (الشكل 2 (1)).
ملاحظة: يصعب تندب البذور والبذور الجافة في غضون 40 دقيقة من الشرب في الخصية والسويداء وإزالة الجنين من داخل البذرة دون إتلاف غلاف البذور الفارغ في الخطوتين 2.2.1 و 2.2.2 ، في حين أن وقت الشرب الأطول يسهل التلاعب. - استخدم ماصة دقيقة سعة 1000 ميكرولتر لنقل البذور المشببة على ورق ترشيح مبلل.
- تشريح البذور الناضجة
ملاحظة: يجب تنفيذ الخطوات التالية على ورق الترشيح المبلل لحماية العينات من الجفاف. يجب إجراء التلاعب تحت مجهر مجسم.- أمسك البذرة بالملقط دون تحطيم البذرة ، اصنع ندبة بحجم 0.2 مم تقريبا على الخصية والسويداء المحيطة بالجنين باستخدام إبرة حقن (الشكل 2 (2)).
- ادفع الجنين للخارج عن طريق قرص البذرة بالملقط (الشكل 2 (3)). لا تسحق غلاف البذور الفارغ ، والذي يتضمن الخصية والسويداء. حاول الحفاظ على شكله الدائري.
- قم بقص الجانبين العلوي والسفلي من غلاف البذور الفارغ بإبرة حقن لتشكيله على شكل أسطوانة (الشكل 2 (4)).
- قم بقص غلاف البذور الفارغ الأسطواني الشكل على طول محوره المركزي لفصله إلى قطعتين (الشكل 2 (5)). يجب عزل العينات على شكل صفائح ثنائية الطبقة تتكون من طبقة السويداء وطبقة الخصية (الشكل 2 (6)).
3. المراقبة المجهرية
- ضع عينات السويداء في شكل صفيحة على شريحة زجاجية وقم بتثبيتها في الماء أو البيرفلوروديكالين (PFD).
ملاحظة: إذا بقيت فقاعات الهواء بين العينة والغطاء ، فإن البيرفلوروديكالين (PFD) ، الذي تم الإبلاغ عنه مفيد بشكل خاص لتصوير العينات التي تحتوي على جيوب هوائية ، مثل الأوراق18،19 ، سيكون مفيدا. من المعروف أن PFD يحتوي على أقل توتر سطحي ، مما يسمح له بملء الفراغات الهوائية بسهولة على سطح العينة. ومع ذلك ، بالنسبة للتصوير بفاصل زمني ، يوصى باستخدام الماء كوسيط تركيب ، حيث يجب أن يكون محتوى الماء في البذور الناضجة وفيرا للحفاظ على السيولة الخلوية. - ضع غطاء برفق فوق العينة. تأكد من أن طبقة السويداء تواجه الغطاء.
ملاحظة: يمكن استخدام طلاء الأظافر أو الشحوم لإغلاق حواف الغطاء لمنع جفاف العينة ووسط التركيب.
النتائج
باستخدام البروتوكول الموضح في الشكل 1 ، تم تحضير عينات السويداء من البذور النامية التي تم حصادها من السيليكات في 14 DAF (في هذه المرحلة ، لا تزال الخصية خضراء). لوحظ وجود العديد من خلايا السويداء عبر مساحة كبيرة وهياكلها داخل الخلايا (الشكل 3 أ). في هذه التجربة ، تم استخدام البذور التي تعبر عن PHYB المدمجة مع GFP في الطرف C (PHYB-GFP). من المعروف أن PHYB ينتقل إلى النواة عند تنشيطه بواسطة الضوء الأحمر ويشكل بقعا موجبة ل PHYB ، تعرف باسم الأجسام الضوئية (PBs) ، والتي تشارك في إنبات البذور4،20،21،22. تم حصاد العينات من النباتات المزروعة في ظل ظروف الضوء الأبيض المستمر عند 22 درجة مئوية. كما هو موضح في الشكل 3 ب ، تم اكتشاف PBs داخل النواة في خلايا السويداء. تتوافق هذه النتيجة مع دراسة سابقة تظهر أن PHYB في السويداء ينظم إنبات البذور الأمثل15. بالإضافة إلى ذلك ، تم إجراء تصوير بفاصل زمني للخلايا الحية للتأكد من أن خلايا السويداء المعزولة احتفظت بالنشاط البيولوجي حتى بعد تحضير العينة من خلال مراقبة قابلية الانعكاس الضوئي للنباتات FR / R (الشكل 3 ج). تم تحضير عينات السويداء من البذور النامية التي تم حصادها من السيليك في حوالي 17-18 DAF. تم اكتشاف PBs داخل النواة عند التشريح ، بينما اختفت تماما بعد التشعيع بالضوء الأحمر البعيد. بعد ذلك ، تسبب تشعيع الضوء الأحمر مرة أخرى في تحفيز PBs. تم الكشف عن هذه القابلية الضوئية للانعكاس الضوئي للشيخورام مرتين ، مما يشير إلى أن خلايا السويداء المعزولة بواسطة هذا البروتوكول احتفظت بالنشاط البيولوجي لمدة 4.5 ساعة على الأقل بعد التشريح (الشكل 3 ج).
بعد ذلك ، تم تحضير عينات السويداء من البذور الناضجة (حيث تكون الخصية بنية اللون) ، كما هو موضح في الشكل 2. في هذه التجربة ، لوحظت حركة الميتوكوندريا باستخدام البذور التي تعبر عن GFP المستهدف للميتوكوندريا (mtGFP) 23 ، والذي تم تخزينه في مجفف في درجة حرارة الغرفة في الظلام لمدة عام تقريبا بعد الحصاد. تم الإبلاغ عن أن الميتوكوندريا في الجنين تتحرك بنشاط وتغير مورفولوجيا ديناميكيا بعد الشرب والانتقال إلى ظروف الإنبات24. تم إجراء التصوير بفاصل زمني فلوري للميتوكوندريا في خلايا السويداء السليمة بعد 3 ساعات من شرب البذور ، وتم الكشف عن حركة الميتوكوندريا (الفيلم التكميلي 1). تحركت الميتوكوندريا في السويداء على الفور داخل العصارة الخلوية بعد فترة قصيرة من الشرب عند 22 درجة مئوية. بعد يوم واحد من شرب البذور عند 22 درجة مئوية ، لوحظت الميتوكوندريا التي تتحرك بشكل ديناميكي (الشكل 4 والفيلم التكميلي 2).

الشكل 1: تحضير عينة السويداء من البذور النامية. الخطوة 1: يتم فصل الصمام من الريبلوم. الخطوة 2: يتم جمع البذور النامية. الخطوة 3: يتم إنشاء ندبة على الخصية والسويداء باستخدام إبرة حقن. الخطوة 4: تتم إزالة الجنين عن طريق قرص البذرة بالملقط. الخطوة 5: يتم إدخال إبرة الحقن من خلال غلاف البذور الفارغ من الداخل إلى الخارج. الخطوة 6: يتم خدش سطح الخصية باستخدام ملقط. الخطوة 7: يتم فتح مغلف البذور الفارغ في شكل ورقة باستخدام الملقط. الخطوة 8: يتم تحضير عينة ورقة السويداء النهائية للمراقبة المجهرية. يتم تنفيذ جميع الخطوات على ورق ترشيح مبلل تحت مجهر استريو. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير عينة السويداء من البذور الناضجة. الخطوة 1: تشرب البذور الجافة في الماء لأكثر من 40 دقيقة في أنبوب سعة 1.5 مل. الخطوة 2: يتم إنشاء ندبة على الخصية والسويداء باستخدام إبرة الحقن. الخطوة 3: تتم إزالة الجنين عن طريق قرص البذرة بالملقط. الخطوة 4: يتم قطع الجانبين العلوي والسفلي من غلاف البذور الفارغ لتشكيله على شكل أسطوانة. الخطوة 5: يتم قطع غلاف البذور الفارغ الأسطواني على طول محوره المركزي. الخطوة 6: يتم تحضير عينة ورقة السويداء النهائية للمراقبة المجهرية. يتم تنفيذ جميع الخطوات على ورق ترشيح مبلل تحت مجهر استريو. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
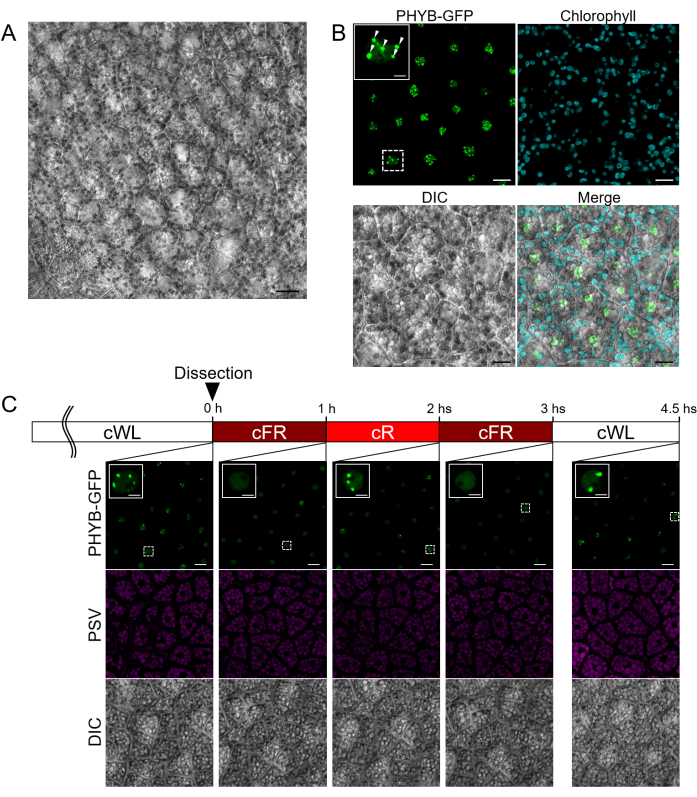
الشكل 3: التصوير الفلوري لطبقة خلية السويداء السليمة باستخدام البذور النامية. تم تحضير عينات طبقة خلايا السويداء السليمة من بذور تطوير 14 يوما بعد الإزهار (DAF) (A ، B) و 17-18 DAF siliques (C). تم إجراء التصوير المجهري باستخدام مجهر المسح الضوئي بالليزر متحد البؤر المجهز بعدسة موضوعية غمر بالزيت Plan-Apochromat 63× وليزر الضوء الأبيض. (أ) تظهر صورة متحد البؤر للذذاء تحت تباين التداخل التفاضلي (DIC) مساحات كبيرة بها العديد من خلايا السويداء السليمة. شريط المقياس: 20 ميكرومتر. (ب) يتم عرض صور متحد البؤر للذذاء الذي يعبر عن PHYB-GFP ، مع PHYB-GFP باللون الأخضر والتألق الذاتي للكلوروفيل في سماوي. يشار إلى الأجسام الضوئية (PBs) في النواة برؤوس سهام بيضاء. قضبان المقياس: 10 ميكرومتر ؛ شريط مقياس الصورة الموسع: 2.5 ميكرومتر. تم فصل إشارة GFP عن التألق الذاتي لفجوات تخزين البروتين (PSVs) باستخدام الفحص المجهري الفلوري (FLIM). تم الحصول على عمر التألق باستخدام TauScan وفصلها باستخدام وظيفة TauSeparation. كان متوسط عمر التألق ل GFP 2.2 ns. كان مضان GFP متحمسا عند 488 نانومتر وتم جمعه بين 500-530 نانومتر ، بينما كان التألق الذاتي للكلوروفيل متحمسا عند 405 نانومتر وتم جمعه بين 688-729 نانومتر. (ج) يتم تقديم صور متحد البؤر للذذاء الذي يعبر عن PHYB-GFP تحت الضوء الأبيض المستمر (cWL) أو الضوء الأحمر البعيد المستمر (cFR) أو الضوء الأحمر المستمر (cR). يظهر PHYB-GFP باللون الأخضر ، ويظهر التألق الذاتي PSV باللون الأرجواني. قضبان المقياس: 10 ميكرومتر ؛ شريط مقياس الصورة الموسع: 2.5 ميكرومتر. شدة الضوء: WL ، 46.5 ميكرومول / م2 / ثانية ؛ FR ، 35.2 ميكرومول / م2 / ثانية ؛ R ، 18.6 ميكرولتر / م2 / ثانية. تم إثارة التألق الذاتي PSV عند 561 نانومتر وتم جمعه بين 565-621 نانومتر. تم فصل إشارة GFP باستخدام نفس الطريقة الموضحة أعلاه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تصوير الخلايا الحية الفلورية لطبقة خلية السويداء السليمة باستخدام البذور الناضجة. تم إجراء التصوير المجهري باستخدام نفس الطريقة الموضحة في الشكل 3. (أ) تظهر صورة متحدة البؤر لطبقة خلية السويداء السليمة بأكملها ، تم الحصول عليها من الفيلم التكميلي 2. يتم تصنيف الميتوكوندريا باللون الأخضر ، ويتم تصنيف التألق الذاتي PSV باللون الأرجواني. شريط المقياس: 10 ميكرومتر. (ب) تظهر سلسلة اللقطات المتتابعة من الصور المكبرة من المساحة المربعة المتقطعة في اللوحة (A) حركة الميتوكوندريا ، المشار إليها برؤوس الأسهم البيضاء. شريط المقياس: 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
الفيلم التكميلي 1: يتم عرض مقطع فيديو بفاصل زمني ل mtGFP في طبقة خلية السويداء لبذرة ناضجة بعد 3 ساعات من التشرب. تم التقاط إطار واحد كل 10 ثوان ، ومعدل إطارات الفيديو هو 10 إطارات / ثانية. شريط المقياس: 10 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
الفيلم التكميلي 2: يظهر مقطع فيديو بفاصل زمني ل mtGFP في طبقة خلية السويداء لبذرة ناضجة بعد يوم واحد من التشرب. تم التقاط إطار واحد كل 10 ثوان ، ومعدل إطارات الفيديو هو 10 إطارات / ثانية. شريط المقياس: 10 ميكرومتر. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تم الكشف عن أدوار السويداء في إنبات البذور من خلال التحليلات الجينية والكيميائية الحيوية باستخدام أنسجة البذور المنفصلة ، مثل تحليل التعبير الجيني والقياس الكمي للدهون والهرمونات النباتية9،14،25،26،27. كشف مقايسة فراش طبقة البذور في المختبر ، الذي يجمع بين غلاف البذور الفارغ (السويداء والخصة) مع جنين معزول من طفرات نبات الأرابيدوبسيس المختلفة ، عن الآليات الجزيئية الكامنة وراء عمليات الإنبات14،15،16،28. ومع ذلك ، كان تحضير العينة للمراقبة المجهرية أمرا صعبا بسبب صغر حجم بذور نبات الأرابيدوبسيس وموقع طبقة خلية السويداء أسفل الخصية. على وجه الخصوص ، نادرا ما يتم إجراء مراقبة طبقة خلايا السويداء أثناء نمو البذور دون تثبيت كيميائي وتقطيع.
أثناء تحضير العينة ، يكون غلاف البذور الفارغ من البذور النامية هشا لأن الخصية حية وبالتالي ناعمة. هنا ، تم إنشاء بروتوكولين للتحضير السريع لعينات طبقة خلايا السويداء السليمة المناسبة للمراقبة والتحليل المجهري في تطوير البذور دون الحاجة إلى التثبيت أو التقسيم. في حالة تحضير العينة من البذور الناضجة ، تكون الخصية ميتة وقوية ، مما يتسبب في احتفاظ غلاف البذور الفارغ بانحناءه عند تركيبه على زجاج منزلق. يجعل هذا الانحناء من الصعب مراقبة طبقة خلايا السويداء بوضوح عبر مجموعة واسعة من التركيز. لذلك ، تم تعديل طريقة التشريح لتطوير البذور بشكل طفيف لتقليم غلاف البذور الفارغ بشكل مناسب. من خلال تقسيمها إلى قطعتين باستخدام هذه الطريقة ، تم تحقيق ملاحظة واضحة للعديد من خلايا السويداء مع الحفاظ على التركيز.
تم تطوير كواشف تصوير مختلفة (لتلوين الحمض النووي ، وأنواع الأكسجين التفاعلية ، والأجزاء الحمضية ، وما إلى ذلك) ، وتم تطبيق بعضها على نباتات نبات نبات الأرابيدوبسيس 29،30،31،32. تم بالفعل استخدام عينات طبقة خلايا السويداء المعدة باستخدام هذا البروتوكول للمراقبة المجهرية باستخدام LysoTracker و Propidium Iodide تلطيخ ، مما يساهم في تقييم وظيفة السويداء17. منذ اكتشاف GFP في عام 196233 ، أصبحت البروتينات الموسومة ب GFP أدوات أساسية لتوضيح ديناميكيات الهياكل داخل الخلايا23،24،34،35،36،37،38. من خلال تحضير عينات السويداء وفقا لهذا البروتوكول واستخدام الطرق المذكورة أعلاه ، من الممكن إجراء تصوير الخلايا الحية للبذور أثناء نمو البذور وإنباتها ، كما هو موضح في الشكل 3 والشكل 4 ، وبالتالي توضيح الأحداث داخل الخلايا وتوطين بروتينات معينة. علاوة على ذلك ، من المتوقع أن يوفر تطبيق مثبطات محددة (مثل مثبطات الإنزيم البروتيني ، ومثبطات إنزيم تعديل البروتين ، ومثبطات الديناميكيات الخلوية) 39،40،41،42 على خلايا السويداء الحية باستخدام هذا البروتوكول رؤى أعمق حول الأحداث داخل الخلايا والآليات الجزيئية الكامنة وراء وظيفة السويداء أثناء نمو البذور وإنباتها.
أحد قيود هذا البروتوكول هو أنه لا يمكن تحضير طبقات خلايا السويداء من البذور المجففة تماما لأنه من الصعب فصل البذور إلى الجنين وغلاف البذور الفارغ. كما هو موضح في الشكل 2 ، من الضروري وقت الشرب لا يقل عن 40 دقيقة لفصل البذور الناضجة. من المهم ملاحظة أن العديد من الأحداث الخلوية داخل خلايا السويداء قد يتم إحداثها عند التشرب. قيد آخر هو أن هذا البروتوكول لا يسمح بمراقبة أنسجة السويداء خلال المراحل المبكرة من تطور البذور ، خاصة قبل 10 DAF ، حيث إنه مصمم خصيصا لمراقبة طبقة السويداء أحادية الخلية. خلال هذه المراحل المبكرة ، يملأ النسيج الذي يسبق تكوين طبقة السويداء أحادية الخلية - وهي طبقة غير طبقات - الجزء الداخلي من البذور النامية43 ، مما يجعل من الصعب تحضير عينات السويداء.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
نشكر الدكتورين ماتسوشيتا وأوكا من جامعة كيوتو على توفير متحولة phyB التي تعبر عن PHYB-GFP مدفوعا بمروج 35S. تم دعم هذه الدراسة جزئيا من خلال منحة المعونة للبحث العلمي في المجالات المبتكرة ، والبحث في مجال البحث المقترح (19H05713 إلى KY).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge Tubes | Watoson Bio Lab | 131-815C | |
| Coverslip (18 x 18 mm) | Matsunami Glass Ind.,Ltd. | C218181 | |
| DDW | Water for mountting | ||
| Filter Paper No.526 (400 x 400 mm) | ADVANTEC VIETNAM CO., LTD. | 02453400 | |
| Genki-kun Seru Senyo yodo kopu N-150 (55 L) | Katakura & Co-op Agri Corporation | Soils for Plant Growth | |
| Glass slide (26mm x 76 mm) | Matsunami Glass Ind.,Ltd. | S1215 | |
| Grodan AO 36 x 36 x 40 mm Cubes | Grodan | Rockwools for Plant Growth | |
| Iris Scissors | Premium Plus Japan Co.,Ltd. | FC-0212 | |
| Jewelers forceps, Dumont No. 5 (4 1/4 in.) | Dumont | F6521 | Forceps for Tearing |
| Leica Application Suite X (LAS X) | Leica | Software for Sterallis 8 | |
| Leica Microsystems Immersion Oil for Microscopes | Very Low Autofluorescence Immersion Oil | THMOIL-10LF | |
| LIOR precision forceps 110mm SL-14 | KENIS Ltd. | KN33450438 | Forceps for Holding |
| NAIL HOLIC | KOSE | Nail polish | |
| Needls 27G 3/4 (19 mm) RB | Misawa Medical Industry Co., Ltd. | A Ingection Needle for Cutting | |
| Nichipet Air 1000 uL | Nichiryo | 00-NAR-1000 | A 1000 µL Micropipette |
| Perfluorodecalin | APOLLO SCIENTIFIC | PC5960 | Reagents for mounting |
| Red light/far-red light LED panel | TOKYO RIKAKIKAI CO., LTD. | 10147599 | |
| Schappe Spun #60 | Fujix Co., Ltd. | Thread | |
| SPINKOTE Lubricant 2 oz | BECKMAN COULTER | 306812 | Grease |
| Sterallis 8 | Leica | Confocal Laser Scanning Microscopy | |
| Stereomicroscope Stemi 305 cam W | Carl Zeiss NTS Ltd. | 491903-0017-000 | |
| White light LED | PANASONIC | FL40SSW/37 |
References
- Bentsink, L., Jowett, J., Hanhart, J. C., Koornneef, M. Cloning of DOG1, a quantitative trait locus controlling seed dormancy in Arabidopsis. Proc Natl Acad Sci USA. 103 (45), 17042-17047 (2006).
- Toh, S., et al. High temperature-induced abscisic acid biosynthesis and its role in the inhibition of gibberellin action in Arabidopsis seeds. Plant Physiol. 146 (3), 1368-1385 (2008).
- Seo, M., Nambara, E., Choi, G., Yamaguchi, S. Interaction of light and hormone signals in germinating seeds. Plant Mol Biol. 69 (4), 463-472 (2009).
- Shinomura, T., et al. Action spectra for phytochrome A- and B-specific photoinduction of seed germination in Arabidopsis thaliana. Proc Natl Acad Sci USA. 93 (15), 8129-8133 (1996).
- Liu, Y., et al. Nitric oxide-induced rapid decrease of abscisic acid concentration is required in breaking seed dormancy in Arabidopsis. New Physiol. 183 (4), 1030-1042 (2009).
- Yan, D., et al. NIN-like protein 8 is a master regulator of nitrate-promoted seed germination in Arabidopsis. Nat Commun. 7, 13179(2016).
- Yan, D., Duermeyer, L., Leoveanu, C., Nambara, E. The functions of the endosperm during seed germination. Plant Cell Physiol. 55 (9), 1521-1533 (2014).
- Lopes, A. M., Larkins, A. B. Endosperm origin, development, and function. Plant Cell. 5 (10), 1383-1399 (1993).
- Penfield, S., et al. Reserve mobilization in the Arabidopsis endosperm fuels hypocotyl elongation in the dark, is independent of abscisic acid,and requires PHOSPHOENOLPYRUVATE CARBOXYKINASE1. Plant Cell. 16 (10), 2705-2718 (2004).
- Leubner-Metzger, G., Fründt, C., Meins, F. Jr Effects of gibberellins, darkness and osmotica on endosperm rupture and class I β-1,3-glucanase induction in tobacco seed germination. Planta. 199, 282-288 (1996).
- Sargant, E. Recent work on the results of fertilization in angiosperms. Ann Bot. 14 (4), 689-712 (1900).
- Groot, P. S., Karssen, M. C. Gibberellins regulate seed germination in tomato by endosperm weakening: A study with gibberellin-deficient mutants. Planta. 171 (4), 525-531 (1987).
- Groot, P. S., Kieliszewa-Rokicka, B., Vermeer, E., Karssen, M. C. Gibberellin-induced hydrolysis of endosperm cell walls in gibberellin-deficient tomato seeds prior to radicle protrusion. Planta. 174, 500-504 (1988).
- Lee, P. K., Piskurewicz, U., Turečková, V., Strnad, M., Lopez-Molina, L. A seed coat bedding assay shows that RGL2-dependent release of abscisic acid by the endosperm controls embryo growth in Arabidopsis dormant seeds. Proc Natl Acad Sci USA. 107 (44), 19108-19113 (2010).
- Lee, P. K., et al. Spatially and genetically distinct control of seed germination by phytochromes A and B. Genes Dev. 26 (17), 1984-1996 (2012).
- Piskurewicz, U., Sentandreu, M., Iwasaki, M., Glauser, G., Lopez-Molina, L. The Arabidopsis endosperm is a temperature-sensing tissue that implements seed thermoinhibition through phyB. Nat Commun. 14, 1202(2023).
- Shinozaki, D., Takayama, E., Kawakami, N., Yoshimoto, K. Autophagy maintains endosperm quality during seed storage to preserve germination ability in Arabidopsis. Proc Natl Acad Sci USA. 121 (14), e2321612121(2024).
- Littlejohn, R. G., Gouveia, D. J., Edner, C., Smirnoff, N., Love, J. Perfluorodecalin enhances in vivo confocal microscopy resolution of Arabidopsis thaliana mesophyll. New Phytol. 186 (4), 1018-1025 (2010).
- Littlejohn, R. G., Love, J. A simple method for imaging Arabidopsis leaves using perfluorodecalin as an infiltrative imaging medium. J Vis Exp. (59), e3394(2012).
- Chen, M., Schwab, R., Chory, J. Characterization of the requirements for localization of phytochrome B to nuclear bodies. Proc Natl Acad Sci USA. 100 (24), 14493-14498 (2003).
- Matsushita, T., Mochizuki, N., Nagatani, A. Dimers of the N-terminal domain of phytochrome B are functional in the nucleus. Nature. 424 (6948), 571-574 (2003).
- Buskirk, V. K. E., Decker, V. P., Chen, M. Photobodies in light signaling. Plant Physiol. 158 (1), 52-60 (2012).
- Logan, C. D., Leaver, J. C. Mitochondria-targeted GFP highlights the heterogeneity of mitochondrial shape, size and movement within living plant cells. J Exp Bot. 51 (346), 865-871 (2000).
- Paszkiewicz, G., Gualberto, M. J., Benamar, A., Macherel, D., Logan, C. D. Arabidopsis seed mitochondria are bioenergetically active immediately upon imbibition and specialize via biogenesis in preparation for autotrophic growth. Plant Cell. 29 (1), 109-128 (2017).
- Lefebvre, V., et al. Functional analysis of Arabidopsis NCED6 and NCED9 genes indicates that ABA synthesized in the endosperm is involved in the induction of seed dormancy. Plant J. 45 (3), 309-319 (2006).
- Okamoto, M., et al. CYP707A1 and CYP707A2, which encode abscisic acid 8' hydroxylases, are indispensable for proper control of seed dormancy and germination in Arabidopsis. Plant Physiol. 141 (1), 97-107 (2006).
- Endo, A., et al. Tissue-specific transcriptome analysis reveals cell wall metabolism, flavonol biosynthesis and defense responses are activated in the endosperm of germinating Arabidopsis thaliana seeds. Plant Cell Physiol. 53 (1), 16-27 (2012).
- Lee, P. K., Lopez-Molina, L. A seed coat bedding assay to genetically explore in vitro how the endosperm controls seed germination in Arabidopsis thaliana. J Vis Exp. (81), e50732(2013).
- Uno, K., Sugimoto, N., Sato, Y. N-aryl pyrido cyanine derivatives are nuclear and organelle DNA markers for two-photon and super-resolution imaging. Nat Commun. 12, 2650(2021).
- Shinozaki, D., et al. Autophagy increases zinc bioavailability to avoid light-mediated reactive oxygen species production under zinc deficiency. Plant Physiol. 182 (3), 1284-1296 (2020).
- Laxmi, A., Pan, J., Morsy, M., Chen, R. Light plays an essential role in intracellular distribution of auxin efflux carrier PIN2 in Arabidopsis thaliana. PLOS One. 3 (1), e1510(2008).
- Rigal, A., Doyle, M. S., Robert, S. Live cell imaging of FM4-64, a tool for tracing the endocytic pathways in Arabidopsis root cells. Methods Mol Biol. 1242, 93-103 (2015).
- Shimomura, O., Johnson, H. F., Saiga, Y. Extraction, purification and properties of Aequorin, a bioluminescent protein from the luminous hydromedusan, Aequorea. J Cell Comp Physiol. 59 (3), 223-239 (1962).
- Holzinger, A., Buchner, O., Lütz, C., Hanson, R. M. Temperature-sensitive formation of chloroplast protrusions and stromules in mesophyll cells of Arabidopsis thaliana. Protoplasma. 230, 23-30 (2007).
- Mano, S., et al. Distribution and characterization of peroxisomes in Arabidopsis by visualization with GFP: dynamic morphology and actin-dependent movement. Plant Cell Physiol. 43 (3), 331-341 (2002).
- Nelson, K. B., Cai, X., Nebenführ, A. A multicolored set of in vivo organelle markers for co-localization studies in Arabidopsis and other plants. Plant J. 51 (6), 1126-1136 (2007).
- Goto, C., Tamura, K., Fukao, Y., Shimada, T., Hara-Nishimura, I. The novel nuclear envelope protein KAKU4 modulates nuclear morphology in Arabidopsis. Plant Cell. 26 (5), 2143-2155 (2014).
- Geldner, N., et al. combinatorial analysis of membrane compartments in intact plants with a multicolor marker set. Plant J. 59 (1), 169-178 (2009).
- Jang, I. -C., Henriques, R., Seo, S. H., Nagatani, A., Chua, N. -H. Arabidopsis phytochrome interacting factor proteins promote phytochrome B polyubiquitination by COP1 E3 ligase in the nucleus. Plant Cell. 22 (7), 2370-2383 (2010).
- AI-Sady, B., Ni, W., Kircher, S., Schäfer, E., Quail, H. P. Photoactivated phytochrome induces rapid PIF3 phosphorylation prior to proteasome-mediated degradation. Mol Cell. 23 (4), 439-446 (2006).
- Lam, K. S., et al. BFA-induced compartments from the Golgi apparatus and trans-Golgi network/early endosome are distinct in plant cells. Plant J. 60 (5), 865-881 (2009).
- Yoshimoto, K., et al. Processing of ATG8s, ubiquitin-like proteins, and their deconjugation by ATG4s are essential for plant autophagy. Plant Cell. 16 (11), 2967-2983 (2004).
- Xu, G., Zhang, X. Mechanisms controlling seed size by early endosperm development. Seed Biol. 2, 1(2023).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved