Method Article
نموذج الفئران الخدج لدراسات الألم
In This Article
Summary
هنا ، نقدم بروتوكولا موجزا لإنشاء نموذج للفئران المبكرة ، مما يسهل البحث في إدارة الألم المبكر بعد الولادة. تتضمن الطريقة إجراء عملية قيصرية قبل ثلاثة أيام من الولادة المتوقعة ، واستخراج صغار الفئران المبكرة عن طريق استئصال الرحم ، ودمجها مع النسل البيولوجي لسد بديل.
Abstract
يتعمق هذا البحث في عواقب التحفيز المستمر للوخز على النسل الخدج للتأكد من آثاره طويلة المدى على حساسية الألم. كان الهدف الأساسي من هذا البروتوكول هو التحقيق في تأثير محفزات وخز الدبوس الوليدية على عتبة الألم في المراحل اللاحقة من الحياة باستخدام نموذج الفئران الخدجية. من خلال إنشاء هذا النموذج ، نهدف إلى تطوير البحث حول فهم وإدارة آلام ما بعد الولادة المبكرة المرتبطة بالخداج. تشير نتائج هذه الدراسة إلى أنه في حين أن عتبات خط الأساس للمنبهات الميكانيكية ظلت غير متأثرة ، كانت هناك زيادة ملحوظة في فرط الحساسية الميكانيكية بعد حقن فرويند المساعد الكامل (CFA) في الفئران البالغة. ومن المثير للاهتمام ، بالمقارنة مع ذكور الفئران ، أن إناث الفئران أظهرت فرط حساسية التهابية متزايدة. والجدير بالذكر أن سلوك الأم ووزن الفضلات ومسار نمو النسل ظل دون تغيير بسبب التحفيز. يمكن أن يكون مظاهر الاستجابات المتغيرة لاستقبال الألم في مرحلة البلوغ بعد المحفزات المؤلمة لحديثي الولادة مؤشرا على تغيرات في المعالجة الحسية وعمل مستقبلات القشرانيات السكرية. ومع ذلك، هناك حاجة إلى مزيد من البحث لفهم الآليات الأساسية المعنية وتطوير التدخلات لعواقب الخداج وآلام الولدان لدى البالغين.
Introduction
خلال فترة حديثي الولادة ، تخضع مسارات تأهل الألم لنضج هيكلي ووظيفي كبير ، ووجود تلف الأنسجة والألم المرتبط به له آثار عميقة على تطوير المعالجة الحسية الجسدية1.
يسمح استخدام النماذج الحيوانية بالتلاعب التجريبي الخاضع للرقابة بالحيوانات غير البشرية ، مما يتيح فهما أعمق لعواقب آلام الأطفال حديثي الولادة على السلوك في وقت لاحق من الحياة مع التخفيف من المتغيرات المربكةالمحتملة 2،3. النتيجة الملحوظة الشائعة هي تأثير آلام الولدان على زيادة حساسية الألم في مرحلة البلوغ2،4،5. في وحدة العناية المركزة لحديثي الولادة (NICU)، يعد ألم الولدان مصدرا شديد الانتشار للإجهاد، حيث يخضع الخدج عادة لمتوسط 10 إجراءات جراحية يوميا6. يواجه الأطفال حديثو الولادة الخدج في وحدة العناية المركزة لحديثي الولادة مجموعة من الضغوطات ، بما في ذلك الألم ، والاتصال المحدود للأم ، والمحفزات السمعية ، والإضاءةالمفرطة 7،8،9.
يعد استخدام النماذج الحيوانية أمرا ضروريا لتعزيز فهمنا للآليات الأساسية التي تنطوي عليها هذه العمليات وتسهيل التقدم الجديد في هذا المجال. على وجه الخصوص، يمكن أن يساهم استخدام النماذج الحيوانية الخدج في الدراسات بشكل كبير في توسيع مجموعة المعارف حول الخدج وتوفير رؤى قيمة حول تدخلات إدارة الألم للولدان الخدج10.
حاليا ، هناك عدد محدود من نماذج القوارض التي تعالج الخداج على وجه التحديد ، حيث تبحث غالبية هذه الدراسات في المقام الأول في آثار الخداج على الدماغ11 ، أو نمو الرئة12 ، أو التهاب الأمعاء والقولون الناخر13 ، أو دراسات التغذية المناعية14. ومع ذلك ، لا يفحص أي من هذه النماذج نضوج نظام الألم ، وهو ضعيف بشكل خاص في حالات الخداج.
تظل الولادة المبكرة وعواقبها على إدارة الألم المبكرة بعد الولادة مجالات مهمة للدراسة. لذلك ، يهدف العمل الحالي إلى المساهمة في الأدبيات من خلال إنشاء نموذج للفئران المبكرة. يوفر هذا النموذج رؤى حول تأثير محفزات وخز البوس عند حديثي الولادة على عتبات الألم خلال المراحل اللاحقة من الحياة ، مما يعزز فهمنا للألم المرتبط بخداج.
Protocol
اتبعت جميع الإجراءات التجريبية دليل رعاية واستخدام المختبر المعتمدة من قبل اللجنة الأخلاقية للتجارب على التابعة لجامعة ألفيناس الفيدرالية (البروتوكول 32/2016).
1.
- الحصول على ذكور الجرذان البالغة وإناث الويستار (حوالي ثمانية أسابيع من العمر) من مرفق المركزي التابع لجامعة ألفيناس الفيدرالية.
- قم بإسكان الفئران في ظروف درجة حرارة ورطوبة خاضعة للرقابة في ضوء 12:12 ساعة: دورة مظلمة وإطعامها بالطعام والماء المخصص في كلية مرافق للعلاج الطبيعي (الجامعة الفيدرالية في ألفيناس).
2. التحقق من الحمل
- لمدة شهر واحد ، كل صباح بين الساعة 8:00 و 9:00 صباحا ، انقل كل قفص إلى غرفة التجربة. لإجراء غسيل مهبلي ، أدخل بعناية ماصة بلاستيكية تحتوي على 10 ميكرولتر من محلول كلوريد الصوديوم 0.9٪ في مهبل الفئران. تأكد من الإدخال الضحل لتجنب الإيلاج العميق ، ثم انسحب برفق لجمع الإفرازات المهبلية.
- ضع السائل المهبلي الذي تم جمعه على شرائح زجاجية فردية ، مع تعيين شريحة منفصلة لكل قفص من.
- احصل على قطرة واحدة من المواد غير الملوثة من كل فأر باستخدام طرف ماصة نظيف. افحص المادة تحت المجهر الضوئي باستخدام عدسات موضوعية 10x و 40x ، دون استخدام عدسة المكثف.
- حدد ثلاثة أنواع متميزة من الخلايا بناء على خصائصها: الخلايا الظهارية المستديرة وذات النواة ، والخلايا غير المنتظمة بدون نواة ، والكريات البيض الصغيرة والمستديرة15.
- تعريض إناث فئران الويستار مع التقرن الشديد والتقشر المهبلي ، وهو سمة من سمات دورة الشبق ويشير إلى زيادة تقبل الذكور للتزاوج. تزاوج الفئران عن طريق وضع 2 من الإناث و 1 ذكر لكل قفص. حدد يوم الحمل 0 عن طريق التحقق من وجود المنوية وخلايا المرحلة الشبقية في اللطاخات المهبلية.
3. تصنيف وإدارة السدود الحامل وذريتها
- تخلص من ثلاثة أنواع من السدود الحامل (2 سد لكل منهما) بناء على مرحلة الحمل: السدود المبكرة ، والسدود الآجلة ، والسدود البديلة. اسمح للسدود الحامل بالولادة بشكل طبيعي في اليوم 22 من الحمل ، واستخدم فضلاتها لمجموعة المصطلح.
- في اليوم 19 من الحمل ، قم بإجراء عملية قيصرية على السدود الحامل المبكرة ، أي قبل 3 أيام من تاريخ الولادة المتوقع. استخدم هذه الفضلات للمجموعة المبكرة. بالنظر إلى أن هذا الإجراء لا يفضي إلى بقاء الأم على قيد الحياة ، فعهد إلى الجراء الخدج بالسدود البديلة ، التي أنجبت بشكل طبيعي قبل يومين من الولادة القيصرية من السدود المبكرة.
- احتفظ بجراء السد البديل معها لبضع ساعات ، مما يسمح لروائحهم بالاختلاط مع فضلات الخدج. بعد هذه الفترة ، أدخل الفضلات المبكرة وقم بإزالة الجراء الأصلية للبديل ، ثم ضحية بها بجرعات عالية من استنشاق الأيزوفلوران.
ملاحظة: هذه الخطوة ضرورية للتأكد من أن السدود البديلة قد حفزت بالفعل إنتاج الحليب في الغدد الثديية ، مما يجعلها في وضع يمكنها من إرضاع الجراء الخدج بشكل فعال16.
4. الجراحة القيصرية
- تخدير السدود الحامل الخدج جزئيا ب 2٪ أيزوفلوران والقتل الرحيم قبل 3 أيام من تاريخ الولادة المتوقع باستخدام خلع عنق الرحم. بعد القتل الرحيم ، استخرج النسل واحدا تلو الآخر من خلال استئصال الرحم.
- قم بعمل قطع 3 سم في خط الوسط لأسفل البطن ، متبوعا بقطع طولي 2 سم. قم بعمل شق على طول الحدود المعوية في الجزء الأوسط من كل أنبوب رحم من هذه الجروح.
- استخرج صغار الفئران والمشيمة برفق عن طريق استئصال الرحم17،18. استخرج النسل واحدا تلو الآخر على الفور.
5. رعاية ما بعد الجراحة وإعداد الجراء للتبني
- استخدم إجراء التبني لمنع الأم التي خضعت للعملية من إظهار سلوك غير لائق بسبب الإجراء الجراحي والألم المحتمل ، والذي قد يؤثر على سلوك الجراء البالغين.
- نظف الشعب الهوائية لصغار الفئران باستخدام مناشف ورقية بعد الولادة. نظف صغار الفئران عن طريق إعطائهم حماما لمنع أكل لحوم البشر بواسطة السدود البديلة. اغسل صغار الفئران في الماء عند 28 درجة مئوية وجففها.
- قم بإزالة أي آثار للدم وضع الجراء في أطباق بتري تحت إضاءة الأشعة تحت الحمراء الساخنة ، مع الحفاظ على درجة حرارة حوالي 28 درجة مئوية حتى يصبح تنفسهم منتظما.
- اقطع الحبال السرية أسفل المشيمة مباشرة واستخدم القطن المنقوع في H2O2 لوقف أي نزيف من الحبل السري. أخيرا ، اعرضها على الأمهات الحاضنات للتبني.
6. تعزيز تفاعل الأم وتبني النسل الخدج
- ضع كل أم حاضنة مع فضلاتها في أقفاص بلاستيكية منفصلة. قبل النقل ، ضع علامة على كل جرو من يد الحاضنة. هذه العلامة ضرورية لتحليلات سلوك الأم اللاحقة. الحفاظ على سلامة أقفاص الأمهات الحاضنات طوال عملية التبني.
- في البداية ، ضع الجراء الخدج خارج العش. تسمح هذه الإستراتيجية للأم البديلة بالتعرف على رائحة الجراء الجديدة والتعرف عليها في منطقة محايدة. أيضا ، حدد واحدا أو اثنين من صغار الأم الحاضنة وضعها خارج العش جنبا إلى جنب مع الجراء الخدج. يدفع هذا المزيج الأم البديلة إلى جمع كل من صغارها والجراء المبكرة ، وبالتالي تعزيز قبول الجراء الجديدة ودمجها في عشها.
- امزج النسل بالتبني مع النسل البيولوجي في البداية. تأكيد التبني الفعلي. أخرج صغار الأم الحاضنة من العش وضحي بهم19.
ملاحظة: في هذه الدراسة ، كانت صلاحية الفئران الخدج للحياة 100٪ ولم يتم رفضها من قبل السد البديل.
7. توحيد الفضلات
- حافظ على حجم القمامة البالغ 8 صغار لكل القمامة في جميع مجموعات الجراء التي يتم تربيتها بديلين ، مع 4 ذكور و 4 إناث. التضحية بالفئران الجرو المتبقية بعد التوحيد القياسي.
8. التصميم التجريبي وتنفيذ البروتوكول
ملاحظة: كان الهدف من هذا البروتوكول هو الحصول على صغار خدج قابلة للحياة لتطوير الإجراءات التجريبية التالية.
- استخدام ما مجموعه 20 سدا للحامل للإجراءات. قسمهم إلى مجموعتين تجريبيتين ، تتكون كل منهما من 10 سدود.
- حفز الجراء في المجموعة الأولى ، مجموعة PP ، مع محفزات وخز من PND 2 إلى PND 15.
- قم بتعيين المجموعة الثانية كمجموعة CC ، والتي تعمل كعنصر تحكم ، مع عدم تلقي الجراء في هذه المجموعة لتحفيز الوخز.
- مراقبة سلوك الأم للسدود ووزن الفضلات بجد طوال هذه الفترة.
9. تقييمات ما بعد الفطام والاختبارات السلوكية
- فطم النسل على PND 22. قم بفرزها حسب الجنس ووضعها في أقفاص بسعة قصوى تبلغ 4 لكل منها حتى تصل إلى حوالي 8 أسابيع من العمر.
- بعد ذلك ، أخضع هذه لتقييمات الحساسية للمنبهات المؤلمة باستخدام اختبار فون فراي الإلكتروني. ركز بشكل خاص على الألم الناجم عن الالتهاب من CFA.
- للتخفيف من أي تأثيرات محتملة متعلقة بالفضلات ، حدد 1 ذكر و 1 أنثى فأر من كل قمامة لكل مجموعة تجريبية للخضوع لاختبار سلوكي أثناء مرحلة البلوغ.
- استخدم كل في تجربة واحدة لتجنب تدخل العامل الهرموني في الاستجابات المسببة للألم لإناث الفئران. على وجه التحديد ، تأكد من إجراء الاختبارات على الإناث خلال مرحلة ديستروس من دورة الشبق.
10. تحريض آلام حديثي الولادة المتكرر
- إحداث آلام متكررة لحديثي الولادة باستخدام تقنية وخز القرص المشابهة لتلك الموصوفة في دراسة سابقة20. ابدأ محفزات وخز الدبوس اليومية لصغار الفئران بدءا من اليوم 2 بعد الولادة (PND 2) واستمر في هذه الممارسة حتى PND 15.
- أدخل إبرة 22 جم بعناية إلى عمق ضحل في المنطقة الأخمصية الوسطى من المخلب الخلفي الأيمن.
- تأكد من أن الاختراق كاف للتحفيز دون التسبب في إصابة لا داعي لها. قم بمعايرة المقياس لمنع الاختراق الأعمق ، مع الأخذ في الاعتبار خطر مروره بالكامل عبر المخلب في هذا العمر.
- في حالة حدوث نزيف ، أوقفه على الفور باستخدام مسحة قطنية ؛ عادة ما يستمر هذا التدخل بضع ثوان فقط. قم بإدارة المحفزات 4 مرات ، مع الحفاظ على فجوة مدتها دقيقتان بين كل منهما ، بإجمالي 8 وخز في اليوم.
- لتقليل العوامل المربكة المحتملة المتعلقة بانفصال الأمهات والتعامل مع حديثي الولادة ، افصل صغار الفئران عن سدودها لمدة أقصاها 5 دقائق. قم بتطبيق نفس مدة الفصل على مجموعة التحكم. بعد كل مجموعة من المحفزات ، أعد صغار الفئران على الفور إلى سدودها5،21،22.
11. تقييم سلوكيات الأم
- لتقييم سلوك الأم ، قم بتقييم سلوك السدود في كلتا المجموعتين التجريبيتين (ن = 10 لكل مجموعة) من PND 2 إلى PND 15. قم بإجراء التقييم في جلستين: واحدة في الصباح ، قبل محفزات وخز الدبوس على صغار الفئران (بين الساعة 08:00 و 09:30) ، وواحدة في فترة ما بعد الظهر ، بعد محفزات وخز الدبوس على صغار الفئران (بين الساعة 15:00 و 16:30).
- خلال هذه الجلسات ، راقب بجد سلوك كل أم وسجله وسجله كل 3 دقائق خلال هذه الجلسات ، مما يؤدي إلى 30 ملاحظة لكل فترة في اليوم. يتراكم هذا إلى ما مجموعه 60 ملاحظة لكل أم في اليوم.
12. تسجيل سلوكيات الأمهات وغير الأمومة
- سجل معايير سلوك الأم التي تشمل إجراءات مثل الاستمالة أو اللعق (على الجسم أو منطقة الالتهاب التناسلي) ، والرضاعة ، والحفاظ على ظهر مقوس في "بطانية" مثل الموقف عن طريق الاستلقاء على الجراء ، والاستلقاء بشكل سلبي على ظهره أو جانبه أثناء الرضاعة ، والانخراط في بناء الأعشاش ، والاستمالة الذاتية للأم (بما في ذلك تحفيز الثديين من خلال التنظيف الذاتي).
- توثيق معايير السلوك غير الأمومي ، بما في ذلك إجراءات مثل التغذية ، واستكشاف سكن القفص ، وعدم الاستكشاف ، وغياب الاستمالة الذاتية للأمهات.
- عرض البيانات كنسبة مئوية من إجمالي سلوك الأم وسلوك غير الأمومة. اقسم عدد الملاحظات المسجلة للسلوك المستهدف على إجمالي عدد الملاحظات واضرب النتيجة في 100 5,23,24.
13. تقييم وزن القمامة
- خلال مرحلة تحفيز وخز الدبوس (PND 2-15) ، راقب وزن الفضلات في كل من مجموعات PP و CC ، كل منها يتكون من 8 لترات.
- خلال مرحلة تحفيز وخز الدبوس (PND 2-15) ، حافظ على فحص مستمر لوزن الفضلات في كل من مجموعات PP و CC ، كل منها يتكون من 8 لترات.
14. اختبار العتبة الميكانيكية
- في هذه التجربة ، قم بإعطاء حقن إما من محلول ملحي أو CFA ، كل منهما بحجم 100 ميكرولتر ، للفئران (8 أسابيع) من مجموعات PP و CC. بعد ذلك ، ضعها بشكل فردي في أقفاص أكريليك (42 سم × 24 سم × 15 سم) مع أرضيات شبكية سلكية قبل 15-30 دقيقة من الاختبار لتقييم فرط الألم الميكانيكي.
- في الاختبار ، قم بتحفيز منعكس ثني المخلب الخلفي باستخدام محول قوة محمول باليد مزود بطرف بولي بروبيلين 0.5 مم2 (فون فراي الإلكتروني).
- ضع الطرف تدريجيا بين وسادات القدم الخمس البعيدة للمخلب الخلفي الأيمن ، مع زيادة الضغط حتى يتم ملاحظة الاستجابة.
ملاحظة: عندما يحدث تراجع المخلب ، يتوقف المنبه تلقائيا ، ويتم توثيق قوته. يختتم الاختبار باستجابة واضحة من الجفل متبوعة بسحب المخلب. يؤدي إعطاء CFA تحت الجلد إلى التهاب طويل الأمد ، ويبلغ ذروته عند 24 ساعة ويستمر لمدة 7 أيام على الأقل25.
- ضع الطرف تدريجيا بين وسادات القدم الخمس البعيدة للمخلب الخلفي الأيمن ، مع زيادة الضغط حتى يتم ملاحظة الاستجابة.
- إجراء اختبارات على قبل وبعد 4 ساعات و 7 ساعات و 10 ساعات و 24 ساعة بعد إعطاء المحلول الملحي أو CFA4. اعرض النتائج من حيث عتبة الانسحاب المقاسة بالجرام (جم) ، واحسبها بمتوسط ثلاثة قياسات.
- لمنع تداخل العوامل الهرمونية المحتملة في استجابات الشعور بالألم بين النسل الإناث ، تأكد من إجراء الاختبارات حصريا خلال مرحلة الديستروس من دورة الشبق.
15. تحليل البيانات
- معالجة البيانات باستخدام برنامج التحليل الإحصائي وتقديمها كمتوسط ± الخطأ المعياري للمتوسط (SEM). لتحديد الفروق ذات الدلالة الإحصائية بين المجموعات ، قم بتطبيق تحليل ثنائي الاتجاه للتباين (ANOVA) مع مقاييس متكررة ، مع مراعاة عوامل مثل تقييم معايير الأم مقابل المعلمات غير الأمومية وتقييم وزن القمامة.
- على وجه التحديد ، قم بتحليل محفزات PND و pinck لمعايير الأم و von Frey: محفزات CFA و pinquick لتقييم وزن القمامة. قم بإجراء تحليل لاحق باستخدام اختبار Bonferroni عند الحاجة.
النتائج
في هذه الدراسة ، لم تكن هناك فروق في سلوك الأمومة أو غير الأمومة بين الأمهات ، بغض النظر عما إذا كان ذريتهن قد خضع لتجارب وخز البوس خلال فترة حديثي الولادة أو كانوا خديجا أو أوانا (الشكل 1). فيما يتعلق بسلوك الأم للأمهات بالتبني من النسل الخدج ، أظهر ANOVA ثنائي الاتجاه أنه كان هناك تأثير PND (يوم ما بعد الولادة) ولكن لا يوجد تأثير لمحفزات وخز الدبوس أو أي تفاعل بين العاملين في تقييم سلوك الأم المرصود في الساعة 8 صباحا [عامل PND: F (13 ، 140) = 6.31 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (1 ، 140) = 1.04 ، ص = 0.30 ؛ محفز الوخز × تفاعل PND: F (13 ، 140) = 0.55 ، ص = 0.88 ؛ الشكل 1 أ]؛ أو في الساعة 3 مساء [عامل PND: F (13 ، 140) = 16.97 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (1 ، 140) = 3.27 ، ص = 0.07 ؛ تحفيز الوخز × تفاعل PND: F (13 ، 140) = 1.82 ، ص = 0.04 ؛ الشكل 1 ج]. فيما يتعلق بالسلوك غير الأمومي ، كان هناك تأثير ملحوظ بسبب PND ، ولكن لم يكن هناك تأثير كبير من محفزات وخز الدبوس أو التفاعل بين هذين العاملين في الساعة 8 صباحا [عامل PND: F (13 ، 140) = 6.31 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (1 ، 140) = 1.04 ، ص = 0.30 ؛ التفاعل بين محفز وخز الدبوس و PND: F (13 ، 140) = 0.55 ، ص = 0.88 ؛ انظر الشكل 1 ب]. وبالمثل ، بينما استمر تأثير PND ، لم يكن تأثير محفزات الوخز وتفاعله مع PND ذا دلالة إحصائية في الساعة 3 مساء [عامل PND: F (13 ، 140) = 16.97 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (1 ، 140) = 3.27 ، ص = 0.07. كشف ANOVA ثنائي الاتجاه عن تأثير جدير بالملاحظة ل PND ، والأهم من ذلك ، تفاعل كبير بين محفزات الوخز و PND في الساعة 3:00 مساء (عامل PND: F (13 ، 182) = 13.82 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (1 ، 182) = 3.78 ، ص = 0.05 ؛ تفاعل محفزات PND x pinqueck: F (13 ، 182) = 1.82 ، ص = 0.04 ؛ راجع الشكل 1 د]. يؤكد هذا التفاعل على التأثير الواضح لمحفزات وخز القرصة على السلوك غير الأمومي ، والذي يتضح بشكل خاص في تقييم فترة ما بعد الظهر.
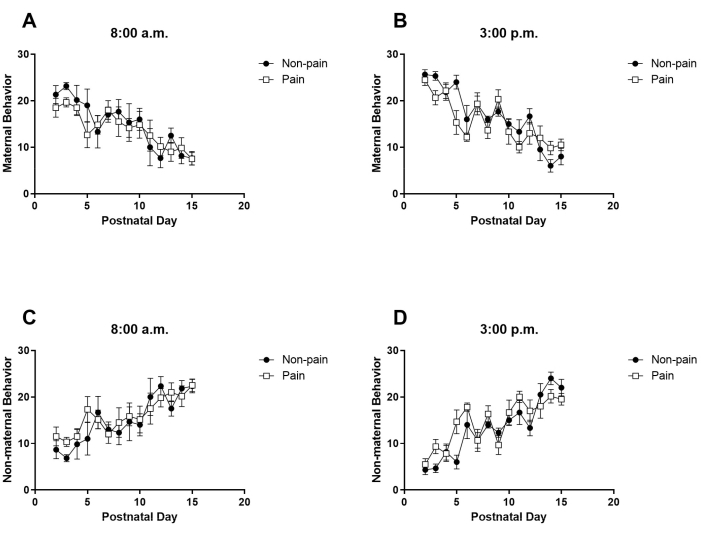
الشكل 1: آثار وخز الدبوس خلال فترة حديثي الولادة (PND 2-15) على سلوك الأمهات بالتبني من ذرية مبتسرة. (أ) عدد سلوكيات الأمومة المسجلة التي تم تقييمها في الساعة 8:00 صباحا (ب) عدد السلوكيات غير الأمومية المسجلة التي تم تقييمها في الساعة 8:00 صباحا (ج) عدد السلوكيات الأمومية المسجلة التي تم تقييمها في الساعة 3:00 مساء (د) عدد السلوكيات غير الأمومية المسجلة التي تم تقييمها في الساعة 3:00 مساء. تمثل كل نقطة متوسط ± التسويق بالروبوت الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
يوضح الشكل 2 زيادة وزن القمامة المبكرة خلال الفترة التي تم فيها تطبيق محفز وخز الدبوس (PND 2-15). لم يلاحظ أي تغييرات في وزن القمامة بين مجموعة CC (التحكم) ومجموعة PP (الوخز). كشف ANOVA ثنائي الاتجاه عن تأثير كبير ل PND ولكن لا توجد تأثيرات ذات دلالة إحصائية لتحفيز وخز الدبوس أو التفاعل بين العاملين على وزن القمامة [عامل PND: F (13 ، 140) = 247.5 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (1 ، 140) = 0.89 ، ص = 0.34 ؛ تحفيز وخز × تفاعل PND: F (13 ، 140) = 0.05 ، ص = 1.00].

الشكل 2 - آثار وخز الدبوس خلال فترة حديثي الولادة (PND 2-15) على وزن القمامة المبكرة بالجرام. تمثل كل نقطة متوسط ± SEM ل 8. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
لوحظت تأثيرات رئيسية كبيرة لمحفزات وخز الدبوس و CFA على عتبة انسحاب المخلب ، مع انخفاض كبير (ص < 0.001) واضح في ذكور الجراء من مجموعات CC / CFA و PP / CFA في جميع النقاط الزمنية مقارنة بتلك الموجودة في مجموعات CC / Sal و PP / Sal (الشكل 3 أ). هذا يؤكد التأثير القوي لكل من محفزات وخز السن و CFA على استجابات الشعور بالألم لدى الجراء الذكور. والجدير بالذكر أنه بعد 4 ساعات من حقن CFA ، لوحظ انخفاض كبير في PWT (p < 0.001) في مجموعة PP / CFA مقارنة بمجموعة CC / CFA [عامل CFA: F (4,112) = 13.12 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (3,112) = 14.45 ، ص < 0.05 ؛ CFA × تفاعل تحفيز الوخز الدبوس: F (12،112) = 5.14 ، ص < 0.05]. فيما يتعلق بإناث الجراء (الشكل 3 ب) ، لوحظ انخفاض في عتبة الانسحاب (p < 0.001) في مجموعات CC / CFA و PP / CFA في جميع النقاط الزمنية مقارنة بتلك الموجودة في مجموعات CC / Sal و PP / SAL. على وجه التحديد, بعد 4 ساعات من حقن CFA, لوحظ انخفاض كبير في عتبة الانسحاب (p < 0.05) في مجموعة PP / CFA مقارنة بمجموعة CC / CFA [عامل CFA: F (4,112) = 31.16 ، ص < 0.001 ؛ عامل تحفيز الوخز: F (3,112) = 18.22 ، ص < 0.01 ؛ CFA × تفاعل تحفيز الوخز: F (12،112) = 58.13 ، ص < 0.01]. أظهر كل من البالغين والبالغين عتبة انسحاب مخلب مخفضة بين مجموعة PP / CFA ومجموعة CC / CFA في جميع النقاط الزمنية بدءا من علامة 4 ساعات.

الشكل 3 - آثار وخز الدبوس خلال فترة حديثي الولادة (PND 2-15) في الفضلات الخدجة على الألم وفقا لاختبار فون فراي قبل وبعد حقن CFA داخل الأخمص أو محلول ملحي. عتبة انسحاب المخلب ، بالجرام ، في (أ) ذكور الفئران أو (ب) إناث الفئران. تمثل كل نقطة متوسط ± SEM ل 8. * p < 0.05 و *** p < 0.001 مقارنة بالمجموعات الشاهدة وPP/Salte مقابل المجموعات الشاهدة وPP/CFA؛ # ص < 0.01 مقارنة مجموعة CFA للتحكم بمجموعة PP / CFA. يمثل BASAL عتبة الألم المقاسة قبل الحقن داخل أخمص البحر CFA أو المحلول الملحي. يشير السهم إلى وقت الحقن داخل أخمص البحر المالي الأفريقي أو المحلول الملحي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في هذا التحقيق ، لاحظنا أن سلوكيات الأمهات وغير الأمومة ظلت غير متأثرة بتجارب وخز البوس حديثي الولادة. امتد هذا الاتجاه إلى السلوك غير الأمومي أيضا. علاوة على ذلك ، لم تكن زيادة الوزن في الفضلات الخدجة خلال فترة تحفيز وخز الدبوس مختلفة بشكل كبير بين مجموعات التحكم والوخز. كشفت تحليلات عتبة انسحاب المخلب عن انخفاض ملحوظ في كل من الجراء من الذكور والإناث من مجموعات وخز الدبوس و CFA مقارنة بتلك الموجودة في مجموعات التحكم. كان اللافت للنظر بشكل خاص ملاحظة انخفاض إضافي في عتبة سحب المخلب بعد 4 ساعات من حقن CFA في مجموعة الوخز / CFA مقارنة بمجموعة التحكم / CFA. تؤكد هذه النتائج الدقيقة على التأثيرات متعددة الأوجه لتحفيز وخز الدبوس عند حديثي الولادة على سلوك الأم ، وزيادة وزن القمامة ، واستجابات الألم لدى النسل ، مع التأكيد على أهمية مراعاة كل من الحالات المبكرة والولادة عند تفسير النتائج.
يتماشى استكشافنا للاستجابات المسببة للألم مع نتائج de Carvalho et al.26 ويوسعها ، الذين أبلغوا عن تغييرات في استجابات الشعور بالألم وفرط الحساسية الالتهابية في مرحلة البلوغ الناتجة عن تحفيز وخز الدبوس المتكرر في النسل الخدج. يؤكد هذا التقارب في النتائج على التأثير الدائم لتجارب الولدان على مسارات الشعور بالألم ، مع التأكيد على متانة هذه النتائج عبر الدراسات. اقترحت الحساسية المتزايدة الملحوظة للمنبهات الضارة في كل من الذكور والإناث المعرضين لتحفيز وخز الدبوس عند حديثي الولادة اتجاها ثابتا في تعديل استجابات الشعور بالألم ، مما يساهم بشكل أكبر في فهمنا للعواقب طويلة المدى لضغوط الحياة المبكرة.
تتوافق نتائج هذه الدراسة أيضا مع عمل Gieré et al.27 ، الذين استكشفوا فرط الحساسية الناجم عن الألم في الفئران البالغة بعد انفصال الأمهات حديثي الولادة. اقترحت دراستهم أصلا مركزيا لفرط الحساسية الناجم عن الألم ، مما يعزز فكرة أن الضغوطات في وقت مبكر من الحياة يمكن أن تحفز تغييرات دائمة في آليات معالجة الألم. يؤكد تقارب النتائج على التفاعل المعقد بين أحداث الحياة المبكرة واستجابات الألم ، مما يؤكد الحاجة إلى فهم شامل للآليات المركزية التي تساهم في التغيرات طويلة المدى في حساسية الألم.
يتم دعم تأثير تجارب الحياة المبكرة على مسارات الشعور بالألم من خلال النتائج التي توصل إليها Chang et al.28 ، الذين حققوا في التغيرات في اتصال الألم الوظيفي في قشرة الفص الجبهي الإنسي للفئران بعد تجارب الألم في وقت مبكر من الحياة. سلط عملهم الضوء على التغييرات طويلة المدى في آليات معالجة الألم الناجمة عن الضغوطات في وقت مبكر من الحياة ، مع التأكيد على أهمية فهم الارتباطات العصبية للاستجابات العصبية لاستجابات الألم. يساهم دمج هذه النتائج مع ملاحظات الحساسية المتزايدة للمنبهات الضارة في النسل الخدج المعرضين لتحفيز وخز الدبوس الوليدي في فهم أكثر شمولا للعواقب الدائمة لتجارب الألم في وقت مبكر من الحياة على دوائر الألم لدى البالغين.
بالإضافة إلى ذلك ، أظهر van den Hoogen et al.29 أن اللمس المتكرر وتحفيز وخز الإبرة خلال فترة حديثي الولادة زاد من الحساسية الميكانيكية الأساسية وفرط الحساسية بعد الإصابة في الخلايا العصبية الحسية للنخاع الشوكي للبالغين. تؤكد النتائج الحالية ، التي تتماشى مع الأبحاث السابقة ، على العواقب الدائمة لتجارب الألم لدى الأطفال حديثي الولادة على مسارات الألم. تؤكد هذه الدراسات معا على أهمية التعرف على التأثير طويل المدى لتجارب الحياة المبكرة على حساسية الألم لدى البالغين ، مما يساهم في فهم شامل للتفاعل المعقد بين محفزات حديثي الولادة واستجابات الألم.
من خلال الجمع بين الولادة المبتسرة والتعرض للمحفزات المؤلمة خلال فترة الولدان، قمنا بتطوير نموذج يحاكي عن كثب تجارب الحياة المبكرة للرضع الخدج من البشر، مع مراعاة الحاجة الملحة للعناية المركزة التي يستلزمها الخداج. ومع ذلك، فإن الأهمية الانتقالية لهذا النموذج، خاصة فيما يتعلق بتجارب وحدة العناية المركزة لحديثي الولادة للخدج، تتطلب مزيدا من التوضيح. والجدير بالذكر أنه لم يتم تحديد أي دراسات تستخدم نموذجا مشابها للنموذج المستخدم في هذه الدراسة. ومع ذلك ، عند النظر في الأيام الأولى من الحياة (1-2) على أنها تمثيل للخداج ، فقد أظهرت الأبحاث السابقة أن الذكور يظهرون عرضة أكبر لمحفزات الألم من الإناث خلال هذه الفترة الحرجة. تم تأكيد هذا الضعف من خلال اختبارات آلام المطبقة في مرحلة البلوغ ، مما يوفر تبريرا جزئيا للنتائج الملحوظة لهذه الدراسة30.
كانت الدراسة الحالية رائدة في استخدام الخدج المولودة بالولادة القيصرية في 19 يوما من الحمل لتقييم عتبة الألم في مرحلة البلوغ. يوفر هذا النموذج الجديد لدراسة الألم عند الأطفال الخدج منظورا فريدا لهذه الفئة من السكان. يثير هذا النموذج أسئلة جديدة تتعلق باختبارات آلام ، مثل اختبار فون فراي ، في البالغة من كلا الجنسين ، بالإضافة إلى جميع الجوانب التي تنطوي عليها عتبات الألم لهذه ، سواء خلال فترة حديثي الولادة أو في مرحلة البلوغ.
في حين أن الدراسة الحالية ركزت بشكل أساسي على تأثير محفزات وخز الولدان على عتبات الألم في المراحل اللاحقة من الحياة ، إلا أن هناك وسيلة واعدة لتوسيع نطاق هذا البحث ليشمل التدخلات واستراتيجيات تسكين ما بعد الولادة. يمكن للدراسات المستقبلية تقييم فعالية تدخلات إدارة الألم المختلفة في نموذج الفئران الخدج، واستكشاف السبل المحتملة للتخفيف من الآثار طويلة المدى لألم الولدان. قد يشمل ذلك التحقيق في مناهج المسكنات الجديدة، وتقييم مدة وشدة التدخلات اللازمة، واستكشاف الآليات الأساسية التي تؤثر على فعالية هذه التدخلات.
في الختام ، يهدف التحقيق الشامل الذي تم إجراؤه في هذه الدراسة إلى تشريح التفاعل المعقد لتحفيز وخز الدبوس عند حديثي الولادة ، وسلوك الأم ، وظروف الولادة المبكرة على استجابات الشعور بالألم في النسل. أعاد التحليل الدقيق لسلوك الأم ، إلى جانب استبعاد العوامل المربكة المحتملة مثل الولادة المبكرة وتقديم الرعاية بالتبني ، التأكيد على مرونة سلوك الأم في مواجهة محفز الألم المعيار. ظلت زيادة الوزن في الفضلات المبكرة غير متأثرة ، مما يشير إلى أن التغيرات الملحوظة في استجابات الشعور بالألم أثناء مرحلة البلوغ تعزى على الأرجح إلى تحفيز وخز الدبوس في وقت مبكر من رعاية الأم أو نمو النسل. تتوافق نتائج هذه الدراسة مع الأدبيات المتعلقة بالعواقب الدائمة لتجارب الألم لدى الأطفال حديثي الولادة ، مع التركيز على الحساسية المتزايدة للمنبهات الضارة في مرحلة البلوغ. علاوة على ذلك ، فإن استكشاف النظريات الميكانيكية المحتملة ، بما في ذلك التعديلات في المعالجة العصبية ووظيفة مستقبلات الجلوكوكورتيكويد ، يوفر رؤى قيمة حول المسارات الأساسية التي تساهم في التغيرات العاطفية للألم. تؤكد النتائج المقدمة هنا ونتائج الدراسات السابقة معا على تعقيد تجارب الحياة المبكرة في مسارات الشعور بالألم ، مما يلقي الضوء على العواقب الدائمة لمحفزات حديثي الولادة على دوائر الألم لدى البالغين. في حين أن هناك ما يبرر إجراء مزيد من البحث لتوضيح الآليات الأساسية الدقيقة المعنية ، فإن هذه الدراسة تساهم في مجموعة المعرفة المتزايدة التي تهدف إلى الكشف عن التأثير طويل المدى لأحداث الحياة المبكرة على استجابات الألم لدى النسل البالغ.
Disclosures
ليس لدينا ما نفصح عنه.
Acknowledgements
وحظي هذا العمل بدعم من جامعة ألفيناس الفيدرالية - UNIFAL-MG و Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brazil (CAPES Fellowship, Laura Pereira Generoso; ناتالي لانج كانديدو وماريا غابرييلا مازييرو كابيلو) - رمز التمويل 001.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | Concare, Brazil | ||
| Acrylic cages (42 cm × 24 cm × 15 cm) with wire grid floors | Insight Equipamentos, Brazil | ||
| Complete Freund's Adjuvant (CFA) | Sigma Aldrich, Brazil | ||
| Electronic von Frey, | Insight Equipamentos, Brazil | ||
| H2O2 (hydrogen peroxide) | ACS Cientifica, Brazil | ||
| Infrared lighting | Carci, Brazil | ||
| Isoflurane (2%) | Cristália, Brazil | ||
| Upright microscope | Nikon, Brazil | ECLIPSE Ei | Microscope with 10x and 40x objective lenses |
References
- Cooper, A. H., Hanmer, J. M., Chapman, V., Hathway, G. J. Neonatal complete Freund's adjuvant-induced inflammation does not induce or alter hyperalgesic priming or alter adult distributions of C-fibre dorsal horn innervation. Pain Reports. 5 (6), e872 (2020).
- Davis, S. M., Rice, M., Burman, M. A. Inflammatory neonatal pain disrupts maternal behavior and subsequent fear conditioning in a rodent model. Developmental Psychobiology. 62 (1), 88-98 (2020).
- Mooney-Leber, S. M., Brummelte, S. Neonatal pain and reduced maternal care alter adult behavior and hypothalamic-pituitary-adrenal axis reactivity in a sex-specific manner. Developmental Psychobiology. 62 (5), 631-643 (2020).
- Vilela, F. C., Vieira, J. S., Giusti-Paiva, A., Silva, M. L. D. Experiencing early life maternal separation increases pain sensitivity in adult offspring. International Journal of Developmental Neuroscience. 62, 8-14 (2017).
- de Carvalho, R. C., et al. Repeated neonatal needle-prick stimulation increases inflammatory mechanical hypersensitivity in adult rats. International Journal of Developmental Neuroscience. 78, 191-197 (2019).
- Carbajal, R., et al. Epidemiology and treatment of painful procedures in neonates in intensive care units. JAMA. 300 (1), 60-70 (2008).
- Cong, X., et al. The impact of cumulative pain/stress on neurobehavioral development of preterm infants in the NICU. Early Human Development. 108, 9-16 (2017).
- König, K., Stock, E. L., Jarvis, M. Noise levels of neonatal high-flow nasal cannula devices - An in-vitro study. Neonatology. 103 (4), 264-267 (2013).
- Newnham, C. A., Inder, T. E., Milgrom, J. Measuring preterm cumulative stressors within the NICU: the Neonatal Infant Stressor Scale. Early Human Development. 85 (9), 549-555 (2009).
- De Clifford-Faugère, G., Aita, M., Arbour, C., Colson, S. Development, evaluation and adaptation of a critical realism informed theory of procedural pain management in preterm infants: The PAIN-Neo theory. Journal of Advanced Nursing. 79 (6), 2155-2166 (2023).
- Barkhuizen, M., et al. Nitric oxide production in the striatum and cerebellum of a rat model of preterm global perinatal asphyxia. Neurotoxicity Research. 31 (3), 400-409 (2017).
- Remesal, A., et al. Effect of prenatal steroidal inhibition of sPLA2 in a rat model of preterm lung. Pulmonary Pharmacology & Therapeutics. 36, 31-36 (2016).
- Corsini, I., et al. Peroxisome proliferator-activated receptor-γ agonist pioglitazone reduces the development of necrotizing enterocolitis in a neonatal preterm rat model. Pediatric Research. 81 (2), 364-368 (2017).
- Grases-Pintó, B., et al. A preterm rat model for immunonutritional studies. Nutrients. 11 (5), 999 (2019).
- Marcondes, F. K., Bianchi, F. J., Tanno, A. P. Determination of the estrous cycle phases of rats: some helpful considerations. Brazilian Journal of Biology. 62 (4), 609-614 (2002).
- Zhu, M. -. R., Liu, H. -. Y., Liu, P. -. P., Wu, H. Establishment of the patent ductus arteriosus model in preterm rats. Chinese Journal of Contemporary Pediatrics. 18, 372-375 (2016).
- Bowers, D., McKenzie, D., Dutta, D., Wheeless, C. R., Cohen, W. R. Growth hormone treatment after cesarean delivery in rats increases the strength of the uterine scar. American Journal of Obstetrics and Gynecology. 185 (3), 614-617 (2001).
- Wang, J., et al. Whey peptides improve wound healing following caesarean section in rats. The British Journal of Nutrition. 104 (11), 1621-1627 (2010).
- Appleby, C. J., Towner, R. A. Magnetic resonance imaging of pulmonary damage in the term and premature rat neonate exposed to hyperoxia. Pediatric Research. 50 (4), 502-507 (2001).
- Anand, K. J., Coskun, V., Thrivikraman, K. V., Nemeroff, C. B., Plotsky, P. M. Long-term behavioral effects of repetitive pain in neonatal rat pups. Physiology & Behavior. 66 (4), 627-637 (1999).
- Tal, M., Bennett, G. J. Extra-territorial pain in rats with a peripheral mononeuropathy: mechano-hyperalgesia and mechano-allodynia in the territory of an uninjured nerve. Pain. 57 (3), 375-382 (1994).
- Chen, M., et al. Neonatal repetitive pain in rats leads to impaired spatial learning and dysregulated hypothalamic-pituitary-adrenal axis function in later life. Scientific Reports. 6 (1), 39159 (2016).
- Costa, H. H., Vilela, F. C., Giusti-Paiva, A. Continuous central infusion of cannabinoid receptor agonist WIN 55,212-2 decreases maternal care in lactating rats: consequences for fear conditioning in adulthood males. Behavioural Brain Research. 257, 31-38 (2013).
- Vilela, F. C., Ruginsk, S. G., de Melo, C. M., Giusti-Paiva, A. The CB1 cannabinoid receptor mediates glucocorticoid-induced effects on behavioural and neuronal responses during lactation. Pflugers Archiv: European Journal of Physiology. 465 (8), 1197-1207 (2013).
- Fehrenbacher, J. C., Vasko, M. R., Duarte, D. B. Models of inflammation: Carrageenan- or complete Freund's Adjuvant (CFA)-induced edema and hypersensitivity in the rat. Current Protocols in Pharmacology. , (2012).
- de Carvalho, R. C., et al. Effects of repetitive pinprick stimulation on preterm offspring: Alterations in nociceptive responses and inflammatory hypersensitivity in adulthood. Behavioural Brain Research. 454, 114633 (2023).
- Gieré, C., et al. Towards a central origin of nociceptive hypersensitivity in adult rats after a neonatal maternal separation. The European Journal of Neuroscience. 58 (10), 4155-4165 (2023).
- Chang, P., Fabrizi, L., Fitzgerald, M. Early life pain experience changes adult functional pain connectivity in the rat somatosensory and the medial prefrontal cortex. The Journal of Neuroscience. 42 (44), 8284-8296 (2022).
- vanden Hoogen, N. J., et al. Repeated touch and needle-prick stimulation in the neonatal period increases the baseline mechanical sensitivity and postinjury hypersensitivity of adult spinal sensory neurons. Pain. 159 (6), 1166-1175 (2018).
- Butkevich, I. P., Mikhailenko, V. A. Long-term effects of neonatal pain and stress on reactivity of the nociceptive system. Bulletin of Experimental Biology and Medicine. 161 (6), 755-758 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved