Method Article
تقييم استهلاك الأكسجين في الميتوكوندريا باستخدام مقايسة الفلورسنت القائمة على قارئ اللوحة
In This Article
Erratum Notice
Summary
يوفر تقييم استهلاك الأكسجين معلومات متكاملة حول وظيفة الميتوكوندريا. باستخدام مسبار فسفوري مع قارئ لوحة فلورية ، يمكن الحصول على بيانات دقيقة وقابلة للتكرار بسهولة بدون معدات متخصصة. يمكن هذا الاختبار أي مختبر من قياس استهلاك الأكسجين للميتوكوندريا المعزولة وحساب نسب التحكم في الجهاز التنفسي.
Abstract
تخدم الميتوكوندريا العديد من الوظائف المهمة ، بما في ذلك التنفس الخلوي ، وإنتاج ATP ، والتحكم في موت الخلايا المبرمج ، والعمل كمحور مركزي لمسارات التمثيل الغذائي. لذلك ، يمكن أن يوفر التقييم التجريبي لوظائف الميتوكوندريا نظرة ثاقبة للاختلافات بين المجموعات السكانية المختلفة أو الحالات المرضية. بالإضافة إلى ذلك ، من المفيد تقييم ما إذا كانت الميتوكوندريا المعزولة صحية بما يكفي لمتابعة التجارب. إحدى الخصائص التي غالبا ما تستخدم لمقارنة وظيفة الميتوكوندريا في عينات مختلفة هي معدل استهلاك الأكسجين. يمكن أن يخدم استهلاك الأكسجين والحساب اللاحق لنسبة التحكم في الجهاز التنفسي في الخلايا السليمة أو الميتوكوندريا المعزولة من الأنسجة الأغراض الثلاثة. باستخدام الميتوكوندريا المعزولة من كبد سحالي الفرشاة بالتزامن مع مسبار فسفوري حساس للتقلبات في تركيز الأكسجين في المحلول ، قمنا بقياس استهلاك الأكسجين باستخدام قارئ لوحة الفلورسنت. هذه الطريقة ليست سريعة وفعالة فحسب ، بل يمكن إجراؤها أيضا بكمية صغيرة من الميتوكوندريا ودون الحاجة إلى معدات متخصصة. يزيد البروتوكول خطوة بخطوة الموصوف هنا من إمكانية وصول الباحثين إلى التقييم الوظيفي للميتوكوندريا.
Introduction
الميتوكوندريا هي عضيات ، بحجم البكتيريا تقريبا ، توجد في الخلايا حقيقية النواة. إنها عضيات فريدة لأنها تحتوي على الحمض النووي ولها غشاءان ، أحدهما خارجي وداخلي. يتم فصل الأغشية الخارجية والداخلية للميتوكوندريا عن طريق مساحة بين الغشاء ، ويتم طي الغشاء الداخلي في هياكل تسمى كريستا حول الحجرة الأعمق ، والتي تسمى المصفوفة. تزيد هذه الكريستا من مساحة سطح الغشاء الداخلي بحيث يمكن أن تحدث عمليات متعددة تستخدم الكريستا في وقت واحد. بينما تشارك الميتوكوندريا في العديد من الوظائف الخلوية مثل التحكم في موت الخلايا المبرمج وإيواء مسارات التمثيل الغذائي المتعددة ، فإن دورها الحيوي في إنتاج ATP ضروري لبقاء الخلية. في الواقع ، 90٪ من طاقة الخلية مشتقة من الميتوكوندريا1. يتضمن إنتاج ATP توليد فرق كهروكيميائي عبر الأغشية الخارجية والداخلية ، يسمى إمكانات غشاء الميتوكوندريا (Δψ) ، والتي تنشأ عندما يتم ضخ أيونات H + من المصفوفة إلى الفضاء بين الغشاء. يتم تسخير إنتاج ATP في النهاية أثناء أكسدة المكافئات المختزلة عن طريق حركة الإلكترون عبر سلسلة الجهاز التنفسي للميتوكوندريا (ETC). متقبل الإلكترون النهائي هو الأكسجين الجزيئي (O2). مع استهلاك الأكسجين ، يتراكم فرق تركيز H + إلى الحد الأقصى ، وعند هذه النقطة تتحرك أيونات H + لأسفل تدرج تركيزها من الفضاء بين الغشاء إلى المصفوفة عن طريق المرور عبر مركب سينسيز ATP. تسبب حركة أيونات H + تغييرا توافقيا في سينسيز ATP ، ويتم إحضار ADP بالقرب من الفوسفات غير العضوي للتفاعل وتوليد ATP. أخيرا ، يتم نقل ATP من مصفوفة الميتوكوندريا إلى العصارة الخلوية ويمكن تخزينها أو استخدامها لتسهيل التفاعلات بسبب الكمية الكبيرة من الطاقة الحرة المنبعثة أثناء التحلل المائي للفوسفات. تسمى هذه العملية برمتها بالفسفرة المؤكسدة ، وبما أن الأكسجين يستهلك ، يقال إن الميتوكوندريا تتنفس2.
يمكن استخدام تراكم وقوة Δψ ، وكمية O2 المخفضة (تسمى استهلاك الأكسجين) ، بالإضافة إلى توليد ATP كمؤشرات على صحة الخلية. يمكن قياس الدراسات الوظيفية للميتوكوندريا ، مثل قياس Δψ ، ومحتوى ATP الكلي وإنتاجه ، واستهلاك الأكسجين إما عن طريق الطرق الكيميائية الحيوية التقليدية أو التألق والتلألؤ في المقايسات القائمة على اللوحة. على سبيل المثال ، يمكن مقارنة إمكانات غشاء الميتوكوندريا بين عينات مختلفة باستخدام أصباغ الفلورسنت مثل إستر رباعي ميثيل رودامين إيثيل ، الذي يرتبط على وجه التحديد بالميتوكوندريا. يمكن مراقبة توليد ATP عن طريق إضافة بروتين مضيء إلى تفاعل ترتبط تغيره بتركيز ATP. يمكن أن يساعد القياس الكمي لمعدلات استهلاك الأكسجين ، أو المعدلات المطلقة للتنفس ، أثناء OXPHOS ، في توضيح أسباب التفاوتات في وظيفة الميتوكوندريا واستقلاب الطاقة. يمكن استخدام تقييم استهلاك الأكسجين لحساب نسب التحكم في الجهاز التنفسي (RCRs). تصف قيم RCR قدرة الميتوكوندريا على صنع ATP استجابة لتدفق ADP ، وهي الوظيفة الرئيسية للميتوكوندريا. تشير قيم RCR إلى الحالة العامة للميتوكوندريا المعزولة وتسمح بمقارنة الاستجابات للعلاجات التجريبية المختلفة. قد تمثل الاختلافات في قيم RCR خللا وظيفيا في الميتوكوندريا أو تشير إلى اختلاف بيولوجي بين الميتوكوندريا المختلفة المعزولة من مصدرين أو أكثر. مقياس مهم آخر للوظيفة في الميتوكوندريا المعزولة هو كفاءة الميتوكوندريا التي تعرف على أنها مولات ATP مركبة لكل مول من O2 ، أو نسبة P / O3.
نظرا لكمية المعلومات التي يمكن جمعها من قياس معلمات الميتوكوندريا والحالات المختلفة التي يمكن فيها استخدام هذه المعلومات ، يمكن أن تكون القدرة على جمع البيانات الوظيفية بكفاءة مفيدة في العديد من مجالات البحث المختلفة. تم إجراء قياسات استهلاك الأكسجين في الميتوكوندريا لعقود من الزمن باستخدام أجهزة محددة للغاية - باستخدام قطب كلارك ، والذي يمكن أن يكون محدودا بحجم العينة اللازم لإجراء القياسات ، ومؤخرا ، أدوات متطورة يمكنها قياس تنفس الميتوكوندريا والعديد من المعلمات الأخرى ولكن يمكن أن تكون باهظة التكلفة. هذا البروتوكول هو نهج بديل مكيف باستخدام مسبار فسفوري حساس للأكسجين (MitoXpress)4،5. يتم الكشف عن إشارة المسبار باستخدام قارئ لوحة في وضع التألق الذي تم حله بمرور الوقت لإجراء قياسات مستمرة بمرور الوقت. يحتوي الفسفور على فرق طاقة أكبر بين الفوتون الممتص والمنبعث مقارنة بالمضان ، وبالتالي فهو أكثر ملاءمة للمراقبة المستمرة للتغيرات في الإشارة. يتيح ذلك لأي مختبر تقريبا إجراء هذه القياسات ، وليس فقط أولئك الذين يركزون على استقلاب الميتوكوندريا أو الذين يمكنهم تحمل تكاليف المعدات المتخصصة للغاية. النظام النموذجي الذي نستخدمه هو الميتوكوندريا المعزولة من ثلاث سحالي شجرية ، ونوعين من الوالدين وواحد داخلي (يحتوي على الحمض النووي النووي من أحد الأنواع الأبوية والميتوكوندريا من الآخر - الهجينة). تم اختيار هذه السحالي لأننا افترضنا أن هناك عواقب استقلابية وطاقة للهجينة التي لها مصادر مختلفة للحمض النووي النووي والميتوكوندريا. استخدمنا مجموعة فحص متوفرة تجاريا مع قارئ لوحة متعدد الأوضاع يمكنه زيادة الوصول إلى هذا النوع من الاختبارات لمزيد من الباحثين ومجالات البحث.
Protocol
تم القتل الرحيم للسحالي عن طريق الاختناق بثاني أكسيد الكربون2 متبوعا بقطع الرأس الفوري وفقا للسياسات الموضحة في مكتب رعاية مختبرات وإرشادات لجنة رعاية واستخدام المؤسسية في إيلون.
1. عزل الميتوكوندريا6
ملاحظة: حافظ على جميع المحاليل باردة (الجدول 1) والعينات على الجليد خلال هذه الخطوات.
- قم بإزالة الكبد ووزنه ثم اشطفه ب ~ 3 مل من محلول ملحي مخزن بالفوسفات المثلج (1x ، -/-).
- افرم الكبد في 1 مل من L-MIB بشفرة حلاقة جديدة.
- ارفع الحجم الإجمالي للأنسجة بالإضافة إلى L-MIB إلى 2 مل وقم بتعطيل خلايا الكبد ميكانيكيا لمدة أربع تمريرات باستخدام الخالط Dounce.
- قم بتدوير الجانس عند 300 × جم (37 درجة مئوية ، 10 دقائق).
- انقل المادة الطافية إلى أنبوب جديد وضعها على الثلج.
- أعد تعليق الحبيبات في 2 مل من L-MIB ، وأعد تجانس ، ثم قم بالتدوير مرة أخرى عند 300 × جم (37 درجة مئوية ، 10 دقائق).
- اجمع بين المواد الطافية من كل من الدوران وأجهزة الطرد المركزي عند 10,000 × جم (37 درجة مئوية ، 10 دقائق).
- أعد تعليق الحبيبات في ~ 0.350 مل من L-MIB.
- تحديد كمية البروتين الكلي (ملغ من الميتوكوندريا / مل من L-MIB) لاستخدامها كتقريب لمحتوى الميتوكوندريا4،5،6.
2. استهلاك الأكسجين
- قم بتسخين جميع المحاليل المستخدمة (الجدول 1) في الخطوات التالية إلى 30 درجة مئوية في حمام مائي.
- قم بتخفيف الميتوكوندريا في LEB إلى 6 مجم / مل بناء على نتائج فحص تركيز البروتين في الخطوة 1.9.
- قم بإعداد الفحص في لوحة سفلية شفافة معقمة ذات جدار أسود سعة 96 بئرا (الجدول 2).
- أضف 50 ميكرولتر من العينة (عازلة L-EB أو عينة الميتوكوندريا) إلى الآبار المناسبة.
- أضف 50 ميكرولتر من العلاج (L-EB أو الغلوتامات / المالات أو الغلوتامات / الملات مع ADP).
- قم بتخفيف مخزون المسبار 1:10 في L-EB ثم أضف 100 ميكرولتر من مسبار الفلورسنت إلى كل بئر.
- أضف برفق 50 ميكرولتر من الزيت المعدني الثقيل إلى كل بئر لاستبعاد الأكسجين المحيط.
- اقرأ قياسات الفلورسنت من أسفل اللوحة عند 380/650 نانومتر من الإثارة / الانبعاث كل 1.5 دقيقة لمدة 45 دقيقة. استخدم الوضع الحركي مع تأخير زمني يبلغ 30,000 ميكرو ثانية ونافذة قياس تبلغ 100 ميكرو ثانية.
3. تحليل البيانات
- قم بتصدير ملف البيانات الأولية من كمبيوتر قارئ اللوحة كملف .xls.
- افتح الملف، ثم انسخ البيانات الأولية ولصقها في علامة تبويب جديدة، وقم بتسمية الصفوف والأعمدة بشكل مناسب.
- ارسم المخزن المؤقت L-EB فقط على عينة التحكم و L-EB + G / M كوحدات فلورية نسبية (RFU) مقابل الوقت.
ملاحظة: يجب أن تكون هذه الخطوط مسطحة نسبيا حيث لا توجد ميتوكوندريا ، وبالتالي ، لا ينبغي اكتشاف أي تغيير في تركيز الأكسجين. - ارسم قيم عينة L-EB + G/M كRFU مقابل الوقت.
- حدد المكان الذي تصبح فيه القراءات أكثر اتساقا وتسطيحها لعناصر التحكم.
ملاحظة: هذا هو المكان الذي يجب أن يبدأ فيه تحليل البيانات للعينات التجريبية (مميز بأسهم في الشكل 1 أ). يمكن أن تستغرق ردود الفعل من 10 إلى 15 دقيقة لتسطيح وتصل إلى الحد الأقصى. - قم بإنشاء مخطط جديد يحتوي فقط على البيانات بعد النقطة الزمنية المحددة في الخطوة 3.5 (تسمى البيانات "المقتطعة") وأضف الخط الأنسب لتصور البيانات الأولية المراد تحليلها.
- احسب متوسط قيمة RFU لبيانات المخزن المؤقت للتحكم المقتطعة فقط (مظللة باللون الأصفر). تستخدم هذه القيمة كحد أدنى لقيمة RFU كخط الأساس في حساب الأكسجين أدناه.
- حساب معدل استهلاك الأكسجين (ميكرو مولار O2 / دقيقة)
- انسخ والصق المنطقة الخطية للبيانات الأولية من الخطوة 3.6 (أي البيانات المقطوعة) لتحديد تركيز الأكسجين في عينات الميتوكوندريا في معالجة G / M + ADP في كل نقطة زمنية7،8،9،10.
- استخدم المعادلة (1)5 لتحديد تركيز الأكسجين في كل نقطة زمنية. [س2]أ هو تركيز الأكسجين في المخزن المؤقت المشبع بالهواء (235 ملي مولار عند 30 درجة مئوية). I (t) و Ia و Io هي إشارة الفلورسنت للعينة + المسبار في الوقت t (على سبيل المثال ، العينة + G / M + ADP) ، ومتوسط إشارة المسبار في المخزن المؤقت المشبع بالهواء المحسوبة في الخطوة 3.7 ، والإشارة القصوى في المخزن المؤقت غير المؤكسج (تم ضبطه عند الحد الأقصى للإشارة التي يمكن تحقيقها) ، على التوالي.
 (1)
(1) - ارسم قيم [O2] t المحسوبة في الخطوة 3.8.2 مقابل الوقت وأضف خط اتجاه خطي مع معادلة الخط الأنسب.
ملاحظة: استخدم منحدر كل سطر كمعدل استهلاك الأكسجين. يمكن تجميع النسخ المكررة أو الثلاثية لأي عينة واستخدامها لمقارنة معدل الاستهلاك.
- احسب RCR بقسمة تنفس الميتوكوندريا مع وبدون ADP ، والتي تمثل الحالتين 3 و 2 ، على التوالي.
النتائج
تم تحديد معدل استهلاك الأكسجين والميتوكوندريا RCR من الميتوكوندريا لثلاث سحالي مختلفة باستخدام مجموعة فحص مع مسبار استشعار الأكسجين الفسفوري وقارئ لوحة فلورة قياسي. أثبتت الأبحاث السابقة أن المسبار الموجود في هذه المجموعة يرتبط ارتباطا مباشرا باستهلاك الأكسجين ، حيث يتم إخماد الفسفور بواسطة الأكسجين الجزيئي وتزداد إشارة الفلورسنت مع انخفاض مستويات الأكسجين بسبب تنفس الميتوكوندريا7،11. يتم تسجيل قيم RFU بمرور الوقت لكل من عينات التحكم والتجربة ثم تحليلها. تم رسم قراءات RFU لآبار التحكم (العازلة فقط ، والمخزن المؤقت المعالج بالغلوتامات / المالات ، والمخزن المؤقت المعالج بالغلوتامات / المالات + ADP) مع مرور الوقت لإثبات أن أي تغييرات في التألق في آبار العينات التجريبية ترجع إلى وجود الميتوكوندريا. علاوة على ذلك ، يسمح التحكم في الغلوتامات / المالات + ADP بكمية خط الأساس من الأكسجين أثناء جمع البيانات. كما تم رسم عينات تجريبية تحتوي على الميتوكوندريا المعزولة على نفس الرسم البياني مثل الضوابط.
يوضح الشكل 1 أ أن RFUs تزداد بمرور الوقت من عينة من الميتوكوندريا المعزولة ، على عكس قيم RFU المسطحة نسبيا لعناصر التحكم. نظرا لأن التفاعلات تستغرق وقتا لتحقيق التوازن ، تتم إزالة القراءات العشرة الأولى أو نحو ذلك ، حتى لا تكون قراءات عينة التحكم صاخبة ومستوية ، من مجموعة البيانات (الجدول التكميلي S1 والشكل التكميلي S1). بعد ذلك ، يتم تحويل القيم المتبقية من عينة الميتوكوندريا المعالجة بالغلوتامات / المالات + ADP إلى تركيز الأكسجين في كل نقطة زمنية باستخدام المعادلة (1) (انظر خطوة البروتوكول 3.2) ثم يتم رسمها مقابل الوقت. يوضح الشكل 1 ب نتيجة العينة التجريبية التي تظهر في الشكل 1 أ (التقاطع) حيث تكون قيمة R2 قريبة جدا من 1 ويمكن حساب ميل الخط. ميل الخط سالب لأنه مع استهلاك الأكسجين ، ينخفض تركيز الأكسجين الكلي في تلك العينة. تتكرر هذه العملية نفسها لنفس عينات الميتوكوندريا المعالجة بالغلوتامات / المالات بدون ADP للحصول على معدلات استهلاك الأكسجين (الجدول التكميلي S2 والشكل التكميلي S2). بعد ذلك ، يمكن استخدام تنفس الميتوكوندريا مع وبدون ADP ، والتي تمثل الحالتين 3 و 2 ، على التوالي ، لحساب RCR لكل نوع عينة (الشكل التكميلي S2). عند مقارنتها جنبا إلى جنب ، يشير متوسط RCR بين الأنواع الثلاثة المختلفة من سحالي الأشجار إلى أن RCR للهجين مع الميتوكوندريا المدخلة أقل بكثير من أي من النوعين الأبويين (الشكل 1 ج). كان للميتوكوندريا السحلية الهجينة معدلات استهلاك الأكسجين متوسطة للنوعين الأبويين (الشكل 2).
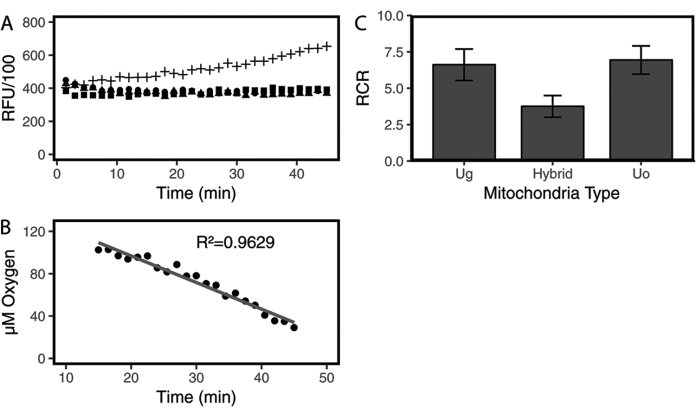
الشكل 1: مثال على نتائج فحص استهلاك الأكسجين. (أ) البيانات الأولية من تفاعلات وتفاعلات التحكم في المخزن المؤقت فقط بما في ذلك الميتوكوندريا المعزولة التي تمت معالجتها بالغلوتامات والمالات (G / M) ، مع أو بدون إضافة ADP. تمت مراقبة التألق بمرور الوقت. مع استهلاك الأكسجين ، يزداد التألق. لم تظهر التفاعلات العازلة فقط (G / M ، المشار إليها بالدوائر ، و G / M + ADP ، المشار إليها بالمثلثات) والميتوكوندريا مع معالجة G / M (المشار إليها بالمربعات) أي تغيير. الميتوكوندريا المعالجة ب G / M + ADP (المشار إليها بعلامات الجمع) تستهلك الأكسجين. (ب) التغيرات في تركيز الأكسجين بمرور الوقت محسوبة من البيانات الأولية للميتوكوندريا المعالجة ب G / M + ADP المعروضة في A. (ج) قيم RCR للميتوكوندريا من ثلاثة أنواع مختلفة من السحالي مقاسة في درجة حرارة الغرفة. هذا الشكل مستنسخ من Haenel و Del Gaizo Moore12. تم إجراء التحليل الإحصائي باستخدام ANOVAs في R. الاختصارات: G = الغلوتامات. م = مالات. RCR = نسبة التحكم في الجهاز التنفسي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: معدلات استهلاك الأكسجين للميتوكوندريا من ثلاثة أنواع من السحالي. تظهر المخططات الصندوقية متوسط معدلات استهلاك الأكسجين كشريط وتعني كنقطة. كانت الأنواع الأبوية ، Urosaurus graciosus و Urosaurus ornatus ، مختلفة بشكل كبير عن بعضها البعض. كان الشكل المدخل (الهجين) وسيطا للأنواع الأبوية ولا يختلف اختلافا كبيرا عن أي منهما. هذا الشكل مستنسخ من Haenel و Del Gaizo Moore12. الاختصارات: Ug = Urosaurus graciosus; Uo = Urosaurus ornatus. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: تكوين الحلول المستخدمة في البروتوكول. الرجاء النقر هنا لتنزيل هذا الجدول.
الجدول 2: خريطة لوحة لمقايسة استهلاك الأكسجين. لكل عينة ، خصص ما لا يقل عن 6 آبار (3 آبار تحكم: L-EB فقط ، L-EB مع معالجة G / M ، L-EB مع معالجة G / M + ADP ؛ 3 بئر تجريبي / عينة: الميتوكوندريا مع معالجة L-EB ، L-EB + G / M ، و L-EB G / M + ADP). عندما يكون ذلك ممكنا، قم بتشغيل كل عينة تجريبية في نسخ مكررة أو ثلاثية. الاختصارات: G = غلوتامات. م = مالات. L-EB = مخزن مؤقت تجريبي خاص بالسحلية. الرجاء النقر هنا لتنزيل هذا الجدول.
الشكل التكميلي S1: مخططات البيانات. (أ) رسم جميع البيانات الأولية لمقارنة العينات والضوابط. (ب) مخطط البيانات الأولية ذات الحواف من الأعمدة المميزة في الجدول التكميلي S1 ، مما يدل على أن الآبار التي تحتوي على عينات من الميتوكوندريا فقط هي التي شهدت زيادة ملحوظة في RFUs. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S2: استهلاك الأكسجين ونسب التحكم في الجهاز التنفسي. (أ) رسم بيانات استهلاك الأكسجين من الجدول التكميلي S1 لتحديد قيم الحالة 2 والحالة 3 من خلال إيجاد معادلات الخطوط الأكثر ملاءمة. (ب) حساب نسبة RCR باستخدام منحدرات الخطوط الواردة في (A) ، والتي تمثل الحالة 2 والحالة 3. الرجاء النقر هنا لتنزيل هذا الملف.
الجدول التكميلي S1: مثال تمثيلي للبيانات الأولية. الأعمدة المميزة هي البيانات التي تستخدم للأرقام والحسابات (أي البيانات المقتطعة). الرجاء النقر هنا لتنزيل هذا الملف.
الجدول التكميلي S2: مثال تمثيلي للبيانات المقطوعة وحسابات استهلاك الأكسجين اللاحقة. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
يعد قياس وظيفة الميتوكوندريا مفيدا عند مقارنة العينات المختلفة ، مثل الحالات المرضية مقابل الحالات غير المرضية ، أو أنواع الأنسجة المختلفة من نفس ، أو بين أنواع العينات المختلفة. استخدمنا المقارنة اللاحقة لاختبار فرضيتنا القائلة بأن هناك نتيجة أيضية لسحالي الأشجار الهجينة التي دخلت الميتوكوندريا. هناك مجموعة متنوعة من الطرق للتأكد من وظيفة الميتوكوندريا تجريبيا ، بما في ذلك القياس الكمي ل Δψ ، ومحتوى ATP الكلي ، وإنتاج ATP ، والتحكم في الجهاز التنفسي ومعدل استهلاك الأكسجين. يمكن إجراء قياسات استهلاك الأكسجين للميتوكوندريا المعزولة باستخدام معدات متخصصة مثل قطب كلارك أو Seahorse XFs الأكثر تطورا. ومع ذلك ، يمكن أن تكون هذه الطرق إما محدودة بحجم العينة اللازم لإجراء القياسات أو باهظة التكلفة. أصبحت قارئات الألواح متعددة الأوضاع التي يمكنها قراءة التألق قطعة قياسية من المعدات في مختبرات بيولوجيا الخلية والكيمياء الحيوية. وبالتالي ، فإن النهج البديل للتحليل الكمي لاستهلاك الأكسجين في الميتوكوندريا هو استخدام مجموعة متوفرة تجاريا مع قارئ لوحة الفلورسنت. يصف هذا البروتوكول خطوة بخطوة كيفية قياس استهلاك الأكسجين بالإضافة إلى إجراء العمليات الحسابية. واقتصاديا في الميتوكوندريا المعزولة. إن القياس الدقيق لقدرة الميتوكوندريا على صنع ATP عند تزويدها ب ADP ، المشار إليه باسم تنفس الحالة 3 ، يسمح بالمقارنة المباشرة ل OXPHOS بين العينات ويمكن أن تشير الاختلافات إلى التفاوتات الوظيفية. علاوة على ذلك ، يشير التنفس في الحالة 3 أيضا إلى جودة الميتوكوندريا التي تم عزلها ، والتي يمكن أن تحدد ما إذا كان إجراء العزل قد نجح و / أو العينة جيدة بما يكفي لاستخدامها في فحوصات أخرى. قيم RCR ، التي يتم حسابها باستخدام الحالة 2 (الغلوتامات والمالات فقط ، لبناء Δψ) وقيم الحالة 3 (الغلوتامات والمالات بالإضافة إلى ADP ، للسماح باستخدام Δψ لإنتاج ATP) ، تعطي معلومة أخرى للمقارنة وحول صحة الميتوكوندريا المعزولة. توضح البيانات المقدمة أن الطريقة المعروضة في هذه الورقة يمكن أن تساعد في فك تشفير الاختلافات بين أنواع العينات المختلفة وقياس معدلات استهلاك الأكسجين وقيم RCR دون الحاجة إلى معدات عالية التخصص ، مما يجعل هذه الأنواع من القياس أكثر سهولة.
في هذا البروتوكول ، قمنا بعزل الميتوكوندريا حديثا من السحالي ، وتم تحديد استهلاك الأكسجين باستخدام اختبار MitoXpress Xtra Hs باتباع بروتوكول الشركة المصنعة وتم تعديله وفقا ل Hynes et al.4 و Will et al.5 تراوحت السحالي من 3.3 جم إلى 5.1 جم في إجمالي كتلة الجسم بمتوسط 0.170 جم من أنسجة الكبد / السحلية ، والتي أنتجت ~ 0.350 مل من الميتوكوندريا الخام المركزة. تم استخدام الميتوكوندريا المعزولة في مقايسة استهلاك الأكسجين عند 6 مجم / مل من البروتين. إذا كان تركيز بروتين الميتوكوندريا ، كما هو محدد في خطوة البروتوكول 1.7 ، منخفضا ، فيمكن إعادة تدوير العينة عند 10,000 × جم وإعادة تعليق الحبيبات في حجم أصغر من L-MIB. وتجدر الإشارة أيضا إلى أننا استخدمنا أقل من 4 مجم / مل لعينات الكبد الصغيرة أو عندما لم يكن الكبد بأكمله متاحا.
لضمان توازن الغاز ودرجة الحرارة للعينات في بداية الفحص ، يجب تسخين جميع المحاليل المستخدمة في قسم البروتوكول 2 مسبقا إلى 30 درجة مئوية في حمام مائي. في القسم 3 من البروتوكول ، يتم استقراء معدلات تغير الأكسجين المذاب (mM / min) من المنحدرات الأولية لملامح تركيز الأكسجين المتناقصة لكل عينة (خطوة البروتوكول 3.3 ؛ الجدول التكميلي S1 والشكل التكميلي S1). تمثل معدلات معالجة العينة + G / M تنفس الميتوكوندريا في الحالة 2 ، في حين أن العينة ذات معدلات معالجة G / M + ADP تمثل تنفس الميتوكوندريا في الحالة 3. وبالتالي ، يتم حساب RCRs لكل عينة بقسمة قيم الحالة 3 على قيم الحالة 2 لكل عينة (الجدول التكميلي S2).
يمكن مقارنة استهلاك الأكسجين بين العينات الفريدة كما هو موضح هنا أو بين العلاجات المختلفة في عينة واحدة. في الحالة الأخيرة ، قد تكون هناك حاجة إلى ضوابط إضافية ، مثل التحكم في السيارة فقط مع الميتوكوندريا وبدونها ، لاستبعاد احتمال أن المعالجة الكيميائية نفسها لا تتفاعل مع المسبار الفسفوري. علاوة على ذلك ، يمكن استخدام بيانات استهلاك الأكسجين وRCR التي تم جمعها جنبا إلى جنب مع البيانات التي تم جمعها من نفس العينات مع فحوصات أخرى. بمجرد عزل الميتوكوندريا ، يمكن استخدامها في فحوصات متعددة لتوفير صورة أكثر اكتمالا لوظيفتها12. يعد قياس Δψ وإجمالي محتوى ATP ومعدل دوران ATP بعض المقايسات التي تم دمجها. علاوة على ذلك ، فإن استخدام مثبطات سينسيز ETC و OXPHOS و ATP مع المقايسات يعطي فهما أكمل لأنواع عينات الميتوكوندريا المختلفة ، مما يعزز أي استنتاجات مستخلصة من البيانات التي تم إنشاؤها.
معلمة أخرى يمكن قياسها في الميتوكوندريا المعزولة هي كفاءة الميتوكوندريا ، والتي يتم تعريفها على أنها نسبة P / O لمولات ATP المركبة لكل مول من O23. يمكن حساب نسب P / O في امتداد لهذا البروتوكول عن طريق السماح للميتوكوندريا للحالة 3 باستنفاد ADP المزود في التفاعل ثم إضافة حصة من ركيزة ADP متبوعا بتثبيط سينسيز ATP بإضافة oligomycin. تسمح هذه الخطوات الإضافية بحساب الحالة 4 ، والتي تحدث عندما تستمر الميتوكوندريا في استهلاك الأكسجين والحفاظ على Δψ قوي لصنع أقصى ATP ، وتوفر معلومات حول تسرب الميتوكوندريا (إذا كانت أيونات H + تعبر مرة أخرى إلى المصفوفة دون استخدام سينسيز ATP وبالتالي تبديد Δψ) ، مما يشير في النهاية إلى خلل وظيفي في الميتوكوندريا. علاوة على ذلك ، يمكن أن تكشف قياسات الحالة 4 أيضا عما إذا كان محول ADP / ATP ، الذي يحرك ATP المشكل حديثا من المصفوفة بينما يجلب في نفس الوقت ركيزة ADP ، يعمل وما إذا كان هناك أي تسرب ل ADP و ATP عبر الأغشية. تعد إضافة oligomycin ، الذي يثبط ATP synthase ، عنصرا في التحكم لتحديد ما إذا كانت الميتوكوندريا متسربة بسبب الخلل الوظيفي الفعلي. في حين أن قياس الحالة 4 بحيث يمكن حساب نسبة P / O كان خارج نطاق المعلومات التي سعينا إليها للمقارنة بين أنواع عينات الميتوكوندريا الثلاثة ، إلا أنها جزء آخر من البيانات حول وظيفة الميتوكوندريا ويمكن إجراؤها كامتداد لهذا البروتوكول. أخيرا ، تجدر الإشارة إلى أنه يمكن عزل الميتوكوندريا عن الخلايا الموجودة في الثقافة والأنسجة المختلفة من الفأر أو الفئران (مثل الكبد والقلب والحبل الشوكي) من بين أمور أخرى. قد تكون التعديلات على صيغ MIB و EB بالإضافة إلى بروتوكولات العزل ضرورية4 ، 13 ، 14 ، 15 ، 16. علاوة على ذلك ، وفقا لتعليمات الشركة المصنعة ، يمكن إجراء هذا الاختبار بخلايا كاملة سليمة. لذلك ، لا تقتصر الطريقة المقدمة على السحالي أو ميتوكوندريا الكبد ، مما يسمح لها بأن تكون مناسبة لمجموعة واسعة من النماذج التجريبية عبر العديد من التخصصات العلمية الفرعية المختلفة.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
تم تمويل هذا البحث من قبل NSF CHE- 1229562 (VDGM) ومنح من لجنة البحث والتطوير في كلية التدريس بجامعة إيلون (VDGM و GH) وبرنامج أبحاث البكالوريوس (AJ).
Materials
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
References
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076 (2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957 (2017).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. , (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved