Method Article
تحضير مستخلصات أحادية الجسيدات من أجنة أسماك الزرد
In This Article
Summary
نقدم بروتوكولا لعزل الجسيدات المفردة من أجنة أسماك الزرد ، والتي يمكن متابعة ديناميكياتها في الثقافة لعدة ساعات عن طريق الفحص المجهري بفاصل زمني مضان ، وبالتالي توفير منهجية لتحديد تغيرات شكل مقياس الأنسجة بدقة الخلية الواحدة.
Abstract
ينقسم محور الجسم لأجنة الفقاريات بشكل دوري إلى وحدات ثلاثية الأبعاد متعددة الخلايا تسمى الجسيدات. في حين أن التذبذبات الجينية والأنماط الجزيئية تحدد مقياس الطول الأولي للجسيدات ، فقد تورطت العمليات الميكانيكية في تحديد حجمها وشكلها النهائي. لفهم الخصائص المادية الجوهرية للجسيدات بشكل أفضل ، تم تطوير طريقة لزراعة استنساخ الجسيد الفردي من أجنة الزرد. يتم عزل الجسيدات المفردة عن طريق إزالة جلد الأجنة أولا ، متبوعا بإزالة صفار البيض والاستئصال المتسلسل للأنسجة المجاورة. باستخدام الأجنة المعدلة وراثيا ، يمكن ملاحظة توزيع الهياكل الخلوية الفرعية المختلفة عن طريق الفحص المجهري بفاصل زمني الفلورسنت. يمكن متابعة ديناميكيات الجسيدات المزروعة لعدة ساعات ، وبالتالي توفير إطار تجريبي لدراسة تغيرات شكل مقياس الأنسجة بدقة الخلية الواحدة. يتيح هذا النهج التلاعب الميكانيكي المباشر بالجسدات ، مما يسمح بتشريح الخصائص المادية للأنسجة. أخيرا ، يمكن تمديد التقنية الموضحة هنا بسهولة لاستخراج الأنسجة الأخرى مثل الحبل الظهري والصفيحة العصبية والأديم المتوسط الجانبي.
Introduction
ينبثق الكثير من الجهاز العضلي الهيكلي البالغ للفقاريات من الجسيدات الجنينية ، والتي تتشكل بطريقة دورية وإيقاعية على طول محور الجسم للأجنة1،2. الجسيدات عبارة عن وحدات ثلاثية الأبعاد (ثلاثية الأبعاد) متعددة الخلايا تتكون عادة من نواة داخلية من الخلايا الوسيطة وطبقة ظهارية محيطية محاطة بمصفوفة خارج الخلية غنية بالألياف3. يتم تحديد مورفولوجيا الجسيدات ، أي حجمها وشكلها ، جزئيا من خلال ساعة التجزئة والأنماط الجزيئية النهائية للمهرب. ومع ذلك ، على مدى العقد الماضي ، اتضح أن الإشارات والقوى الميكانيكية تلعب أيضا دورا في تنظيم ساعة التجزئة4 ، بالإضافة إلى تسهيل تكوين الجسيدات5،6،7 ، وضمان زيادة دقة أطوال الجسيدات بعد تكوين الجسيداتالأولي 8.
يمكن دراسة ميكانيكا الأنسجة مباشرة في الجسم الحي مع توفر أدوات جديدة9 ، ومع ذلك ، للحصول على صورة كاملة تكمن وراء العمليات الفيزيائية ، يجب دراسة خصائص المواد الجوهرية للأنسجة في وقت واحد. يوفر البروتوكول الموصوف هنا نهجا بسيطا لإعداد الجسيدات المفردة ، والتي يمكن دراسة خصائصها الفيزيائية من المقاييس الخلوية إلى الأنسجة بمعزل عن الجنين. في حين أن هناك العديد من البروتوكولات لإعداد النباتات الخارجة في مراحل نمو مماثلة10،11،12،13،14 ، على حد علمنا ، هذا هو البروتوكول الأول الذي يصف عزل الجسيدات الفردية. البروتوكول سهل التنفيذ ولا يتطلب سوى المعدات الأساسية المتوفرة في معظم مختبرات أسماك الزرد التي تعمل مع الأجنة.
للمساعدة في إغاظة دور الميكانيكا في تكوين الجسيدات المورفولوجية ، تم تطوير طريقة لاستزراع مستخرج أحادي الجسيد من أجنة أسماك الزرد ، والتي يمكن استخدامها لاستكشاف الخصائص المادية الجوهرية للجسيدات.
Protocol
يتضمن هذا البروتوكول استخدام أجنة الفقاريات الحية التي تقل أعمارها عن يوم واحد بعد الإخصاب. أجريت جميع التجارب باستخدام أجنة مشتقة من البالغين الذين يتزاوجون بحرية ، وبالتالي فهي مشمولة بترخيص التجارب الحيوانية العام الصادر عن EPFL الممنوح من قبل Service de la Consommation et des Affaires Vétérinaires في كانتون فود - سويسرا (رقم التفويض VD-H23).
1. قبل التشريح
- الحصول على أجنة من صليب من الخطوط المعدلة وراثيا متغايرة الزيجوت ذات الأهمية. لاستخراج اثنين إلى ثلاثة جسيدات ، عادة ما تكون هناك حاجة إلى عدد قليل من الأجنة. في هذا البروتوكول ، تم استخدام جنين واحد لاستخراج جسيدات واحدة.
- قم بإعداد 1x E3 مخزن مؤقت من مخزونين 50x: يحتوي المخزون 1 على 0.458 ملي NaCl2HPO4 ، 0.042 ملي كلوريد الصوديوم2PO4 ، 4.084 ملي كلوريد الصوديوم ، 0.128 ملي كلوريد كلوريد ويحتوي المخزون 2 على 0.33 ملي كلوريد الكالسيوم2 ، 0.33 ملي مولار MgSO4. قم بإعداد 500 مل من 1x E3 المؤقت عن طريق خلط 480 مل من الماء المقطر مع 10 مل لكل من المخزونين 50x.
- في حالة التشريح في نفس اليوم ، قم برفع الأجنة في 25 مل من وسط E3 في طبق بتري عند 33 درجة مئوية حتى مرحلة ثلاثية الجسيدات. في حالة تشريح صباح اليوم التالي ، قم برفع الأجنة في وسط E3 عند 28 درجة مئوية حتى مرحلة الدرع قبل نقلها إلى 19 درجة مئوية للحضانة طوال الليل.
- لتحديد مرحلة الدرع أو مراحل الجسيدات المختلفة ، استخدم مجهر مجسم مختبري قياسي مع نطاق تكبير قابل للتعديل من 0.67x إلى 4.5x تقريبا.
- قم بتجميع الأدوات والكواشف اللازمة للتشريح.
- متوسط L-15 من Aliquot Leibovitz في أنابيب سعة 50 مل وتخزينه في الثلاجة. نوصي باستخدام نفس الكمية من الثلاجة لمدة جولتين كحد أقصى.
- تحضير 50 مل من 2٪ agarose في وسط L-15 باستخدام محرك مغناطيسي والحفاظ على درجة الحرارة عند 85 درجة مئوية. بمجرد الذوبان ، قم بتخزين المحلول في درجة حرارة الغرفة.
- تحضير 25 مل من الاغاروز منخفض الذوبان بنسبة 2٪ في وسط L-15 باستخدام محرك مغناطيسي والحفاظ على درجة الحرارة عند 85 درجة مئوية. بمجرد الذوبان ، قم بتقطيع المحلول في أنابيب سعة 1.5 مل وتخزينه في 4 درجات مئوية. سيتم استخدام هذا لإعداد غرفة التصوير.
- صب الاغاروز المنصهر بنسبة 2٪ في طبق بتري مقاس 20 مم حتى يمتلئ ثلث عمق الطبق ويترك محلول الاغاروز يتصلب. سيتم إجراء التشريح في أطباق بتري هذه. تحضير أطباق بتري بطلاء الاغاروز مسبقا وتخزينها في درجة حرارة 4 درجات مئوية.
- قم بتجميع الأدوات التالية: ماصة باستور لنقل الأجنة ، وزوج من الملقط لإزالة الأجنة ، وزوج من الملقط الدقيق لإزالة جلد الأجنة ، وسكين دقيق لعمل شقوق في الأجنة ، وماصة زجاجية مصقولة بالنار لنقل المصنوعات إلى غرفة التصوير.
- قم بتعقيم الماصة الزجاجية بالإيثانول بنسبة 100٪ لمدة 15 دقيقة واشطفها مرتين عن طريق سحب 5 مل من L-15 متوسط لأعلى ولأسفل.
- قم بإعداد أداة رموش العين عن طريق لصق رمش أو شعر من الحاجب على شعرية زجاجية.
- استخدم مجسما فلوريا بنطاق تكبير قابل للتعديل من 0.63x إلى 6.3x تقريبا ومرشحات GFP و RFP القياسية لفرز الأجنة المعدلة وراثيا الإيجابية ونقلها إلى طبق بتري منفصل مع وسيط E3.
2. تحضير المصنع أحادي الجسيد
- انقل 2 أو 3 أجنة إلى طبق مغطى بالأغروز (مصنوع في الخطوة 1.5.4) مملوء ب 10 مل من وسط L-15. تأكد من تسخين الطبق مع وسط L-15 مسبقا عند 28 درجة مئوية في حاضنة لمدة 30 دقيقة قبل نقل الأجنة.
- قم بإزالة الكسادة بعناية (الشكل 1 أ ، ب) جنين بزوج من الملقط. أمسك المشيمة بأحد الملقط واستخدم الملقط الثاني لقرص المشيمة وسحبها بالقرب من مكان وضع الملقط الأول.
- كرر هذه الخطوة مرة أخرى لفتح المشيمة على نطاق واسع وبعد ذلك يمكن دفع الجنين برفق للخارج. تأكد من عدم تلف الجنين أو ضغطه أثناء التشدش.
- قم بتوجيه الجنين على جانبه الجانبي والتمسك بالجلد بين رأس الجنين وذيله بأحد الملقط الناعم. استخدم الملقط الدقيق الثاني للضغط على الجلد بالقرب من المكان الذي لا يزال فيه الملقط الأول.
- حرك الملقطين بعيدا عن بعضهما البعض ، مع التمسك بالجلد ، وبالتالي إنشاء فتحة كبيرة. حرر أحد الملقط من الجلد وحركه بالقرب من مكان تثبيت الملقط الثاني وكرر عملية إزالة الجلد حتى تتم إزالة الجلد في مناطق تكوين الجسيد.
ملاحظة: من الأهمية بمكان إزالة الجلد المحيط بالجسيدات التي سيتم استئصالها تماما ، وإلا يصبح من الصعب إجراء تشريح أدق في الخطوات اللاحقة من البروتوكول. - استخدم سكينا صغيرا لكشط صفار البيض (الشكل 1 ج - استئصال مع إزالة الجلد وكشط صفار البيض) وقم بعمل سلسلة من الشقوق على النحو التالي:
- قم بتقطيع الجنين مع القطع الأول الأمامي للجسيدات المورفولوجية الأولى في الجنين والثاني القطع الخلفي لأحدث جسيدات تشكلت (الشكل 1 د). شريحة مرة أخرى في الخلف والأمامي للجسيدات ذات الأهمية (الشكل 1 ه).
- استخدم السكين الصغير لكشط أي صفار متبقي من المناطق المزروعة من الجنين. حاول إزالة أكبر قدر ممكن من صفار البيض لتقليل احتمالية التصاق النباتات بالسكين الصغير. إذا حدث هذا ، فاستخدم أداة رموش العين لإعادة النبات إلى المحلول مع إبقاء السكين الصغير مغمورا في الوسط.
- ضع النبتة الظهرية وقم بعمل شريحة على طول المحور الأمامي الخلفي من خلال الحبل الظهري ، بالقرب من الجسيدات على جانب واحد (الشكل 1F ، G).
- خذ النبتة بدون الحبل الظهري وقم بتقطيعها من خلال الأديم المتوسط الجانبي (LPM) بالقرب من الجسيدات.
ملاحظة: يمكن تبادل هذه الخطوة مع الخطوة السابقة ، أي أنها تعمل بشكل جيد على قدم المساواة لتقطيع LPM أولا متبوعا بالتقطيع من خلال الحبل الظهري.
- اختر الجسيدات المراد زراعتها وقم بعمل شريحتين خلفيتين وأماميتين للجسيدات على التوالي (الشكل 1H).
- أخيرا ، قم بتدوير الجسيدات بمقدار 90 درجة باستخدام أداة رمش العين لتصور الصفيحة العصبية التي لا تزال متصلة بالجسد. اصنع شريحة بين الجسيدات والصفيحة العصبية ، وبالتالي إطلاق جسيدات واحدة (الشكل 1I).
ملاحظة: يمكن أيضا إزالة الصفيحة العصبية مباشرة بعد الخطوة 2.6.4 ، أي بعد إزالة الحبل الظهري و LPM وقبل تشريح الجسيدات من الجسيدات المجاورة.
3. تصوير الاستخلاصات أحادية الجسيدات
ملاحظة: هنا ، يتم وصف إجراء تصوير التحويلات أحادية الجسيدات باستخدام مجهر أحادي الرؤية. كبديل ، يمكن أيضا تصوير الجسيدات المفردة المزروعة في مجهر متحد البؤر ، وهو متاح على نطاق واسع أو حتى في مجهر واسع النطاق إذا كان مهتما حصريا بمتابعة التشكل العام للنباتات الخارجية.
- قم بإعداد غرفة التصوير على النحو التالي:
- املأ حقنة سعة 1 مل بتركيبة مطاط السيليكون. اقطع طرف ماصة سعة 200 ميكرولتر على بعد حوالي 1 سم من الفم وأدخل المحقنة في طرف الماصة.
- لف حامل الغشاء يدويا بشريط غشاء من الإيثيلين بروبيلين المفلور (FEP) المقطوع مسبقا (الشكل 2A-C) وقم بتثبيت غرفة التصوير على حامل الغشاء ، والذي يتناسب بشكل مريح مع بعضهما البعض (الشكل 2 د).
- أضف تركيبة مطاط السيليكون على طول تقاطع الغرفة والغشاء وجففها طوال الليل ، مما يسمح للغشاء بالالتصاق بالغرفة. قم بإزالة حامل الغشاء قبل ساعة واحدة من تجربة الإخراج.
- سخني كمية تحتوي على 0.5 مل من الاغاروز منخفض الذوبان بنسبة 2٪ مصنوع من وسط L-15 عند 75 درجة مئوية لمدة 10 دقائق. أضف 160 ميكرولتر من الاغاروز الساخن منخفض الذوبان إلى وسط الغرفة وضع قالب تصوير في الاغاروز (الشكل 2E ، F) واحتفظ به في وضع مستقيم حتى يتجمد الاغاروز.
- أضف 160 ميكرولتر أخرى من الاغاروز الساخن منخفض الذوبان إلى طرفي القالب وانقل الوحدة بأكملها إلى 4 درجات مئوية لمدة 30 دقيقة.
- أضف 600 ميكرولتر من وسط L-15 إلى الغرفة وقم بإزالة القالب من الغرفة باستخدام ملقط. انتظر حتى تعود الغرفة ذات الوسط L-15 إلى درجة حرارة الغرفة.
- انقل الجسيدات المزروعة بماصة زجاجية مصقولة عن طريق سحب العين إلى غرفة التصوير واستخدم أداة رمش العين لوضع المنشأة في وسط الغرفة.
- قم بمحاذاة ليزر التصوير وفقا لتعليمات الشركة المصنعة وانقل غرفة التصوير بعناية إلى المجهر المجهز بغرفة حضانة للحفاظ على المصانع عند 28 درجة مئوية.
- قم بإجراء جولة ثانية من محاذاة الليزر مع مناطق الاهتمام من الخط المعدل وراثيا ، متبوعا بإعداد مكدس z المطلوب والفاصل الزمني والمدة للتصوير بفاصل زمني. في هذه التجربة ، احصل على 70 شريحة z بتباعد 2 ميكرومتر وفاصل إطار 2 دقيقة.
- قم بإجراء تصوير صفائح ضوئية مزدوجة اللون (الشكل 1J) للنباتات الخارجية ب 561 نانومتر (طاقة ليزر 10٪ ، تعرض 100 مللي ثانية) وليزر 488 نانومتر (طاقة ليزر 10٪ ، تعرض 100 مللي ثانية). في هذا البروتوكول ، تم جمع الإشارة بهدف NA 25x / 1.1 ومن خلال مرشحات ممر نطاق 561/25 نانومتر و 525 / 50-25 على التوالي على كاميرا sCMOS.
النتائج
تسمح المصانع بتحديد تغييرات الشكل على نطاق واسع في 3D. لتوضيح ذلك ، قمنا بزراعة أربعة جسيدات (N = 3) من أجنة أسماك الزرد المبكرة التي تم الحصول عليها من تهجين بين Utr:: mCherry (Tg (actb2: mCherry-Hsa.UTRN) ؛ e119Tg) و H2B :: GFP (Tg (h2az2a: h2az2a-GFP) ؛ kca6Tg) خطوط متغايرة الزيجوت. Utrophin هو بروتين مرتبط بالأكتين ، ويظهر خط Utr:: mCherry توزيع هياكل الأكتين الخيطية. تم استخدام هذا الجين المعدل هنا كعلامة لمخططات الخلية. H2B :: GFP عبارة عن هيستون مميز بالفلورسنت وبالتالي يشير إلى توزيع الكروماتين ، مما يوفر وصفا فعالا للموقع والشكل النووي ، بالإضافة إلى الأشكال الانقسامية التي تسلط الضوء على انقسام الخلية.
قمنا بتقييم نجاح بروتوكول الزرع أثناء التصوير. لاحظنا أنه في الجسيدات التي تضررت أثناء التشريح ، تتعرض سلامة الأنسجة الجسيدية للخطر ، مع تفكك العديد من الخلايا وبثقها من الجسيدات المزروعة ، و / أو موت العديد من الخلايا ، وهو ما يمكن ملاحظته من خلال وجود نوى مجزأة في القناة النووية. ظلت التصادمات الناجحة بصحة جيدة لمدة 4-6 ساعات وبعد ذلك لوحظت تغيرات في سلامة الجسيدات مع انفصال الخلايا عن النبتة الخارجية والموت.
في قناة اليوتروفين ، أجرينا تجزئة يدوية للنباتات الخارجية في MATLAB (R2018b) على شرائح z متباعدة كل 10 ميكرومتر. قمنا بتطوير خوارزمية مخصصة في MATLAB للتجزئة ، وهي متاحة مجانا للتنزيل (https://github.com/sundar07/SomSeg). في الخوارزمية ، يمكن تعيين الملف والإطار والشريحة z المراد تقسيمها ، متبوعا بمطالبة المستخدم ، مما يسمح بالرسم اليدوي لمخطط تفصيلي حول منطقة الاهتمام. تم تكرار ذلك لشرائح z متعددة ورسمها ، والتي أظهرت تقريب النماذج الخارجية بمرور الوقت في 3D (الشكل 3 أ). بالإضافة إلى ذلك ، تم أيضا الحصول على معلومات تكميلية حول شكل الأنسجة باستخدام القناة النووية. لهذا ، استخدمنا Mastodon (الإصدار 1.0.0-beta-19 ، https://github.com/mastodon-sc/mastodon) ، وهو مكون إضافي من FIJI15 ، للحصول على مواضع النوى المركزية من خلال الكشف عن البقعة. قمنا أولا بتحويل ملفات tif من المجهر إلى تنسيق xml / hdf5 في FIJI ، وبعد ذلك تم فتح مشروع جديد باستخدام المكون الإضافي Mastodon. في المكون الإضافي اخترنا خيار الكشف عن البقعة حيث حددنا منطقة اهتمام غطت المصنع واستخدمنا فرق كاشف Gaussian بقطر 5 ميكرومتر وعامل جودة 25 للكشف عن البقع. ثم قمنا بنقل مواضع النوى المركزية إلى MATLAB واستخدمنا وظيفة مدمجة (convhull) للحصول على هيكل محدب (الشكل 3 ب) ، والذي ميز هندسة التحويل. أظهر هذا بالمثل تقريب النباتات الخارجية بمرور الوقت (الشكل 3 ب). تسمح بيانات النوى أيضا بقياس حركات الخلايا عن طريق التتبع ثلاثي الأبعاد وتغيير عدد الخلية بمرور الوقت. من ناحية أخرى ، تسمح قناة يوتروفين بتحديد التغيرات في أشكال الخلايا حيث تصبح النباتات المستديرة أكثر استدارة. هذه المعلمات معا ذات قيمة لتوصيف خصائص المواد الجوهرية للجسيدات ، مما يساعد في تطوير أوصاف فيزيائية فعالة لتغيرات شكل مقياس الأنسجة.
تسمح النباتات السطحية أيضا بتوصيف ضغوط التلامس مع الأنسجة المجاورة بطريقة كمية. لتوضيح ذلك ، قمنا يدويا بعزل اثنين من الجسيدات ووضعناهما على مقربة من بعضهما ولاحظنا ديناميكياتهما (N = 2). في هذه التجربة ، لم يتم تتبع اتجاه الجسيدات فيما يتعلق بمحاور الجسم في الجسم الحي . ومن المثير للاهتمام ، بمرور الوقت ، أن الجسيدات المزروعة التزمت ببعضها البعض على طول سطح واحد ، بينما تم تقريب الأسطح الحرة ، أي المناطق البعيدة عن موقع التلامس (الشكل 4). يشير هذا إلى أن القوى اللاصقة تتغلب على الضغوط الناتجة عن التوتر السطحي في مواقع التلامس في التصادم. يمكن تمييز ذلك أيضا من خلال اتباع تغييرات الشكل كما هو موضح أعلاه وعن طريق تحديد زوايا التلامس بين الأنسجتين بمرور الوقت في 3D. وبالتالي ، توفر النماذج المكثفة نظاما جذابا لتحديد القوى المتنافسة في العمل التي تؤدي إلى أشكال أنسجة معينة ، يمكن بعد ذلك استكشاف آثارها في الجسم الحي.
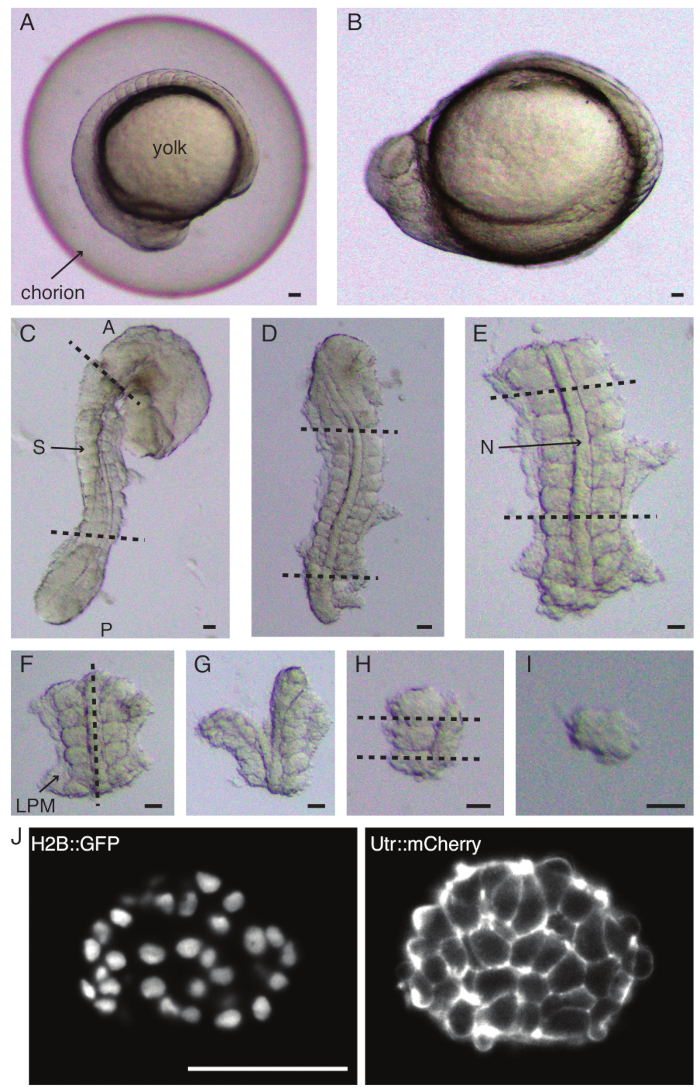
الشكل 1: تحضير النماذج أحادية الجسيد. يتم إزالة جنين الزرد (A) أولا (B) ، يليه إزالة الجلد وصفار البيض (C). ثم يتم تحديد المنطقة المحتوية على الجسيدات من الجنين عن طريق إزالة بقية الأنسجة (D ، E). ثم تتم إزالة المناطق المحيطة بالجسد محل الاهتمام بشكل متسلسل (F-H) لعزل جسيدة واحدة (I) في النهاية ، متبوعا بتصوير بفاصل زمني باستخدام مجهر صفائح ضوئية (القسم z الأوسط من الجسيدات الموضح هنا) (J). الاختصارات: S = جسدي. N = الحبل الظهري. LPM = الأديم المتوسط الجانبي ؛ أ = أمامي. ص = خلفي. تشير الخطوط المتقطعة إلى مواضع القطع. شريط المقياس = 50 ميكرومتر في جميع الألواح. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
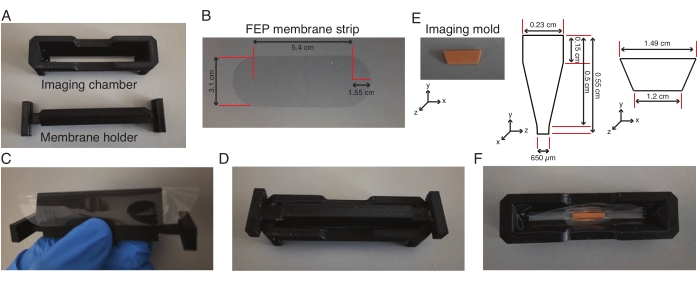
الشكل 2: تجميع غرفة التصوير ذات الألواح الخفيفة. (A-D) يتم لف شريط غشاء FEP (الأبعاد في (B)) حول حامل الغشاء ، ويتم تثبيته على غرفة التصوير ويتم لصق الغشاء على غرفة التصوير. (E-F) في اليوم التالي ، تتم إزالة حامل الغشاء ووضع قالب تصوير (الأبعاد في (E)) في وسط غرفة التصوير في الاغاروز منخفض الذوبان. يتم الاحتفاظ بالوحدة بأكملها عند 4 درجات مئوية لمدة 30 دقيقة ، وبعد ذلك تتم إزالة القالب واستخدام الغرفة ذات الحوض الصغير لتصوير النباتات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحليل ثلاثي الأبعاد لأشكال الأنسجة. (أ) تم تصور الخطوط العريضة للخلية باستخدام يوتروفين الموسوم بالفلورسنت (Utr:: mCherry) وتم تصور النوى باستخدام هيستون الموسوم بالفلورسنت (H2B:: GFP). تم تقسيم الخطوط العريضة للمصنع يدويا على أعماق متعددة باستخدام MATLAB وتظهر هنا. (ب) تم الكشف عن النوى (الحمراء) في نفس المصنع باستخدام Mastodon ، وهو مكون إضافي من FIJI ، وتعرضت لهيكل محدب (سماوي) ، والذي يعلم هندسة التحويل. ملاحظة أن تقريب النباتات الخارجية واضح في كلا التحليلين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
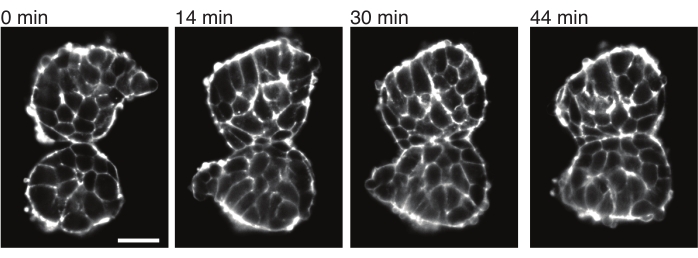
الشكل 4: تلتصق الجسيدات المزروعة ببعضها البعض. يميل اثنان من الجسيدات المعزولة عن الأجنة والموضوعة يدويا على مقربة من الالتصاق بمرور الوقت (N = 2). تم الحصول على شرائح z متعددة بفاصل إطار يبلغ دقيقتين باستخدام مجهر صفائح ضوئية وتظهر هنا الأجزاء الوسطى من الجسيدات من نقاط زمنية محددة. تم تصور الخطوط العريضة للخلية باستخدام Utrophin الموسوم بالفلورسنت (Utr:: mCherry). شريط المقياس = 25 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
سيطرت دراسات حول دور ساعة التجزئة في تحديد أطوال الأجزاء أثناء نمو الجنين على مجال تكوين الجنين. ومع ذلك ، من المهم بنفس القدر النظر في دور ميكانيكا الأنسجة في تحديد أشكال الجسيدات النهائية. يسمح البروتوكول الموصوف هنا باستخراج الجسيدات المفردة ، التي يمكن دراسة خصائصها الفيزيائية الجوهرية بمعزل عن الجنين. ومع ذلك ، فإن التحضير اليدوي يحد من عدد الجسيدات التي يتم تحضيرها عادة إلى أربعة إلى ستة في كل جلسة تصوير. نظرا لأن البروتوكول يتضمن تشريحا دقيقا للعديد من الأنسجة في الأجنة دون استخدام أي إنزيمات لتسهيل إزالة الأنسجة ، فقد يستغرق الأمر بضعة أسابيع من الممارسة لإتقان عملية التشريح. في أيدينا ، تتضمن الخطوات الحاسمة في البروتوكول إزالة الجلد وصفار البيض بعناية من النباتات الخارجية ، مما يمنع التصادم في مراحل مختلفة من البروتوكول من الالتصاق بالأدوات المستخدمة ، والتي بدورها تتيح تشريحا أسهل لإزالة الأنسجة المحيطة بالجسد بشكل متسلسل.
يمكن إيقاف بروتوكول التشريح بخطوات وسيطة للحصول على جسيدات متصلة بواحد فقط من الأنسجة المحيطة أو للحصول على نباتات لمجموعات من الجسيدات. يوفر هذا طريقة قوية لتجريد الأنسجة بشكل متسلسل ودراسة تأثير الأنسجة المجاورة في تسهيل تغيرات الشكل في الجسيدات ، أو في الأنسجة المجاورة. من ناحية أخرى ، باستخدام هذا البروتوكول ، يمكن السماح للأنسجة الفردية المزروعة بالالتصاق والتنظيم الذاتي ميكانيكيا ، كما يتضح من وضع اثنين من الجسيدات المزروعة على مقربة.
لا تتطلب النباتات المحضرة بهذه الطريقة أي مكونات مضافة في المخزن المؤقت أو قيودا لضمان البقاء على قيد الحياة لفترات زمنية تصل إلى عدة ساعات. ومع ذلك ، يمكن للمرء أن يتخيل زراعتها في الهلاميات المائية واتباع ديناميكياتها في وجود قيود خارجية ، والتي يمكن أن تكون بمثابة نموذج لضغوط التلامس التي يواجهها الجسيدات في الجسم الحي. علاوة على ذلك ، تسمح المصانع المستخرجة بفحص خصائصها المادية مباشرة من خلال الفحص المجهري للقوة الذرية أو شفط الماصة أو باستخدام الأدوات الروبوتية الدقيقة16. أخيرا ، نتوقع أن هذه الطريقة يمكن تكييفها بسهولة نحو زراعة ودراسة الأنسجة التنموية الأخرى في مراحل مماثلة مثل الحبل الظهري والصفيحة العصبية والأديم المتوسط الجانبي.
Disclosures
ويعلن أصحاب البلاغ عدم وجود مصالح متضاربة.
Acknowledgements
نشكر أعضاء مختبر Oates على التعليقات على البروتوكول ومرفق الأسماك في École polytechnique fédérale de Lausanne (EPFL). على وجه الخصوص ، نعترف ب Laurel Ann Rohde لنصائح قيمة حول إزالة الجلد وصفار البيض في بروتوكول التشريح. أريان بيركوفسكي راما لبناء خط أنابيب فعال لمعالجة مجموعات بيانات الورقة الخفيفة من خلال Mastodon ؛ جان إيف تينيفيز لبناء برنامج Mastodon مفتوح المصدر ؛ ماركو بوبوفيتش للحصول على نصائح حول تحليل البيانات ؛ كلوي جوليفيت وغيوم فالنتين وفلوريان لانغ للحصول على دعم مكثف في منشأة الأسماك. بيتر سترناد وأندريا بوني لبناء مجهر الألواح الضوئية وللحصول على نصائح حول تصوير الألواح الضوئية. تم دعم هذا العمل من قبل EPFL و SRN تم دعمه من خلال زمالة ما بعد الدكتوراه لبرنامج علوم الحدود البشرية طويل الأجل (LT000078/2016).
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma | 9012-36-6 | For coating bottom of petri dishes |
| Agarose, low gelling temperature | Sigma | 39346-81-1 | For preparing Viventis imaging chamber |
| Camera | Andor | Andor Zyla 4.2 Plus | For image acquisition in the light-sheet microscope |
| Detection objective | Nikon | Nikon CFI75 Apo LWD 25x/1.1 NA | For imaging explants |
| FEP membrane strip | Lohmann Technologies UK Ltd | Dupont FEP Fluorocarbon film, 200A | For preparing Viventis imaging chamber |
| Fine forceps | Dumont | Dumont 5SF 11252-00 | For removal of skin of embryos |
| Forceps | Dumont | Dumont 55 | For dechorionating embryos |
| Leibovitz's L-15 medium | Gibco | 21083-027 | Explant culture medium |
| Light-sheet microscope | Viventis | LS1 live | For imaging explants |
| Micro knife | Fine Science Tools | 10318-14 | For making incisions in embryos |
| Silicone rubber formulation | Wacker Chemie AG | Silpuran 4200 | For preparing Viventis imaging chamber |
References
- Oates, A. C., Morelli, L. G., Ares, S. Patterning embryos with oscillations: structure, function and dynamics of the vertebrate segmentation clock. Development. 139 (4), 625-639 (2012).
- Pourquié, O. Segmentation of the vertebrate spine: From clock to scoliosis. Cell. 145 (5), 650-663 (2011).
- Naganathan, S. R., Oates, A. C. Patterning and mechanics of somite boundaries in zebrafish embryos. Seminars in Cell & Developmental Biology. 107, 170-178 (2020).
- Hubaud, A., Regev, I., Mahadevan, L., Pourquié, O. Excitable Dynamics and Yap-Dependent Mechanical Cues Drive the Segmentation Clock. Cell. 171 (3), 668-682 (2017).
- Dias, A. S., de Almeida, I., Belmonte, J. M., Glazier, J. A., Stern, C. D. Somites without a clock. Science. 343 (6172), 791-795 (2014).
- Nelemans, B. K. A., Schmitz, M., Tahir, H., Merks, R. M., Smit, T. H. Somite Division and New Boundary Formation by Mechanical Strain. iScience. 23 (4), 100976 (2020).
- Grima, R., Schnell, S. Can tissue surface tension drive somite formation. Developmental Biology. 307 (2), 248-257 (2007).
- Naganathan, S. R., Popovic, M., Oates, A. C. Left–right symmetry of zebrafish embryos requires somite surface tension. Nature. 605, 516-521 (2022).
- Campàs, O. A toolbox to explore the mechanics of living embryonic tissues. Seminars in Cell & Developmental Biology. 55, 119-130 (2016).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Developmental Dynamics: An Official Publication of The American Association of Anatomists. 228 (3), 464-474 (2003).
- Henry, C. A., Poage, C. T., McCarthy, M. B., Campos-Ortega, J., Cooper, M. S. Regionally autonomous segmentation within zebrafish presomitic mesoderm. Zebrafish. 2 (1), 7-18 (2005).
- Picker, A., Roellig, D., Pourquié, O., Oates, A. C., Brand, M. Tissue micromanipulation in zebrafish embryos. Methods in Molecular Biology. 546, 153-172 (2009).
- Manning, A. J., Kimelman, D. Tbx16 and Msgn1 are required to establish directional cell migration of zebrafish mesodermal progenitors. Developmental Biology. 406 (2), 172-185 (2015).
- Simsek, M. F., Özbudak, E. M. A 3-D Tail Explant Culture to Study Vertebrate Segmentation in Zebrafish. Journal of Visualized Experiments:JoVE. (172), e61981 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Özkale, B., et al. Modular soft robotic microdevices for dexterous biomanipulation. Lab on a Chip. 19 (5), 778-788 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved