Method Article
تحلل البروتين المحدود والرحلان الكهربائي للهلام في وجود كاتيونات معدنية: مجال الإنارة المرتبط ب Au (III) في ألبومينات المصل
In This Article
Summary
نقدم بروتوكولا لدراسة مجال ربط Au (III) في ألبومين مصل الأبقار (BSA).
Abstract
الغرض من البروتوكولات المقدمة هو تحديد مجال ربط Au (III) في BSA. يظهر مركب BSA-Au (III) تلألؤ أحمر قابل للإثارة بالأشعة فوق البنفسجية (UV) (λem = 640 نانومتر) ، مع تحولات ستوكس غير عادية مقارنة بالأشعة فوق البنفسجية الفطرية / التألق الأزرق الناشئ عن المخلفات العطرية. تتشكل المجمعات ذات الإضاءة الحمراء في ظروف شديدة القلوية أعلى من درجة الحموضة 10 وتتطلب حدوث تغيير في التشكل داخل البروتين. بالإضافة إلى ذلك ، يعد الحفاظ على روابط ثاني كبريتيد Cys-Cys في BSA أمرا ضروريا للحصول على هذا التلألؤ الأحمر. من أجل فهم آلية هذا التلألؤ ، من الضروري توضيح موقع ربط Au (III) المكون. تتمثل إحدى الطرق السهلة لتقييم موقع تكوين اللومينوفور في (1) تجزئة البروتين بشكل متوقع عن طريق الهضم الأنزيمي ، (2) تفاعل الشظايا التي تم الحصول عليها مع Au (III) ، ثم (3) إجراء الرحلان الكهربائي للهلام لمراقبة نطاقات الشظايا المنفصلة جيدا وتحليل التلألؤ الأحمر داخل الهلام. ومع ذلك ، نظرا للظروف القلوية والتفاعل مع الكاتيونات المعدنية ، يجب تطبيق تقنيات جديدة محدودة للتحلل البروتيني وظروف الرحلان الكهربائي للهلام. على وجه الخصوص ، يمكن أن يؤدي وجود الكاتيونات المعدنية في الرحلان الكهربائي للهلام إلى جعل فصل النطاق صعبا من الناحية الفنية. نصف هذا البروتوكول الجديد في خطوات لتحديد مجال ربط المعادن المكونة لللومينوفور الأحمر في BSA. وبالتالي يمكن تطبيق هذا البروتوكول لتحليل شظايا البروتين التي يجب أن تظل في حالة غير مشوهة أو مشوهة جزئيا ، في وجود كاتيونات معدنية. نظرا لأن غالبية البروتينات تحتاج إلى كاتيونات معدنية لتعمل ، غالبا ما تكون تحليلات البروتينات المرتبطة بالمعدن مرغوبة ، والتي اعتمدت على علم البلورات بالأشعة السينية في الأدبيات. من ناحية أخرى ، يمكن استخدام هذه الطريقة في مكمل لدراسة تفاعلات البروتينات مع الكاتيونات المعدنية دون الحاجة إلى تبلور البروتين وفي حالة الأس الهيدروجيني المطلوبة.
Introduction
من المعروف أن مجمعات ألبومين مصلالأبقار 1،2،3 (BSA) - الذهب (Au) ، التي تم الحصول عليها عن طريق التفاعلات في ظروف شديدة القلوية (درجة الحموضة > 10) ، تظهر تلألؤ أحمر قابل للإثارة للأشعة فوق البنفسجية (λem = 640 نانومتر) 4،5،6،7. تم اقتراح العديد من التطبيقات لهذا المركب والتحقيق فيها ، بما في ذلك الاستشعار ، 8،9،10 التصوير11،12،13 ، والطبالنانوي 14،15،16. ومع ذلك ، فإن آلية اللمعان ليست مفهومة تماما. يعد تحديد موقع ارتباط Au (III) وتكوين luminophore في BSA خطوة مهمة.
لقد تم توضيح مؤخرا أن تغيير التشكل الديناميكي الذي يتم التحكم فيه بواسطة الأس الهيدروجيني ل BSA ، متبوعا بارتباط Au (III) برابطة ثاني كبريتيد Cys-Cys ، ضروري لإنتاج اللمعان الأحمر4. من أجل اكتساب مزيد من الأفكار حول آلية هذا التلألؤ ، من الضروري توضيح موقع ربط Au (III) المكون. تتمثل إحدى الطرق السهلة لتقييم موقع تكوين اللمعان في تجزئة مركب BSA-Au عن طريق الهضم الأنزيمي ، وتحليل كل جزء من أجل اللمعان. ومع ذلك ، نظرا للظروف القلوية ووجود الكاتيونات المعدنية ، هناك حاجة إلى بروتوكولات جديدة لتحلل البروتين والرحلان الكهربائي للهلام.
استخدمنا تحلل البروتين الأنزيمي المحدود كطريقة لمستحضرات شظايا البروتين ، مع الحفاظ على روابط ثاني كبريتيد Cys-Cys. في الانحلال البروتيني التقليدي ، من الضروري شق جميع روابط ثاني كبريتيد وخطية البروتين (عن طريق تغيير طبيعة العوامل مثل ثنائي ثيوثريتول واليوريا ، وكذلك الحرارة). هنا ، نوضح انحلال البروتين الذي يحافظ على رابطة Cys-Cys ونقيم الأجزاء التي تم الحصول عليها ولألؤانها بعد التفاعل مع Au (III). نستخدم التربسين للإنزيم الهضمي ، كمثال ملموس.
يصف البروتوكول بشكل عام الرحلان الكهربائي الهلامي للبروتينات والشظايا في وجود الكاتيونات المعدنية. نظرا لأن غالبية البروتينات تحتاج إلى كاتيونات معدنية لتعمل17،18 ، غالبا ما تكون تحليلات البروتينات المرتبطة بالمعادن مرغوبة ، والتي اعتمدت على علم البلورات بالأشعة السينية في الأدبيات. لا تعرف هياكل BSA وشظاياها بمطابقات الأس الهيدروجيني غير المحايدة بما في ذلك عند درجة الحموضة > 10. لذلك ، لا يمكن تحليل التفاصيل الهيكلية لتنسيق Au (III) عن طريق الرحلان الكهربائي للهلام وحده. من ناحية أخرى ، يمكن استخدام هذه الطريقة في مكمل لدراسة تفاعلات البروتينات مع الكاتيونات المعدنية دون الحاجة إلى تبلور البروتين ، والذي قد لا يكون ممكنا في حالة الأس الهيدروجيني الوظيفية المرغوبة. يمكن أن يتسبب وجود الكاتيونات المعدنية في "تلطيخ" كبير في عصابات الهلام. ينصب تركيز هذه الورقة على التغلب على هذه الصعوبة التقنية وتقديم بروتوكول لتقليل تلطيخ النطاق الناجم عن المعدن.
Protocol
1. توليف شظايا BSA-Au المعقدة
- قم بإذابة 5 مجم من BSA في 1 مل من الماء من درجة HPLC التي تحتوي على 50 ملي Tris-HCl و 50 ملي كلوريد الصوديوم مع درجة حموضة 8.0 في قارورة سعة 5 مل.
- قم بإذابة 2 مجم من التربسين في 1 مل من محلول طازج من ماء HPLC يحتوي على 50 ملي من Tris-HCl و 50 ملي كلوريد الصوديوم مع درجة حموضة 8.0.
- ضع قارورة تفاعل BSA في حمام مائي بدرجة حرارة 37 درجة مئوية وحركها بقوة عند 750 دورة في الدقيقة باستخدام محرك مغناطيسي.
- مباشرة بعد بدء التقليب ، أضف 50 ميكرولتر من التربسين الطازج إلى المحلول.
ملاحظة: لا ينبغي إضافة كبريتات دوديسيل الصوديوم (SDS) أو ديثيوثريتول (DDT) أو اليوريا إلى المحلول ، على عكس تفاعلات هضم الإنزيم التقليدية. أيضا ، لا ينبغي إجراء التلدين بدرجة الحرارة. بسبب هذا التحلل البروتيني المحدود ، سيتم الاحتفاظ بروابط ثاني كبريتيد Cys-Cys سليمة وسيتم شق أجزاء الملف العشوائي التي يمكن الوصول إليها على السطح فقط بواسطة الإنزيم. - قم بإذابة كلوريد Au (III) (حمض الكلوروريك) في 1 مل من الماء بدرجة HPLC بتركيز 750 ميكرومتر.
- في قارورة التفاعل ، أضف محلول حمض الكلوروريك للحصول على نسبة مولار BSA: Au ناتجة عن 1:10.
- قلب الخليط لمدة دقيقتين عند 37 درجة مئوية وعند 750 دورة في الدقيقة باستخدام محرك مغناطيسي.
- أضف 100 ميكرولتر من 1 M هيدروكسيد الصوديوم إلى قارورة التفاعل لتحقيق درجة حموضة 12.5.
ملاحظة: يجب أن تؤدي الظروف القلوية العالية للتفاعل إلى تكوين مركب الإنارة الأحمر وإخماد النشاط الأنزيمي للتربسين. - قلب الخليط بقوة عند 750 دورة في الدقيقة لمدة ساعتين عند 37 درجة مئوية.
ملاحظة: تم استخدام المنتج النهائي على الفور دون مزيد من التنقية.
2. الرحلان الكهربائي للهلام لشظايا BSA-Au المعقدة عن طريق التحلل البروتيني المحدود
- اشطف جل Bis-Tris المتدرج مسبقا المصبوب بنسبة 4-12٪ باستخدام الماء منزوع الأيونات وضعه في خزان الرحلان الكهربائي للجل.
- قم بإعداد 500 مل من محلول عازل تشغيل MES من محلول مخزون مركز ، مخفف بالماء منزوع الأيونات.
- استعد لكل حارة بئر عن طريق تخفيف العينات إلى 1 ميكروغرام من البروتين / ميكرولتر في محلول جلسرين بنسبة 20٪. هذا التخفيف يجعل الرقم الهيدروجيني من 12.5 إلى ~ 8.
ملاحظة: لا يتم استخدام SDS أو DTT أو اليوريا في المخزن المؤقت للعينة. بالإضافة إلى ذلك ، لا ينبغي إجراء التلدين بدرجة حرارة العينات. - أضف 10 ميكرولتر من كل محلول عينة إلى كل حارة من الجل.
- قم بتشغيل الجل لمدة 1 ساعة بجهد ثابت 150 فولت.
- بعد تشغيل الجل ، قم بإزالة الجل من الجبيرة واشطفه 3 مرات لمدة 1 دقيقة باستخدام الماء منزوع الأيونات لإزالة المخزن المؤقت الجاري.
- قم بتخزين الجل في 200 مل من الماء منزوع الأيونات وقم بقياس التألق داخل الهلام على الفور ، باستخدام نظام تصوير هلامي.
- تحضير محلول تلطيخ طازج يحتوي على 200 مجم من Coomassie Brilliant Blue في 200 مل من المحلول التالي: الميثانول وحمض الأسيتيك والماء بنسبة حجم 50:10:40.
- اغسل الجل في 200 مل من محلول التلوين لمدة 30 دقيقة باستخدام هزاز لطيف.
- قم بإعداد محلول جديد لإزالة البقع عن طريق خلط الميثانول وحمض الأسيتيك والماء بنسبة حجم الميثانول: حمض الخليك: الماء = 50:10:40.
- اغسل الجل في 100 مل من محلول إزالة البقع لمدة 1 ساعة باستخدام التحريك اللطيف.
- كرر الإجراء أعلاه 4 مرات وأخيرا قم بتخزين الماء الثابت منزوع الأيونات في درجة حرارة الغرفة.
3. تحليل شظايا BSA-Au المعقدة عن طريق تحلل البروتين المحدود
- افحص تسلسل الأحماض الأمينية ل BSA وقم بإعداد جدول للأجزاء المتوقعة التي يمكن الحصول عليها عن طريق الهضم الأنزيمي ، بافتراض الحفاظ على رابطة Cys-Cys (التحلل البروتيني المحدود). في حالة هضم التربسين (الجدول 1) ، فإن مواقع القطع هي الطرف C من Lys و Arg ، باستثناء Pro. حساب الأخطاء الصغيرة في الأوزان الجزيئية للجزء ، الناشئة عن الغموض في مواقع القطع التربتية.
ملاحظة: عند تحليل تسلسل الأحماض الأمينية ل BSA ، فإن الشظايا التريبتية المحدودة المتوقعة التي تم الحصول عليها من هذه الخطوة هي: [A] (7.3 kDa ، المخلفات 1 - 64) ؛ [B] (5.9 كيلو دالتون ، المخلفات 65-114) ؛ [C] (20.1 ~ 22.4 كيلو دالتون ، المخلفات 115/117 - 294/312) ؛ [د] (21.3 ~ 23.4 كيلو دالتون ، المخلفات 295/313 - 499) ؛ و [E] (9.5 كيلو دالتون ، المخلفات 500 - 583). ينتج الغموض في مواقع القطع التربتية عن الأجزاء خارج الوحدات المتصلة ب Cys. بالنسبة ل BSA ، يمكن أن تظهر المخلفات 107 - 114 (0.9 كيلو دالتون) والمخلفات 295 - 312 (2.1 كيلو دالتون) كجزء الطرف N أو C من جزء متصل برابطة Cys-Cys. - حدد موقع (مواقع) Cys المكشوفة للسطح في هذه الأجزاء المتوقعة. بالنسبة إلى BSA المهضوم بالتربسين ، فإن Cys34 الوحيد المكشوف للسطح موجود في جزء [A].
- قم بإعداد قائمة الأوزان الجزيئية التي لوحظت كنطاقات الرحلان الكهربائي الهلامية ، أقل من ~ 66 كيلو دالتون (الوزن الجزيئي ل BSA).
ملاحظة: لهضم التربسين ، فإن نطاقات الرحلان الكهربائي للهلام المرصودة هي: النطاق (1) = BSA غير المهضوم ؛ النطاق (2) ~ 50 كيلو دالتون ؛ النطاق (3) ~ 44 كيلو دالتون ؛ الفرقة (4) ~ 42 كيلو دالتون ؛ الفرقة (5) ~ 36 كيلو دالتون ؛ الفرقة (6) ~ 32 كيلو دالتون ؛ الفرقة (7) ~ 26 كيلو دالتون ؛ النطاق (8) ~ 21 كيلو دالتون ؛ الفرقة (9) ~ 15 كيلو دالتون ؛ الفرقة (10) ~ 12 كيلو دالتون ؛ الفرقة (11) ~ 10 كيلو دالتون ؛ والفرقة (12) ~ 8 كيلو دالتون. - أعد بناء قائمة الأوزان الجزيئية المرصودة في الهلام ، من خلال الإضافات المتسلسلة لشظايا BSA المتوقعة. بالنسبة للتربسين ، يمكن أن يشكل الجزء [A] ثنائي [A] - [A] من خلال بقايا Cys المكشوفة للسطح.
النتائج
تم إعادة بناء الشريط الهلامي الاثني عشر المرصودة بشكل فريد من شظايا BSA الخمسة المتوقعة [A] - [E] (الشكل 1). كانت النتائج متوافقة مع الأدبيات ، حيث تم الحفاظ على الهياكل الثانوية بما في ذلك α الحلزونات والخيوطβ 19،20،21،22،23. النطاق (1) = [ABCDE] (غير مهضوم) ؛ النطاق (2) = [ABCD] (شظايا متصلة) ؛ النطاق (3) = [BCD] ؛ النطاق (4) = [CD]؛ النطاق (5) = [A] + [ABC] ؛ النطاق (6) = [ABC] ؛ النطاق (7) = [قبل الميلاد] ؛ النطاق (8) = [D]؛ النطاق (9) = [A] + [A]؛ النطاق (10) = [AB] ؛ النطاق (11) = [E] ؛ النطاق (12) = [أ] (الشكل 2 أ). يحتوي الشريط (5) والفرقة (9) على جزء ثنائي [A] ، والذي يبرره Cys34 2 المكشوفللسطح. يمكن استبعاد النطاقات التي تزيد عن الوزن الجزيئي ل BSA ~ 66 كيلو دالتون من التحليلات الإضافية لشظايا BSA.
لوحظ تلطيخ العصابات الهلامية في وجود Au (III). نعزو هذا التشويه إلى تفاعل Au (III) المرتبط بالسطح 5 مع مصفوفة الهلام24،25. يمكن تقليل هذا التشويه عند اتباع البروتوكول. من بين اثني عشر نطاقا هلاميا ل BSA-trypsin ، لوحظت تسعة نطاقات باسم [BSA-trypsin] -Au (الشكل 2 ب). تم نطق نطاقات متعددة (أعلى ~ 66 كيلو دالتون) ، بسبب التجميع الناجم عن Au (III) المرتبط بالسطح 12.
أظهرت خمسة نطاقات التلألؤ الأحمر داخل الهلام (الشكل 2 ج). كانت هذه النطاقات النطاق (1) = [ABCDE] (BSA غير مهضوم) ؛ النطاق (2) = [ABCD]؛ النطاق (3) = [BCD] ؛ النطاق (6) = [ABC] ؛ النطاق (7) = [قبل الميلاد]. كان التلألؤ غائبا في النطاق (8) = [D] ، النطاق (9) = [A] + [A] ، النطاق (10) = [AB] ، والنطاق (12) = [A] (الشكل 2 د). يمكن تفسير نمط شريط التلألؤ داخل الهلام هذا بوجود لومينوفور أحمر في الجزء التريبتسي [C] (البقايا 115/117 - 294/312).
تفاقم تلطيخ شريط الجل مع أوقات الهضم الطويلة ، في وجود Au (III). تم تقليل التشويه عند استخدام البروتوكول الموصوف أعلاه. تم وصف أمثلة على الرحلان الكهربائي للهلام غير المحسن في الشكل 3 والشكل 4 والشكل 5 والشكل 6 ، لتوضيح العوامل المؤثرة على الانحلال البروتيني التربتي المحدود والرحلان الكهربائي للهلام في وجود الكاتيونات المعدنية.

الشكل 1. قائمة نطاقات الحفاظ على السندات Cys-Cys من BSA عن طريق الانحلال البروتيني الثقبي المحدود. يمكن أن يؤدي الشق الترجري في مناطق الملف العشوائي إلى 15 شظيا (#i-xv) ، لكن روابط Cys-Cys تربط التسلسلات كما هو موضح. تم تعديل هذا الجدول من Dixon et al.6. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2. الرحلان الكهربائي الهلامي للشظايا التريبتية ل BSA التي تم الحصول عليها عن طريق الانحلال البروتيني المحدود. (أ) لوحظ ما مجموعه اثني عشر نطاقا في الرحلان الكهربائي الهلامي ل BSA عن طريق تحلل البروتين التربتي المحدود. (ب) تفاعلت شظايا BSA الترژبية مع Au (III). (ج) تلألؤ داخل الهلام (ب). (د) رسم العصابات المرصودة داخل الهلام. لوحظ تلألؤ أحمر داخل الهلام مع النطاق (1) = BSA غير المهضوم ، النطاق (2) = [ABCD] ، النطاق (3) = [BCD] ، النطاق (6) = [ABC] ، والنطاق (7) = [BC] (يشار إليه ب †). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3. تحسين وقت رد الفعل مع Au. (أ) BSA؛ (ب) BSA-Au (رد فعله لمدة ساعتين) ؛ (ج) BSA-Au (رد فعل لمدة ساعة واحدة)؛ (د) BSA-Au (رد فعله لمدة 30 دقيقة)؛ (ه) BSA-Au (رد فعله لمدة 5 دقائق). تطلب التلألؤ الأحمر لمجمعات BSA-Au 30 دقيقة على الأقل عند 37 درجة مئوية ، وكان التلألؤ أكثر كثافة في الجل بعد التفاعل لمدة ساعتين. ومع ذلك ، أدى وقت رد الفعل الأطول إلى مزيد من التلطيخ في عصابات الرحلان الكهربائي للهلام. من أجل تعظيم شدة اللمعان وتقليل التلطيخ ، تم اختيار وقت رد الفعل الأمثل ليكون ساعتين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. تحسين توقيت إضافة التربسين للهضم ، و Au للتفاعل. تم استكشاف وقت رد الفعل مع Au في نطاق 2 إلى 24 ساعة. (ب) [BSA-trypsin] -Au (بعد ساعتين) ؛ (ج) [BSA-trypsin] -Au (بعد 4 ساعات)؛ (د) [BSA-trypsin] -Au (بعد 8 ساعات) ؛ (E) [BSA-trypsin] -Au (بعد 24 ساعة). أدى وقت رد الفعل الأطول إلى مزيد من تلطيخ العصابات الهلامية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
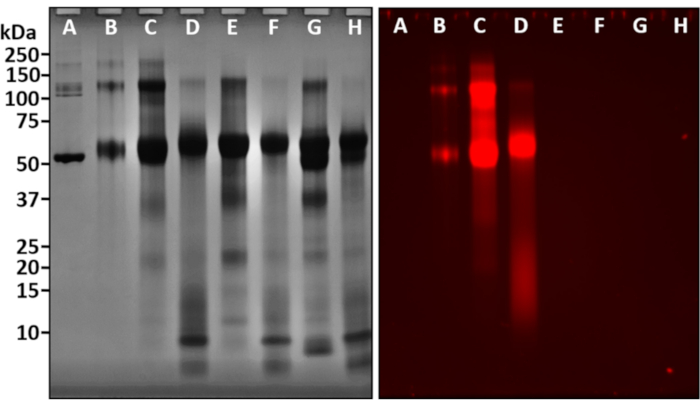
الشكل 5. آثار الكاتيونات المعدنية وتلطيخ شريط الجل. لوحظ تلطيخ العصابات الهلامية من خلال إضافات وتفاعلات مع Au (III) بالمثل مع Cu (II) و Ni (II). (أ) BSA؛ (ب) BSA-AU؛ (ج) [BSA-trypsin] -Au (هضم ساعتين) ؛ (د) [BSA-trypsin]-Au (الهضم بين عشية وضحاها) ؛ (ه) [BSA-trypsin] -Cu (هضم لمدة ساعتين) ؛ (F) [BSA-trypsin] -Cu (الهضم بين عشية وضحاها) ؛ (ز) [BSA-trypsin] -Ni (هضم ساعتين) ؛ (ح) [BSA-trypsin] -Ni (الهضم بين عشية وضحاها). لم يلاحظ اللمعان الأحمر عند التفاعلات مع Cu (III) أو Ni (II). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6. تأثيرات الأس الهيدروجيني وترتيب إضافات التربسين والاتحاد الافريقي. تم تحضير المركبات المجزأة عن طريق تفاعل Au مع BSA المهضوم ([BSA-trypsin]-Au) ، أو عن طريق هضم BSA-Au ([BSA-Au]-trypsin) المشكل مسبقا ، ثم تشغيله في هلام كما هو أو بعد ضبط الرقم الهيدروجيني إلى 7 في المخزن المؤقت للعينة. (أ) BSA؛ (ب) BSA-Au (كما هو)؛ (ج) BSA-Au (درجة الحموضة = 7)؛ (د) BSA-trypsin؛ (ه) [BSA-trypsin] - Au (كما هو)؛ (و) [BSA-Au] - التربسين (كما هو)؛ (ز) [BSA-trypsin]-Au (الأس الهيدروجيني = 7)؛ (ح) [BSA-Au]-التربسين (الرقم الهيدروجيني = 7). لم يتأثر وجود التلألؤ الأحمر بترتيب إضافات التربسين و Au ، ولكن تلطيخ عصابات الهلام كان أكثر وضوحا ل [BSA-Au] -trypsin. لم يؤد تعديل الأس الهيدروجيني إلى المحايد في المخزن المؤقت للعينة إلى تحسين تلطيخ شريط الهلام بشكل كبير ، ولكنه زاد من تراكم الشظايا كما هو موضح في نطاقات الهلام أعلاه ~ 66 كيلو دالتون. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
كان الغرض من هذا البروتوكول هو تحديد مجال تكوين اللومينوفور الأحمر في مجمعات BSA-Au. استخدمنا تحلل البروتين التربتي المحدود للحصول على شظايا BSA ، مع الحفاظ على روابط Cys-Cys الضرورية لإنتاج اللمعان الأحمر. قمنا بتحسين ظروف تحلل البروتين والرحلان الكهربائي في وجود Au (III). يمكن تطبيق نفس المبادئ على نطاق واسع على تحليلات الهلام للبروتينات المجزأة في وجود الكاتيونات المعدنية.
أجرينا تحسينات متعددة لتمكين تحليل شظايا BSA-Au وتألقها داخل الهلام. تطلب التلألؤ الأحمر لمجمعات BSA-Au وشظايا [BSA-trypsin] -Au ما لا يقل عن 30 دقيقة من وقت التفاعل عند 37 درجة مئوية لتكون قابلة للملاحظة في المواد الهلامية ، وكان التلألؤ أكثر كثافة في الجل بعد التفاعل لمدة ساعتين (الشكل 3 ، الشكل 4). ومع ذلك ، أدى وقت رد الفعل الأطول إلى مزيد من التلطيخ في عصابات الرحلان الكهربائي للهلام. من أجل تعظيم شدة اللمعان وتقليل التلطيخ ، تم اختيار وقت رد الفعل الأمثل ليكون ساعتين.
يبدو أن وجود الكاتيونات المعدنية هو السبب الرئيسي لتلطيخ شريط الجل. لوحظ تلطيخ العصابات الهلامية من خلال إضافات وتفاعلات مع Au (III) ، وكذلك مع Cu (II) 24،25 و Ni (II) (الشكل 5). قمنا أيضا بتقييم تأثيرات ترتيب إضافة التربسين و Au ، ودرجة الحموضة العازلة لتحميل العينة (الشكل 6). لاحظنا التلألؤ الأحمر داخل الهلام بغض النظر عن ترتيب إضافات التربسين والاتحاد الافريقي. ومع ذلك ، تم قمع تلطيخ العصابات الهلامية ل [BSA-trypsin]-Au ، أي عن طريق هضم BSA أولا ثم تفاعل الأجزاء التي تم الحصول عليها مع Au. لم يؤد تعديل الأس الهيدروجيني إلى المحايد في المخزن المؤقت لتحميل العينة للرحلان الكهربائي للهلام إلى تحسين تلطيخ نطاق الهلام بشكل كبير ، بل زاد من تراكم الشظايا كما هو موضح في نطاقات الهلام فوق الوزن الجزيئي البالغ 66.4 كيلو دالتون. العوامل المهمة الأخرى التي نلاحظها لتحسين تحليل نطاق الهلام هي نسبة BSA: Au (تم الحصول على أقصى كثافة لنسبة 1:255 ، لكننا قمنا بتحسينها إلى 1:10 لتقليل تلطيخ الهلام الناجم عن الكاتيون المعدني ، مع زيادة شدة اللمعان الأحمر) وتحميل الجل (10 ميكروغرام من البروتين لكل حارة ، لزيادة شدة تلألؤ الشريط داخل الهلام مع تجنب التحميل الزائد). بالنسبة للبروتينات القائمة على الهلام ، قد يكون من الضروري إجراء مزيد من التحسين في التلطيخ.
تحتاج غالبية البروتينات إلى كاتيونات معدنية لتعمل ، وبدرجة حموضة فسيولوجية معينة. من أجل الفهم الكامل لهذه البروتينات ، فإن علم البلورات بالأشعة السينية مطلوب في النهاية للتحليلات الهيكلية وتحديد التنسيق المعدني. ومع ذلك ، غالبا ما يكون تبلور البروتين صعبا وليس ممكنا دائما عند درجة الحموضة المرغوبة (الوظيفية من الناحية الفسيولوجية). بأخذ التجارب المعروضة هنا كمثال ، فإن هياكل BSA ، وشظاياها ، غير معروفة بتشكل الأس الهيدروجيني غير المحايد المطلوب لإنتاج اللمعان الأحمر. ومع ذلك ، تمكنا من الحصول على معلومات وظيفية مهمة لشظايا BSA المرتبطة بالمعدن عند درجة الحموضة المطلوبة. لذلك يمكن استخدام هذه الطريقة في مكمل لدراسة تفاعلات البروتينات مع الكاتيونات المعدنية بطريقة سهلة دون الحاجة إلى تبلور البروتين.
يمكن أن يكون الاستنساخ الجزيئي صعبا من الناحية الفنية في بعض الحالات ، بسبب انخفاض قابلية الذوبان لجزء المنتج أو انخفاض التعبير في الإشريكية القولونية ، وعادة ما يستغرق وقتاطويلا 6. يمكن للطريقة السهلة القائمة على التحلل البروتيني المحدود المعروض هنا أن تكمل نهج الاستنساخ الجزيئي.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يقر S.E. بالدعم المقدم من مؤسسة PhRMA ومؤسسة أبحاث سرطان الدم والمعاهد الوطنية للصحة (NIH R15GM129678).
Materials
| Name | Company | Catalog Number | Comments |
| Ammonium bicarbonate, 99.5% | Sigma-Aldrich | 9830 | |
| Azure Biosystems C400 gel imaging system | Azure Biosystems | C400 | |
| Bovine Serum Albumin (BSA), 96% | Sigma-Aldrich | A5611 | |
| Glycerol, >99.0% | Sigma-Aldrich | G5516 | |
| gold (III) chloride trihydrate, 99.9% | Sigma-Aldrich | 520918 | |
| NuPAGE 4-12% Bis-Tris Mini Protein Gel | Thermo Fisher | NP0321BOX | |
| NuPAGE MES Running Buffer (20X) | Thermo Fisher | NP0002 | |
| Sodium Chloride (NaCl), >99.5% | Sigma-Aldrich | S7653 | |
| Sodium hydroxide, >98.0% | Sigma-Aldrich | S8045 | |
| Tris Hydrochloride (Tris-HCl) | Sigma-Aldrich | 10812846001 | |
| Trypsin from Bovine Pancreas (>10,000 BAEE units/mg) | Sigma-Aldrich | T1426 |
References
- Majorek, K. A., et al. Structural and immunologic characterization of bovine, horse, and rabbit serum albumins. Molecular Immunology. 52, 174-182 (2012).
- Peters, T. . All About Albumin. , (1996).
- Peters, T. Serum albumin. Advances in Protein Chemistry. 37, 161-245 (1985).
- Dixon, J. M., Egusa, S. Conformational change-induced fluorescence of bovine serum albumin-gold complexes. Journal of the American Chemical Society. 140, 2265-2271 (2018).
- Dixon, J. M., Egusa, S. Kinetics of the fluorophore formation in bovine serum albumin-gold complexes. The Journal of Physical Chemistry C. 123, 10094-10100 (2019).
- Dixon, J. M., Tomida, J., Egusa, S. Identifying the red-luminophore-forming domain in serum albumin-gold complexes. The Journal of Physical Chemistry Letters. 11, 3345-3349 (2020).
- Xie, J., Zheng, Y., Ying, J. Y. Protein-directed synthesis of highly fluorescent gold nanoclusters. Journal of the American Chemical Society. 131, 888-889 (2009).
- Chen, L. -. Y., Wang, C. -. W., Yuan, Z., Chang, H. -. T. Fluorescent gold nanoclusters: Recent advances in sensing and imaging. Analitycal Chemistry. 87, 216-229 (2015).
- Saha, K., Agasti, S. S., Kim, C., Li, X., Rotello, V. M. Gold nanoparticles in chemical and biological sensing. Chemical Review. 112, 2739-2779 (2012).
- Daniel, M. C., Astruc, D. Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chemical Review. 104, 293-346 (2004).
- Cai, W., Gao, T., Hong, H., Sun, J. Applications of gold nanoparticles in cancer nanotechnology. Nanotechnology, Science and Applications. 1, 17-32 (2008).
- Dorsey, J. F., et al. Gold nanoparticles in radiation research: potential applications for imaging and radiosensitization. Translational Cancer Research. 2, 280-291 (2013).
- Nune, S. K., et al. Nanoparticles for biomedical imaging. Expert Opinion on Drug Delivery. 6, 1175-1194 (2009).
- Huang, X., Jain, P. K., El-Sayed, I. H., El-Sayed, M. A. Gold nanoparticles: interesting optical properties and recent applications in cancer diagnostics and therapy. Nanomedicine. 2, 681-693 (2007).
- Doane, T. L., Burda, C. The unique role of nanoparticles in nanomedicine: imaging, drug delivery and therapy. Chemical Society Reviews. 41, 2885-2911 (2012).
- Egusa, S., Ebrahem, Q., Mahfouz, R. Z., Saunthararajah, Y. Ligand exchange on gold nanoparticles for drug delivery and enhanced therapeutic index evaluated in acute myeloid leukemia models. Experimental Biology and Medicine. 239, 853-861 (2014).
- Dupont, C. L., Butcher, A., Valas, R. E., Bourne, P. E., Caetano-Anollés, G. History of biological metal utilization inferred through phylogenomic analysis of protein structures. Proceedings of the National Academy of Science. 107, 10567-10572 (2010).
- Andreini, C., Bertini, I., Cavallaro, G., Holliday, G. L., Thornton, J. M. Metal ions in biological catalysis: from enzyme databases to general principles. Journal of Biological Inorganic Chemistry. 13, 1205-1218 (2008).
- King, T. P. Limited pepsin digestion of bovine plasma albumin. Archives of Biochemistry and Biophysiscs. 156, 509-520 (1973).
- King, T. P., Spencer, M. Structural studies and organic ligand-binding properties of bovine plasma albumin. Journal of Biological Chemistry. 245, 6134-6148 (1970).
- Reed, R. G., Feldhoff, R. C., Clute, O. L., Peters, T. Fragments of bovine serum albumin produced by limited proteolysis. Conformation and ligand binding. Biochemistry. 14, 4578-4583 (1975).
- Peters, T., Feldhoff, R. C. Fragments of bovine serum albumin produced by limited proteolysis. Isolation and characterization of tryptic fragments. Biochemistry. 14, 3384-3391 (1975).
- Kazanov, M. D., et al. Structural determinants of limited proteolysis. Journal of Proteome Research. 10, 3642-3651 (2011).
- Ortiz, M. L., Calero, M., Fernandez Patron, C., Patron, C. F., Castellanos, L., Mendez, E. Imidazole-SDS-Zn reverse staining of proteins in gels containing or not SDS and microsequence of individual unmodified electroblotted proteins. FEBS Letters. 296, 300-304 (1992).
- Lee, C., Levin, A., Branton, D. Copper staining: A five-minute protein stain for sodium dodecyl sulfate-polyacrylamide gels. Analytical Biochemistry. 166, 308-312 (1987).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved