Method Article
قياس الطيف الكتلي للكروماتوغرافيا الغازية مقترن باختصاص ميكروإكستراكشن المرحلة الصلبة للتبخير الكلي كأداة للطب الشرعي
In This Article
Summary
مجموع التبخر الصلبة المرحلة Microextraction (TV-SPME) يتبخر تماما عينة السائل في حين يتم sorbed التحليلات على ألياف SPME. وهذا يسمح لتقسيم التحليل بين بخار المذيبات فقط وطلاء الألياف SPME.
Abstract
الكروماتوغرافيا الغازية – قياس الطيف الكتلي (GC-MS) هو تقنية تستخدم بشكل متكرر لتحليل العديد من التحليلات ذات الاهتمام الشرعي، بما في ذلك المواد الخاضعة للرقابة والسوائل القابلة للاشتعال والمتفجرات. يمكن أن يقترن GC-MS مع Microextraction المرحلة الصلبة (SPME)، حيث يتم وضع الألياف مع طلاء الامتصاص في مساحة الرأس فوق عينة أو مغمورة في عينة سائلة. يتم شرب الاليات على الألياف التي يتم وضعها بعد ذلك داخل مدخل GC ساخنة desorption. مجموع تبخير الصلبة المرحلة Microextraction (TV-SPME) يستخدم نفس الأسلوب كما SPME الغمر ولكن يغمر الألياف في استخراج عينة تبخير تماما. ينتج عن هذا التبخير الكامل تقسيم بين مرحلة البخار فقط وألياف SPME دون تدخل من مرحلة سائلة أو أي مواد غير قابلة للذوبان. اعتمادا على نقطة الغليان للمذيب المستخدمة، TV-SPME يسمح لحجم عينة كبيرة (على سبيل المثال، تصل إلى مئات من microliters). يمكن أيضا تنفيذ اشتقاق الألياف باستخدام TV-SPME. وقد استخدمت TV-SPME لتحليل الأدوية والأيض في الشعر والبول واللعاب. وقد طبقت هذه التقنية البسيطة أيضا على عقاقير الشوارع والدهون وعينات الوقود ومخلفات المتفجرات بعد الانفجار والملوثات في المياه. تسلط هذه الورقة الضوء على استخدام TV-SPME لتحديد الزناة غير الشرعيين في عينات صغيرة جدا (كميات ميكرولتر) من المشروبات الكحولية. تم تحديد كل من غاما هيدروكسي بوتيرات (GHB) وغاما بوتيرولاكتون (GBL) عند مستويات يمكن العثور عليها في المشروبات ارتفعت. الاشتقاق بواسطة عامل تريميثيلسيليل يسمح لتحويل المصفوفة المائية وGHB إلى مشتقات TMS الخاصة بهم. بشكل عام، TV-SPME سريع وسهل ولا يتطلب إعداد عينة باستثناء وضع العينة في قارورة مساحة الرأس.
Introduction
المرحلة الصلبة Microextraction (SPME) هي تقنية أخذ العينات التي يتم فيها وضع عينة سائلة أو صلبة في قارورة مساحة الرأس ويتم إدخال ألياف SPME ، المغلفة بمادة بوليمرية ، في مساحة الرأس العينة (أو مغمورة في عينة سائلة). يتم شرب التحليل على الألياف ثم يتم وضع الألياف داخل مدخل GC لإزالة الامتصاص1،2. مجموع تبخير الصلبة المرحلة Microextraction (TV-SPME) هو تقنية مماثلة كما SPME الغمر ولكن يتبخر تماما عينة السائل قبل أن يتم امتصاص التحليلات على الألياف. وهذا يسمح لتقسيم التحليل بين بخار المذيبات فقط وطلاء الألياف ، مما يسمح لمزيد من التحليل أن يكون مهزوا على الألياف ويؤدي إلى حساسية جيدة3. هناك مختلف ألياف SPME المتاحة وينبغي اختيار الألياف على أساس تحليل الفائدة، والمذيبات / مصفوفة، وعامل اشتقاق. راجع الجدول 1 للحصول على التحليلات TV-SPME المنشأة.
| عينة | تحليل (ق) | الموصى بها SPME الألياف | المرجع (المراجع) |
| شعر الإنسان | النيكوتين، الكوتينين | بوليديميثيلسيلوكسيان/ديفينيلبنزين (PDMS/DVB)، بولي أكريلات (PA) | 3 |
| مسحوق بلا دخان | نيتروجليسرين، ديفينيلامين | بوليديمثيلسيل أوكسان (PDMS)، بولي إيثيلين غليكول (PEG) | 7, 8 |
| سباق الوقود | الميثانول، نيتروميثان | الوتد | 9 |
| الماء | الهيدروكربونات العطرية متعددة الحلقات | نظام إدارة البيانات الرقمية | 10 |
| المشروبات | حمض ɣ هيدروكسي بوتيريك، ɣ بوتيرولاكتون | نظام إدارة البيانات الرقمية | هذا العمل |
| مسحوق صلب | الميثامفيتامين والأمفيتامين | PDMS/DVB | غير منشوره |
الجدول 1 - الجداول ألياف SPME الموصى بها مع التحليلات TV-SPME المنشأة.
لأداء TV-SPME، يتم حل التحليلات في المذيبات ويتم وضع aliquot من هذا الخليط في قارورة مساحة الرأس. لا تحتاج العينات إلى التصفية لأن المذيبات والتحليلات المتطايرة فقط هي التي ستتبخر. يجب استخدام كميات محددة من العينات السائلة لضمان التبخير الكلي للعينة. يتم تحديد هذه الأحجام باستخدام قانون الغاز المثالي لحساب عدد الشامات من المذيبات مضروبة في حجم الضرس من السائل (المعادلة 1). المعادلة 1
المعادلة 1
حيث Vo هو حجم العينة (مل)، P هو ضغط بخار المذيب (بار)،V v هو حجم القارورة (L)، R هو ثابت الغاز المثالي (0.083145)، M هو 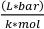 الكتلة الأضراس للمذيب (ز / مول)، T هو درجة الحرارة (K)،
الكتلة الأضراس للمذيب (ز / مول)، T هو درجة الحرارة (K)،  وكثافة المذيب (غرام / مل). 3
وكثافة المذيب (غرام / مل). 3
من أجل استخدام ضغط البخار الصحيح ، يتم استخدام معادلة أنطوان (المعادلة 2) لحساب تأثير درجة الحرارة:4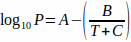 المعادلة 2
المعادلة 2
حيث T هي درجة الحرارة و A، B، و C هي ثوابت أنطوان للمذيب. يمكن استبدال المعادلة 2 في المعادلة 1، مما يؤدي إلى: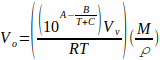 المعادلة 3
المعادلة 3
المعادلة 3 يعطي حجم العينة (Vس)التي يمكن تبخيرها تماما كدالة لدرجة الحرارة والمذيبات المستخدمة.
لتنفيذ derivatization مع TV-SPME، يتم أولا عرض الألياف SPME إلى قارورة تحتوي على عامل اشتقاق لمقدار محدد مسبقا من الوقت اعتمادا على التحليل. ثم تتعرض ألياف SPME إلى قارورة جديدة تحتوي على تحليل الاهتمام. يتم تسخين هذه القارورة داخل محرض ساخن. ثم يتم نقع التحليل على الألياف باستخدام عامل الاشتقاق. اشتقاق التحليل و / أو المصفوفة يحدث على الألياف قبل إدراجها في مدخل GC لإزالة الامتصاص. يظهر الشكل 1 تصويرا لعملية TV-SPME مع اشتقاق.

الشكل 1: تصوير عملية TV-SPME مع اشتقاق. تدخل ألياف SPME أولا قارورة الاشتقاق حيث يقوم عامل الاشتقاق (الدوائر الصفراء) بالتسرب إلى الألياف. ثم يتم إدخال الألياف إلى العينة (الدوائر الزرقاء) وتسخينها. تشكيل مشتق (الدوائر الخضراء) يحدث على الألياف خلال وقت الاستخراج. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
TV-SPME مفيد لأنه يسمح للتحليل أن تكون مشتقة أثناء عملية الاستخراج مما يقلل من وقت التحليل. تتطلب الطرق الأخرى ، مثل الحقن السائل ، تفاعل التحليل مع عامل الاشتقاق في المحلول قبل حقنه في GC. التلفزيون SPME يتطلب أيضا القليل من إعداد العينة أو معدومة. يمكن وضع مصفوفة تحتوي على تحليل مباشرة في قارورة مساحة الرأس وتحليلها. العديد من المركبات ذات الاهتمام متوافقة مع TV-SPME. يجب أن تكون المركبات قابلة للذوبان في المذيبات ومتقلبة بما فيه الكفاية للسماح للتبخير. بالإضافة إلى ذلك، يجب أن تكون المركبات مستقرة حراريا ليتم تحليلها بواسطة GC-MS. وقد استخدمت TV-SPME لتحليل المخدرات والأيض المخدرات, سباقات الوقود, الهيدروكربونات العطرية متعددة الحلقات, والمواد المتفجرة3,5,6,7,8,9,10.
Protocol
1. إعداد عينة TV-SPME العامة وتحليل GC-MS
ملاحظة: إذا تم حل العينة بالفعل في مصفوفة، انتقل إلى الخطوة 1.2.
- استخراج أو حل العينة الصلبة في ما يكفي من المذيبات (الماء والميثانول والأسيتون، الخ) للوصول إلى التركيز المطلوب. يمكن استخدام عينات السائل "كما هو".
ملاحظة: تعتمد كمية العينة الصلبة المستخدمة على التركيز المطلوب للعينة. يوصى بالتركيزات التي تقل عن 1 ppm (w/v) لتجنب تحميل عمود GC فوق طاقته. يجب أن يكون التحليل قابلا للذوبان في المذيبات العضوية المختارة.- تأكد من أن العينة قد حلت بالكامل.
- احسب الحجم اللازم لتبخير العينة بالكامل باستخدام المعادلة 3 عند درجة الحرارة المختارة. على سبيل المثال، إذا كان للتجربة أن تتم عند 60 درجة مئوية، فاحسب الحجم اللازم لتبخير المذيب بالكامل عند 60 درجة مئوية.
- نقل حجم العينة هذا إلى قارورة مساحة الرأس وتأمين الغطاء. وتشمل الطرق المقبولة لنقل العينات السائلة على مقياس الميكرليتر يدويا عن طريق حقنة زجاجية، أو حقنة زجاجية إلكترونية، أو روبوت أوتوسامبلر قادر على نقل السوائل لإعداد العينات.
- إذا اشتقاق العينة، قم بإعداد عامل اشتقاق المناسبة عن طريق وضع ~ 1 مل من العامل في قارورة مساحة الرأس.
- اختر عامل اشتقاق استنادا إلى نوع اشتقاق المطلوبة: الألكيليشن، acylation، أو سيلييشن. في هذه الحالة، عامل اشتقاق الموصى بها لحمض الكربوكسيليك ومجموعات الكحول وظيفية وجدت على GHB هو O-bis(trimethylsilyl) ثلاثي فلوريواسيتاميد (BSTFA). يمكن استخدام عامل اشتقاق "كما هو" ولا يتطلب التخفيف. مل واحد من عامل اشتقاق يكفي لضمان التشبع الكامل للألياف SPME.
تنبيه: عوامل الاشتقاق سامة وينبغي التعامل معها في غطاء الدخان.
- اختر عامل اشتقاق استنادا إلى نوع اشتقاق المطلوبة: الألكيليشن، acylation، أو سيلييشن. في هذه الحالة، عامل اشتقاق الموصى بها لحمض الكربوكسيليك ومجموعات الكحول وظيفية وجدت على GHB هو O-bis(trimethylsilyl) ثلاثي فلوريواسيتاميد (BSTFA). يمكن استخدام عامل اشتقاق "كما هو" ولا يتطلب التخفيف. مل واحد من عامل اشتقاق يكفي لضمان التشبع الكامل للألياف SPME.
- تعيين درجة حرارة الحضانة / الاستخراج المناسبة استنادا إلى الحساب في الخطوة 1.2. تضمن درجة الحرارة هذه التبخير الكلي، واستخراج عينات كافية، والإشتقاق الكامل (إذا لزم الأمر).
- حدد معلمات GC-MS (برنامج درجة حرارة الفرن ومعدل التدفق ودرجة حرارة المدخل وما إلى ذلك) استنادا إلى فئة المركب (المركب) من الفائدة. راجع الخطوة 3 للحصول على مجموعة معلمات مثال.
- تأكد من أن بطانة المدخل المناسبة (على سبيل المثال، قطرها الداخلي 2 مم أو أقل) موجودة في مدخل GC.
- تأكد من أن ألياف SPME قد تم تكييفها بشكل صحيح وهي في حالة عمل جيدة قبل بدء التحليل.
- تختلف معلمات تكييف استنادا إلى نوع من الألياف SPME المستخدمة. يرجى الاطلاع على إرشادات الألياف SPME لدرجة حرارة التكييف المناسبة والوقت. بشكل عام، تحليل العديد من الفراغات الألياف SPME حتى تكون قابلة للاستنساخ كافية لوصف الألياف SPME كما مشروطة تماما.
2. غاما هيدروكسي بوتيرات (GHB) و غاما بوتيرولاكتون (GBL) إعداد العينة
- إعداد عينة من GHB و / أو GBL في الماء بتركيز أقل من 1 جزء في المليون.
- نقل 1 ميكرولتر من هذه العينة إلى قارورة مساحة رأس 20 مل باستخدام إحدى الطرق الموضحة في 1.2.1.
- لاحظ أن تحليل عينات المائية يتطلب وحدات تخزين العينة أدنى. على سبيل المثال، سوف يتبخر μL واحد من الماء تماما في قارورة مساحة الرأس 20 مل في 60 درجة مئوية.
- قم بسقف القارورة على الفور.
- ضع ~ 1 مل من BSTFA + 1٪ تريميثيلكلوروسيلين (TMCS) في قارورة وغطاء منفصلين لمساحة الرأس سعة 20 مل.
ملاحظة: GBL لا derivatize. ومع ذلك، لا تزال هناك حاجة إلى خطوة اشتقاق لضمان اشتقاق مذيب المياه وعدم تداخله مع العينة.
تنبيه: BSTFA سامة وينبغي التعامل معها في غطاء الدخان.
3. GC-MS المعلمات والإعداد لGHB و GBL في الماء
- إنشاء أسلوب باستخدام المعلمات GC-MS التالية:
درجة حرارة الفرن الأولية: 60 درجة مئوية لمدة دقيقة واحدة.
برنامج الفرن: 15 درجة مئوية/دقيقة.
درجة حرارة الفرن النهائي: 280 درجة مئوية، لمدة دقيقة واحدة.
معدل التدفق: 2.5 مل/دقيقة (التدفق الأمثل للسرعة لعمود 0.25 مم في اليوم).
درجة حرارة المدخل: 250 °C.
درجة حرارة خط النقل: 280 °C. - تأكد من أنه تم وضع بطانة مدخل SPME ضيقة (2 مم أو أقل) داخل مدخل GC.
- تأكد من أن ألياف PDMS/DVB SPME قد تم تكييفها بشكل صحيح وهي في حالة عمل جيدة قبل التحليل.
ملاحظة: يجب أن تكون مشروطة PDMS/DVB ألياف SPME في مدخل GC عند 250 درجة مئوية لمدة 30 دقيقة. PDMS/DVB ألياف SPME يجب أن يكون لون أبيض. - تشغيل GC-MS على النموذج.
النتائج
تم إجراء دراسة حجم GBL لإثبات حساسية TV-SPME مقارنة بمساحة الرأس وSPME الغمر. تم إعداد عينة 100 جزء في المليونمن GBL في الماء ووضعها في قارورة مساحة رأس 20 مل بأحجام 1 و3 و10 و30 و100 و300 و1000 و3000 و1000 و10000 ميكرولتر. نسبة المرحلة من العينات المسموح بها للتلفزيون SPME (1-3 ميكرولتر)، مساحة الرأس SPME (10 - 3000 ميكرولتر) وغمر SPME (10،000 ميكرولتر). تم تحليل جميع العينات في ثلاثة نسخ وتم رسم متوسط منطقة الذروة مقابل حجم العينة. بشكل عام، أظهرت أحجام العينة التي سمحت للتلفزيون SPME حساسية أكثر من مساحة الرأس أو الغمر SPME لGBL في الماء كما هو موضح في الشكل 2. تظهر مقارنة بين اللونيات لكل طريقة في الشكل 3.
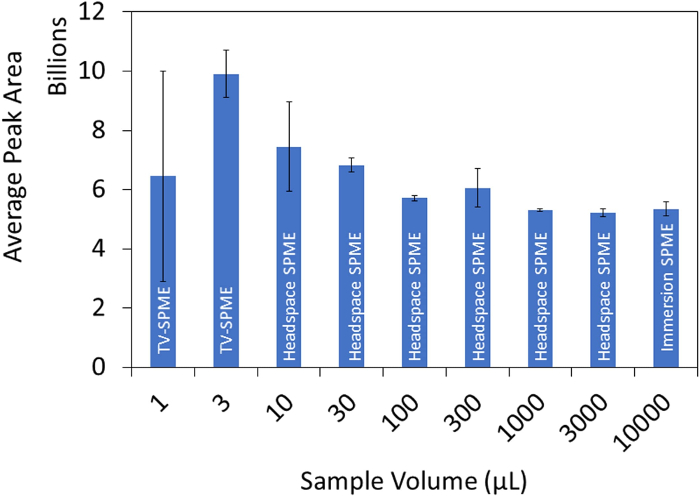
الشكل 2: رسم بياني لمتوسط مساحة الذروة مقابل حجم العينة ل GBL في الماء. تم إجراء دراسة حجم GBL لإثبات فعالية TV-SPME مقارنة بمساحة الرأس وSPME الغمر. تم إعدادعينة 100 جزء في المليون من GBL في الماء ووضعها في قارورة مساحة رأس 20 مل بأحجام 1 و3 و10 و30 و100 و300 و1000 و3000 و1000 و10000 ميكرولتر. تم تحليل جميع العينات في ثلاثة أشرطة والأخطاء تتوافق مع الانحراف المعياري للوضيع. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
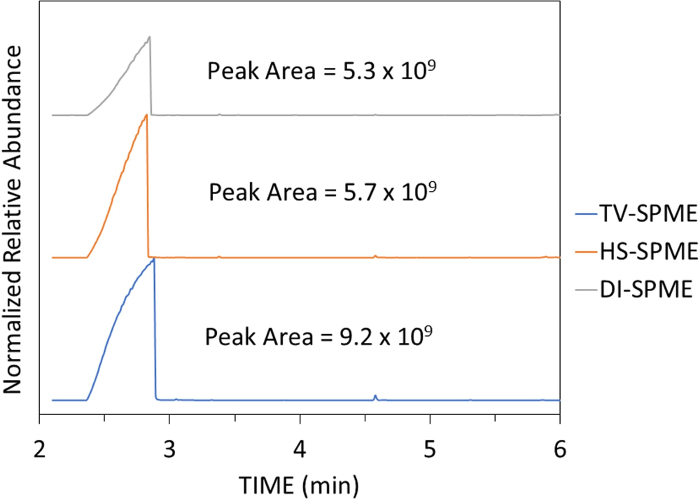
الشكل 3: مجموع الكروماتوجرامات الأيونية ل GBL في الماء. (100 ورقة في الدقيقة) ل 3 ميكرولتر (أزرق)، و300 ميكرولتر (أحمر)، و10000 ميكرولتر (أخضر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
وتظهر عينات واقعية من النبيذ ارتفعت مع جرعة فعالة من GHB وGBL في الشكل 4 والشكل 5، على التوالي. وتبين هذه العينات أيضا تداخل GBL وGHB. عندما يتم تنفيذ TV-SPME بشكل صحيح، سوف ينتج ذروة حادة وفيرة كما هو موضح في الشكل 6. TV-SPME لديه حساسية جيدة، وبالتالي ينبغي استخدام تركيزات مناسبة لعدم الزائد العمود. عندما تكون تركيزات عالية موجودة، سوف يؤدي عدم التماثل الذروة كما هو مبين في الشكل 5 والشكل 7. في هذه الحالات، يمكن أن يؤدي تمييع العينة أو استخدام حقنة منقسمة إلى تحسين شكل الذروة.
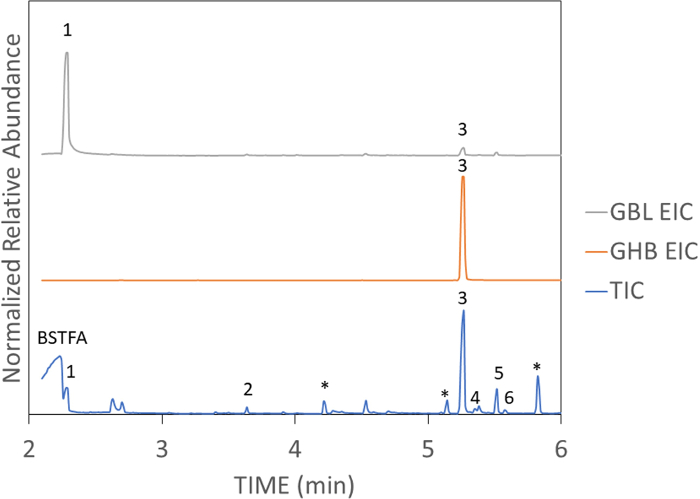
الشكل 4: عينة واقعية من GHB في النبيذ مع تركيز 8 ملغم / مل. قمم: 1) GBL، 2) حمض الهيكسانويك-TMS، 3) GHB-TMS2، 4) حمض البنزويك-TMS، 5) حمض أوكتانويك-TMS، 6) الجلسرين-TMS3، * يدل على سيلوكسان دوري (الألياف / عمود تنزف). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
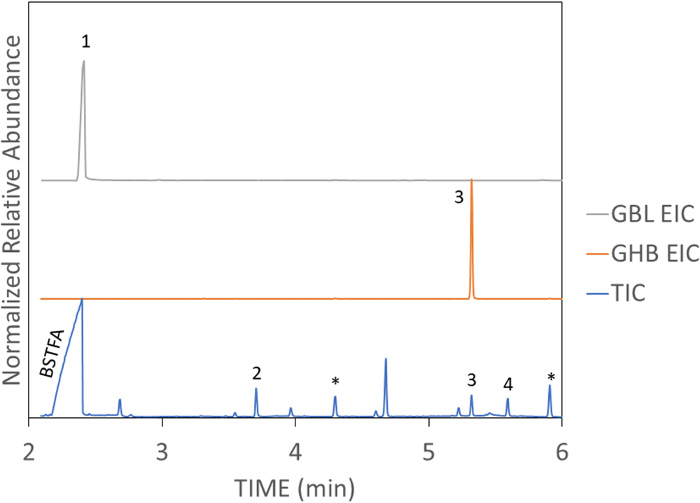
الشكل 5: عينة واقعية من GBL في النبيذ مع تركيز 10 ملغم / مل. القمم: 1) GBL، 2) حمض الهيكسانويك-TMS، 3) سيلوكسان، 4) تريميثيل (2-phenylethoxy) سيلان، 5) GHB-TMS2. TIC يظهر GBL تحويل إلى GHB. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
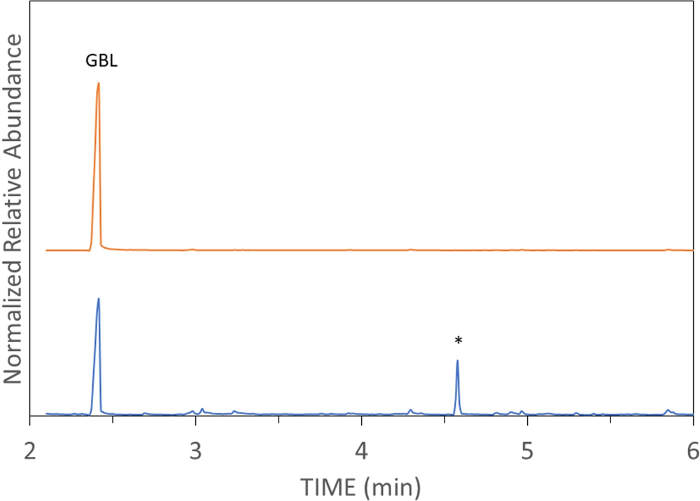
الشكل 6: مجموع الكروماتوغرام الأيوني ل GBL في الماء بتركيز 0.1 في الدقيقة. النتائج التي تتبع طريقة TV-SPME الموصوفة سابقا ل GBL في الماء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
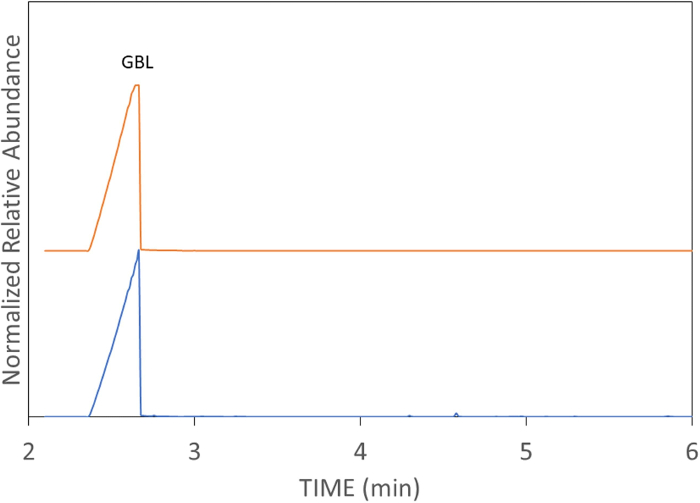
الشكل 7: مجموع الكروماتوغرام الأيوني ل GBL في الماء بتركيز 10 ppm. النتائج التي تتبع طريقة TV-SPME الموصوفة سابقا ل GBL في الماء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
عند اشتقاق، يجب أن يضمن المحلل أن الأسلوب يسمح للت التحليلية (الأساليب) أن تكون مشتقة بالكامل قبل أن يتم desorbed في GC. يمكن أن يؤدي اشتقاق جزئي إلى ذروة تمثل التحليل المشتق وذروة تمثل التحليل المشتق. كما سيؤدي الاشتقاق الجزئي إلى انخفاض الحساسية للت التحليلي حيث أن أقل منه قد يلتصق بالألياف.
Discussion
TV-SPME له بعض الفوائد على GC الحقن السائل في أن أحجام عينة كبيرة (على سبيل المثال، 100 ميكرولتر) يمكن استخدامها دون تعديلات الصك. TV-SPME أيضا بعض من نفس الفوائد كما SPME مساحة الرأس. لا تتطلب مساحة الرأس SPME أي استخراج أو ترشيح لأن أي مركبات غير قابلة للفولات ستبقى في قارورة مساحة الرأس ولن يتم امتزازها على الألياف ، مما ينتج عنه عينة نظيفة. يساعد هذا الأسلوب أيضا على إزالة تأثيرات المصفوفة بسبب هذا النظام ثنائي المرحلة (مساحة الرأس والألياف) بدلا من نظام ثلاثي المراحل (عينة ومساحة رأس وألياف) مثل مساحة الرأس القياسية SPME. TV-SPME مثل SPME الغمر في هذا الغمر SPME هو أيضا نظام من مرحلتين. مع SPME الغمر، يتم غمر الألياف في عينة سائلة (مائي عادة) تحتوي على التحليل بدلا من استخراج التحليل من بخاره. التلفزيون SPME يختلف عن SPME الغمر لأن SPME الغمر يتطلب مصفوفة القطبية / المائية من أجل توليد قوة دافعة كافية للت التحليلية لمغادرة مرحلة الحل وs sorb لطلاء الألياف. بالإضافة إلى ذلك، يتطلب SPME الغمر أحجام عينة أكبر بكثير (على سبيل المثال، مل).
يمكن استخدام العديد من المذيبات مع TV-SPME بما في ذلك الميثانول والأسيتون والماء والأسيتونيتريل. لا ينبغي أن تتعرض ألياف SPME أو مغمورة في الكلوروفورم لأن هذه المذيبات يمكن أن تلحق الضرر بطلاء الألياف. وقد تم العثور على عشرين مل المسمار غطاء الزجاج قارورة headspace أن يكون أفضل أداء مع التلفزيون SPME الأساليب. من المستحسن استخدام طابع تلقائي مع TV-SPME. في حين أن العديد من المعلمات من طريقة TV-SPME يمكن تعديلها على النحو المطلوب، يجب استخدام الحجم المناسب ودرجة حرارة الاستخراج لكل مذيب. حجم العينة ودرجة حرارة الاستخراج تتناسب مع بعضها البعض ويجب تعديلها وفقا لذلك. على سبيل المثال، قد يتم تقليل درجة حرارة استخراج طريقة، ولكن يجب أيضا تقليل حجم العينة. يمكن العثور على وحدة التخزين هذه عن طريق ضبط المعادلة 3.
يمكن إجراء تعديلات على إجراء اشتقاق. يمكن إجراء اشتقاق قبل أو بعد الاستخراج ، في درجة حرارة الغرفة أو تسخينها في المحرض ، عن طريق تعريض الألياف لبخار عامل الاشتقاق أو عن طريق الغمر المباشر للألياف في عامل الاشتقاق.
هناك قيود على طريقة TV-SPME بما في ذلك الحاجة إلى أن تكون المركبات قابلة للذوبان ومستقرة حراريا ومتقلبة. التلفزيون SPME يتطلب ألياف SPME باهظة الثمن التي يمكن أن يكون طلاء تجريدها أو كسر أثناء التحليل. وتفوق هذه القيود فوائد مثل أحجام عينات كبيرة بالنسبة لأحجام حقن GC النموذجية، وحساسية عالية، ولا حاجة للترشيح. ويفضل TV-SPME لمساحة الرأس SPME لأنه يتم استخراج المزيد من العينة على الألياف ويتم تقليل آثار المصفوفة. ويفضل TV-SPME أيضا إلى الغمر SPME لأن الغمر SPME يستهلك عينة أكثر بكثير من TV-SPME. TV-SPME يسمح ل derivatization أثناء عملية الاستخراج مما يقلل من وقت التحليل مقارنة مع أساليب مثل الحقن السائل التي تتطلب أن يتم اشتقاق التحليل قبل الحقن. التلفزيون SPME يتطلب أيضا القليل من إعداد العينة أو معدومة. TV-SPME بسيطة وفعالة وحساسة لتحليل مجموعة واسعة من العينات، بما في ذلك المخدرات والمواد المتفجرة، ووقود السباق.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد دعم هذا البحث المعهد الوطني للعدالة (الجائزة رقم 2015-DN-BX-K058 و2018-75-CX-0035). إن الآراء والنتائج والاستنتاجات المعرب عنها هنا هي آراء المؤلف ولا تعكس بالضرورة آراء منظمات التمويل.
Materials
| Name | Company | Catalog Number | Comments |
| 10 µL Syringe | Gerstel | 100111-014-00 | |
| BSTFA + 1% TMCS (10 x 1 GM) | Regis Technologies Inc. | 50442882 | |
| eVol XR Sample Dispensing System Kit | ThermoFisher Scientific | 66002-024 | |
 -Butyrolactone (GBL) -Butyrolactone (GBL) | Sigma-Aldrich | B103608-26G | |
 -Hydroxy Butyric Acid (GHB) -Hydroxy Butyric Acid (GHB) | Cayman Chemicals | 9002506 | |
| Headspace Screw-Thread Vials, 18 mm | Restek | 23083 | |
| Magnetic Screw-Thread Caps, 18 mm | Restek | 23091 | |
| Optima water for HPLC | Fisher Chemical | W71 | |
| SPME Fiber Assembly Polydimethylsiloxane (PDMS) | Supelco | 57341-U | |
| SPME Fiber Assembly Polydimethylsiloxane/Divinylbenzene (PDMS/DVB) | Supelco | 57293-U | |
| Topaz 2.0 mm ID Straight Inlet Liner | Restek | 23313 |
References
- Pawliszyn, J. B. Method and Device for Solid Phase Microextraction and Desorption. United States patent. , (2005).
- Pawliszyn, J. Solid phase microextraction: theory and practice. , John Wiley & Sons. (1997).
- Rainey, C. L., Bors, D. E., Goodpaster, J. V. Design and optimization of a total vaporization technique coupled to solid-phase microextraction. Analytical Chemistry. 86 (22), 11319-11325 (2014).
- Sinnott, R. Chemical Engineering Design: Chemical Engineering. 6, Elsevier. (2005).
- Davis, K. Detection of Illicit Drugs in Various Matrices Via Total Vaporization Solid-Phase Microextraction (TV-SPME). , Indiana University - Purdue University Indianapolis. Master of Science thesis (2019).
- Ash, J., Hickey, L., Goodpaster, J. Formation and identification of novel derivatives of primary amine and zwitterionic drugs. Forensic Chemistry. 10, 37-47 (2018).
- Sauzier, G., Bors, D., Ash, J., Goodpaster, J. V., Lewis, S. W. Optimisation of recovery protocols for double-base smokeless powder residues analysed by total vaporisation (TV) SPME/GC-MS. Talanta. 158, 368-374 (2016).
- Bors, D., Goodpaster, J. Mapping smokeless powder residue on PVC pipe bomb fragments using total vaporization solid phase microextraction. Forensic science international. 276, 71-76 (2017).
- Bors, D., Goodpaster, J. Chemical analysis of racing fuels using total vaporization and gas chromatography mass spectrometry (GC/MS). Analytical Methods. 8 (19), 3899-3902 (2016).
- Beiranvand, M., Ghiasvand, A. Design and optimization of the VA-TV-SPME method for ultrasensitive determination of the PAHs in polluted water. Talanta. 212, 120809(2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved