Method Article
سير عمل التصوير المقطعي للصفيف للحصول المستهدف على معلومات الحجم باستخدام المجهر الإلكتروني المسح الضوئي
In This Article
Summary
نحن نصف إعداد شرائط من المقاطع التسلسلية وجمعها على دعم نقل كبير لاستخدامها كعينات التصوير المقطعي الصفيف، جنبا إلى جنب مع إجراءات التصوير الآلي في المجهر الإلكتروني المسح الضوئي. يسمح البروتوكول بفحص واسترجاع وتصوير مستهدف للأحداث المحلية النادرة، والحصول على كميات كبيرة من البيانات.
Abstract
يتم تطبيق المجهر الإلكتروني في علم الأحياء والطب لتصوير التفاصيل الخلوية والهيكلية بدقة نانومتر. تاريخيا، قدم المجهر الإلكتروني الإرسال (TEM) نظرة ثاقبة في البنية الفوقية الخلية، ولكن في العقد الأخير، وتطوير المجاهر الإلكترونية المسح الضوئي الحديثة (SEM) قد غيرت طريقة النظر داخل الخلايا. على الرغم من أن دقة TEM متفوقة عندما تكون هناك حاجة إلى تفاصيل هيكلية على مستوى البروتين ، فإن دقة SEM كافية لغالبية الأسئلة المتعلقة ببيولوجيا الخلايا على مستوى الجهاز. مكن التقدم في التكنولوجيا حلول الاستحواذ التلقائي على الحجم مثل التصوير التسلسلي لوجه الكتلة (SBF-SEM) وشعاع الأيونات المركز SEM (FIB-SEM). ومع ذلك، تظل هذه الأساليب حتى يومنا هذا غير فعالة عندما يكون تحديد الهوية والملاحة إلى المناطق ذات الاهتمام أمرا حاسما. وبدون وسائل التوطين الدقيق للمناطق المستهدفة قبل التصوير، يحتاج المشغلون إلى الحصول على بيانات أكثر بكثير مما يحتاجون إليه (في SBF-SEM)، أو الأسوأ من ذلك، إعداد العديد من الشبكات وتصويرها جميعا (في TEM). نقترح استراتيجية "الفحص الجانبي" باستخدام التصوير المقطعي للصفيف في SEM ، مما يسهل توطين المناطق ذات الاهتمام ، يليه التصوير الآلي للكسر ذي الصلة من إجمالي حجم العينة. يتم حفظ عينات التصوير المقطعي الصفيف أثناء التصوير، ويمكن ترتيبها في مكتبات القسم جاهزة للتصوير المتكرر. تظهر العديد من الأمثلة التي يتيح لنا فيها الفحص الجانبي تحليل التفاصيل الهيكلية التي تشكل تحديا لا يصدق للوصول إليها باستخدام أي طريقة أخرى.
Introduction
على الرغم من أهمية التقنيات المتعلقة ب EM ، فإن الجهد المطلوب لإتقانها يبقي المجال بأكمله مقتصرا على عدد قليل من المتخصصين. وتتمثل إحدى الصعوبات الكبيرة في تحديد واسترجاع منطقة الاهتمام في العينات المحفوظة في منطقة الطوارئ. يختلف مظهر العينة نفسها بشكل كبير عند تحليلها عن طريق المجهر البصري وبعد المعالجة لمراقبة EM. وتشمل التغييرات لعينات أعدت كيميائيا انكماش عينة النظائر بعد خطوات الجفاف (~ 10٪ في كل البعد) وفقدان الفلورسينس عند استخدام الأوسميوم في التثبيت وتلطيخ البروتوكول (الشكل 1A). بالنسبة للأقسام فائقة النحافة ، يتم تضمين العينات في راتنجات الايبوكسي أو الأكريليك باستخدام استراتيجيات مختلفة(الشكل 1B). للحصول على نتائج ناجحة لهذا الإعداد، يجب تقسيم العينة بأكملها إلى قطع لا تتجاوز 1 مم × 1 مم. لتلبية متطلبات المراقبة القياسية الخاصة بالمنظار الإلكتروني للإلكترون (TEM)، يتم تقسيم هذا الجزء الصغير من العينة إلى شرائح سمكها 50-150 نانومتر. تظهر الصور الرمادية الناتجة تنظيم الأنسجة وبنية العضية لجزء صغير من العينة بأكملها بتفاصيل أكبر من أي تقنية مجهرية أخرى(الشكل 1C). توفر مجموعة بيانات TEM النموذجية معلومات ثلاثية الأبعاد ، استقراء نظريا لفهم العمليات التي تحدث بشكل طبيعي في مساحة ثلاثية الأبعاد في الخلايا والأنسجة. الشكل 1D يمثل التحدي المتمثل في اقتناء أحجام ultrastructural: إذا كان مكعب من جانب 1000 ميكرومتر مقطعة في سمك 50 نانومتر، وسوف تكون هناك حاجة 20000 أقسام لتغطية حجم كامل؛ لمكعب جانبي 500 ميكرومتر، سيكون 10،000 مقطع. لتغطية حجم 50 ميكرومتر × 50 ميكرومتر × 50 ميكرومتر، قد يكون من الضروري وجود 1000 مقطع "فقط". الحصول على وحدة التخزين هذه يدويا هو عمليا مستحيلة وصعبة للغاية لأداء مع التشغيل الآلي. إذا، بالإضافة إلى عمق العينة، ونحن بحاجة لتغطية كامل سطح هذه المكعبات افتراضية، وتغطيةسطح 2 1 ميكرومتر في قرار معقول يصبح مشكلة لوجستية خطيرة (الشكل 1E). وفي حين أن العدد الكبير من الأقسام بالنسبة للمشاريع غير العادية الواسعة النطاق، مثل نهج الاتصال، أمر بالغ الأهمية بالنسبة لغالبية مشاريع إعادة الطوارئ "الدنيوية"، فإن توليد المزيد من الأقسام اللازمة للمراقبة يمثل عيبا كبيرا.
هناك عدة طرق للحصول على معلومات 3D ultrastructural : تسلسل تقسيم انتقال المجهر الإلكتروني (TEM) ، TEM التصوير المقطعي ، التصوير المقطعي الصفيف (AT) ، المسلسل كتلة الوجه التصوير المجهر الإلكتروني المسح الضوئي (SBF - SEM) ، وركزت أيون شعاع المسح المجهري الإلكتروني (FIB - SEM). الاختلافات الرئيسية بين هذه الطرق هي استراتيجية الأقسام وما إذا كان الحصول على الصورة مقترنا بالمقطع1. في تقسيم تسلسلي TEM، يتم جمع المقاطع التسلسلية على شبكات القمار، يتم إنشاء صور TEM من هذه التسلسلات ومحاذاتها2و3و4و5. في التصوير المقطعي TEM، سلسلة الميل من 150-300 نانومتر أقسام على الشبكة، وعندما يقترن القسم التسلسلي، وتوفير دقة عالية جدا، علىالرغممن أحجام صغيرة نسبيا 6،7،8. يستخدم نهج AT القسمة المادية مع آداب يدوية وشبه تلقائية متنوعة من تجميع الأقسام على دعم كبير نسبيا ، مثل غطاء الزجاج أو رقائق السيليكون أو شريط خاص. للحصول على الصورة ، يتم تحليل الدعم في SEM ، مع استراتيجيات اقتناء الصور المتنوعة المتاحة9،10،11،12،13،14،15 . بالنسبة ل SBF-SEM ، يتم تحقيق التقسيم المادي باستخدام ميكروتوم صغير مع سكين ألماس تم ضبطه مباشرة داخل غرفة SEM ، مع صورة SEM الناتجة من سطح كتلة الراتنج16و17و18و19. بالنسبة ل FIB-SEM، يزيل مصدر الأيونات طبقات رقيقة من العينة، يليها التصوير التلقائي للسطح المكشوف من قبل SEM20،21. توليد التصوير المقطعي TEM و AT أقسام المادية، والتي يمكن إعادة تصويرها إذا لزم الأمر، في حين FSBF-SEM وFIB-SEM القضاء على القسم بعد التصوير. مزيج حديث من المقاطع المادية التي صورتها SEM متعددة الحزم يوفر مزيجا من الأساليب التي تحل "عنق الزجاجة" قضية سرعة الحصول على صورة22. وقد أحدثت كل من هذه التقنيات ثورة في الطريقة التي يمكن بها الحصول على بيانات EM وتحليلها ، ولكل نهج آثاره العملية المتعلقة بسؤال بحثي معين.
نظرا لطبيعة الإعداد وحجم الأبعاد فوق الهيكلية ، فإنه ليس من السهل التنبؤ بمكان وجود بنية مستهدفة محددة في كتلة العينة(Figure1D، E). أحد حلول توطين عائد الاستثمار هو تسجيل الصور من الكتلة بأكملها بالدقة المطلوبة من البداية. يمكن أن تكون الهياكل ذات الاهتمام في حجم البيانات المكتسبة عندما تكون بعيدة عن المجهر. وقت الاستحواذ ومعالجة البيانات المرتبطة بهذه الاستراتيجية هي إشكالية. من المستحسن تقليل كمية البيانات المسجلة ، خاصة إذا كانت مؤشرات الاستثمار أصغر بكثير من كتلة الأنسجة ، أي إذا كانت الأشياء ذات الأهمية أنواعا محددة من الخلايا (وليس أعضاء كاملة). يمكن أن تكون تقنيات المجهر المختلفة ذات الصلة للضوء والإلكترون (CLEM) ناجحة عندما يتم الحفاظ على الفلورية ومحلية قبل أو بعد التحضير داخل نفس العينة23،24،25،26،27،28،29. ومع ذلك ، يمكن التعرف على العديد من الهياكل الخلوية حتى بدون ارتباط مضان ، فقط على أساس البنية الفوقية المعروفة. بالنسبة لهذه الحالات، نعتقد أن الفحص الجانبي للتصوير المقطعي للصفيف يوفر مقايضة متوازنة بين الجهد المستثمر في توطين عائد الاستثمار وجودة المعلومات فائقة البنية. وباستخدام هذه الاستراتيجية، يتم فحص مجموعة فرعية من الأقسام على الرقاقة في فترات منتظمة، والتي يمكن إنشاؤها استنادا إلى حجم العائد على الاستثمار وطبيعته. بمجرد العثور على ROIs ، يتم إعداد اكتساب البيانات في سلسلة مستمرة من الأقسام بدءا من قبل وتنتهي بعد قسم الارتساء ، وجمع المعلومات ذات الصلة بطريقة مستهدفة.
نقدم بروتوكولات ل AT تعمل على تبسيط وتسريع الحصول على المناطق أو الأحداث ذات الاهتمام في العديد من الأقسام وتسفر عن أحجام صور أكثر توافقا. وينتج عن الفحص الجانبي والحصول على الخطوات المتعددة بيانات ذات دقة عالية جدا في المناطق المستهدفة بدقة. يعالج الإجراء الذي نصفه العديد من التحديات المتعلقة بالحصول على بيانات 3D EM ، حيث ينص على: التوافق مع مجموعة واسعة من العينات دون تغيير جذري في سير عمل إعداد العينة ؛ ترجمة مستهدفة لعمليات الاقتناء بالأقسام وSEM؛ تقليل الوقت والجهد أثناء الإعداد؛ تصوير المناطق في أقسام متعددة مع محاذاة أفضل للأحجام الناتجة؛ وإجراء خياطة ومحاذاة سلس لتجميع صور مختلفة في صورة فسيفساء مخيط. اخترنا أن نظهر قوة طريقتنا مع عدة عينات من المشاريع المنشورة والجارية. ونحن نعتقد أن هذا النهج يمكن أن يسهل بشكل كبير توليد والحصول على بيانات EM المستهدفة، حتى بالنسبة للمحققين ذوي الخبرة المحدودة في مجال إدارة الطوارئ.
Protocol
ملاحظة: يتم وصف أساليب إعداد نموذج في مكان آخر14،30،31، ولا يتم تغطيتها في هذا المنشور. باختصار، كانت الأمثلة المعروضة ثابتة كيميائيا مع الجلوتارالدهيد، بعد ثابتة مع 1٪ OsO4،ثم تعامل مع 1٪ خلات أورانيل مائي قبل تضمين في الراتنج تضمين. بدلا من ذلك، يمكن إعداد عينات باستخدام تجميد الضغط العالي، وتجميد استبدالها مع خلات أورانيل 0.1٪ في الأسيتون، وجزءا لا يتجزأ من راتنج الاكريليك. تم إعداد كتل العينة باستخدام أسلوب تضمين مسطح يسمح بعرض واضح للعينة ، مما يسهل اتجاهها للقسم(الشكل 1B).
1. إجراء إنشاء الصفيف
- اتجاه العينة المضمنة والتشذيب
- باستخدام المنظار/المجهر، حدد وضع علامة على عائد الاستثمار على سطح الكتلة المضمنة عن طريق خدش سطح الكتلة برفق باستخدام شفرة حلاقة. وهذا سوف يساعد على توجيه العينة داخل الصفن الفائق، وسوف يقلل من سطح المقطع.
- المشبك العينة على حامل الصفن الفائق (الشكل 2A).
- تقليم الراتنج حول العينة، أولا مع شفرة الحلاقة (التشذيب الخام) والاستمرار مع أداة تقليم الماس (تقليم غرامة؛ الشكل 2A). استخدم السكاكين ذات الميل الحافة 20 درجة أو 90 درجة لضمان أن الأسطح العلوية والسفلية للكتلة موازية لحافة السكين المتطورة.
ملاحظة: هذه الخطوة هامة للقسم التسلسلي والحصول على أشرطة مستقيمة. - مزيج الزيلين والغراء في نسبة 3:1. مع رمش تعلق على مسواك، وتطبيق هذا الخليط إلى أعلى والحواف السفلية من كتلة قلصت. دعه يجف جيدا.
- إعداد دعم تصاعد الصفيف A (أي رقائق السيليكون).
- قطع قطعة رقاقة باستخدام أداة شق رقاقة (EMS)، وتعديل حجمها لهدف المشروع. 2 سم × 4 سم هو مناسب لكل من الضوء والإلكترون الرصدات المجهرية.
- تنظيف رقاقة في الماء المقطر للتخلص من الحطام.
- توهج التفريغ / البلازما تنظيف السطح باستخدام المعدات القياسية. تعتمد المعلمات الدقيقة على الجهاز المستخدم. تبدأ مع المعلمات لتفريغ الشبكات وتعديل الوقت تجريبيا. هذه الخطوة حاسمة لانتشار جيد للأقسام على الدعم في حين أن الأقسام تجف ولا ينبغي حذفها.
- إعداد دعم تركيب الصفائف B (أي، غطاء الزجاج)
- إذا كنت تخطط لتجارب وضع العلامات المناعية المتعددة، قم بنقل العينات على غطاء للكشف بشكل أفضل عن إشارة الفلورسينس. لتحسين لاصقة coverslip، واستخدام مفصلة الجيلاتين طلاء الإجراء هو وصف سابقا9.
- زيادة الموصلية عن طريق طلاء الشرائح مع أكسيد القصدير الانديوم (ITO) أو الذهب عن طريق التبخر. حافظ على الأغطية المعدة في بيئة نظيفة. توهج تفريغ العينات كما هو موضح في 1.2.3.
2. تقسيم العينة
- في إعداد سكين
ملاحظة: لإنشاء صفائف، استخدم سكين معدلة (ATS)، مصممة لتسهيل الحصول على شرائط طويلة. يمكن أن تخدم سكاكين Histo-Jumbo أو السكاكين المماثلة التي تم تصميمها لتوليد الأقسام على الدعامات الكبيرة في قسم AT أيضا.- إرفاق الإبرة إلى الجزء السفلي من السكين باستخدام الشريط لزجة رغوي وثقبه (الشكل 2B). ضع سكين ATS في حامل الصفن الفائق عند درجة 0. ضبط حافة السكين موازية لسطح كتلة باستخدام الإجراء القياسي.
- جلب كتلة قلصت إلى حافة السكين في موقف جاهز للقسم.
- ضع رقاقة / coverslip داخل حوض السكين وملئه بالماء إلى نفس مستوى حافة السكين. دع حافة الماس من السكين ترطيب بشكل صحيح، وإذا لزم الأمر، سحب المياه باستخدام الحقنة المرفقة(الشكل 2C).
- تقسيم الصفيف ونقله
- تعيين microtome إلى المعلمات القطع المطلوب. مع سكين ATS، مجموعة من 50-100 نانومتر وسرعة القطع من 0.6-1 مم / ثانية من المستحسن. بدء القسمة (الشكل 2Di).
- الحصول على شريط من الطول الذي سيغطي وحدة تخزين z المستهدفة وإيقاف المجموعة. اعتمادا على حجم الكتلة، وتجانس الأنسجة، ونوع الراتنج، الشريط سيكون مستقيم نسبيا(الشكل 2D-ii). العديد من العينات لن تنتج شرائط مستقيمة، على الرغم من الجهد المستثمر ويستخدم نوع السكين.
- اعتمادا على الهدف النهائي، جعل واحد طويل أو عدة أشرطة قصيرة محاذاة جنبا إلى جنب. يمكن أن يلائم الدعم بحجم 2 سم × 4 سم 100 إلى 1000 مقطع. ترتيب الشريط على خطوة الدعم هو خطوة تتطلب البراعة والأيدي الثابتة. ومع ذلك، يتم الحصول على منحنى التعلم لهذه المهارة بسرعة.
- فصل الشريط من حافة السكين باستخدام نظيفة، طرف غير لزجة من رمش لصقها على مسواك(الشكل 2Diii).
- باستخدام رمش، حرك الشريط برفق فوق وسط وسيط الدعم. عند هذه النقطة، استخدم الكلوروفورم أو قلم التدفئة لتمتد من المقاطع إذا لزم الأمر. ومع ذلك، تذكر أن هذا التلاعب قد يؤدي إلى كسر الشريط وتشوه.
- بدء استنزاف المياه عن طريق سحب الحقنة. للحصول على شرائط أكثر حساسية أو تراجع أبطأ للمياه، دع الماء يقطر عن طريق فصل الحقنة عن الخرطوم. عندما ينخفض مستوى الماء إلى مستوى الرقاقة، يمكنك التحكم في الشريط وإعادة وضعه إذا لزم الأمر، عن طريق دفع الشريط برفق إلى المركز. بعد تسوية الأشرطة على سطح الرقاقة، استمر في التصريف حتى يتم سحب المياه المتبقية بالكامل من الحوض.
ملاحظة: إذا لم يكن استخدام المياه السفلية سحب سكين ATS، والحد بعناية من المياه من جانبي سكين ATS لعدم الحث على الاضطراب. - اترك المقاطع الموجودة على الدعم داخل الحمام لتجف تماما. اعتمادا على رهاب الماء من مستوى الدعم والرطوبة البيئية، وسوف تتبخر المياه بمعدل مختلف(الشكل 2Div). من المهم السماح للعينة بالجفاف ببطء لتقليل أو تجنب جميع طيات العينة تماما.
- نقل العينة الجافة إلى مربع مغلق بإحكام للحماية من تلوث الأوساخ ووضعها في فرن 60 درجة مئوية لمدة 30 دقيقة على الأقل. إذا لزم الأمر، يمكن أن تحتوي على أقسام باستخدام المعادن الثقيلة لتعزيز التباين العام.
- في نهاية الإجراء، تنظيف السكين بحذر باتباع تعليمات الشركة المصنعة
ملاحظة: نقل أقسام متعددة أو تسلسلية على رقاقة (الشكل 2E) مقارنة مع نقل على شبكة فتحة(الشكل 2F) تغيير تجربة إعداد EM تماما. ويقلل تقسيم الأقسام وجمعها دون انقطاع على دعم واحد من مقدار الأخطاء المتعلقة بالقسم ومجموعة المقاطع المتكررة في القسم التسلسلي. ما يعادل 100 قسم من 1000 ميكرومتر × 500 ميكرومتر تم جمعها على رقاقة واحدة يتوافق مع 33 شبكة فتحة (الشكل 2G).
3. عينة المراقبة
ملاحظة: يصف هذا القسم خطوات سير العمل كما تم تنفيذها باستخدام برنامج متوفر تجاريا (راجع جدول المواد). يمكن استخدام أي برنامج الحصول على صورة على أي SEM مجهزة كاشفات الصحيح، ومع ذلك، فإن إجراءات المستخدم محددة تختلف وغالبا ما تكون أكثر دليل.
- احصل على خريطة عامة لصور SEM تكشف عن مواقع المقاطع على الرقاقة. تساعد صورة الكاميرا البصرية المضمنة في تعريف فسيفساء صورة SEM التي تغطي شريطا من المقاطع أو جميع الأقسام. إنشاء الفسيفساء عن طريق النقر السحب مع الماوس الحق على صورة الكاميرا للعينة وبدء اكتساب التلقائي.
ملاحظة: إعدادات التصوير الخشنة جدا، أي حجم بكسل 1-2 ميكرومتر ووقت 1 ميكروس من الإسهاب يكفي. ويتضح هذا الإجراء في المواد التكميلية (صفحات 2-7). - حدد موقع المقاطع باستخدام وظيفة الكشف التلقائي عن "الباحث عن الأقسام" أو حدد موقعها يدويا. يتم استرداد مواقف القسم والخطوط العريضة تلقائيا باستخدام هذا البرنامج استنادا إلى مطابقة الصور. وللاطلاع على توضيح لهذه العملية، انظر المواد التكميلية (الصفحات 8-15).
- في حالة عدم عرض صور النظرة العامة ل ROIs بوضوح، احصل على صور ذات دقة أعلى للأقسام. استخدم وظيفة معاينة المقطع لإنشاء الصور والحصول عليها تلقائيا. ويتضح هذا الإجراء في المواد التكميلية، صفحات 16-18. يجب اختيار إعدادات التصوير وفقا لطبيعة وحجم عائد الاستثمار الذي يبحث عنه المستخدم.
- للعثور على الإعدادات المثلى، قم بتنشيط برنامج التصوير المباشر في برنامج التحكم بالمجهر وانتقل إلى عائد استثمار واحد. تغيير إعدادات التصوير حتى تظهر الصور ROIs بوضوح، ولكن اكتساب الصورة ليست طويلة بشكل مفرط.
- تحديد مناطق التصوير
ملاحظة: يقترح عدة استراتيجيات مختلفة.- إذا كان هناك عدد قليل من المقاطع التي تحتاج إلى تصوير، فاستخدم صور المقاطع التي تم إنشاؤها حتى الآن للتنقل إلى الأقسام ذات الصلة واستخدم عارض التكبير/التصغير الذي يعرض جميع الصور المكتسبة في مواقعها النسبية الأصلية للنظر في جميع الأقسام. بمجرد العثور على مقطع يجب أن يتم تصويره بدقة عالية، قم بإنشاء منطقة تصوير باستخدام السحب فوق. اختر إعدادات تصوير عالية الدقة وخزن الإعدادات في قالب. إعادة استخدام هذا القالب لمزيد من المقاطع.
- للعثور على أحداث نادرة أو صغيرة بشكل خاص أو يصعب اكتشافها، استخدم نهج الفحص الجانبي. إنشاء منطقة تصوير يدويا مع إعدادات تصوير عالية الدقة في كل قسم عشري أو على قسم واحد لكل شريط والحصول على الصور. راجع الصور والأقسام التي تحتوي على عائد الاستثمار في البرنامج أو دون ملاحظة.
- بدءا من المقاطع التي تحتوي على عائد الاستثمار، انتقل إلى الأمام والخلف خلال مجموعة المقاطع وإنشاء مناطق تصوير عالية الدقة في نفس المواقع النسبية طالما أن البنية لا تزال مرئية في القسم. يمكن القيام بذلك يدويا أو باستخدام الإجراء الموضح في الخطوات التالية.
- الحصول على الصور في أكثر من عشرة أقسام متتالية. انقر فوق بدء تحسين الموضع بعد تكبير الصورة لزيادة دقة مواقع المقاطع المسجلة كما هو موضح في الدليل. يؤدي القيام بذلك إلى تقليل تباين موضع سلسلة الصور. ويوضح الإجراء ويشرح في صفحات المواد التكميلية 19-21.
- انقر فوق السحب على أي مقطع لتعريف منطقة تصوير أثناء الضغط باستمرار على المفتاح Alt وحدد إنشاء صفيف مجموعة تجانب من قائمة السياق التي تفتح عند تحرير زر الماوس. البرنامج ثم يخلق مناطق التصوير في نفس الموقع النسبي في جميع المقاطع التي تم العثور عليها أو وضع علامة سابقا. من الممكن تحديد التصوير إلى نطاق محدد من المقاطع باستخدام شريط التمرير "مقطع سبان".
ملاحظة: يمكن تكرار هذا الإجراء مع أي عدد من مناطق التصوير، وبالتالي يسمح بتسجيل العديد من الصور الصغيرة عالية الدقة بدلا من تسجيل صورة واحدة أكبر في كل مقطع. - بمجرد إنشائها ، قم بإعداد عدد البكسل ، وحجم البكسل ، وتخطيط التجانب ، ووقت البكسل ، وما إلى ذلك في كل سلسلة صور حسب الحاجة. بمجرد إنشاء سلسلة التصوير وإعدادها ، يتم سردها جميعا في إشارة مهمة.
- تكوين الوظائف التلقائية وبدء الحصول على الصورة
- إنشاء سلسلة صور منفصلة للوظائف التلقائية باستخدام نفس الطريقة كما هو الوصف في الخطوة السابقة. نقل سلسلة الصور إلى موضع على المقطع الذي يحتوي على بنيات التباين العالي.
- تعيين سلسلة الصور إلى 1024 × 884 بكسل واختيار حجم بكسل المقابلة لأعلى دقة المستخدمة في سلسلة الصور التي تم إعدادها في الخطوات السابقة. في قائمة وظائف السيارات، تحقق من التركيز التلقائي والسيارات Stigmator.
- حدد حسب القسم في عناصر التحكم في تسلسل الامتلاك وتأكد من أن صورة الوظائف التلقائية هي العنصر الأول في القائمة. ابدأ عملية الحصول على الصورة بالنقر فوق الزر تشغيل بجوار إشارة المهمة. ويتضح من هذه الإجراءات في المواد التكميلية، صفحات 22-23.
ملاحظة: ليس من الضروري التركيز مسبقا يدويا على كل مقطع. أثناء جلسة التسجيل، كلما تقدم المجهر إلى قسم جديد، سيتم تنفيذ وظائف السيارات قبل أن يتم تسجيل جميع الصور الأخرى في هذا القسم.
4. محاذاة البيانات وتحليلها
- تصدير البيانات
- تأكد من حفظ البيانات بتنسيق .tif، لذلك لا حاجة إلى وظيفة تصدير مخصصة. فرز البيانات إلى بنية مجلد تتوافق مباشرة مع الطبقات والعناصر في شجرة الطبقة.
- بمجرد تسجيل فسيفساء الصور، استخدم وظيفة StitchAll لخياطة جميع البلاطات تلقائيا.
- محاذاة المكدس واقتصاصه في فيجي
ملاحظه. يمكن استخدام العديد من حزم البرامج (المجانية والتجارية) للعمل مع بيانات التصوير المقطعي للصفيف. تظهر الخطوات أدناه مع برنامج المصدر المفتوح فيجي32 لأنه متاح على نطاق واسع ويحتوي على كافة الوظائف المطلوبة.- استيراد كومة من الصور (أو الصور مخيط) في فيجي ككومة الظاهري.
- إذا كان التباين / السطوع يحتاج إلى تطبيع ، اختر تحسين التباين... من القائمة عملية. تعيين وحدات البكسل المشبعة إلى 0.1 أو أقل، وتحقق من معالجة كافة الشرائح.
- من قائمة الإضافات، اختر التسجيل | خطي محاذاة المكدس مع SIFT.
- اختر Rigid أو Affine من القائمة المنسدلة تحويل متوقع. وإلا، احتفظ بالإعدادات الافتراضية. ابدأ المحاذاة بالنقر فوق موافق.
ملاحظة: تحميل البيانات كما المكدس الظاهري يسمح فيجي لمعالجة مكدسات من أي حجم. يتم إنشاء إخراج المحاذاة في ذاكرة الوصول العشوائي; ومع ذلك، يمكن أن يحد هذا من الحد الأقصى لحجم مكدسات التي يمكن معالجتها. في هذه الحالة، استخدم تسجيل شرائح المكدس الظاهري، وهو تطبيق مجلد إلى مجلد من خوارزمية التسجيل نفسه. بمجرد اكتمال التسجيل، قم بتحميل بيانات الإخراج ككدسة ظاهرية. - اقتصاص مكدس الصور بالنقر فوق اقتصاص بحيث يحتوي على عائد الاستثمار فقط.
- حفظ المكدس كصورة .tif واحدة أو سلسلة من الصور .tif.
ملاحظة: يتم عرض الخطوات الهامة من التصوير المقطعي الصفيف في الشكل 3.
النتائج
تهدف الأمثلة أدناه إلى إظهار تعدد استخدامات سير العمل الموصى بها. الرسوم التوضيحية لدراسة الحالة هي المشاريع التي واجهتنا صعوبة في الحصول على نتائج مرضية مع أي تقنيات أخرى. اخترنا Drosophila الكبار لتوضيح التحديات النموذجية التي يمكن للمرء أن يواجهها مع أنواع عديدة من العينات. هذا الجهاز أنبوبي من حوالي 6mm طويلة، 500-1000 ميكرومتر في المقطع العرضي، وينقسم إلى مناطق مختلفة مع وظيفة فريدة من نوعها وتكوين الخلوية (الشكل 4A)33. اعتمادا على اتجاه المقطع، تختلف أبعاد ملف تعريف القناة الهضمية ومظهره في القسم. أما أقسام موجهة عرضية أو طولية كبيرة نسبيا، ويمكن وضع زوجين فقط على شبكة TEM واحد(الشكل 2F). يمكن تصوير جزء صغير فقط من الأنسجة في FIB ، وبالنسبة ل SBF-SEM ، فإن الصعوبة تشبه أي عينات غير متجانسة. توفر AT مقايضة فعالة لتحليل هذه العينات ويسهل التضمين المسطح توطين عائد الاستثمار. التشذيب الدقيق الزائد من الراتنج حول المنطقة المختارة (الشكل 4B) مهم لجمع كفاءة الصفائف من المنطقة ذات الصلة (الشكل 4C). يمكن جمع مئات الأقسام على رقاقة واحدة بشكل تسلسلي أو عشوائي(الشكل 4D). اعتمادا على مسألة البحث، سوف يتطلب فحص العينات واكتسابها استراتيجية مختلفة، والتي قسمناها بشكل تعسفي إلى عدة سيناريوهات. لتوضيح السيناريوهات المختلفة المعروضة بطريقة أكثر استهدافا، اخترنا العديد من دراسات الحالة من المشروع البحثي المختلف.
تحليل العديد من الهياكل الكبيرة الموزعة عشوائيا 1-10 نطاق ميكرومتر (الشكل 4E)
في كثير من الأحيان ، مطلوب بيانات فائقة البنية للتحقق من صحة فرضية نشأت عن العديد من النهج التجريبية ، ومقارنة حالة قياسية ومغيرة تجريبيا. في هذه الحالات، يتم تجميع عدة أقسام بشكل عشوائي على الشبكات وفحصها لترجمة المناطق ذات الاهتمام وتصورها. هذا التكتيك عادة ما يكون أقل منهجية ويقتصر على عدد قليل من المقاطع التي تم تحليلها. نقترح تسجيل لمحات عامة عن عشرات / مئات من المقاطع متوسطة الدقة من شريط معين(الشكل 4D). بالنسبة للأقسام النموذجية من 70 نانومتر، 200 قسم سوف تمتد حوالي 14 ميكرومتر، والتي سوف تحتوي على العديد من الخلايا، إما كليا أو جزئيا، الانتهاء في غضون نصف ساعة. كخطوة أولى، يتم تسجيل نظرة عامة منخفضة الدقة على الشريط بأكمله، وتساعد النظرة العامة على حذف المقاطع التي تعرض قطع التحضير (على سبيل المثال، الطيات والأوساخ). بعد ذلك ، يمكن إجراء الاستحواذ يدويا أو تلقائيا مباشرة على أجزاء مختارة من القسم ، أو مقطع بأكمله ، باستخدام تصوير فردي أو فسيفساء ، يليه خياطة(الشكل 4E). بعد ذلك، يمكن الحصول على صور من المنطقة المحددة باستخدام معلمات عالية الدقة. على سبيل المثال، يمكن أن تستفيد الميتوكوندريا والنوى والميكروفيلي من طريقة محسنة إحصائيا(الشكل 4Ei-iii).
تحليل هياكل صغيرة متعددة، موزعة بشكل متفرق 500-1000 نانومتر (الفيلم التكميلي 1)
في هذا السيناريو، لا يمكن التعرف على عائد الاستثمار ببساطة في مسح نظرة عامة منخفضة التكبير، وهناك حاجة إلى صور عالية الدقة. في عينات TEM التقليدية ، يكون التكبير والخروج الممل ضروريا حتى يتم العثور على الميزة المطلوبة. في كثير من الأحيان ، والتصوير عدة مواقع مستقلة في عينات متعددة هو أكثر أهمية إحصائيا من توليد حجم واحد كبير. وفي مثل هذه الحالات، يزداد تعقيد الحيازة اليدوية نموا هائلا. على الرغم من أن العديد من حلول TEM تمكن من عمليات الاستحواذ التلقائية أو فحص شبكات متعددة ، فإن حجم الشبكة وتحديات القسم التسلسلي تجعل النهج غير متوافق في كثير من الأحيان للعديد من العينات. وفي حالات مماثلة، نقوم بإنشاء خريطة كاملة متوسطة الدقة لعائد استثمار عام في أقسام متعددة بدقة كافية لتحديد الهياكل ذات الاهتمام. خلال هذه الخطوة الجانبية للفحص ، من المستحسن القفز على عدة أقسام في وقت واحد ، بهدف ضرب جزء على الأقل من بنية الاهتمام عند الاقتراب منها عشوائيا. وسيعتمد ذلك إلى حد كبير على الأبعاد الإجمالية للهيكل: على سبيل المثال، إذا كان الحجم الإجمالي للهيكل 500 نانومتر وكانت الأجزاء سمكها 50 نانومتر، فمن المرجح أن تحتوي تسعة أقسام متتالية على الأقل على جزء من هيكل الاهتمام. وبهذه الطريقة، فإن تخطي 6-7 أقسام سيكون فعالا في العثور على أنواع مختلفة من الهياكل في مجالات متعددة. ويتيح الاقتناء التلقائي لخرائط الفسيفساء التي تم حلها لأقسام مختارة إجراء فحص دقيق لهذه الأقسام بعد الحصول عليها. وبمجرد الحصول على مثل هذه الخريطة عالية الدقة، يمكن اقتصاص العديد من ROIs أو استخدامها لتحديد مناطق تصوير محلية إضافية على ROIs(الفيلم التكميلي 1). Golgi ، centrioles ، تقاطعات ، microtubules ، أنواع مختلفة من الحويصلات هي أمثلة جيدة على الهياكل التي قد تستفيد من هذا السيناريو(الفيلم التكميلي 1).
تحليل مؤشرات الاستثمار الكبيرة القليلة التوزيع في عينات كبيرة (الأرقام 4F-4H)
يتضمن هذا السيناريو أحداث نادرة، والتي توصف في كثير من الأحيان بأنها "إبرة في كومة قش" حيث المشكلة ليست في تحديد عائد الاستثمار ولكن توطينها. بالنسبة للعديد من العينات ، فإن النهج المترابط ليس خيارا صالحا ، ومع ذلك غالبا ما يكون عائد الاستثمار يحتوي على بنية فائقة كاشفة ، وعندما يتم توطينه ، يمكن تحديده موثوقية عالية. بالنسبة لهذه العينات، من الضروري تطبيق اكتساب متعدد المستويات، بدءا من العينات التي تم فحصها مسبقا مع عشرات إلى مئات الأقسام بدقة متوسطة. في البرنامج المستخدم هنا، هناك استراتيجيتان مختلفتان للحصول على مجموعات صور من أقسام متعددة: تسجيل صور المعاينة بدقة أعلى أو الحصول على مجموعة بلاط الصفيف مع إعدادات مناسبة (الشكل 4F). يتم توزيع أنواع مختلفة منالخلايا المتخصصة في الأمعاء Drosophila عشوائيا (مثل الجذعية، الخلايا المعوية)، ورقيقة مقطعة في اتجاه عشوائي. ومع ذلك يمكن تمييزها بصريا بعد فحص الصور التي تم الحصول عليها باستخدام معلمات عالية الدقة إما من أقسام مفردة أو كجمع من الصور التسلسلية(الشكل 4G). بعد المحاذاة، يمكن تقديم المداخن باستخدام حلول برامج مختلفة (الشكل 4H، فيلم تكميلي 2).
السيناريو 1: الأجهزة المعوية (الشكل 5A)
الأجهزة العضوية تتحول بسرعة واحدة من أحدث الأدوات في علوم الحياة الحديثة. هذا النموذج شبه الفسيولوجي ثلاثي الأبعاد للخلايا الجذعية المشتقة من الخلايا يجعل من الممكن إجراء دراسة دقيقة لمجموعة من العمليات البيولوجية في الجسم الحي ، بما في ذلك تجديد الأنسجة ، والاستجابة للأدوية ، والطب التجديدي. أدخلت مؤخرا أنابيب الأمعاء المصغرة34 فتح جيل جديد من التكنولوجيا organoid، تشبه إلى حد كبير في فسيولوجيا الأنسجة الحية، وتكوين من نوع الخلية، وهوسط، وتمكين وجهات نظر واسعة لنمذجة الأمراض، والتفاعل المضيف الميكروب، واكتشاف المخدرات. ومع ذلك ، عندما يكون هناك حاجة إلى توصيف البنية الفائقة ، يمكن أن يكون توطين أنواع الخلايا المختلفة في مثل هذه الأنسجة الكبيرة باستخدام عينات عشوائية أمرا صعبا. أيضا ، في اختبارات "العدوى" المتغيرة ، من الأهمية بمكان ضمان أن يكشف التحليل عن مراحل نمو مختلفة تؤثر على الأنسجة. وبالنسبة لهذه الدراسات، فإن التغطية الهامة إحصائيا للعينة أساسية، ولكن من الصعب تحقيقها باستخدام النهج التقليدي للTEM على الشبكة. AT-السيناريو 1 مفيد في مثل هذه الحالات: يمكن إنشاء العديد من المقاطع المتتابعة على رقاقة(الشكل 5Aii)وفحصها باستخدام معلمات منخفضة الدقة لترجمة المناطق العامة ذات الاهتمام (الشكل 5Aiii; الأسهم). ويمكن استهداف هذه المجالات لإجراء مزيد من التحليل باستخدام معلمات الاستحواذ المتقدمة(الشكلان 5Aiv والشكل 5Av). عندما يتم الكشف عن بنية ذات الصلة (عادة مجموعة من 5-10 أقسام مرة واحدة في كل 100-300 أقسام)، فمن السهل التركيز على كل من الهياكل ذات الاهتمام والحصول على صور واحدة يدويا أو استخدام ميزات التشغيل الآلي للحصول على أحجام الصور عبر أقسام متعددة.
السيناريو 2: دروزوفيلا pupal نوتوم ( الشكل5B)
دراسة انقسام الخلايا والآليات التي تتحكم في التقدم من خلال دورة الخلية أمر بالغ الأهمية لفهم كل من العمليات القياسية والمبدلة في الكائنات متعددة الخلايا. المعلومات الموجودة كثيرا ما يتم اشتقاقها من أنظمة أحادية الخلية; ومع ذلك ، يفتقر هذا الحل إلى السياق الحرج للتفاعلات ثلاثية الأبعاد بين الخلايا في الأنسجة. طبقة أحادية الخلية واحدة من نوتوم ، ظهر النامية من يرقة Drosophila ، هو نموذج مثالي للتفاعل بين الخلايا الظهارية بشكل عام وتقسيم الخلايا على وجه الخصوص35. وهو نموذج راسخ لدراسات التفاعلات الجزيئية والخلوية باستخدام الجمع بين البيانات المتاحة عن طريق المجهر الفلوري والتلاعب الجيني. يضمن الخراج ، الخطوة الأخيرة من انقسام الخلايا ، الفصل النهائي بين خليتين منقسمتين ، وتتميز التغيرات الهيكلية التي تحدث أثناء الخراج أمر ضروري لفهمنا للفصيلة. ومع ذلك ، فإن الانقسامات mitotic في notum ليس من السهل توطينها على المستوى الهيكلي الفائق: الخلايا كبيرة نسبيا ، مقارنة بمنطقة الخراج(الشكل 5B). النسبة بين الحجم الإجمالي لمنطقة الخراج وسطح القسم لتغطية كبيرة(الشكل 5Bi). على الرغم من أنه من الممكن توطين منطقة الخراج باستخدام أساليب TEM أو SBF-SEM36، إلا أن المهمة شاقة. مع هذا السيناريو، يمكن استخدام الصور التلقائية لمحة عامة متوسطة الدقة من قفزات من 20-40 أقسام لترجمة الخلايا الفاصلة(الشكل 5بيي). وعندما يتم تحديد هذه الخلايا، تعمل الأقسام كمرساة لفحص الأقسام في المنطقة المجاورة عن كثب، ويمكن العثور على العديد من الخلايا المقسمة واختيارها لإجراء مزيد من التحليل. وبهذه الطريقة، يمكن تحديد موقع منطقة الخراج وصورت في مجملها(الشكل 5Biii). اعتمادا على السؤال، يمكن جمع صور واحدة عالية الدقة أو تسلسل صور 3-7 لتغطية عمق الهيكل(الشكل 5Biv).
السيناريو 3: الماوس الخلايا العصبية تانيسيت (الشكل 5C)
الماوس يوفر نموذجا راسخا لتطور الدماغ وموثقة توثيقا جيدا على مستويات مختلفة، بما في ذلك من قبل EM. على الرغم من أن مختلف الطرق الآلية تسلسل كتلة الوجه قد استخدمت على نطاق واسع لدراسة أنسجة الدماغ، وهناك حالات حيث يتم تكييفها بشكل أفضل AT لجمع البيانات اللازمة. تحت المهاد هو نموذج راسخ لعلم الأعصاب، وهو جزء من الدماغ يحتوي على وظائف أنواع الخلايا العصبية المتعددة. تمثل التانيسيات تحت المهاد مجموعة فرعية معينة من الخلايا الإبنديموغلية المبطنة لقاع البطين الثالث ، مع عمليات طويلة بشكل غير عادي (تصل إلى 300 ميكرومتر) وendfeet كبيرة (~ 5 ميكرومتر)37. وهذا يجعلها غير ملائمة للتحليل بواسطة أساليب TEM أو FIB. وتكتنف المهمة تعقيدا عندما تحتاج العديد من التانيسيت المستقلة إلى ترجمة وتحليل. ويمكن أن يكون أحد النهج لتسهيل هذه المهمة هو الاستهداف شبه المترابط، حيث يتم الحصول على خريطة الفلورسينس من العينات المسماة بالفلورسنت قبل تحديد ودمج EM. يتم إجراء المقطع على المنطقة التي تم التقاطها من خلال الجمع بين المعلومات الموضعية من عينة الفلورية والنسخة المتماثلة البلاستيكية المضمنة المسطحة. بعد ذلك ، يمكن استخدام سيناريو AT 3: يتم إنشاء صور الفسيفساء نظرة عامة عالية المستوى للكشف عن المناطق ذات مجموعات نهاية tanycyte. بعد ذلك ، يتم استخدام ميزات التشغيل الآلي في البرنامج لإعداد الحصول على تسلسل الصور من منطقة واحدة أو عدة مناطق في صورة واحدة أو وضع البلاط. يمكن تحليل هذه الصور بشكل منفصل، ككدسات محاذاة أو تقديمها بعد ذلك.
وتسمح قوة طريقة AT "بترقية" البيانات من 2D إلى 3D دون عناء نسبيا: الخرائط متوفرة من عملية الاستحواذ الأولية، ويمكن الحصول على الأحجام من المنطقة المختارة والمناطق المجاورة لها. يمكن محاذاة المكدس الناتج وتقديمه لاحقا. من الضروري تحديد الدقة وجودة الصورة المطلوبة مسبقا للعثور على ROIs. يجب أن يتيح التصوير التعرف على ROIs، ولكن ليس خارج هذه القيمة لأن مقاييس وقت الامتلاك تتناسب مع وقت البكسل المربع العكسي لحجم البكسل.

الشكل 1: تحديات إعداد عينة EM واكتساب الحجم. (أ) فقدان الفلورسينس والانكماش يحدث بسبب تركيز المعادن الثقيلة العالية والجفاف أثناء إعداد العينة. '1' رسم تخطيطي لعينة لوحظت تحت LM '2' نفس العينة المعدة ل EM، والتي تصبح مبهمة تماما وتفقد حوالي 10٪ من حجمها. (ب)وعادة ما يتم تضمين عينة باستخدام راتنجات الايبوكسي أو الاكريليك. يمكن استخدام الكتل التقليدية (1) بنجاح للعينات المتجانسة التي لا تتطلب توجها معينا. الكتل المسطحة (2) مفيدة عندما يكون من الضروري استهداف وتوجيه تحت المجهر، وهي منطقة دقيقة تهدف إلى تقسيم، على سبيل المثال، في عينات غير متجانسة أو إجراءات المجهر المترابطة. (ج)من حجم العينة بأكمله، يتم تمثيل جزء محدود فقط على مقطع واحد 50 نانومتر، وتوفير صورة 2D من عينة 3D، في كثير من الأحيان في اتجاه غير مألوف. (د)لتوضيح مشكلة تسجيل كميات كبيرة جدا مقابل استهداف دقيق، اخترنا ثلاثة مكعبات متحدة المركز مع وجوه 1000، 500، و 50 ميكرومتر يتم تنظيمها لتشمل افتراضية 1000 × 500 × 500 ميكرومتر عينة (مارون الظلام). إذا تم تقسيم هذه المكعبات عينة افتراضية تماما مع شرائح 50 نانومتر، لتغطية حجم كامل، وسوف يتطلب ما مجموعه 20،000، 10،000، و 1،000 شرائح، و 800 السل، 100 السل، و 100 غيغابايت، وفقا لذلك (قرار التصوير 5 نانومتر × 5 نانومتر × 50 نانومتر، 8 بت البيانات). وهذا يدل على أهمية التخطيط للحصول على بيانات EM فقط للحصول على الحد الأدنى من الحجم اللازم. (ه) لتغطية مساحة كبيرة من سطح العينة بدقة عالية يمثل مشكلة مماثلة لتلك التي من حجم كبير. تجانب عدة صور عالية الدقة في واحد هو حل مفيد لمثل هذه المشكلة. ومع ذلك ، لتغطية سطح 1 مم × 1 مم باستخدام إطار 2024 × 1048 في تكبير 10000x سيتطلب عددا كبيرا من البلاط ، والتي يمكن أن تصبح صعبة لغرزة. علاوة على ذلك، إذا كانت المقاطع مضغوطة أو مشوهة بشكل ثابت أثناء القطع، تصبح تكديسات البيانات الناتجة شبه مستحيلة المحاذاة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
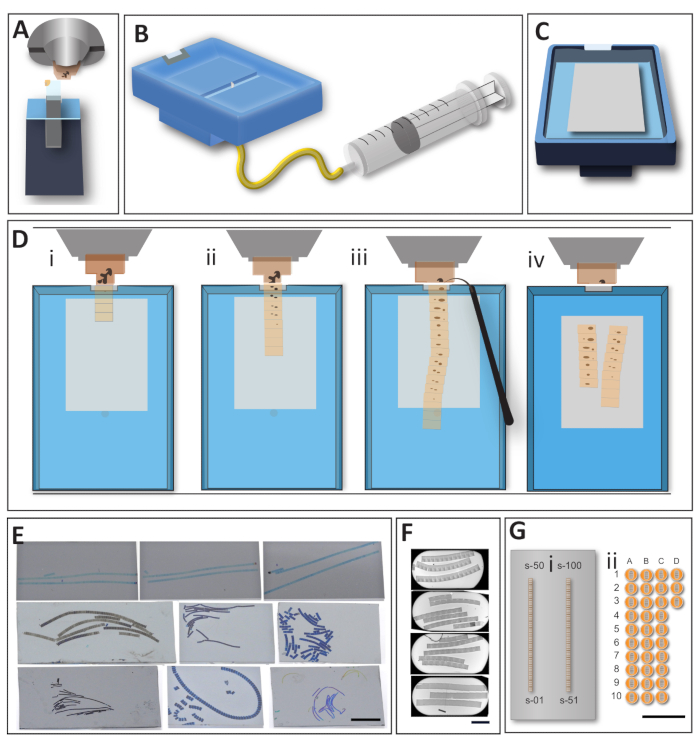
الشكل 2: سير العمل لتوليد مباشرة من صفائف من المقاطع على دعم كبير. (أ) لتقليم ضيق باستخدام أداة تقليم، يتم تأمين كتل داخل حامل microtome. تساعد هذه الخطوة على ضمان الجوانب المتوازية للكتلة وتقلل أيضا من الراتنج الفارغ حول العينة. (ب)سكين معدلة لاقتناء أقسام AT. قارب كبير يسهل نقل المقاطع والتلاعب بها أثناء تقسيم العينة ونقلها على الدعم. حوض كبير يتيح التلاعب في المقاطع؛ نظام استنزاف يحد من حركة شرائط خلال خطوة استنزاف، أسفل شقة يجعل التجفيف التدريجي للدعم موثوق بها. (ج) السكين، وعلى استعداد للقسم مع رقاقة توهج تفريغها وضعت في الجزء السفلي من الحوض والمياه تسويتها إلى حواف. بناء السكين يبقي الإبرة جزءا لا يتجزأ، دون التدخل في الدعم. (D) إنشاء الصفيف، أعلى عرض على منطقة المقطع microtome. (1) عادة ما يكون من السهل الحصول على الأقسام الأولى لأنها تتمسك بعضها البعض وتشكل شريطا منتظما. '2' عندما تضاف المزيد من الأقسام إلى الشريط، ويصبح أطول، يفقد الشريط استقراره ومنحنياته بشكل متكرر. من المهم الحفاظ على تسلسل المسارات المنظمة في تسلسل استعدادا لخطوة الحصول على الصورة. '3' عندما يصل شريط من المقاطع إلى الطول المطلوب، يتم فصله بعناية عن حافة السكين باستخدام رمش. '4' تصريف المياه من الحوض؛ تبقى الرقاقة في الداخل حتى تجف تماما. هذه الخطوة ضرورية ، لأنها تساعد على تصويب المقاطع وتجنب تكوين الطيات الصغيرة. يتم وضع رقاقة في الفرن في 60 درجة مئوية لمدة 30 دقيقة على الأقل لإرفاق أقسام على الدعم. (ه) رقائق المثال مع المقاطع المنقولة. على الرغم من أنه من المريح الحصول على أشرطة مستقيمة ودقيقة ، إلا أن العينات الفعلية تمنع تشكيل مثل هذه الأشرطة المثالية في معظم الحالات. ومع ذلك ، حتى "قذرة" شرائط مفيدة جدا لعدد كبير من الحالات ، وأهمية الشريط "أنيق" سيعتمد على استراتيجية البحوث التي يتم جمع الأقسام. شريط مقياس 1 سم (F) مثال شبكات الفتحات مع المقاطع التسلسلية. حتى عندما يتم جمع العديد من المقاطع على شبكة واحدة ، فإنه لا يزال جزءا صغيرا مما يمكن جمعه على رقاقة واحدة. وتمثل المهارة المطلوبة لإتقان نقل الأقسام على شبكة (شبكة الفتحات على وجه الخصوص) اختناقا كبيرا لإتقان إعداد عينة المجهر الإلكتروني. مقياس شريط 500 ميكرومتر (G) بغض النظر عن طريقة جمع القسم الذي تم استخدامه، نقاط القوة في نهج AT هو السهولة النسبية لتوليد المقاطع التسلسلية، مقارنة مع جمع على الشبكة. إذا تم النظر في كتلة عينة 1000 ميكرومتر × 500 ميكرومتر ، فلا توجد مشكلة في احتواء حوالي 100 مقطع على رقاقة 2 سم × 4 سم (i). ستتلاءم أقسام الحجم نفسه على شبكة الفتحات مع ثلاثة أقسام/شبكة فقط كحد أقصى (ii). نحن نقدم صورة متدرج لإظهار عدد الشبكات التي قد تكون مطلوبة لتغطية نفس العدد من الأقسام ، دون ذكر صعوبة جمع المقاطع التسلسلية على الشبكة. شريط المقياس = 1 سم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
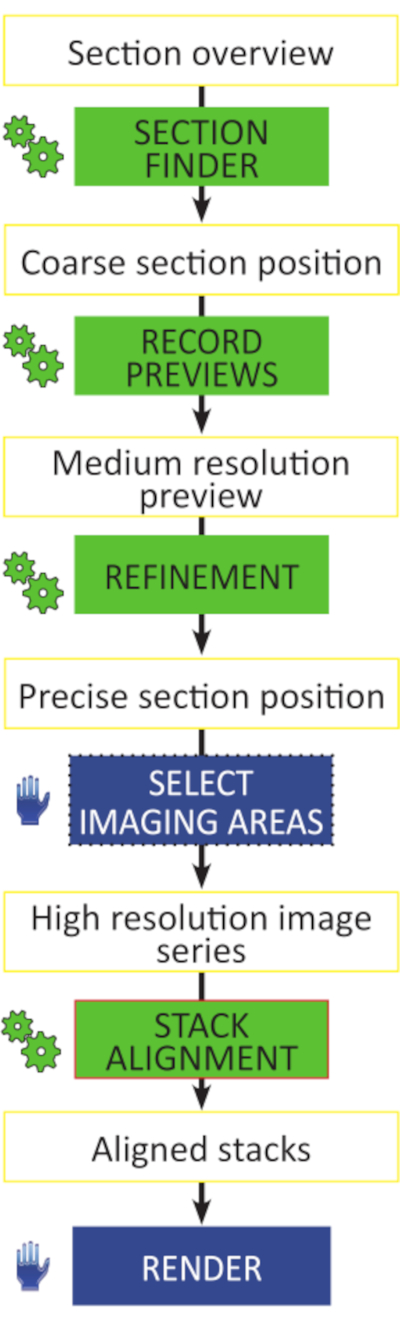
الشكل 3: الخطوات الهامة لسير عمل التصوير المقطعي للصفيف. تخطيطي لسير العمل للحصول على غير المراقب من مكدسات الصور عالية الدقة. جميع الخطوات التحضيرية مؤتمتة (رموز الترس الأخضر) ولا تتطلب أي إجراءات ليتم تنفيذها يدويا ، قسما بعد قسم. يمكن محاذاة مداخن الصور في أي برنامج لتحليل الصور قادر على المحاذاة التلقائية الصلبة أو affine. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: ثلاثة سيناريوهات الاستحواذ مع Drosophila الكبار الأمعاء كنموذج مظاهرة. (أ) رسم ميدغوت Drosophila تشريح، مع ثلاث مناطق رئيسية المعينة بألوان مختلفة: الأمامي، الوسط، والخلفي. (B) كتلة مسطحة قلصت فيها القناة الهضمية موجهة للقسم المستعرض. لاحظ أن كمية الراتنج الفارغة متوازنة بعناية حول الأنسجة التي تحتوي على منطقة الاهتمام (المستطيل الأبيض). (ج) المقاطع التسلسلية العرضية تطفو على سطح الماء داخل حوض سكين AT. تم الحصول على جميع الصور في وضع SEM الإلكترون الثانوي باستخدام كاشف المرآة مع التباين العكسي. (D) صورة فسيفساء مخيط من المقاطع التسلسلية عرضية على رقاقة. مقياس شريط هو 1000 ميكرومتر. (ه) المقطع العرضي من خلال الأمعاء Drosophila. شريط المقياس 20 ميكرومتر. الصورة هي فسيفساء مخيط من 7 × 7 صور متوسطة المدى. Insets - صور أعلى للتكبير والدقة للمناطق المحددة ذات الاهتمام: (2) النواة، (3) حدود الفرشاة، و (1) الميتوكوندريا. شريط مقياس 5 ميكرومتر للجميع. (F) صورة متوسطة المدى لقسم عرضية من خلال القناة الهضمية التي تستهدف موقع الخلايا النامية (مربع). شريط المقياس هو 20 ميكرومتر (G)المجموعة المستهدفة من المقاطع التسلسلية التي تم جمعها على أساس المنطقة المترجمة أثناء تحليل المقطع الموجود في لوحة F. شريط المقياس هو 10 ميكرومتر. (H) يتم تقديم النموذج ثلاثي الأبعاد استنادا إلى تسلسل مكدس الأقسام 50 التي تم الحصول عليها من الاستحواذ التسلسلي المستهدف في اللوحة G. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
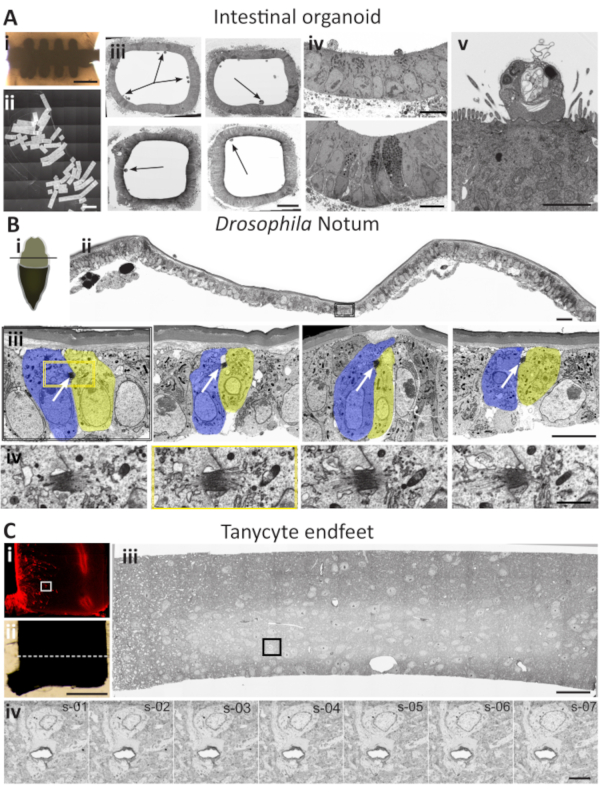
الشكل 5: دراسات حالة لسيناريوهات تطبيق AT. (أ) توطين هياكل الخلايا المختلفة في الجهاز المعوي. '1' رقاقة السيليكون المدمجة. شريط المقياس = 200 ميكرومتر (ii) صورة فسيفساء مخيطة من 127 مقطعا عرضيا من خلال الجزء المركزي من الشريحة. شريط المقياس = 1500 ميكرومتر (iii) أربع صور منخفضة الدقة لقسم عرضي كامل من خلال جزء من الجهاز المعوي. تشير الأسهم إلى الموقع المحتمل للاهتمام. يبلغ شريط المقياس 20 ميكرومترا(4) مؤشرات استثمار مختلفة، تستهدف على صور دقيقة منخفضة الدقة تم اختيارها لإجراء مزيد من التحليل. شريط المقياس = 10 ميكرومتر (v) صورة عالية الدقة للخلية المصابة ذات الاهتمام. تحليل المنطقة نفسها في المقاطع المجاورة يمكن أن توفر معلومات 3D المستهدفة إذا لزم الأمر. شريط مقياس = 5 ميكرومتر(ب) تعريب الجسم المتوسط في Drosophila melanogaster pupal notum. '1' منظر تخطيطي لجروة دروسوفيلا تشريحية. نوتوم يتعرض لتشريح (البيج) بعد إزالة جزء من البشرة الواقية (البني). يعين الخط الأسود اتجاه المقطع (ii) مقطع عرضي عبر المنطقة المعروضة في الرسم التخطيطي. تجمع الصورة بين صور 3x7 التي تم التقاطها بشكل تسلسلي عالية الدقة من SEM مخيطة بلوحة فسيفساء واحدة. يحدد المستطيل الأسود المنطقة التي تحتوي على خلية مقسمة. شريط المقياس هو 15 ميكرومتر (iii) صورة مكبرة على الخلية الفاصلة من اللوحة ii. في هذا التكبير والقرار ، ومنتصف الجسم واضح (السهام البيضاء). يتم تحليل المقطع بأكمله للعثور على الخلايا المقسمة. القفز بين شرائط مختلفة من المقاطع في 20-30 أقسام الفواصل الزمنية خلال خطوة الفحص الجانبي يسمح sto توطين العديد من أزواج الخلايا التقسيم. شريط المقياس هو 5 ميكرومتر (iv) عندما يتم ترجمة الخلية الفاصلة ، صور متسلسلة للنطاق الوسطي تم جمعها من أربعة أقسام حول الجسم الأوسط محددة بمربع أصفر في اللوحة (iii). شريط المقياس هو 1 ميكرومتر (C) تعريب نهاية Tanycytes في تحت المهاد الماوس. (1) صورة مفلورة لشريحة هزاز. التانيسيت التعبير عن البروتين الفلورسنت tdTomato (الأحمر). مستطيل أبيض يحدد منطقة الاهتمام. شريط مقياس 500 ميكرومتر.'2' نفس قسم الهزاز المعدة لEM سيتم قلص بعناية حول منطقة الاهتمام على أساس الارتباط غير المباشر للمعلومات الفلورسنت من لوحة (1). يمثل الخط الأبيض المنقط مساحة المقطع فوق النقط. شريط المقياس هو 50 ميكرومتر لكلا اللوحتين. '3' المقطع العرضي من خلال شريحة الهزاز في مجال الاهتمام. تتكون صورة فسيفساء SEM من 75 صورة مخيطة. يتم استهداف العديد من الأقسام من خلال الفحص الجانبي وصورت مع معلمات مماثلة. يتم تحليل المقاطع "دون اتصال" من أجل العثور على عائد الاستثمار - نهاية tanycyte. يمثل المستطيل الأسود المنطقة التي تحتوي على endfeet التانيسيت. وسيعمل هذا القسم كمرساة لمزيد من التحليل. شريط المقياس هو 15 ميكرومتر(iv) صورة عالية الدقة وعالية التكبير من نهاية التانيسيت المحيطة بوعاء دموي. وبعد التوطين الأولي لعائد الاستثمار في قسم واحد، يتم جمع تسلسل z من الأقسام المجاورة في المنبع إلى قسم الارتساء (اللوحة الثالثة). شريط مقياس 5 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: مشاكل أثناء الميكروتومية فائقة، وجمع القسم، وتخزين القسم يمكن أن يؤدي إلى التحف. (أ) أقسام عينة الدماغ على رقاقة. معظم الراتنج فارغة منفصلة عن الأنسجة ومطوية على نفسها (بني داكن). يعين المربع الأسود المتقطع منطقة تستخدم لاحتواء المقطع بأكمله. شريط مقياس 500 ميكرومتر (ب ) صغيرة، أضعاف المحلية على سطح مقطع حمار وحشي سمك 50 نانومتر. شريط مقياس 1 ميكرومتر (C) علامة سكين على سطح مقطع دماغ الماوس 70nm. شريط مقياس 5 ميكرومتر (D) الشعر (النجمة) على سطح رقاقة التي تغطي جزئيا قسم العضلات حمار وحشي. باللون الأصفر ، يتم استهداف الأنسجة للتحليل. باللون الوردي، خلية تستخدم لتكون مرجعا لحجم المنطقة المصابة. مقياس شريط 50 ميكرومتر. (ه) حمار وحشي notochord مع التجاعيد في أسفل اليمين (السهام السوداء)، حيث الأنسجة العصبية الكثيفة (مظللة باللون الأزرق) الحدود على الأنسجة العضلية ليونة والراتنج فارغة (السهام السوداء). شريط مقياس 10 ميكرومتر (F) حجم تجزئة كومة من 50 صورة كما هو الحال في E، مما يدل على أن هذه المنطقة أظهرت التجاعيد في معظم الأقسام. يوضح المضلع المتقطع المساحة الموضحة في شريط مقياس G. 10 ميكرومتر. (G) عرض XY لنفس تقسيم الحجم كما هو الحال في F ، مما يظهر التجاعيد كضربات سوداء قصيرة في النصف الأيمن من الكتلة. لاحظ أن محاذاة المكدس في الأجزاء المتبقية من الأنسجة لا تتأثر بالتجاعيد. مقياس شريط 5 ميكرومتر(H) XZ الإسقاط من نفس المنطقة كما هو الحال في G، وتبين التجاعيد في جميع الأقسام 50. شريط مقياس 5 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
فيلم تكميلي 1: صورة مونتاج عالية الدقة لمقطع عرضي من خلال Drosophila الأمامي midgut. صورة موزاييك لصورة SE-MD SEM مقلوبة. تم الحصول على 352 بلاط صورة منفصلة تلقائيا في 5 نانومتر القرار ومخيط لتقديم المقطع العرضي بأكمله. من الممكن تكبير الصورة للحصول على مزيد من التفاصيل والحصول على تغطية شاملة للبيانات باستخدام نفس الصورة. تقاطعات ضيقة، microtubuli، وأنواع مختلفة من الحويصلات يمكن أن يكون عند التكبير. مقياس شريط هو 10 μm. الرجاء انقر هنا لتحميل هذا الفيلم.
فيلم التكميلية 2: دروسوفيلا الخلايا الأمعاء تقديم. خمسون صورة فسيفساء محاذية للأقسام في منطقة تقسيم الخلايا المعوية. تقديم IMOD من حدود الخلية (الأزرق والفيروزي والبرتقالي) والنوى (أبيض). الرجاء الضغط هنا لتحميل هذا الفيلم.
المواد التكميلية. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
يعطي المجهر الإلكتروني نظرة ثاقبة على البنية الفوقية للخلايا والكائنات الحية ، والتي غالبا ما يكون من المرغوب فيه تصوير الهياكل ذات الاهتمام في سياقها ثلاثي الأبعاد. على الرغم من العديد من تكتيكات EM للتحليل الهيكلي الفائق ، لا يوجد حتى الآن حل "معيار الذهب". والسبب الرئيسي هو التنوع الواسع في العينات، والعديد من الأسئلة البيولوجية، التي تتطلب في كثير من الأحيان نهجا مصمما خصيصا. تم تصميم سير العمل المقترح AT لتقليل الوقت اللازم لمعالجة العينات، والحصول على البيانات، والتقييم، والتخزين. وعلاوة على ذلك، يوفر السكين المعدلة أداة مفيدة لتبسيط اكتساب الصفيف. التصميم المدمج للأقسام على رقائق مريحة، سواء بالنسبة للمراقبة والتخزين اللاحقة للعينات. ويتيح هذا الترتيب "الفحص الجانبي" للعينات عن طريق الانتقال أفقيا من الشريط إلى الشريط ومسح قسم واحد فقط في كل منها، مما يقلل بشكل كبير من الوقت اللازم لترجمة عائد الاستثمار. 10 - وتيسر سيناريوهات الحصول على البيانات المقترحة استهداف المناطق الصغيرة والموزعة عشوائيا. بمجرد العثور عليها، AT/ SEM يقيد التصوير عالي الدقة بدقة إلى حجم الاهتمام، سواء تم إجراؤه يدويا أو بمساعدة وظيفة تلقائية. يمكن إكمال AT لوحدات التخزين المحدودة يدويا ، مع تنقل المشغل عبر العينة وتحديد مناطق التصوير واحدا تلو الآخر. توفر الوحدة الآلية للبرنامج استراتيجية مرنة لاكتساب الصور لتصوير المناطق الصغيرة في أقسام كبيرة. الأتمتة في هذا البرنامج يسمح بتسجيل صور كبيرة عالية الدقة على مئات الأقسام ، وتحقيق وحدات تخزين مماثلة لSBFI. يؤدي تسجيل صور نظرة عامة على جميع الأقسام إلى تبسيط توطين عائد الاستثمار وتقليل الوقت الذي يقضيه في المجهر. وبما أن المقاطع لا تتضرر أثناء تسجيل المعاينات ذات الدقة العالية، فإن AT/SEM تسمح بإعادة استخدام العينة لجمع المزيد من البيانات عن العائد على الاستثمارات الأخرى أو بدقة أعلى.
وقت الحصول على الصورة هو واحد من أهم (وأغلى) جوانب 3D EM ولذلك ينبغي النظر في تصميم التجربة. في حين أنه ليس من المستغرب أن يستغرق التصوير مساحات كبيرة وقتا أطول من مناطق التصوير الصغيرة ، فمن السهل تقليل تقدير التأثير: اعتمادا على معلمات التصوير المحددة ، يمكن أن يختلف وقت الاستحواذ في كل قسم من ثوان إلى ساعات. تتضمن معلمات التصوير الحرجة حجم مجال الرؤية والدقة ووقت الإسهاب. على افتراض دقة الهدف من 10nm لكل بكسل و 1 ميكروس يسكن الوقت، والتصوير حقل من 20 ميكرومتر × 20 ميكرومتر، 100 ميكرومتر x100 ميكرومتر، أو 500 ميكرومتر x 500 ميكرومتر يستغرق 4 ثوان، 100 ثانية، أو 2500 ثانية للتسجيل. يمكننا مضاعفة هذه الأوقات التصوير لكل قسم من قبل عدد من المقاطع لتقدير الوقت اللازم لمهمة التصوير الكامل. يمكن أن تكون أوقات التصوير الطويلة لكل قسم مقبولة إذا كان عدد المقاطع صغيرا أو إذا كان وقت أداة المجهر غير مثير للقلق.
ومع ذلك، فمن الضروري الحد من وقت التسجيل إلى وظيفة بين عشية وضحاها أو وظيفة في عطلة نهاية الأسبوع في معظم الحالات. جانب حرج بنفس القدر من 3D EM التي ينبغي النظر فيها ، هو مقدار وهيكل البيانات الناتجة عن الصورة. تسجيل حقول التصوير المذكورة أعلاه في 100 قسم يولد 400 ميغابايت، 10 غيغابايت، أو 250 غيغابايت من بيانات الصورة، على التوالي؛ تشكل الصور 500 ميكرومتر × 500 ميكرومتر مشكلة إضافية وهي أن تكون أكبر من 2 غيغابايت لكل منها. لا يمكن للعديد من البرامج المستخدمة لتقييم البيانات فتح صور بهذا الحجم.
لتقليل وقت التصوير، من المهم اختيار وقت البكسل لتلبية متطلبات نسبة الإشارة إلى الضوضاء لتقييم البيانات اللاحق (على سبيل المثال، إعادة البناء والتتبع)، والحد من التسجيلات إلى مؤشرات استثمار محددة. تمديد AT للبرنامج يسهل الحصول على الصور في مناطق صغيرة في الأقسام التسلسلية. يدعم البرنامج سير العمل اليدوي والتلقائي والعديد من المتغيرات شبه التلقائية: يمكن وضع مناطق التصوير يدويا وتركيزها على كل قسم ، أو يمكن للمستخدم استخدام مكتشف القسم التلقائي وميزات محاذاة الموضع. اعتمادا على مستوى التشغيل الآلي الذي تم اختياره ودعمه من قبل نوع العينة أو أهداف التصوير ، يمكن أن يستغرق الوقت اللازم لإعداد اكتساب الصورة في مئات الأقسام يوم عمل كامل (يتم يدويا) أو بضع دقائق فقط. من حيث المبدأ، التصوير المقطعي الصفيف يجعل من الصعب أكثر من غيرها من أساليب EM 3D للحصول على ROIs الصغيرة. يجب تعويض وضع المنطقة غير الدقيق في أقسام متتالية من خلال الحصول على مساحات أكبر. على سبيل المثال، إذا كان عائد الاستثمار 20 ميكرومتر × 20 ميكرومتر في الحجم وتقلب موضع من قسم إلى قسم لحقول التصوير هو 10μm، يحتاج المرء إلى الحصول على صور 40 ميكرومتر × 40 ميكرومتر للتأكد من أن عائد الاستثمار يتم التقاطه بالكامل في كل صورة، في كل قسم. يتراوح تباين موضع الصورة في العالم الحقيقي من 100 ميكرومتر إلى <10 ميكرومتر اعتمادا على توافر أو جودة ميزات البرامج لمحاذاة الموضع أو صبر المستخدم. مع هذا البرنامج، يمكن تحقيق 10 ميكرومتر دون تدخل يدوي أكثر من اللازم في معظم العينات.
مثل أي تقنية ، AT لديها العديد من نقاط الضعف التي يمكن أن تؤثر على الحصول على البيانات الناجحة ، والعديد منها مشابهة لطرق أخرى تستند إلى الأقسام. عدم وجود توزيع متجانسة من الراتنج فارغة مقابل الأنسجة يمكن أن يؤدي إلى صفائف منحنية أو مكسورة. في الحالات القصوى، يمكن فصل المقاطع من الدعم (الشكل 6A). ضغط متغير أو تمتد خلال عملية القطع يمكن إنشاء طيات التي يمكن أن تعطل العينة في مناطق متغيرة على المقاطع اللاحقة (الشكل 6B). يمكن أن تظهر علامات السكين على سطح المقاطع التي تم جمعها باستخدام سكين معطوبة(الشكل 6C). يمكن أن تؤدي الاختلافات في ظروف القسمة إلى ضغط المقطع العرضي واختلافات السماكة. الغبار أو الأوساخ الجسيمات يمكن أن تهبط على قسم وحجب جزئيا منطقة الاهتمام (الشكل 6D). يمكن أن تفشل عملية الحصول على الصور بسبب التباين التلقائي الناقص والتركيز التلقائي ووظائف الوصم التلقائي. يمكن أن يكون موضع مناطق التصوير التي تم إنشاؤها تلقائيا متغيرا وقد يفشل في التقاط عائد الاستثمار في جميع الأقسام.
يمكن أن تنشأ عدة مشاكل في مرحلة خياطة والمحاذاة. يمكن أن تفشل الخياطة التلقائية لمقتنيات بلاط الفسيفساء ، على سبيل المثال ، بسبب المساحة الفارغة الكبيرة داخل العينة. نظرا لتغيير جذري في الشكل في 3D ، يمكن أن تكون أكوام الصور صعبة للتسجيل. البرامج المطورة خصيصا (على سبيل المثال، IMOD، فيجي، TrackEM2، MIB، أو MAPS-AT) يمكن أن تسهل المحاذاة شبهالتلقائية 32،38،39،40. يمكن محاذاة المقاطع الأكثر تحديا يدويا باستخدام برنامج تحرير الصور. لسوء الحظ، قد يكون من المستحيل محاذاة بعض مجموعات البيانات بشكل صحيح.
تشكل العينات الكبيرة تحديا للأقسام التسلسلية TEM التي تتناسب مع الشبكات؛ من ناحية أخرى، العديد من المشاريع لا تبرر اقتناء التلقائي طويلة باستخدام FIB / SEM أو SBF-SEM. و AT هو بديل مباشر لقسم المسلسل مملة TEM حيث جمع والتلاعب من المقاطع التسلسلية على رقاقة هي أكثر مباشرة مما كانت عليه مع شبكات فتحة. تم تطوير العديد من الاستراتيجيات لتسهيل جمع الصفائف ، ونحن نشارك طريقتنا لتوسيع مجموعة الأدوات الحالية. وفي الحالات التي يكون فيها تحديد عائد الاستثمار صعبا، يوفر نظام AT-SEM ميزة أساسية، مع الفحص الفعال للعينات التي يلزم فيها استبانة على نطاق عضوي في 50 إلى 500 قسم. بالنسبة للأحجام الكبيرة، يمكن جمع استراتيجيات AT التلقائية بكفاءة إذا كان هناك حاجة إلى المزيد من المقاطع. يمكن إعادة تصوير عينات AT عدة مرات ، مما يسهل التصوير المستهدف للمناطق عالية الدقة استنادا إلى صور النظرة العامة المكتسبة مسبقا. ونحن نعتقد أن التحليل المستهدف وتقليل الإفراط في الاختزال من قبل AT / SEM المقترحة هنا يقلل من متطلبات العمل وتخزين البيانات. وفي نهاية المطاف، يمكن جمع مكتبات الأقسام وصيانتها لإعادة استخدامها والتشاور بشأنها في وقت لاحق. بالنسبة لاكتساب الحجم، تقدم أساليب FIB أو SBF-SEM حلا ممتازا كلما كان من السهل تحديد عائد الاستثمار على وجه الكتلة أو إذا كانت هناك حاجة إلى وحدات تخزين ثلاثية الأبعاد كبيرة للتحليل. ومع ذلك، FIB/SBF-SEM أقل كفاءة عندما يكون صورة مكدس عالي الدقة يجب أن يتم تجميعها من عائد استثمار محدد بطريقة مستهدفة. وفي الختام، فإن الأساليب المقترحة لفحص عينات AT واستخدام صور النظرة العامة متوسطة الدقة تسمح بقصر الحصول على الصور على الأجزاء ذات الصلة من صفيف القسم. يؤدي استهداف مناطق التصوير بدقة إلى تسريع عملية نقل البيانات وتبسيط تقييم البيانات.
وباختصار، على الرغم من أن مفهوم AT/SEM ليس جديدا، فإن استخدامه لا يزال غير واسع الانتشار كما يوحي مزاياه. بشكل عام، يوفر إجراء تكميليا لأساليب EM الموجودة الأخرى. AT/ SEM متوافق مع أوسع نطاق من بروتوكولات إعداد العينة وسير عمل التصوير ويمكن القيام به على أي مجهر FIB/SEM أو SBF-SEM كبقنية مصاحبة. في هذه الورقة، ركزنا على AT لتسجيل البيانات فائقة الهيكلة من العينات التي هي أقل عرضة لمعالجتها بنجاح بطرق أخرى. ونأمل أن يساعد الإجراء الموصوف لجمع الأقسام المريح واستراتيجيات الاستحواذ الآلي إلى حد كبير في المحاولات الأولى لأولئك الذين لم يصادفوا هذه الطريقة أبدا وسيساعد على تحسينها لأولئك الذين لديهم بالفعل بعض الخبرة.
Disclosures
المؤلف تيلمان فرانك هو موظف في ثيرمو فيشر التي تصنع المجاهر الإلكترونية وبرامج التجربة التي تستخدم في هذه المادة.
Acknowledgements
نود أن نشكر أعضاء مرفق EM في جامعة لوزان على دعمهم خلال هذا التطوير لخطوات مختلفة من إجراء AT. نود أن نشكر غاريث غريفيث ومارتا رودريغز وأورسكا ريبنك وكريستل جينود وهيلموت غنايجي وعينات زيلينغر وباولا مورينو رومان ولوسي أوبراين وليندساي لويلين على المناقشات التي جرت أثناء إعداد المخطوطة والقراءة النقدية. نريد أن نعترف بالمجموعات التي ساهمت بالعينات المستخدمة لإظهار السيناريوهات المختلفة: ماتياس لوتولف، ميخائيل نيكولاييف، ديفانجالي دوتا، تيل ماتزات، وفاني لانغليت.
Materials
| Name | Company | Catalog Number | Comments |
| Cutting | |||
| AT sectioning knife | Diatome | DUATS3530 | Diatome Jumbo knife |
| Diamond knife for trimming 90° | Diatome | DTB90 | Diatome trimming 20° Glass knife |
| Pattex contact adhesive | Pattex | PCL3C | |
| Silicon wafer | Ted Pella | 16015 | Resistance: 1-30 Ohms Type P: (Boron) (1 primary flat) Roughness: 2 nm No SiO2 top coating TTV: = <20 µm Wafer is polished on one side |
| Ultramicrotome | Leica UC6 | Alternative: Leica UC7 | |
| Wafer cleaving kit | EMS | 7642 | EMF, Small Sample Cleaver, CatNo. 7652 |
| Image acquisition | |||
| FESEM | Thermo Fischer Helios | 1072419 | Alternatives: Zeiss, Jeol, Hitachi, TESCAN |
| Maps 3 for SEM with Correlative Workflow & Array Tomography | Thermo Fisher Scientific | 1135932 | Maps provides automation of SEM imaging workflows and allows importing of 3rd party data for CLEM and navigation. |
| Image analysis | |||
| Amira x.y | Thermo Fisher Scientific | 1131599 | Amira is a 3D data visualization and analysis software with several practical functions for Array Tomography data reconstruction. |
| Image processing | Open source | Fiji (http://fiji.sc/#download) | IMOD, MIB (See text for refferences) |
References
- Luckner, M., Wanner, G. From light microscopy to analytical scanning electron microscopy (SEM) and focused ion beam (FIB)/SEM in biology: Fixed coordinates, flat embedding, absolute references. Microscopy and Microanalysis. 24 (5), 526-544 (2018).
- White, J. G., Southgate, E., Thomson, J. N., Brenner, S. The structure of the nervous system of the nematode Caenorhabditis elegans. Philosophical Transaction of Royal Society of London B Biological Sciences. 314 (1165), 1 (1986).
- Zheng, Z., et al. A complete electron microscopy volume of the brain of adult Drosophila melanogaster. Cell. 174 (3), 730-743 (2018).
- Mulcahy, B., et al. A pipeline for volume electron microscopy of the caenorhabditis elegans nervous system. Frontiers in Neural Circuits. 12, 94 (2018).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Baumeister, W., Grimm, R., Walz, J. Electron tomography of molecules and cells. Trends in Cell Biology. 9 (2), 81-85 (1999).
- Hoog, J. L., et al. Organization of interphase microtubules in fission yeast analyzed by electron tomography. Developmental Cell. 12 (3), 349-361 (2007).
- Weber, M. S., Wojtynek, M., Medalia, O. Cellular and structural studies of eukaryotic cells by cryo-electron tomography. Cells. 8 (1), 57 (2019).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
- Horstmann, H., Korber, C., Satzler, K., Aydin, D., Kuner, T. Serial section scanning electron microscopy (S3EM) on silicon wafers for ultra-structural volume imaging of cells and tissues. PLoS One. 7 (4), 35172 (2012).
- Hayworth, K. J., et al. Imaging ATUM ultrathin section libraries with WaferMapper: a multi-scale approach to EM reconstruction of neural circuits. Frontiers in Neural Circuits. 8, 68 (2014).
- Kubota, Y., et al. A carbon nanotube tape for serial-section electron microscopy of brain ultrastructure. Nature Communication. 9 (1), 437 (2018).
- Wacker, I. U., et al. Multimodal Hierarchical Imaging of Serial Sections for Finding Specific Cellular Targets within Large Volumes. Journal of Visualized Experiments. (133), e57059 (2018).
- Burel, A., et al. A targeted 3D EM and correlative microscopy method using SEM array tomography. Development. 145 (12), (2018).
- Templier, T. MagC, magnetic collection of ultrathin sections for volumetric correlative light and electron microscopy. Elife. 8, 45696 (2019).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), 329 (2004).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. Journal of Neuroscience. 28 (12), 2959-2964 (2008).
- Wanner, A. A., Genoud, C., Masudi, T., Siksou, L., Friedrich, R. W. Dense EM-based reconstruction of the interglomerular projectome in the zebrafish olfactory bulb. Nature Neuroscience. 19 (6), 816-825 (2016).
- Smith, D., Starborg, T. Serial block face scanning electron microscopy in cell biology: Applications and technology. Tissue Cell. 57, 111-122 (2019).
- Kizilyaprak, C., Bittermann, A. G., Daraspe, J., Humbel, B. M. FIB-SEM tomography in biology. Methods in Molecular Biology. 1117, 541-558 (2014).
- Xu, C. S., et al. Enhanced FIB-SEM systems for large-volume 3D imaging. Elife. 6, 25916 (2017).
- Hayworth, K. J., et al. Gas cluster ion beam SEM for imaging of large tissue samples with 10 nm isotropic resolution. Nature Methods. 17 (1), 68-71 (2020).
- Maco, B., et al. Correlative in vivo 2 photon and focused ion beam scanning electron microscopy of cortical neurons. PLoS One. 8 (2), 57405 (2013).
- Russell, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Lucas, M. S., Gunthert, M., Gasser, P., Lucas, F., Wepf, R. Bridging microscopes: 3D correlative light and scanning electron microscopy of complex biological structures. Methods in Cell Biology. 111, 325-356 (2012).
- Koga, D., Kusumi, S., Bochimoto, H., Watanabe, T., Ushiki, T. Correlative light and scanning electron microscopy for observing the three-dimensional ultrastructure of membranous cell organelles in relation to their molecular components. Journal of Histochemistry and Cytochemistry. 63 (12), 968-979 (2015).
- Peddie, C. J., et al. Correlative and integrated light and electron microscopy of in-resin GFP fluorescence, used to localise diacylglycerol in mammalian cells. Ultramicroscopy. 143, 3-14 (2014).
- Markert, S. M., et al. 3D subcellular localization with superresolution array tomography on ultrathin sections of various species. Methods in Cell Biology. 140, 21-47 (2017).
- Kolotuev, I., Schwab, Y., Labouesse, M. A precise and rapid mapping protocol for correlative light and electron microscopy of small invertebrate organisms. Biology of the Cell. 102 (2), 121-132 (2009).
- Kolotuev, I. Positional correlative anatomy of invertebrate model organisms increases efficiency of TEM data production. Microscopy and Microanalysis. 20 (5), 1392-1403 (2014).
- Kato, M., Kolotuev, I., Cunha, A., Gharib, S., Sternberg, P. W. Extrasynaptic acetylcholine signaling through a muscarinic receptor regulates cell migration. Proceedings of the National Academy of Sciences. 118 (1), e1904338118 (2021).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Miguel-Aliaga, I., Jasper, H., Lemaitre, B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics. 210 (2), 357-396 (2018).
- Nikolaev, M., et al. Homeostatic mini-intestines through scaffold-guided organoid morphogenesis. Nature. 585 (7826), 574-578 (2020).
- Knoblich, J. A. Mechanisms of asymmetric stem cell division. Cell. 132 (4), 583-597 (2008).
- Daniel, E., et al. Coordination of septate junctions assembly and completion of cytokinesis in proliferative epithelial tissues. Current Biology. 28 (9), 1380-1391 (2018).
- Pasquettaz, R., et al. Peculiar protrusions along tanycyte processes face diverse neural and non-neural cell types in the hypothalamic parenchyma. Journal of Comparative Neurology. , (2020).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD. Journal of Structural Biology. 116 (1), 71-76 (1996).
- Cardona, A., et al. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011 (2012).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: A platform for segmentation and analysis of multidimensional datasets. PLoS Biology. 14 (1), 1002340 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.