Method Article
عزل وتوسعة المجالات العصبية من بعد الولادة (P1−3) منافذ عصبية للفأر
In This Article
Summary
في هذه المقالة، نصف، بالتفصيل، بروتوكول لتوليد ثقافات الغلاف العصبي من الخلايا الجذعية العصبية الماوس بعد الولادة المستمدة من منافذ الماوس العصبيالرئيسي الرئيسي. وتستخدم الخلايا العصبية لتحديد الخلايا الجذعية العصبية من أنسجة الدماغ مما يسمح لتقدير أعداد الخلايا السلائف. وعلاوة على ذلك، يمكن مطلي هذه الهياكل 3D في ظروف متباينة، مما يؤدي إلى الخلايا العصبية، oligodendrocytes والخلايا الفلكية، مما يسمح لدراسة مصير الخلية.
Abstract
إن القول بالغلاف العصبي هو تقنية مفيدة للغاية في المختبر لدراسة الخصائص المتأصلة للخلايا الجذعية العصبية / السلف (NSPCs) بما في ذلك الانتشار والتجديد الذاتي والقدرة المتعددة. في الدماغ بعد الولادة والبالغين ، NSPCs موجودة بشكل رئيسي في اثنين من المنافذ العصبية: المنطقة تحت البطين (SVZ) بطانة البطينين الجانبي والمنطقة تحت الحبيبية من الدوران دنيتات فرس النهر (DG). العزلة من المنافذ العصبية من الدماغ بعد الولادة يسمح الحصول على كمية أكبر من NSPCs في الثقافة مع ما يترتب على ذلك من ميزة ارتفاع الغلة. يخلق الاتصال الوثيق بين الخلايا داخل كل كرة عصبية بيئة دقيقة قد تشبه المنافذ العصبية. هنا، نصف، بالتفصيل، كيفية توليد ثقافات الغلاف العصبي المشتقة من SVZ وDG من الفئران التي يبلغ عمرها 1-3 أيام (P1−3) ، وكذلك التمرير ، لتوسيع نطاق الكرة العصبية. وهذا نهج مفيد لأن القول بالغلاف العصبي يسمح بجيل سريع من استنساخ NSPC (6-12 يوماً) ويساهم في انخفاض كبير في عدد استخدام الحيوانات. من خلال طلاء الخلايا العصبية في ظروف متباينة ، يمكننا الحصول على طبقة الزائفة من الخلايا المكونة من NSPCs والخلايا المتمايزة من الأنساب العصبية المختلفة (الخلايا العصبية والخلايا الفلكية وoligodendrocytes) مما يسمح بدراسة إجراءات العوامل الجوهرية أو الخارجية على انتشار NSPC والتمايز وبقاء الخلايا وتولد الخلايا.
Introduction
وصف أولاً في عام 19921,2 ولا يزال أداة فريدة وقوية في أبحاث الخلايا الجذعية العصبية (NSC). عزل NSCs من المناطق العصبية الرئيسية لديه قضايا صعبة لأن متطلبات الحفاظ على هذه الخلايا في الظروف الفسيولوجية لا تزال غير مفهومة بشكل جيد. في وكالة الأمن القومي، يتم استزراع الخلايا في وسط خال من المصل كيميائيا مع وجود عوامل النمو بما في ذلك عامل نمو البشرة (EGF) وعامل النمو الليفي الأساسي (bFGF)1،2،3. يتم اختيار الخلايا السلائف العصبية (الجذعية والسلف) باستخدام هذه الخلايا الميتومية لأن هذه الخلايا هي EGF وFGF استجابة دخول فترة من الانتشار النشط في حين أن الخلايا الأخرى، وهي خلايا متباينة، يموت4. تنمو الخلايا السلائف العصبية ككرة عصبية ، والتي يمكن تمريرها بعد ذلك لزيادة توسيع بركة هذه الخلايا5. الأهم من ذلك، لأن هذه الخلايا السلف الجذعية العصبية (NSPCs) هي متعددة القدرات أنها قادرة على التفريق في ثلاثة أنواع الخلايا الرئيسية للجهاز العصبي المركزي (CNS): الخلايا العصبية، oligodendrocytes والخلايا الفلكية5.
توفر وكالة الأمن القومي مصدرًا متجددًا لسلائف الجهاز العصبي المركزي غير المتمايزة ، والتي يمكن استخدامها لدراسة العديد من العمليات بما في ذلك انتشار NSC والتجديد الذاتي ، والتمايز العصبي والدلي ، في كل من السياق الفسيولوجي وسياق المرض. وعلاوة على ذلك، في الدراسات المختبرية يمكن استخدامها لتقييم درجة المواصفات الجوهرية الموجودة في السلائف العصبية أثناء التنمية، وكذلك لدراسة الإمكانات الكاملة للخلايا، عن طريق إزالة الإشارات الخارجية المرتبطة بيئتها العادية6. نموذج الغلاف العصبي هو قيمة لتقييم المنظمين المفترضين منذ الحفاظ على الخلايا في وسط خالية من المصل، يتم توفير الإشارات البيئية فقط من قبل الخلايا المحيطة6. وعلاوة على ذلك، في وكالة الأمن القومي، يتم توسيع NSPCs بسهولة في الثقافة، وكثافة الخلايا لكل منطقة عالية والتكوين غير المتجانس للكرة العصبية لديه بعض التشابه في منافذ الجسم الحي6. هذه المزايا الراسخة هي السبب في استخدام هذه المنهجية على نطاق واسع من قبل العديد من الباحثين.
يصف البروتوكول التالي بالتفصيل جميع العمليات من عزلة سكان NSPC بعد الولادة من المنطقتين العصبية الرئيسيتين ، المنطقة تحت البطين (SVZ) والدوران في قرن آمون ، إلى توسع تلك الخلايا ككرة عصبية ، وكذلك إلى التمايز في الخلايا العصبية والخلايا الفلكية وoligodendrocytes. وأخيراً، يتم وصف المقالات المختلفة أيضًا للوصول إلى الخصائص المتعددة القدرات والمتعددة القدرات لـ NSPCs المشتقة من SVZ وDG.
Protocol
وأجريت جميع التجارب وفقا للجماعة الأوروبية (86/609/الجماعة الاقتصادية الأوروبية؛ 2010/63/EU؛ 2012/707/EU) والبرتغالية (DL 113/2013) لحماية الحيوانات المستخدمة للأغراض العلمية. وقد وافقت على البروتوكول "الهيئة المؤسسية لرعاية الحيوان التابعة للرابطة - ORBEA-iMM والسلطة الوطنية المختصة - DGAV (Direcção Geral de Alimentação e Veterinária)."
1. الإعداد الأساسي وإعداد وسيلة الثقافة
- في يوم التشريح، قم بإعداد الكمية المناسبة من متوسط النمو المطابق للوسيط الخالي من المصل (SFM) المكون من وسيط النسر المعدل في دولبيككو [(DMEM)/F12 مع L-الجلوتامين](جدول المواد)المكمل بـ 100 U/mL البنسلين و100 ميكروغرام/ملي العقدية (القلم/العقد)، 1% B27، مع أيضا 10 نانوغرام / مل EGF و 5 نانوغرام / مل bFGF. دافئ ة الثقافة وسيطة إلى 37 درجة مئوية في حمام مائي.
ملاحظة: يعتمد حجم متوسط النمو على عدد الجراء ، لـ 5 جراء تعد ~ 100 مل (50 مل لـ SVZ و 50 مل لـ DG) ؛ ومع ذلك، بعد حساب عدد الخلايا (الخطوة 5.1) يجب تعديل الحجم الدقيق. - لmicrodissection من SVZ وDG، وإعداد الكالسيوم والمغنيسيوم خالية من محلول خط المحلول المالح المتوازن (HBSS) وسيطة تشريح تكملها مع 100 U/ mL القلم / العقدية.
ملاحظة: إعداد 50-100 مل من وسيطة التشريح. - إعداد المجهر تشريح وإعداد الأدوات اللازمة لإزالة الدماغ (مقص وملعقة صغيرة) وللميكروديس القسمSZ وDg (مقص صغير دومون، الملقط #7، الملقط #5، #5S ملقط) عن طريق نقع في الإيثانول 70٪.
2- حصاد أدمغة الفئران بعد الولادة (P1-3) وميكروديسات SVZ/DG
- إعداد 60 ملم أطباق بيتري (منطقة النمو 21 سم2)مع HBSS تستكمل مع القلم / العقدية وأنابيب عينة 2 (واحد لSVZ وواحد لDG) مع 500 ميكرولتر من HBSS التكميلية لكل منهما.
- توهي الفئران الجراء (P1-3) وفقا للبروتوكول الذي وافقت عليه مرفق الرعاية الحيوانية المؤسسية / المبادئ التوجيهية. تنفيذ قطع الرأس مع شق واحد مع مقص حاد في قاعدة جذع الدماغ.
- عقد الجزء البطني من الجسم في قاعدة الرأس واستخدام مقص مدببة صغيرة، وجعل شق خط الوسط في الجلد على طول الرأس، وبالتالي الكشف عن سطح الجمجمة.
- إجراء شق طولي في قاعدة الجمجمة ومواصلة قطع على طول خياطة الترهل باستخدام مقص صغير مع زاوية ضحلة قدر الإمكان من أجل تجنب إتلاف هياكل الدماغ.
- قشر الجمجمة إلى الجانبين باستخدام ملقط منحنية وفضح الدماغ.
تنبيه: تأكد من خلو أدوات التشريح من الإيثانول قبل لمس الدماغ. - عزل الدماغ عن الجمجمة باستخدام ملعقة صغيرة، عن طريق الانزلاق تحت قاعدة الدماغ لقطع الأعصاب القحفية والأوعية الدموية التي ترتبط بقاعدة الدماغ، ونقل الدماغ إلى طبق بيتري يحتوي على الباردة المكملة حل HBSS.
- ضع طبق بيتري الذي يحتوي على الدماغ تحت مجهر تشريح عند التكبير المنخفض ووضع الدماغ على سطحه الظهري.
- باستخدام ملقط غرامة، وإزالة meninges من الجانب البطني من الدماغ والمصابيح الشمية، في حين عقد الدماغ في الموقف من المخيخ. تدوير الدماغ على الجانب البطني وقشر قبالة بقية meninges.
ملاحظة: إزالة الزعامات الظهرية خطوة حاسمة لضمان تشريح الدماغ الصحيح. - تجاهل المخيخ جعل قطع باستخدام ملقط. ضع ورقة فلتر بحجم مسام 11 ميكرومتر على مروحية من الأنسجة(جدول المواد)وضع الدماغ على ورق التصفية باستخدام ملقط منحنية مدببة. فرم الدماغ إلى 450 ميكرومتر أقسام إكليلية واستخدام لافينا الرطب لجمع الدماغ مقطعة إلى طبق جديد بيتري مليئة HBSS الباردة التكميلية.
- لتشريح SVZ، استخدم الملقط لفصل الشرائح التاجية بطريقة الأمامية إلى الخلفية حتى تصل إلى شرائح مع البطينين الجانبيين، تحت المجهر تشريح.
- قطع طبقة رقيقة من الأنسجة المحيطة الجدار الجانبي للالبطينين (الذي يتوافق مع SVZ) مع ملقط غرامة، باستثناء parenchyma الترسية وكالوسوم الجسم. عزل SVZ عن طريق وضع غيض من الملقط في الزوايا الجانبية للبطين الجانبي: واحد على الفور تحت كالوسوم كوربوس والآخر في الأنسجة المجاورة مباشرة إلى المنطقة البطنية من البطين الجانبي. ثم، قطع خط صغير من الأنسجة المحيطة البطين الجانبي.
- جمع الأنسجة تشريح في أنبوب عينة مع تكملة الحل HBSS التي تم تحديدها سابقا باسم SVZ.
ملاحظة: استبعاد SVZ في شرائح حيث تبدأ كل من البطينين الجانبي وتشكيل فرس النهر في الظهور. - الذهاب من خلال جميع شرائح بعد sVZ microdissection في aterior إلى الخلفي أزياء والوصول إلى تشكيل فرس النهر. باستخدام ملقط تجاهل الشريحة الأولى مع قرن آمون حيث DG لا يزال لا يمكن التعرف عليها.
- لإزالة DG، قم أولاً بعزل قرن آمون عن الشرائح. إعادة تركيز المجهر لتصور الحدود حول DG.
- قم بتشريح الجزء DG من خلال إجراء قطع بين منطقة DG و CA1 متبوعًا بقص عمودي بين منطقة DG و CA3 باستخدام ملقط. إزالة الفيبريا وأي أنسجة مجاورة.
ملاحظة: في الحيوانات P1−3، لا يمكن تمييز DG تقريبًا عن قرن آمون ولكنه يعرض طرفًا صغيرًا. - جمع الأنسجة تشريح في أنبوب عينة تحتوي على حلول HBSS التكميلية التي تم تحديدها سابقا باسم DG.
ملاحظة: إصابة إجمالية لقرن آمون أو المنطقة المحيطة بها سيجعل من الصعب عزل DG. استخدام أطلس من الدماغ الماوس بعد الولادة أمر ضروري عندما لا يكون المستخدم على دراية عزل SVZ وDG الأنسجة من المقاطع التاجية.
3. تفكك الأنسجة
- لفصل أنسجة SVZ و DG الموجودة في أنابيب كل منهما، أضف التربسين-EDTA 0.05% للحصول على تركيز نهائي بنسبة 5-10% من التربسين-EDTA 0.05% في HBSS. احتضان لمدة 15 دقيقة تقريبا في 37 درجة مئوية، حتى يتم تكتل الأنسجة معا.
- غسل الأنسجة من التربسين عن طريق إزالة وسائل الإعلام وإضافة 1 مل من حلول HBSS جديدة مكملة لمدة 4 مرات متتالية.
- إزالة HBSS وإعادة تعليق الأنسجة المهضومة في 1 مل من SFM تكملها مع 10 نانوغرام / مل EGF و 5 نانوغرام / مل bFGF. ينفصل البيليه ميكانيكيًا عن طريق الأنابيب بلطف لأعلى ولأسفل تقريبًا 7−10x باستخدام ماصة P1000 ، حتى يتم الحصول على محلول خلية متجانس.
تنبيه: يمكن أن يؤدي التفكك الميكانيكي المفرط إلى زيادة موت الخلايا وسيؤثر سلبًا على نمو الخلايا اللاحقة.
4. خلية زوج القول لدراسة مصير الخلية
- قبل التجربة، قم بإعداد لوحات مغلفة من 24 بئرًا لثقافات أحادية الطبقات المعتفية وفقًا للأقسام 8-10.
- لحساب عدد خلايا SVZ أو DG (التي تم الحصول عليها في القسم 3) ليتم مطليها، استخدم محلولًا يحتوي على 0.2٪ Trypan الأزرق وعد الخلايا باستخدام مقياس الخلايا اللومترية.
- تمييع تعليق الخلية المنفصلة في SFM مُكمّلة بـ 5 نانوغرام/مل من طراز EGF و2.5 نانوغرام/مل bFGF (EGF/bFGF منخفض) بكثافة تبلغ 11,300 خلية/سم2 ومطلية بها على ألواح زجاجية مغلفة.
- بعد 24 ساعة، إصلاح الخلايا لالكيمياء المناعية ضد علامات NSC مثل الجنس تحديد المنطقة Y-box 2 (Sox2) وnestin وكذلك مع علامة من النسب العصبي (وهي دوبلكورتين [DCX]، للخلايا العصبية غير ناضجة) (انظر القسم 14).
ملاحظة: Sox2 هو علامة NSCs التي تخضع للmitosis. Sox2+/+ أزواج الخلايا الناتجة عن انقسام خلية السلف واحد يعكس توسع الخلايا الجذعية7.
5- التوسع في الخلايا الجذعية العصبية بعد الولادة كمجالات عصبية
- لتحديد كثافة تعليق الخلية SVZ أو DG المنفصلة (التي تم الحصول عليها في القسم 3)، عد الخلايا باستخدام مقياس الخلايا اللوهية.
- تمييع SVZ وتعليق الخلية الواحدة DG بكثافة 2 × 104 خلايا / مل في SFM مُكمّلة بـ 10 نانوغرام/مل EGF و5 نانوغرام/مل bFGF. البذور SVZ وDG الخلايا في غير المصقول 60 ملم أطباق بيتري مع حجم النهائي من 5 مل / بيتري طبق.
- احتضان خلايا SVZ وDG لمدة 6-8 أيام و 10-12 يومًا ، على التوالي لتشكيل الخلايا العصبية الأولية ، عند 37 درجة مئوية مع 5٪ CO2.
ملاحظة: يمكن أن تعزز أيام الحضانة أكثر من تلك المذكورة تجميع الخلايا العصبية وارتفاع مستويات موت الخلايا في وسط الغلاف العصبي. - عندما يكون قطر معظم النّاسيّات 150-200 ميكرومتر، قم بالمرور على الغلاف العصبي.
ملاحظة: يمر الاعصاب عندما لم يكن لديهم القطر المناسب التنازلات جميع الخطوات التالية.
6. تمرير من الاعصاب
ملاحظة: يمكن تطبيق البروتوكول التالي لتوسيع كل من SVZ و DG الاعصاب.
- لمرور الاعصاب، وجمع SFM مع عوامل النمو التي تحتوي على الاعصاب من 60 ملم طبق (es) والطرد المركزي لمدة 5 دقيقة في 300 × ز.
- تخلص من supernatant وإعادة تعليق بيليه الغلاف العصبي باستخدام مجموعة التفكك الكيميائي (الماوس) وفقًا لتعليمات الشركة المصنعة(جدول المواد).
ملاحظة: لاحظ أوقات الحضانة على وجه التحديد لأنها حاسمة للأداء. - الطرد المركزي لمدة 5 دقيقة في 300 × ز،وإزالة supernatant وإضافة 1 مل من SFM تكملها 10 نانوغرام / مل EGF و 5 نانوغرام / مل bFGF.
- تُرتِب صعوداً وهبوطاً حوالي 10 x مع ماصة P1000 لفصل الخلايا العصبية.
- عد عدد الخلايا باستخدام محلول يحتوي على 0.2٪ Trypan الأزرق ومقياس الخلايا الدم.
- إعادة زرع الخلايا بكثافة 2 × 104 خلايا / مل في أطباق بيتري غير المصقولة 60 مم.
- احتضان خلايا SVZ وDG لمدة 6-8 أيام و 10-12 يومًا على التوالي للحصول على الخلايا العصبية الثانوية ، عند 37 درجة مئوية مع 5٪ CO2.
ملاحظة: يمكن الوصول إلى قدرة التجديد الذاتي لـ NSPCs المشتقة من SVZ و DG بواسطة القسمين البروتوكولين 5 و6 التاليين. لذلك، البذور SVZ وDG الخلايا بكثافة 1.0 × 104 خلايا / مل (في لوحات غير المصقول 24 بئر) في نمو SFM المتوسطة التي تحتوي على 5 نانوغرام / مل EGF و 2.5 نانوغرام / مل bFGF (منخفضة EGF / bFGF). عد عدد المجالات العصبية الأولية والثانوية الناتجة.
7- تخزين المجالات العصبية
- جمع الوسط الذي يحتوي على الاعصاب (التي تم الحصول عليها من الخطوتين 5.3 و 6.7) من أطباق بيتري 60 مم.
- الطرد المركزي لمدة 5 دقيقة في 300 × ز والتخلص من supernatant.
- غسل الخلايا 2x مع 1 مل من HBSS (5 دقيقة في 300 × ز).
- الطرد المركزي لمدة 5 دقيقة في 300 × ز، والتخلص من supernatant وتخزين بيليه من الخلايا العصبية في -20 درجة مئوية لتحليل البيولوجيا الجزيئية.
8. PDL لوحة طلاء الإجراء
- لإعداد الحل 1 (0.1 M بورات المخزن المؤقت)، تزن 3.92 غرام من حمض البوريك وتمييع في 400 مل من المياه عالية النقاء. ضبط درجة الحموضة إلى 8.2 وجعل ما يصل إلى 500 مل مع ارتفاع درجة النقاء المياه.
- لإعداد الحل 2 (0.167 M بورات المخزن المؤقت)، تزن 10.3 غرام من حمض البوريك وتمييع في 900 مل من المياه عالية النقاء. ضبط درجة الحموضة إلى 8.2 وجعل ما يصل إلى 1000 مل مع ارتفاع درجة النقاء المياه.
- لإعادة تشكيل بولي-D-ليسين (PDL) (1 ملغ/مل في 0.1 M بورات المخزن المؤقت)، تمييع 100 ملغ من PDL في 100 مل من الحل 1.
- جعل aliquots من 10 مل لاستخدامها على الفور أو تجميد وتخزينها في -20 درجة مئوية.
- تحت تدفق اللامينار، أضف قسيمة غطاء واحدة لكل بئر وتعقيمها تحت ضوء الأشعة فوق البنفسجية لمدة 15 دقيقة.
- استخدام PDL المعاد تشكيلها أو ذوبان المجمدة PDL المعاد تشكيلها.
- إعداد الحل النهائي من 100 ميكروغرام/مل PDL في 0.167 M بورات المخزن المؤقت بإضافة 10 مل من PDL المعاد تشكيلها إلى 90 مل من الحل 2.
- إضافة الحل النهائي إلى الآبار لمدة لا تقل عن 2 ساعة إلى بين عشية وضحاها في 37 درجة مئوية.
ملاحظة: بالنسبة للوحات 24 بئر، أضف حجمًا قدره 500 ميكرولتر في كل بئر. - إزالة الحل وغسل 3x مع ارتفاع نقاء المياه.
- دع الأغطية تجف في غطاء تدفق اللامينار.
- ترك لوحات ثقافة متعددة الآبار في 4 °C.
9. PDL / لامينين لوحة طلاء الإجراء
- في اليوم الأول، اغطي الأطباق بـ PDL كما هو موضح في القسم 8.
- في اليوم الثاني، قم بإزالة محلول PDL واغسل 3x بالماء عالي النقاء. دع يجف.
- إعداد 5 ميكروغرام / مل لامينين في SFM الباردة خالية من عوامل النمو.
- إضافة الصفيحة المذابة إلى coverslips واحتضان في 37 درجة مئوية بين عشية وضحاها.
ملاحظة: بالنسبة للوحات 24 بئر، أضف حجمًا قدره 500 ميكرولتر في كل بئر. - إزالة اللامينين باستخدام ماصة.
ملاحظة: لا تغسل قسائم الغطاء من الصفيحة. - استخدام فورا أو تخزين في -20 درجة مئوية.
10. بولي L-ornithine (منظمة التحرير الفلسطينية) / إجراء طلاء اللامينين
- تحت تدفق اللامينار، أضف قسيمة غطاء واحدة لكل بئر وتعقيمها تحت ضوء الأشعة فوق البنفسجية لمدة 15 دقيقة.
- أضف 0.01% حل منظمة التحرير الفلسطينية إلى كل بئر لمدة 20 دقيقة في درجة حرارة الغرفة (RT).
ملاحظة: بالنسبة للوحات 24 بئر، أضف حجمًا قدره 500 ميكرولتر في كل بئر. - إزالة المحلول وغسل 3x مع تعقيم 1x PBS. دع يجف.
- إعداد 5 ميكروغرام / مل لامينين في 1x PBS العقيمة.
- احتضان لمدة 2 ساعة في 37 درجة مئوية.
- إزالة اللامينين.
ملاحظة: لا تغسل قسائم الغطاء من الصفيحة. - استخدام على الفور.
ملاحظة: تأكد من تغطية الغطاء بالكامل بواسطة حل منظمة التحرير الفلسطينية عن طريق النقر بلطف على قسيمة الغطاء مع طرف ماصة. عندما اهتزت، لوحات متعددة جيدا ينبغي أن تجعل أي صوت.
11. تقييم الخلايا النيورية عن طريق توليد طبقة أحادية متمايزة من الخلية
- جمع وسائل الإعلام التي تحتوي على الاعصاب من أطباق بيتري 60 ملم (التي تم الحصول عليها من القسم 5) والطرد المركزي لمدة 5 دقيقة في 300 × غرام في RT.
- تجاهل supernatant وانفصام بيليه من الخلايا العصبية في 1 مل من PBS الفصام (أي ، PBS دون ملغ2 +/ Ca2 + ومع EDTA [2.7 mM KCl، 1.5 mM KH2PO4،137 mM NaCl، 8.1 mM Na2HPO4 و 0.5 mM EDTA 4Na، في درجة الحموضة = 7.40]) عن طريق الحضانة لمدة 15 دقيقة تليها التفكك الميكانيكي. بدلا من ذلك، فصل الخلايا العصبية باستخدام مجموعة التفكك الكيميائية (الماوس)(جدول المواد).
- الطرد المركزي لمدة 5 دقيقة في 300 × ز في RT والتخلص من supernatant.
- إعادة تعليق بيليه الخلية في 1 مل من SFM خالية من عوامل النمو.
- تحديد كثافة الخلية باستخدام مقياس الخلايا.
- تمييع تعليق الخلايا المنفصلة في SFM خالية من عوامل النمو بكثافة 3,766 خلية/سم2 وخلايا الصفائح على الألواح الزجاجية المغلفة في لوحات 24 بئر.
- بعد 1-3 أيام، قم بإصلاح خلايا كيمياء الخلايا المناعية مقابل بروتين الهيكل الخلوي (انظر القسم 14).
12- التمايز بين ثقافات الغلاف العصبي
ملاحظة: يمكن تمييز الخلايا العصبية التي يتم الحصول عليها من توسع الخلايا، إما من الخلايا العصبية الأولية أو المنقاة (التي تم الحصول عليها في القسمين 5 أو 6) إلى خلايا من أنساب عصبية مختلفة.
- عندما يكون قطر الألواح العصبية 150-200 ميكرومتر، اجمع 25 ميكرولتر من متوسط تعليق الغلاف العصبي وطبقه على ألواح زجاجية مغلفة، في لوحات 24 بئر.
ملاحظة: لجمع المزيد من الاعصاب، قم بتدوير طبق بيتري بلطف لتركيز الاعصاب في المركز. ثم، ماصة من المركز. - وضع لوحات في حاضنة في 37 درجة مئوية لمدة 15 دقيقة بحيث الاعصاب الالتزام الركيزة. بعد ذلك، أضف 500 ميكرولتر من SFM خالية من عوامل النمو (الظروف المتباينة).
- بعد 24 ساعة، استبدل المتوسط بـ SFM جديدة خالية من عوامل النمو.
- تمييز لنقاط زمنية مختلفة (على سبيل المثال، 2 و 7 أيام في المختبر، DIV2 و DIV7، على التوالي) مع 5٪ CO2 و 95٪ الهواء الجوي عند 37 درجة مئوية.
ملاحظة: يمكن تحليل بقاء الخلية وانتشارها والتمايز باستخدام مُنازِم اتّسالات مختلفة.
13. الخلايا البيولوجيا المقالات
- الخلايا البقاء على قيد الحياة say
- كشف الخلايا العصبية مطلي إلى 3 ميكروغرام / مل يوديد البوليد (PI) لمدة 30 دقيقة قبل تثبيت الخلية في الحاضنة في 37 درجة مئوية.
ملاحظة: PI هو عامل autofluorescent التي هي قادرة فقط على دخول الخلايا مع سلامة غشاء للخطر8. يمكن استخدام طرق أخرى لتحليل بقاء الخلية مثل تلطيخ الكاسباس 3 أو فحص deoxynucleotidyl transferase dUTP nick-end (TUNEL).
- كشف الخلايا العصبية مطلي إلى 3 ميكروغرام / مل يوديد البوليد (PI) لمدة 30 دقيقة قبل تثبيت الخلية في الحاضنة في 37 درجة مئوية.
- احسب انتشار الخلية
- كشف الألواح العصبية المطلية إلى 10 ميكرومتر 5-برومو-2'-ديوكسوريدين (BrdU) لمدة 4 ساعة قبل التثبيت في الحاضنة عند 37 درجة مئوية.
ملاحظة: BrdU هو تناظرية الثيميدين الاصطناعية التي يمكن دمجها أثناء تخليق الحمض النووي في الخلايا المنتشرة9.
- كشف الألواح العصبية المطلية إلى 10 ميكرومتر 5-برومو-2'-ديوكسوريدين (BrdU) لمدة 4 ساعة قبل التثبيت في الحاضنة عند 37 درجة مئوية.
- الخلايا التمايز القول
- كشف الألواح العصبية المطلية التي يبلغ عمرها 7 أيام إلى 10 ميكرومتر برداو في أول 24 ساعة، في الحاضنة عند 37 درجة مئوية.
- تجديد SFM خالية من عوامل النمو (الظروف المتباينة) والسماح للخلايا لتطوير في غياب BrdU لمدة 6 أيام التالية حتى التثبيت.
ملاحظة: تسمح هذه التجارب التي تطارد النبض، من خلال وضع علامات للخلايا العصبية الناضجة، بتقييم الخلايا السلف التي تفرق إلى خلايا ناضجة أثناء البروتوكول.
14- التمنيّات المناعية لثقافات الغلاف العصبي
- تثبيت الخلية
- إعداد 4٪ بارافورمالديهايد (PFA) في 1x PBS وتخزينها في 4 درجة مئوية أو -20 درجة مئوية.
- إزالة SFM خالية من عوامل النمو من الآبار وإضافة، إلى كل بئر، 500 ميكرولتر من 4٪ PFA في 4 درجة مئوية لمدة 20 دقيقة في RT.
- غسل 3x مع 1x PBS، لمدة 5 دقيقة في كل مرة، coverslips تحتوي على العصور العصبية المتمايزة.
- تخزين coverslips حتى استخدامها في 500 ميكرولتر من 1x PBS في 4 درجات مئوية.
ملاحظة: إذا لم يكن لدى التجربة BrdU، انتقل إلى الخطوة 14.3.
- طريقة التسخ (لتجارب BrdU فقط)
- إعداد 1 M HCl عند 37 درجة مئوية.
- شطف coverslips 3x في 1x PBS.
- خلايا Permeabilize لمدة 30 دقيقة في برنامج تلفزيوني تحتوي على 1٪ السطحي غير الأيونية (على سبيل المثال، تريتون X-100).
- DsDNA التشوه مع 1 M HCl ساخنة مسبقا إلى 37 درجة مئوية لمدة 30-40 دقيقة في 37 درجة مئوية (~ 300 μL/well).
- غسل الآبار 4x مع 1x PBS.
- Permeabilization وحجب
- شطف coverslips في 1x PBS لمدة 5 دقيقة.
- احتضان لمدة 1.5 ساعة مع 0.5٪ السطحي غير الأيونية و3٪ الزل المصل البقري (BSA) في 1x PBS (~ 300 μL/well).
ملاحظة: لNeuN، استخدم 6٪ BSA في 1x PBS.
- الحضانة والتركيب
- في اليوم 1، دون غسل، الخلايا المحتضنة مع الأجسام المضادةالأولية (جدول المواد)في 0.1٪ السطحي غير الأيونية و 0.3٪ BSA في 1x PBS في غرفة الحضانة (للوحات 24 بئر استخدام 20 ميكرولتر / بئر). ترك coverslips الحضانة بين عشية وضحاها في ضوء 4 درجة مئوية محمية إذا كانت الأجسام المضادة مترافقة مع الفلوروفور.
- في اليوم 2، عودة coverslips إلى الآبار الخاصة بهم وشطف 3x في 1x PBS لمدة 5 دقيقة.
- مضاد مع الفلورسينس المناسب الأجسام المضادة الثانوية (تخفيف 1:200) ومع 12 ميكروغرام / مل هويشت 33342 في 1x PBS لمدة 2 ساعة في RT والضوء المحمي في غرفة الحضانة (20 ميكرون/ coverslip).
- غسل coverslips 3x في 1x PBS لمدة 5 دقيقة.
- جبل coverslips على شرائح المجهر باستخدام 5 μL / coverslip من الفلورسence تصاعد المتوسطة.
- دع التغطيات الهواء الجاف في RT، محمية من الضوء، لمدة يوم واحد.
- مجهريه
- عرض الصور والحصول عليها باستخدام مجهر الفلورسينس.
- لكل شرط، استخدم ثلاثة نسخ متماثل. تنفيذ تعداد الخلايا في خمسة حقول مجهرية مستقلة في كل غطاء مع هدف 40x (~ 100 خلية لكل حقل).
15. إعداد حلول الأسهم EGF وbFGF
- حل أسهم EGF
- لإعادة تشكيل EGF lyophilized، تمييع المنتج في مياه النقاء العالية للوصول إلى تركيز نهائي قدره 20 ميكروغرام/مل.
- Aliquot وتخزينها في الأنابيب الدقيقة في -5 إلى -20 درجة مئوية.
- حل أسهم bFGF
ملاحظة: يجب إعادة تشكيل bFGF مع حل من 10 mM تريس، درجة الحموضة 7.6.- طرد مركزي القارورة لفترة وجيزة قبل فتح لجلب المحتوى إلى القاع.
- إعداد 50 مل من 10 mM تريس، درجة الحموضة 7.6. لذلك، تزن 60.57 ملغ من تريس ((HOCH2)3CNH2)وتمييع في 40 مل من الماء عالية النقاء. ضبط درجة الحموضة إلى 7.6 وجعل ما يصل إلى 50 مل مع ارتفاع درجة النقاء المياه.
- إعداد 10 مل من 0.1٪ BSA في 10 mM Tris، درجة الحموضة 7.6. لذلك, تزن 10 ملغ من BSA وتمييع في 10 مل من 10 mM تريس.
- حلول التصفية المعدة في الخطوتين 15.2.2 و 15.2.3 مع فلتر 0.22 ميكرومتر تحت غطاء تدفق لامينار.
- إعادة تشكيل 10 ميكروغرام من bFGF في 1000 ميكرولتر من 0.1٪ BSA في 10 mM Tris مع درجة الحموضة 7.6 للوصول إلى تركيز نهائي قدره 10 ميكروغرام /مل. Aliquot في microtubes في -20 درجة مئوية لمدة أقصاها 6 أشهر.
النتائج
تتكون SVZ و DG neurospheres ، التي تم الحصول عليها باستخدام NSA ، من خلايا غير متمايزة ، إيجابية لـ Sox2 ، وهو عامل النسخ الذي ينطوي عليه قدرة التجديد الذاتي وإيجابي للنيشتين ، وهو بروتين خيوط متوسط يتم التعبير عنه في NSPCs(الشكل 1A). بالإضافة إلى ذلك ، فإن المجالات العصبية المشتقة من SVZ لها أبعاد أكبر من نظيراتها في DG(الشكل 1A). الأهم من ذلك ، في ظروف متباينة ، SVZ - وDG المشتقة NSPCs الهجرة من الخلايا العصبية تشكيل pseudomonolayer من الخلايا(الشكل 1باء).
للوصول إلى قدرة التجديد الذاتي ، يتم إجراء المقازة زوج الخلية استنادًا إلى تعبير Sox2 و nestin الذي يميل إلى الاختفاء في الخلايا المنقسمة التي تبدأ عملية التمايز مع مزيج من علامة النسب العصبي وهي DCX. في كلتا المنطقتين العصبية، من الممكن مراقبة وجود Sox2+/+/nestin+/+/DCX-/- الانقسامات المتماثلة (التجديد الذاتي)(الشكل 2A1، B1)،Sox2-/+/nestin-/+/DCX+/- أقسام غير متناظرة(الشكل 2A1، B2)وSox2-/-/nestin-/-/DCX+/+ أقسام متناظرة (تمايز)(الشكل 2A2، B1).
تمرير الاعصاب يزيد من غلة NSPCs; ومع ذلك، موت الخلية في DIV2 التغييرات مع تمرير. في الواقع ، يتم زيادة النسبة المئوية للخلايا إيجابية PI مع مرور الخلية في SVZ (P0: P0: 15.6٪ ± 1.2٪ مقابل P1: 19.2٪ ± 2.7٪ مقابل P2: 32.35٪ ± 0.14٪ مقابل P3: 39.6٪ ± 4.0٪ وفي DG (P0: 16.31٪ ± 0.95٪ مقابل P1: 32.1٪ ± 1.7٪ مقابل P2: 27.42٪ مقابل P3: 32.2٪ ± 3.1٪) (الشكل3).
يمكن تقييم الخلايا العصبية النيأوريتومجينيسيس في الخلايا العصبية التي تم الحصول عليها من التمايز SVZ و DG NSPCs في بداية التمايز: DIV1(الشكل 4A, D)، DIV2(الشكل 4B, E)و DIV3(الشكل 4C, F). في الواقع ، كما لوحظ في الشكل 4، يزيد طول وتشعبات النتريت مع التمايز.
ويمكن تقييم انتشار الخلايا في المجالات العصبية المشتقة من SVZ وDG. مقارنة الخلايا العصبية المتمايزة الأولية في DIV1 من SVZ(الشكل 5A1)و DG(الشكل 5A2)، فإن النسبة المئوية للخلايا الإيجابية بـ BrdU أعلى في SVZ منها في DG (SVZ: 6.15٪ ± 0.64٪ مقابل DG: 3.27٪ ± 0.13٪؛ p & 0.05؛ n = 4؛ الشكل 5A3). وعلاوة على ذلك، يمكن أيضا الوصول إلى التمايز الخلية عن طريق الجمع بين تلطيخ BrdU مع صانع ناضجة مثل نواة الخلايا العصبية (نيوان) الذي يحدد الخلايا العصبية الناضجة(الشكل 5B1، B2). ويبين الشكل 5B3 أن النسبة المئوية للذريات المنتشرة التي تميز في الخلايا العصبية الناضجة مماثلة في SVZ و DG (SVZ: 12.04٪ ± 1.58٪ مقابل DG: 13.56٪ ± 0.48٪؛ p > 0.05؛ n = 4).
يمكن الوصول إلى الصلابة والفعالية المتعددة لـ NSPCs المشتقة من SVZ وDG باستخدام وكالة الأمن القومي من خلال تقييم التعبير عن علامات مختلفة في أيام تمايز مختلفة (DIV2 و DIV7). في الواقع ، NSCs (النشاش والبروتين الحمضي الببري ليفي [GFAP] - الخلايا المزدوجة إيجابية) موجودة في كل من المناطق العصبية(الشكل 6A، G). هذه الخلايا قادرة على التفريق في الخلايا العصبية غير ناضجة (الخلايا الإيجابية DCX)(الشكل 6B, H),الخلايا العصبية الناضجة (الخلايا الإيجابية نيوني)(الشكل 6F, L),خلايا السلائف oligodendrocyte (الخلايا العصبية الدبقية 2 [NG2] والصفائح الدموية المستمدة عامل النمو مستقبلات α [PDGFRα]- الخلايا الإيجابية)(الشكل 6C, I),ناضجة oligodendrocytes (المايليين البروتين الأساسي [MBP]-الخلايا الإيجابية)(الشكل 6E, K)والخلايا الفلكية (خلايا GFAP إيجابية)(الشكل 6D, J).
يمكن استخدام ركائز مختلفة لمعطف coverslips لتشكيل pseudomonolayer من الخلايا في ظل ظروف متباينة. كما هو موضح في الشكل التكميلي 1، تهاجر خلايا DG أكثر عندما يكون لدى coverslips طلاء إضافي مع اللامينين مع منظمة التحرير الفلسطينية أو PDL من PDL وحده(الشكل التكميلي 1B−H). في الواقع، عندما يتم استخدام PDL واللامينين معا كركائز(الرقم التكميلي 1C، G)،خلايا DG تشكل pseudomonolayer أكثر تعامي من خلايا SVZ التي يتم استخدام PDL وحدها(الرقم التكميلي 1A، E).
والأهم من ذلك أن هذه النتائج تظهر قدرة وكالة الأمن القومي على تقييم خصائص الصلابة والقدرات المتعددة لـ NSCs المستمدة من المنافذ العصبية الرئيسية.

الشكل 1: المنطقة تحت البطين ية والدنات جيروس المستمدة NSPC المستزرعة كدراسات عصبية أو كما pseudomonolayers. (أ)ممثل برايتفيلد(A1، A3)وfluorescence(A2، A4)صور من SVZ- وDG المستمدة من الاعصاب، حيث كانت ملطخة النوى مع هويشت 33342 (الأزرق) وNSCs لSox2 (الأخضر) والنشاش (الأحمر). (B)صور ساطعة تمثيلية لطبقات الصوت الزائفة المتولدة من المجالات العصبية المشتقة من SVZ وDG في ظل ظروف متباينة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: احسب زوج الخلية. صور الفلورسينس التمثيلية لأزواج الخلايا المشتقة من انقسام الخلايا السلف. كانت نواة SVZ و DG ملطخة بـ Hoechst 33342 (الأزرق) والخلايا الجذعية الشبيهة بـ Sox2 (الأحمر) والنشاش (أبيض) بالإضافة إلى الخلايا العصبية غير الناضجة مع DCX (الأخضر). تشير رؤوس الأسهم في الألواح A1 و B1 إلى Sox2+/+/ nestin+/+/ DCX-/- الانقسامات المتماثلة للتجديد الذاتي، تشير الأسهم في الألواح A1 و B2 إلى Sox2+/-/nestin+/-/DCX-/+ تقسيمات غير متناظرة، سهام خط متقطعة في الألواح A2 وB1 تظهر Sox2-/-/nestin-/--DCX+/+ تقسيمات متناظرة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تحليل بقاء الخلية مع تمرير الخلية. التحليل الكمي للخلايا الإيجابية PI في DIV2 في SVZ- وDG المستمدة من ثقافة الخلايا العصبية المتمايزة، بعد 0 و 1 و 2 و 3 مقاطع (P0-P3). يتم التعبير عن البيانات على أنها متوسط ± SEM، n = 1−8. PI = البوليديوم يوديد. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
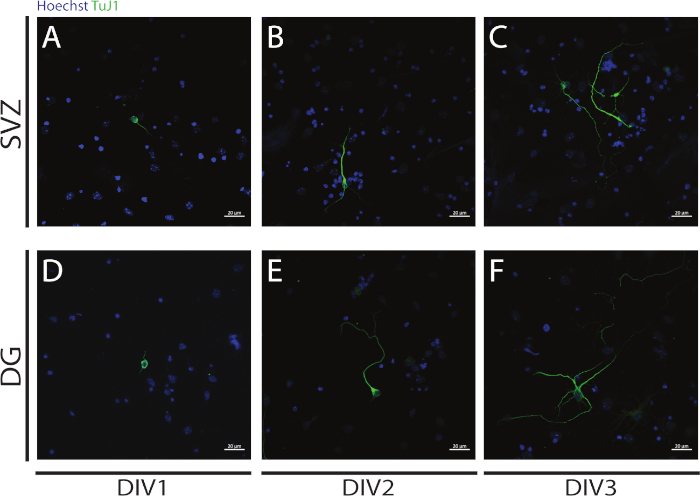
الشكل 4: تحليل تكوين النيلوريات في DIV 1 و 2 و 3. ممثل الصور الفلورية confocal من neurites, التي حددتها إشارة αIII-tubulin, في الخلايا العصبية SVZ و DG في(A, D)DIV1,(B, E)DIV2, و(C, F)DIV3. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
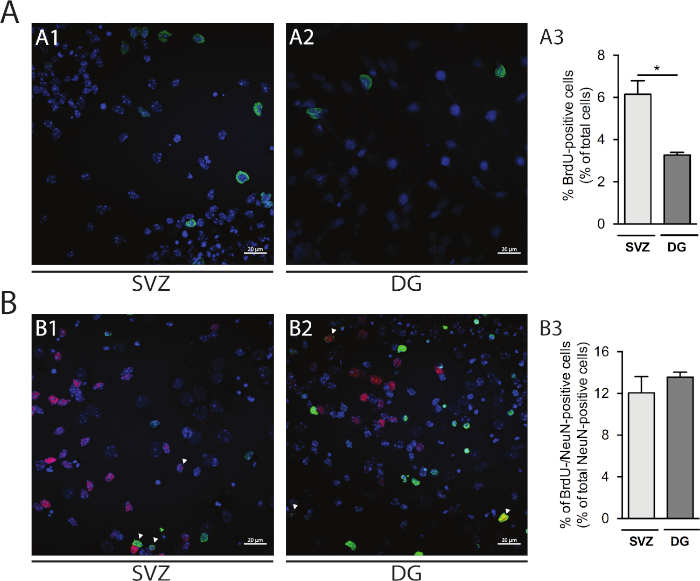
الشكل 5: القول بانتشار الخلايا. صور تمثيلية من الخلايا الإيجابية BrdU في DIV1 في (A1) SVZ و (A2) DG. (A3) التحليل الكمي للخلايا الإيجابية بـ BrdU في DIV1 في DG - و SVZ المستمدة من ثقافة الخلايا العصبية المتمايزة. يتم التعبير عن البيانات على أنها متوسط ± SEM، n = 4. * ع < 0.05 عن طريق اختبار تي. صور الفلورسينس التمثيلية للخلايا الإيجابية لـ BrdU وNeuN في DIV7 في(B1)SVZ و(B2)DG. تشير رؤوس الأسهم إلى خلايا BrdU-/NeuN-positive. (B3) التحليل الكمي للخلايا الإيجابية BrdU/NeuN في DIV7 في كلا المجالين. يتم التعبير عن البيانات على أنها متوسط ± SEM، n = 4. BrdU: 5-برومو-2'-deoxyuridine، الاصطناعية الثيميدين التماثلية. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: أنواع الخلايا العصبية الموجودة في استزراع الغلاف العصبي المتمايز المشتق من SVZ وDG. صور الفلورسينس التمثيلية لأنواع الخلايا المشتقة من SVZ و DG بعد 2 و 7 أيام من تمايز الغلاف العصبي (DIV2 و DIV7) ، حيث كانت نواة الخلايا ملطخة بـ Hoechst 33342 (الأزرق) و:(A، G)NSCs لGFAP (الأخضر) والنشاش (الأحمر) (B ، H) الخلايا العصبية غير الناضجة لDCX (الأخضر),(C, I)خلايا السلائف oligodendrocyte لPDGFRα (الأخضر) وNG2 (الأحمر),(D, J)الخلايا الفلكية لGFAP (الأخضر),(E, K)oligodendrocytes ناضجة لMBP (الأخضر), و(F, L)الخلايا العصبية ناضجة لنوين (أحمر). يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
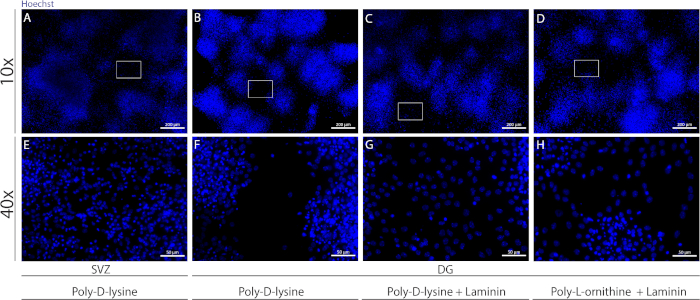
الشكل التكميلي 1: اختبار ركائز مختلفة للالتزام بالغلاف العصبي والهجرة لتشكيل طبقة زائفة. صور الفلورسين التمثيلية لـ(A, E)SVZ المشتقة من الـ pseudomonolayer باستخدام البولي د-ليسين كركيزة،(B, F)DG المشتقة pseudomonolayer باستخدام البولي D-ليسين كركيزة,(C, G)DG المشتقة من pseudomonolayer باستخدام البولي D-lysine مع اللامينين كركيزة, و (D, H)DG المشتقة من pseudomonolayer باستخدام البولي د-ليسين مع بولي-L-ornithine كركيزة. يرجى الضغط هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
في النظم المختبرية من NSPCs تسمح فهم أفضل للآليات الخلوية والجزيئية، والتي يمكن التحقق من صحتها في الجسم الحي. وكالة الأمن القومي هي طريقة قوية جدا لمحاكاة الظروف الفسيولوجية بسبب هيكلها ثلاثي الأبعاد. وعلاوة على ذلك، هذا النظام الثقافي هو أيضا أسهل من الناحية الفنية للثقافة10، بالمقارنة مع غيرها من النظم في المختبر مثل نظام ثقافة أحادية الطبقات. في الواقع ، مع وكالة الأمن القومي ، من السهل التحكم في الإشارات الخارجية المكشوفة أثناء تطور الخلايا ، إما أثناء التوسع أو مرحلة التمايز ، عن طريق إضافة كميات دقيقة ومتغيرة من العوامل التي تهم وسائل الإعلام وكذلك عن طريق زراعة الخلايا العصبية مع أنواع الخلايا الأخرى6. وعلاوة على ذلك، بالمقارنة مع الثقافات أحادية الطبقة، في وكالة الأمن القومي، فمن الممكن الحصول على كثافة أعلى الخلية من كمية صغيرة من الأنسجة أو مع عدد قليل من الخلايا، مما يسمح بإجراء دراسات موازية، وبالتالي تقليل عدد الحيوانات1.
وكالة الأمن القومي هي الطريقة الأكثر شيوعا لعزل وتوسيع NSCs11،12،13، يمكن استخدامها لتقدير عدد الخلايا السلائف الموجودة في عينة نسيج معين5 وتردد الخلايا السليفة بين الظروف المختلفة. ومع ذلك، كل من الثقافات العصبية والثقافات أحادية الطبقات لا تأخذ في الاعتبار لnSCs التكويسين14. وعلاوة على ذلك، فإن وكالة الأمن القومي لديها بعض القيود11،,12،,13 ويعتمد تردد الغلاف العصبي الناتج على العديد من العوامل بما في ذلك المكونات المتوسطة، وإجراءات التشريح، وعملية التفكك11،,12،,13،وتجميع الغلاف العصبي5. والواقع أن المجالات العصبية تميل إلى التجميع في ثقافة عالية الكثافة. وبالتالي، يجب توخي الحذر عند تقدير عدد الخلايا السليفة في العينة. للتغلب على القيود المذكورة أعلاه، يمكن أيضا توسيع NSPCs معزولة ومرورها في أحادية5،15. والأهم من ذلك، استخدام وكالة الأمن القومي لمقارنة تردد الخلايا السليفة بين ظروف مختلفة مفيد جدا ودقيق لأن كل هذه القيود ضمنية ومتشابهة بين جميع الشروط التي أجريت في نفس التجربة.
هناك خطوات حاسمة في ثقافة الغلاف العصبي التي تحتاج إلى الاهتمام. في خطوة حصاد الدماغ ، والإزالة الكاملة للmeninges والعزلة الجيدة للمحاريب العصبية ضرورية لتحقيق أقصى قدر من نقاء وغلة NSPCs. أثناء انفصال الأنسجة ، بسبب النشاط البروتيني للتريبسين ، يمكن أن يؤدي الاستخدام المفرط للتريبسين أو أوقات الحضانة الأطول إلى التحلل الخلوي. وعلاوة على ذلك، فإن يوم المرور أمر بالغ الأهمية للحصول على سكان أصحاء من الاعصاب. الممرات العصبية مع قطر أعلى من 200 ميكرون يؤثر بشكل كبير على قدرة البقاء، التكاثرية والتفريقية من NSPCs. والأهم من ذلك، دورات أطول من الممرات، أكثر من 10 يمكن أن تزيد من عدم الاستقرار الوراثي6. وعلاوة على ذلك، طلاء مع PDL وPLD / laminin لخلايا SVZ وDG، على التوالي، أمر ضروري لضمان هجرة الخلايا جيدة من الخلايا العصبية دون المساس بعملية التمايز. من حيث تحليل الكيمياء المناعية ، يمكن لأوقات الحضانة الأطول مع PFA أن تعرض تلطيخًا للخطر عن طريق إخفاء المستضدات وزيادة الخلفية.
وكالة الأمن القومي هي أداة قوية لتوفير مصدر ثابت وغير محدود من NSPCs للدراسات المختبرية للتنمية العصبية والتمايز وكذلك للأغراض العلاجية16،17. في الواقع، يمكن تطبيق هذا القول على النماذج الوراثية والسلوكية لمزيد من فهم الآليات الجزيئية والخلوية التي ينطوي عليها انتشار NSPC والتمايز18,19. هذا المقاهى مفيد أيضا لاختبار مختلف الأدوية والمركبات20،21،22 وكذلك لتنفيذ التلاعب الجيني19،23 لتعديل خصائص NSC. بالإضافة إلى الكيمياء المناعية، يمكن إجراء تفاعل سلسلة البوليميراز النسخ العكسي وتحليل لطخة الغربية للوصول إلى الحمض النووي الريبي والتعبير البروتيني، في حين يمكن استخدام الدراسات الكهروفيزيولوجية والتصوير الكالسيوم لتقييم وظيفة الخلايا العصبية المولودة حديثا21.
Disclosures
وليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
تم دعم هذا العمل من قبل IF/01227/2015 وUID/BIM/50005/2019، projeto financiado بيلا فونداساو بارا سيينسيا إي تكنولوغيا (FCT)/ Ministério da Ciência, Tecnologia e Ensino Superior (MCTES) através de Fundos do Orçamento de Estado. R.S. (SFRH/BD/128280/2017، F.F.R. (IMM/CT/35-2018)، D.M.L. (PD/BD/141784/2018)، وR.S.R. (SFRH/BD/129710/2017) حصلت على زمالة من FCT. يود المؤلفان أن يشكرا أعضاء مرفق التصوير الحيوي في معهد ميديسينا الجزيئي جواو لوبو أنتونز على المساعدة في الفحص المجهري.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA (1X) | Gibco | 25300-054 | |
| 0.4% Trypan Blue solution | Sigma-Aldrich | T8154-20ML | |
| 12mm Glass coverslips | VWR | 631-1577 | |
| 15mL Centrifuge Tube | Corning | 430791 | |
| 5-bromo-2'-deoxyuridine | Sigma-Aldrich | B9285-1G | |
| 50 mL Centrifuge Tube | Corning | 430829 | |
| 70% Ethanol | Manuel Vieira & Cª (Irmão) Sucrs, Lda | UN1170 | |
| Adhesion slides, Menzel Gläser, SuperFrost Plus | VWR | 631-9483 | |
| Alexa Fluor 488 donkey anti-chicken IgG (H+L) | Life Technologies | A11039 | |
| Alexa Fluor 488 donkey anti-rabbit IgG (H+L) | Life Technologies | A21206 | |
| Alexa Fluor 488 donkey anti-rat IgG (H+L) | Life Technologies | A21208 | |
| Alexa Fluor 568 donkey anti-mouse IgG (H+L) | Life Technologies | A10037 | |
| Alexa Fluor 568 donkey anti-rabbit IgG (H+L) | Life Technologies | A10042 | |
| Alexa Fluor 647 goat anti-mouse IgG (H+L) | Life Technologies | A21235 | |
| Anti-5-Bromo-2-Deoxyuridine | Dako | M0744 | |
| Anti-CD140a (PDGFRα) (rat) | BD Biosciences | 558774 | Dilute at a ratio 1:500. |
| Anti-Chondroitin Sulphate Proteoglycan NG2 (rabbit) | Merck Milipore | AB5320 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (rabbit) | Abcam | ab18723 | Dilute at a ratio 1:200. |
| Anti-Doublecortin (chicken) | Synaptic Systems | 326006 | Dilute at a ratio 1:500. |
| Anti-Glial Fibrillary Acidic Protein (rabbit) | Sigma-Aldrich | G9269-.2ML | Dilute at a ratio 1:1000. |
| Anti-Myelin Basic Protein (rabbit) | Cell Signalling Technology | 78896S | Dilute at a ratio 1:200. |
| Anti-Nestin (mouse) | Merck Milipore | MAB353 | Dilute at a ratio 1:200. |
| Anti-Neuronal Nuclei (mouse) | Merck Milipore | MAB377 | Use 6% BSA in PBS 1X. Dilute at a ratio 1:400. |
| Anti-SOX2 (rabbit) | Abcam | ab97959 | Dilute at a ratio 1:500. |
| Anti-Tubulin β3 (rabbit) | BioLegend | 802001 | Dilute at a ratio 1:200. |
| Axiovert 200 wide field microscope | ZEISS | ||
| B-27 Supplement (50X), serum free | ThermoFisher | 17504044 | |
| Boric Acid | Sigma-Aldrich | B6768-500g | |
| Bovine Serum Albumin | NZYTech | MB04602 | |
| Cell counting chamber, Neubauer | Hirschmann | 8100104 | |
| Cell culture CO2 incubator | ESCO | CCL-170B-8 | |
| Corning Costar TC-Treated 24 Multiple Well Plate | Corning | CLS3524-100EA | |
| di-Sodium hydrogen phosphate dihydrate | Merck Milipore | 1.06580.1000 | |
| DMEM/F-12, GlutaMAX Supplement | ThermoFisher | 31331028 | |
| Dumont #5 - Fine Forceps | FST | 11254-20 | |
| Dumont #5S Forceps | FST | 11252-00 | |
| Dumont #7 Forceps | FST | 11272-30 | |
| Epidermal growth factor | ThermoFisher | 53003018 | |
| Fibroblast growth factor | ThermoFisher | 13256029 | |
| Filter papers | Whatman | 1001-055 | |
| Fine Scissors - Sharp | FST | 14060-09 | |
| Gillete Platinum 5 blades | Gillette | ||
| HBSS, no calcium, no magnesium | ThermoFisher | 14175053 | |
| Hoechst 33342 | Invitrogen | 1399 | |
| Hydrochloric acid | Merck Milipore | 1.09057.1000 (1L) | |
| Labculture Class II Biological Safety Cabinet | ESCO | 2012-65727 | |
| Laminin | Sigma-Aldrich | L2020 | |
| McILWAIN Tissue Chopper | The Mickle Laboratory Engineering CO. LTD. | MTC/2 | Set to 450 μm |
| Micro Spatula - 12 cm | FST | 10091-12 | |
| Micro tube 0.5 mL | SARSTEDT | 72.699 | |
| Micro tube 1.5 mL | SARSTEDT | 72.690.001 | |
| Micro tube 2.0 mL | SARSTEDT | 72.691 | |
| NeuroCult Chemical Dissociation Kit (Mouse) | Stem Cell | 5707 | |
| Olympus microscope SZ51 | Olympus | SZ51 | |
| Paraformaldehyde, powder | VWR | 28794.295 | |
| Penicillin-Streptomycin | ThermoFisher | 15140122 | |
| Petri dishes 60 mm | Corning | 430166 | |
| Phosphate standard solutions, PO43 - in water | BDH ARISTAR | 452232C | |
| Poly-D-Lysine 100mg | Sigma-Aldrich | P7886 | |
| Poly-L-ornithine solution | Sigma-Aldrich | P4957 | |
| Potassium chloride | Sigma-Aldrich | P5405-250g | |
| Propidium iodide | Sigma-Aldrich | P4170-25MG | |
| Sodium chloride | VWR | 27800.360.5K | |
| Sodium Hydroxide | Merck Milipore | 535C549998 | |
| Triton X-100 | BDH | 14630 | |
| VWR INCU-Line IL10 | VWR | 390-0384 |
References
- Reynolds, B., Weiss, S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 255 (5052), 1707-1710 (1992).
- Azari, H., Rahman, M., Sharififar, S., Reynolds, B. A. Isolation and expansion of the adult mouse neural stem cells using the neurosphere assay. Journal of Visualized Experiments. (45), e2393 (2010).
- Vescovi, A. L., Reynolds, B. A., Fraser, D. D., Weiss, S. bFGF regulates the proliferative fate of unipotent (neuronal) and bipotent (neuronal/astroglial) EGF-generated CNS progenitor cells. Neuron. 11 (5), 951-966 (1993).
- Rietze, R. L., Reynolds, B. A. Neural Stem Cell Isolation and Characterization. Methods in Enzymology. 419, 3-23 (2006).
- Walker, T. L., Kempermann, G. One Mouse, Two Cultures: Isolation and Culture of Adult Neural Stem Cells from the Two Neurogenic Zones of Individual Mice. Journal of Visualized Experiments. (84), e51225 (2014).
- Jensen, J. B., Parmar, M. Strengths and Limitations of the Neurosphere Culture System. Molecular Neurobiology. 34 (3), 153-162 (2006).
- Xapelli, S., et al. Activation of Type 1 Cannabinoid Receptor (CB1R) Promotes Neurogenesis in Murine Subventricular Zone Cell Cultures. PLoS ONE. 8 (5), e63529 (2013).
- Riccardi, C., Nicoletti, I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nature Protocols. 1 (3), 1458-1461 (2006).
- Nowakowski, R. S., Lewin, S. B., Miller, M. W. Bromodeoxyuridine immunohistochemical determination of the lengths of the cell cycle and the DNA-synthetic phase for an anatomically defined population. Journal of Neurocytology. 18 (3), 311-318 (1989).
- Weinberg, D., Adams, C. F., Chari, D. M. Deploying clinical grade magnetic nanoparticles with magnetic fields to magnetolabel neural stem cells in adherent versus suspension cultures. RSC Advances. 5 (54), 43353-43360 (2015).
- Azari, H., Sharififar, S., Rahman, M., Ansari, S., Reynolds, B. A. Establishing Embryonic Mouse Neural Stem Cell Culture Using the Neurosphere Assay. Journal of Visualized Experiments. (47), e2457 (2011).
- Azari, H., Louis, S. A., Sharififar, S., Vedam-Mai, V., Reynolds, B. A. Neural-Colony Forming Cell Assay: An Assay To Discriminate Bona Fide Neural Stem Cells from Neural Progenitor Cells. Journal of Visualized Experiments. (49), e2639 (2011).
- Reynolds, B. A., Rietze, R. L. Neural stem cells and neurospheres-re-evaluating the relationship. Nature Methods. 2 (5), 333-336 (2005).
- Pastrana, E., Cheng, L. C., Doetsch, F. Simultaneous prospective purification of adult subventricular zone neural stem cells and their progeny. Proceedings of the National Academy of Sciences. 106 (15), 6387-6392 (2009).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nature Reviews Neuroscience. 11 (3), 176-187 (2010).
- Ghate, P. S., Sidhar, H., Carlson, G. A., Giri, R. K. Development of a novel cellular model of Alzheimer's disease utilizing neurosphere cultures derived from B6C3-Tg(APPswe,PSEN1dE9)85Dbo/J embryonic mouse brain. SpringerPlus. 3 (1), 161 (2014).
- Pluchino, S., et al. Injection of adult neurospheres induces recovery in a chronic model of multiple sclerosis. Nature. 422 (6933), 688-694 (2003).
- Ogawa, Y., Kaizu, K., Yanagi, Y., Takada, S., Sakuraba, H., Oishi, K. Abnormal differentiation of Sandhoff disease model mouse-derived multipotent stem cells toward a neural lineage. PLoS ONE. 12 (6), e0178978 (2017).
- Khacho, M., et al. Mitochondrial Dynamics Impacts Stem Cell Identity and Fate Decisions by Regulating a Nuclear Transcriptional Program. Cell Stem Cell. 19 (2), 232-247 (2016).
- Soares, R., et al. Tauroursodeoxycholic Acid Enhances Mitochondrial Biogenesis, Neural Stem Cell Pool, and Early Neurogenesis in Adult Rats. Molecular Neurobiology. 55 (5), 3725-3738 (2017).
- Rodrigues, R. S., Ribeiro, F. F., Ferreira, F., Vaz, S. H., Sebastião, A. M., Xapelli, S. Interaction between Cannabinoid Type 1 and Type 2 Receptors in the Modulation of Subventricular Zone and Dentate Gyrus Neurogenesis. Frontiers in Pharmacology. 8, 516 (2017).
- Xapelli, S., et al. Modulation of subventricular zone oligodendrogenesis: a role for hemopressin?. Frontiers in Cellular Neuroscience. 8, 59 (2014).
- Kim, H. J., et al. Dynamin-related protein 1 controls the migration and neuronal differentiation of subventricular zone-derived neural progenitor cells. Scientific Reports. 5 (1), 15962 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved