Method Article
اشتقاق الخلايا الجذعية الجنينية البشرية التي Immunosurgery
In This Article
Summary
قدرة الخلايا الجذعية الجنينية البشرية لتجديد الذات وتميز في جميع أنواع الخلايا في الجسم يشير إلى أن لديهم وعدا كبيرا للتطبيقات الطبية والبحوث كأداة لمعالجة المسائل الأساسية في التنمية والمرض. هنا ، ونحن نقدم موجزة ، خطوة بخطوة بروتوكول لاشتقاق خلايا جذعية جنينية من أجنة من جراء العزلة immunosurgical من كتلة الخلايا الداخلية.
Abstract
قدرة الخلايا الجذعية الجنينية البشرية لتجديد الذات وتميز في جميع أنواع الخلايا في الجسم يشير إلى أن لديهم وعدا كبيرا للتطبيقات الطبية والبحوث كأداة لمعالجة المسائل الأساسية في التنمية والمرض. هنا ، ونحن نقدم موجزة ، خطوة بخطوة بروتوكول لاشتقاق خلايا جذعية جنينية من أجنة من جراء العزلة immunosurgical من كتلة الخلايا الداخلية.
Protocol
وقد تم التبرع تجميد الأجنة البشرية المستخدمة لاشتقاق الجذعية الجنينية البشرية خلية (HES) للموافقة المسبقة عن البحوث التالية المناسبة بموجب بروتوكولات البحوث التي تم مراجعتها والموافقة عليها من قبل لجنة على حد سواء على استخدام المواد البشرية وابحاث الخلايا الجذعية الجنينية لجنة الرقابة في جامعة هارفارد .
ويستند بروتوكول مكتوب أدناه على نشر المعلمات التي أبلغ عنها كوان وآخرون. عام 2004 ، مع تعديلات طفيفة.
جنين الثقافة
أذاب أجنة بشرية باستخدام أدوات كوين ذوبان مزايا والثقافة في قطرات من المتوسط العالمي تستكمل مع Plasmanate 15 ٪ حتى التنمية إلى مرحلة الكيسة الموسعة.
Immunosurgery القائم على عزل كتلة الخلايا الداخلية
إعداد :
- إعداد لوحات لإزالة الشفافة وزونا immunosurgery (أنظر أدناه) عن طريق إقامة قطرات من كل حل في لوحات 10cm. تراكب مع الزيوت المعدنية لمنع التبخر. إعداد صف واحد في الجنين المراد الاشتقاق.
- EmbryoMax Tyrodes الحمضية ، استخدم كما هو.
- وسائل الاعلام HES اشتقاق الخلية : 75 ٪ KO - DMEM ، و 10 ٪ KO - مصل استبدال ، Plasmanate 10 ٪ ، 2.5 ٪ وفاق الخلية اختبار مصل بقري جنيني (FBS) ، 2mm وGlutamax - I ، 1 ٪ غير الأحماض الأمينية الأساسية ، و 50 وحدات / مل البنسلين ، 50μg/ml ستربتوميسين 0.055mM ب - المركابتويثانول ، 5ng/ml bFGF.
- أرنب المضادة للجسم الإنسان خلايا الدم الحمراء الابتدائية ، وفقا لاقتراح إعادة التصنيع ، مخففة في 1:10 مع وسائل الاعلام HES اشتقاق الخلية.
- غينيا الخنازير تكملة مصل ، وفقا لاقتراح إعادة التصنيع ، مخففة في 1:10 مع وسائل الاعلام HES اشتقاق الخلية.

- يوازن جميع اللوحات الى 37 درجة مئوية في حاضنة زراعة الأنسجة قبل الاستخدام.
- سحب 50μl - 100μl ماصات الشعرية (VWR) لاستخدامها في نقل الأجنة. قطع الماس ينتهي مع القلم واستخدام مع أنابيب ماصة فم مجهزة تصفية 0.2μm.
Immunosurgery الداخلي :
ملاحظات :
- في هذا الإجراء ، يتم تدمير خلايا الأديم الظاهر الغاذي عن التعرض قصيرة إلى الأجسام المضادة الموجهة ضد الخلايا البشرية جنبا إلى جنب مع النشاط مكملا. ولذلك ، والبروتوكول يعمل بشكل أفضل مع أجنة عالية الجودة مع الأديم الظاهر الغاذي سليمة ، وإلا السلامة الهيكلية للالكيسة يمنع الحركة من كونها أيضا عرضة لردود الفعل المناعية.
- تنفيذ كافة الإجراءات باستخدام نطاق تشريح مجهزة مرحلة ساخنة.
الخطوات التالية :
- شطف الفم ماصة لاستخدامها لنقل الأجنة مع FBS لمنع الأجنة من الالتصاق.
- نقل الكيسة طبق من ثقافة إلى قطرة من عقد HES AT الطبق.
- يبدأ الإجراء عن طريق نقل الكيسة من انخفاض HES من خلال سلسلة من قطرات AT. في الانخفاض الثالث ، ومشاهدة لفسخ الشفافة زونا (50-30 ثانية عادة). قد يكون حريصا على عدم الإفراط في النزاهة علاج أو الجنين للخطر.
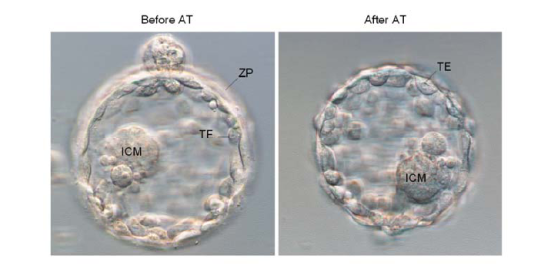
- نقل الكيسة من خلال سلسلة من وسائل الإعلام HES اشتقاق الخلية ينخفض إلى شطف AT. ينصح ماصة تحميلها مسبقا مع وسائل الاعلام لتحييد على الفور في رد الفعل. ويمكن عقد Blastocysts هنا حتى تم كل AT - المجهزة.
- نقل الكيسة من خلال سلسلة من قطرات الضد الابتدائية ، وترك في الانخفاض الثالث لمدة 30 دقيقة من الحضانة عند 37 درجة مئوية في نسيج حاضنة الثقافة.
- نقل الكيسة من خلال سلسلة من وسائل الإعلام HES اشتقاق الخلية ينخفض إلى شطف الابتدائي.
- نقل الكيسة من خلال سلسلة من قطرات تكمل ، وترك في الانخفاض الثالث لمشاهدة لتحلل خلايا الأديم الظاهر الغاذي. مراقبة الكيسة لأول 30 ثانية على خشبة المسرح ل"فقاعات" من خلايا الأديم الظاهر الغاذي كما ليز. إذا لوحظ تحلل ضمن هذا الإطار الزمني ، والحفاظ على طبق على خشبة المسرح المجهر لمراقبة رد فعل حتى الاكتمال. إذا لوحظ أي محتدما خلال أول 30 ثانية ، والعودة إلى الحاضنة ، والتحقق من كل 5 دقائق حتى أكثر من الأديم الظاهر الغاذي وقد lysed. وهذا يمكن أن يستغرق 5-15 دقائق. مراقبة عن كثب رد فعل على تقليل وقت رد الفعل والضرر المحتمل للكتلة الخلية الداخلية.
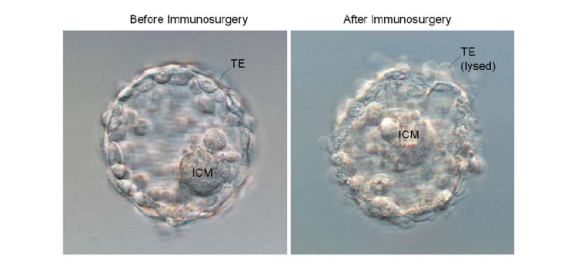
- نقل الكيسة من خلال سلسلة من وسائل الإعلام HES اشتقاق الخلية قطرات ليغسل تكمل النشاط.
- باستخدام ماصة الزجاج مع قطره أصغر قليلا من الكيسة (سحبت من أنابيب VWR 10μl الشعرية) ، يوجه الكيسة صعودا وهبوطا لتجريد بعيدا أكثر من الأديم الظاهر الغاذي lysed.
ز "بديل =" 574_Figure - 0 "العرض =" 577 "ذروة =" 270 "/> - لوحة ICM عزل الخلايا المغذية على المعطل mitotically الليفية من جنين فأر (MEFs). وينبغي إعداد MEFs قبل يوم والاشتقاق ، وتحولت إلى خلية HES اشتقاق وسائل الاعلام يوم. 4 - جيدا الأطباق نونك تعمل بشكل جيد لخطوات أولية من الاشتقاق.
- لا تخل لوحة لأيام 1-2 الأولى. بعد ذلك ، والتحقق اليومي للثمرة مستعمرات الخلايا الجذعية الجنينية (عادة ما يبدو في غضون 1-2 أسابيع). يجب تغيير وسائل الإعلام في حجم نصف كل يوم وبداية أخرى في اليوم 3.
وفاق نمو الخلية والركض
عندما ثمرة الخلية HES وصلت حوالي 0.5mm أو أكثر ، وانها مستعدة للتوسع عن طريق التقاط الميكانيكية.
- تفريق ميكانيكيا نصف ثمرة ونقل لوحات جديدة تحتوي على مغذيات جديدة. وينبغي أن الخلايا الجذعية الجنينية كتل تكون حوالي 3-50 خلايا لكل منهما. ترك النصف الآخر من ثمرة باعتبارها احتياطية لمرور الأول (P1). يمكن الحصول على ثمرة (P0) من عدة مرات لأنها لا تزال في التوسع.

- يمكن المستعمرات الثانوية موزعة على نحو مماثل ، وتوسعت عبر الأطباق اكبر الثقافة حتى الممرات 3-5 ، في الوقت الذي يمكن تكييفها للخطوط الخلايا الجديدة إلى الركض مع الأنزيمية التربسين. وينبغي أيضا على محتوى وسائل الاعلام المصل الثقافة سيخفض تدريجيا الى 1 ٪ و 0 ٪ خلال هذه المقاطع الأولية للحد من وفاق تمايز الخلايا.
- وينبغي وضع راهن جميع الخلايا الجذعية الجنينية من خلال تجميد جزء من أسفل الممرات المبكر للتوسعات المستقبلية.
- بالإضافة ، يجب أن تتسم كل سطر الخلية عن طريق تحليل النمط النووي والتحقق من الدراسات تعدد القدرات وتمايز في المختبر والمجراة.
Discussion
بروتوكول المعروضة هنا يقدم الباحثون مع موجزة وسهلة لمتابعة الخطوط العريضة لكيفية اشتقاق الخلايا الجذعية الجنينية البشرية عن طريق عزل خطوط immunosurgical من كتلة الخلايا الداخلية.
Disclosures
The authors have nothing to disclose.
Acknowledgements
AEC هو زميل في التابوت جين الصندوق التذكاري تشايلدز للأبحاث الطبية ومختبرات ميرك للبحوث. نشكر دال Egli وكوان جيم التجريبية للحصول على المشورة والمناقشة.
Materials
| Name | Company | Catalog Number | Comments |
| Quinn’s Advantage Thaw Kit | Sage | ART-8016 | |
| Global medium | Life Global | GMGB-050 | |
| Plasmanate | Talecris | 61325 | |
| EmbryoMax Acidic Tyrodes | Chemicon International | MR-004-D | |
| KO-DMEM | Invitrogen | 10829-018 | |
| KO-Serum Replacement | Invitrogen | 10828-028 | |
| ES cell-tested fetal bovine serum, Defined | Hyclone | SH30070.03 | |
| Glutamax-I | Invitrogen | 35050-079 | |
| Non-essential amino acids | Invitrogen | 11140-076 | |
| Penicillin/Streptomycin | Invitrogen | 15070-063 | |
| Recombinant human basic fibroblast growth factor | Invitrogen | 13256-029 | |
| Beta-mercapt–thanol | Invitrogen | 21985-023 | |
| Rabbit anti-human red blood cell primary antibody | Rockland Immunochemicals | 109-4139 | |
| Guinea-pig complement serum | Sigma-Aldrich | S-1639 | |
| Capillary pipettes in 10 microL, 50 microL, 100 microL sizes | VWR international | ||
| Mouth pipettes with tubing | VWR international | supplied with capillary pipettes from VWR | |
| 0.2 microm Acrodisc syringe filter | Pall Corporation | PN4192 | |
| 0.5% Trypsin-EDTA | Invitrogen | 25300-120 | |
| Tissue culture dishes | VWR international | ||
| Tissue culture dishes | Nalge Nunc international | ||
| Nikon SMZ1500 dissection scope equipped with Nikon Tokai Hit ThermoPlate warming stage | |||
| Mouse embryonic fibroblasts (E12.5) |
References
- Cowan, C. A., Klimanskaya, I., McMahon, J., Atienza, J., Whitmyer, J., Zucker, J. P., Wang, S. P., Morton, C. C., McMahon, A. P., Powers, D., Melton, D. A. Derivation of embryonic stem-cell lines from human blastocysts. N ENGL J MED. 350 (13), 1353-1356 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved