Method Article
تنقية خلايا الكبد وخلايا بطانية جيبية من الكبد الماوس التروية
In This Article
Summary
والهدف من هذا البروتوكول الحصول على صلاحية عالية وعالية الغلة من خلايا الكبد وخلايا بطانية جيبية من الكبد. يتم ذلك عن طريق بيرفوسينج في الكبد مع حل نوع كولاجيناز الرابع عن طريق الوريد البابي، متبوعاً بالطرد المركزي التفاضلي للحصول على خلايا الكبد وخلايا بطانية جيبية.
Abstract
هذا البروتوكول يوضح طريقة للحصول على المردود العالي والبقاء للماوس خلايا الكبد وخلايا بطانية جيبية (ثانية) ملائمة لاستزراع أو للحصول على خلية ليساتيس. في هذا البروتوكول، الوريد البابي كالموقع لقسطرة، بدلاً من الوريد الأجوف، كما يحد هذا التلوث بأنواع الخلايا الممكنة الأخرى في إعداد الكبد النهائي. مطلوب لا الأجهزة الخاصة طوال فترة الإجراءات. حمام مائي يستخدم كمصدر للحرارة للحفاظ على درجة الحرارة لكافة المخازن المؤقتة والحلول. يتم استخدام مضخة تمعجية قياسية لمحرك السائل، ومطلوب أجهزة الطرد مركزي في أعلى الجدول مبردة لإجراءات الطرد المركزي. القيد الوحيد لهذا الأسلوب هو موضع القسطرة داخل الوريد البابي، الذي يمثل تحديا في بعض من الفئران في نطاق الحجم ز 18-25. ميزة هذا الأسلوب هو أن يستخدم المنوال واحد فقط التروية والوصول إلى هذا السياق السريع، مما يقلل من الاسكيمية وضخه من الكبد يقلل من جدوى الخلية الكبدية. وهناك ميزة أخرى لهذا البروتوكول أنه من السهل التمييز بين لايف من خلايا الكبد الميت بالبصر بسبب الاختلاف في كثافة الخلوية أثناء خطوات استخدام الطرد المركزي. خلايا من هذا البروتوكول قد تكون المستخدمة في خلية ثقافة لأي تطبيق من المتلقين للمعلومات، فضلا عن معالجة لأي تقييم البيوكيميائية.
Introduction
وقد أجريت منذ أوائل الخمسينات نضح كولاجيناز في الكبد للحصول على خلايا الكبد وقد تحسنت بشكل مستمر عند1،2،،من34. تم تجميع استعراض لطيفة جداً للعديد من المنهجيات والتقنيات، ووالكواشف المستخدمة في تنقية خلايا الكبد في ماير وآخرون5. الحصول على عائد مرضيا من خلايا الكبد عالية قادرة على البقاء وثانية تحديا من الناحية التقنية. القوات الميكانيكية التي تفصل بين الخلايا بما في ذلك نوعية كولاجيناز هي بعض من المتغيرات التي من الصعب السيطرة عليها. نظراً لحساسية تتمثل بقوى ميكانيكية، يتم تقليل قابليتها ملحوظا في ظروف دون المستوى الأمثل، مما دفع الحاجة إلى بروتوكول وصف الظروف المثلى لعزل. تظهر ثانية من غير أن تكون حساسة للقص الميكانيكية. نضح في الموقع مع الهضم كولاجيناز هو إلى حد بعيد أفضل طريقة لتعطيل الوصلات خلية خلية للحصول على الأعمال التحضيرية خلية مفردة من الكبد والأجهزة الأخرى مثل الأمعاء والطحال6. هذا البروتوكول يوضح طريقة بسيطة لإدخال المخزن المؤقت التروية في الوريد البابي باستخدام قسطرة بلاستيكية قابل للطي بدلاً من شق التي يمكن أن تسبب الوريد البابي إلى الانهيار، كما هو موضح في Smedsrød وآخرون7.
والهدف من هذه المخطوطة إثبات أهم الخطوات المطلوبة للنجاح في إجراء إسراف الكبد. وتشمل هذه الخطوات موضع القسطرة، تدفق سوائل التروية، والتعامل مع الأنسجة بعد الهضم. معدلات التدفق المعدل فوق المعدل الطبيعي لتدفق الدم، ولكن منخفضة بما يكفي لإبقاء الكبسولة جليسون سليمة. مرة واحدة الكبد يهضم بشكل صحيح ويتم فصل الخلايا في الحل، تنقية خلية بسيطة نسبيا عما إذا كانت تتم بالطرد المركزي التفاضلي، التصاق لوحة، أو بواسطة تنقية حبة المغناطيسية. خلايا الكبد الحية بكثافة أعلى ويتم تنقيتها بسهولة من الخلايا نونبارينتشيمال (الشخصيات) وخلايا الكبد الميت بسرعة بطيئة الطرد المركزي. معظم التطبيقات، التصاق لوحة لفصل كوبفر الخلايا (KCs) وثانية هو أسلوب مشترك8، على الرغم من أن هناك تقارير تفيد بأنها لا تنتج أفضل نقاء ثانية9. KCs لديهم ميل إلى التمسك بالأسطح الصلبة الصلبة بسرعة وأطباق بتري (معيار البوليسترين) هي المواد الأكثر استخداماً لهذا الإجراء. تنقية ثانية أو كيه سي بالاستخدام الأجسام المضادة مترافق المغناطيسي الخرز هو بلا شك أفضل طريقة لتنقية كبيرة من هذه الخلايا، على الرغم من أن الإجراء إضافة آخر 3-4 ح على هذا البروتوكول، وهو العائد الإجمالي انخفضت9. يوضح هذا التقرير بالتفصيل عملية نضح كبد مثلى التي عادة ما تسفر عن عدد مرتفع من خلايا قابلة للحياة.
Protocol
عليها جميع الإجراءات الحيوانية المبينة في هذا البروتوكول "رعاية الحيوان المؤسسية" واستخدام اللجنة (إياكوك) في جامعة لينكولن-نبراسكا تحت بروتوكول #1435.
1-إعداد
- إعداد الحلول وثقافة وسائل الإعلام
- إعداد كافة وسائط الثقافة والمخزن المؤقت وفقا الجدول للمواد.
- إعداد الصكوك
- قم بإعداد حمام مائي (> 10 لتر) في 42 درجة مئوية، ومضخة تمعجية مع سرعة متغيرة، والمشابك لعقد قوارير. إعداد منحنى المقص والملقط (الشكل 1).
- على أو المتاخمة لحوض ماء، قم بإعداد ورقة الخبز (حوالي 38 × 26 سم) مع لوحة الستايروفوم (50 مل الرف المخروطية)، مضافين مع أونديرباد ماصة يقتطع قطعة 20 × 20 سم (الشكل 1).
- ضع قطعة من إخفاء الشريط (5-8 سم) القريبة. ضع خيط الحياكة بوليستر 20 سم القريبة هي قص وجاهزة للاستخدام. الحصول على قسطرة بلاستيكية بإبرة قابل للطي (7 مم × 19 مم، الشكل 1).
- إعداد الأواني الزجاجية
- استخدام المشابك، وشل قارورة 1 لتر في حوض ماء يحتوي على 200 مل من 1 x PBS بسداده له اثنين من الممصات 1 مل الخوض في الحل. هو حقق الفلين المطاط للسماح بإعادة تدوير السائل في دائرة مغلقة.
- مع المشبك آخر، ضع قارورة 125 مل تحتوي على 45 مل من المخزن المؤقت 2 جنبا إلى جنب مع سداده له اثنين 1 مل الممصات، يتمثل أحدها في السائل بالقرب من الأسفل في قارورة والآخر الذي يبقى فوق السائل وضربات الأكسجين إلى قارورة.
ملاحظة: سيكون كل ماصة في السدادات سريعة قطع اتصال محول تعلق على نهاية لسهولة التحويل من الأنبوب. برفق في تتدفق الأكسجين كلا قوارير عبر الماصة في سداده أن لا مغمور في السائل. - جانبا اثنين من الأطباق المتبلور العقيمة.
2-الإجراء الحيوان
- الاحماء الحلول PBS و 2 المخزن المؤقت إلى 42 درجة مئوية في حمام المياه وتعميم برنامج تلفزيوني لمالا يقل عن 20 مل/دقيقة في الأنبوب في دائرة مغلقة للحفاظ على خطوط السائل الحار. تزج أي أنابيب الزائدة في حمام الماء يبقى أقرب ما يمكن إلى 42 درجة مئوية. هجرة الذكور نهاية الأنبوب إلى 1 لتر قارورة تحتوي على برنامج تلفزيوني.
- وضع كرة القطن على أونديرباد ماصة وإضافة حوالي 2 مل إيسوفلوراني 30% (تتكون في البولي إثيلين غليكول 200 مما يقلل من معدل التبخر isoflurane) على الكرة القطن باستخدام ماصة نقل.
- التقاط الماوس من ذيله ووضعه في أحد الأطباق المتبلور، وثم نقض الطبق على الكرة القطن بسرعة حيث يحتوي الماوس على مساحة صغيرة يستنشق التخدير. مراقبة معدل التنفس للماوس وضمان الماوس فعلياً تحت التخدير.
ملاحظة: يجب أن يكون معدل التنفس أبطأ وأكثر عمقاً، الذيل الرخو، وآثار أقدام nonresponsive لاختبار رشة تحت التخدير؛ انظر المبادئ التوجيهية IACUC للحصول على تفاصيل إضافية. - بينما الماوس يجري تحت التخدير (وهذا يأخذ 1-2 دقيقة)، تعد فوهة حقنه 10 مل بسحب المكبس وإدراج كرة القطن صغيرة. إضافة 1 – 2 مل إيسوفلوراني 30% مع ماصة نقل إلى الكرة القطن داخل البرميل ووضع فوهة انفك أسفل على طاولة أثناء انتظار الماوس ليصبح فاقداً للوعي.
- بسرعة تقلع الطبق المتبلور وانعكاس الماوس على ظهرها ووضع فوهة المحقن عبر انفها. مضاعفة فحص معدل التنفس وقرصة أخمص القدمين، والذيل الرخو. أي ردود على قرصه أخمص القدمين وذيل الرخو يشير إلى أن الماوس لا تحت التخدير الكامل. تبقى للبرميل حقنه عبر الآنف للحفاظ على فقدان الوعي.
- الإبهام مكان المسامير من خلال آثار أقدام للماوس، مع أطرافه الممدودة في موقف ضعيف. الرطب في البطن والقفص الصدري مع الإيثانول أو الكحول 70%.
- مع الملقط مستقيم في يد واحدة، يرفع الجلد بالقرب من القاعدة للبطن. مع مقص في ناحية أخرى، قطع الجلد الخيام والصفاق. ينبغي أن يكون الشق أفقي أو عبر القاعدة من الجلد الخيام. من المؤكد أن تخترق كل الطبقات من الجلد والصفاق بغية الوصول إلى القناة الهضمية. قطع أفقياً حول البطن يصل إلى القفص الصدري على كلا الجانبين دون نيكينج أي من الأجهزة.
- قطع رفرف من الجلد بقطع عبر القفص الصدري السفلي. تحريك الأمعاء إلى اليمين مع الجزء الخلفي الملقط لفضح الوريد البابي.
ملاحظة: النزيف من الحيوان يجب أن يكون الحد الأدنى؛ ينبغي أن يكون لا يزال يتنفس الحيوان وتحت التخدير العميق. - ضع ملقط منحنى مغلق تحت الوريد البابي بين الكبد والوريد بانكريتيكودودينال متفوقة (الشكل 3 السهم).
- فتح الملقط بينما تحت الوريد البابي. فهم الموضوع وتسحبه بعناية من خلال ذلك أن يتم توسيطه أسفل الوريد البابي. يعقدا قرانهما تراكم حول الوريد البابي دون سينتشينج من أسفل.
- ضع ملقط منحنية تحت الوريد البابي واسحبه برفق نحو ذيل الماوس لتصويب على المنوال (الشكل 4أ).
- مع القسطرة في ناحية أخرى، مكان المجسم مشطوف الحواف الإبرة الوجه للأعلى و بالتوازي مع الجزء السفلي من الوريد البابي قرب الملقط (الشكل 4ب).
- برفق ثقب في الوريد بالإبرة (الشكل 4ج). ضمان شطبه الإبرة في تجويف الوريد. سحب الإبرة نابض ومواصلة دفع القسطرة البوليمر عن طريق الوريد حتى المجسم مشطوف الحواف بالقرب من منطقة تشعبت الوريدي. وهذا داخل الكبد. إذا القسطرة يتم وضعها بشكل صحيح، سيكون مرئياً مرة أخرى--تدفق الدم. (الشكل 4د).
- تشديد عقده تراكم وتسحبه إلى أسفل في القسطرة للمساعدة على تحقيق الاستقرار في ذلك. على الفور بدوره إلى انخفاض معدل الضخ من 20 مل/دقيقة إلى 4 مل/دقيقة وقطع أخرى من الأوعية الدموية الرئيسية لتصريف المياه. قطع أبدوميناليس الشريان الاورطي لتحقيق أفضل النتائج.
- ضع نهاية الأنبوب إلى نهاية القسطرة (الشكل 5ألف) الإناث الذكور. تأكد من أنه لا يوجد أي فقاعات الهواء في السطر. كن حذراً من أن القسطرة ليست أما دفعت داخل الكبد أو خارج هذا السياق. وضع مؤشر الترابط ليس أساسيا، على الرغم من أنه يساعد على منع التدفق الخلفي خارج هذا السياق ويساعد على إبقاء القسطرة في الموضع الصحيح (الشكل 5ب، ج).
- استخدام إخفاء الشريط لشل الأنبوب على أونديرباد. استخدام الملقط على التوالي للضغط على الأوعية الدموية النفايات السائلة تضخم الكبد عدة مرات لضمان قد استنزفت جميع الدم (الشكل 5د).
ملاحظة: قد لا يعمل الشريط المختبر القياسية؛ ومع ذلك، إخفاء الشريط ستظل عالقة في أونديرباد، حتى في ظروف رطبة.
3-الكبد التروية
- بينما يتم مسح الكبد مع برنامج تلفزيوني، قياس حوالي 24 ملغ كولاجيناز النوع الرابع ووضعه في قارورة تحتوي على 45 مل من المخزن المؤقت 2 في حوض ماء. من المؤكد أن دوامة السائل في قارورة حتى أن يحل كولاجيناز الكامل ووضع في قارورة مرة أخرى في المشبك حيث جزء قارورة تحتوي على سائل هي مغمورة تماما في الماء.
- مراقبة التغيير في لون الكبد كما أنه يتم مسح مع برنامج تلفزيوني. تغيير أنابيب تدفق من قارورة 1 لتر إلى قارورة 125 مل. عدم السماح بفقاعات الهواء في التدفق إلى الكبد.
- مرة واحدة المخزن المؤقت لنضح يصل إلى الكبد، الضغط بإيجاز ضيق الأوعية الدموية النفايات السائلة بناء بعض الضغوط داخل السفينة والسماح بهذا السائل لملء جميع الفصوص من الكبد. تأكد من عدم قطع الصرف طويلة جداً، كما أنه قد انفجر رقيقة النسيج الضام المحيطة بالكبد (الكبسولة في جليسون) وتدمير نضح أو تدفق السائل داخل السرير الشعرية الكبد.
- تسمح 2 المخزن المؤقت مع كولاجيناز نتخلل عن طريق الكبد حتى تدفقت جميع 45 مل من خلال الأنسجة.
ملاحظة: في حالة نجاح كبسولة جليسون ينبغي أن تفصل نفسها من حمة أو نسيج الكبد والكبد يجب أن تظهر غير متبلور. - إضافة حوالي 10 مل من المخزن المؤقت 1 إلى الطبق بلورة أخرى ووضعه بجانب الماوس.
- إزالة القسطرة وإيقاف تشغيل المضخة.
- مع الملقط مستقيمة ومقص، قص الكبد من الماوس. إذا كان الهضم كولاجيناز فعالة جداً، فإنه قد يكون من الضروري على قد ملعقة نظيفة ومعقمة ومن ناحية حلج القطن في الكبد من الماوس، ثم ضعه في المخزن المؤقت 1.
4-تتمثل تنقية
ملاحظة: يتم تنفيذ التلاعب بالخلايا في غطاء زراعة الأنسجة معقمة للحد من التلوث إذا كانت الخلايا لتكون مثقف في جميع الخطوات اللاحقة.
- باستخدام تقنية تعقيم، انتزاع الكبد بالملقط وهزه بلطف الخلايا من الكبد. تمزق أو سحب الكبسولة جليسون: المخزن المؤقت سوف تصبح مبهمة كما هي تهتز الخلايا من الكبد.
- صب قبالة الحل خلية في 50 مل مخروطية مع مرشح 100 ميكرومتر وضعها فوق الأعلى.
- إضافة المزيد المخزن المؤقت 1 إلى مخلفات الكبد ويهز بها الخلايا. تستمر حتى يظهر الكبد يخلو من الخلايا أو عندما عسر الهضم أجزاء الكبد لا تسفر عن بعد الآن الخلايا.
- صب السائل الخلوي في آخر 50 مل المخروطية التي تحتوي على عامل تصفية 40 ميكرومتر.
- الطرد المركزي المخروطية في دوار دلو يتأرجح في ز 100 x لمدة 3 دقائق.
ملاحظة: لا تستخدم الفرامل الحد الأقصى كهذا قد إزاحة بيليه الخلية. استخدام الفرامل في 80% وكافية لجميع الخطوات المتبقية الطرد المركزي عند 4 درجة مئوية - صب قبالة المادة طافية (التي تحتوي على الشخصيات وخلايا الكبد الميت) في المخروطية نظيفة ووضعه على الجليد. كفالة يتم ذلك في اقتراح واحد لمراقبة التقيد بيليه.
- ريسوسبيند بيليه في 40 مل من المخزن المؤقت 1. كرر الخطوات من 4.5 و 4.6. ريسوسبيند بيليه في 40 مل من 3 المخزن المؤقت. كرر الخطوات 4-5 و 4.6 مرتين.
- ريسوسبيند خلايا الكبد المنقاة في الحارة دميم + 10% FBS + 2 × البنسلين-ستربتوميسين (القلم/بكتيريا).
- إذا كانت الخلايا تستزرع في لوحات الكولاجين المغلفة، تسمح لهم بالانضمام ح 1 واستبدال وسائط الإعلام مرة واحدة على الأقل كهذا سوف يمنع أي ملوثات بكتيرية الوليدة.
- جعل لوحات الكولاجين المغلفة بحضانة لهم مع الكولاجين 0.05% في حمض الخليك 0.001 في المائة على الأقل 1 ساعة عند 37 درجة مئوية، والغسيل ثم مع برنامج تلفزيوني 1 x.
- إذا كانت صلاحية تتمثل منخفضة وهناك رغبة للحصول على خلايا الكبد عالية صالحة المنقي ثم استخدام بروتوكول التالية مقتبسة من كريامير وآخرون10.
- وحدات تخزين 9 مزيج من حل حماية الأصناف النباتية (بيركول وحل 23% w/w للمياه 15-30 نانومتر جزيئات السليكا الغروية المغلفة في بوفيدون لكثافة استخدام الطرد المركزي) وحجم 1 من 10 x HBSS جعل حلاً حماية الأصناف النباتية iso ناضح (SIP).
- إضافة مل 24 من المسبار إلى معقم 50 مل مخروطية التي قد تكون مخزنة في هذه الظروف لمدة تصل إلى شهرين في 4 درجات مئوية.
- ضبط تركيز تتمثل في 5-10 × 106 خلايا/مل مع الثقافة المتوسطة مثل الذي سجلته في الخطوة 4، 8.
- إضافة 25 مل تعليق خلية لكل مل 24 المسبار الذي يتضمن المخروطية ومزيج من انعكاس لطيف. كثافة هذا الحل 1.06 غ/مل.
- الطرد المركزي المخروطية في 50 غ س لمدة 10 دقائق في 4 درجات مئوية.
- نضح المسبار ولمندف، وريسوسبيند الخلايا في حبس.
- غسل الخلايا باستخدام الطرد المركزي في 50 غ س لمدة 10 دقائق في 4 درجات مئوية.
- كرر الخطوة 4.10.6 مرة أخرى وثم ريسوسبيند الخلايا في المتوسطة النمو.
5-ثانية تنقية
- بيليه الخلايا في supernatants من الخطوة 4، 6 من الغزل الأنابيب في ز 163 x لأدنى 10 تجاهل supernatants من الأنابيب وريسوسبيند كل من الكريات الخلية في 5 مل ربمي دون المصل وتجمع لهم معا في أنبوب واحد.
- مرة واحدة وقد تم تجميع جميع الكريات، إضافة ربمي إلى الحجم النهائي لمل 35.
- الطرد المركزي في المجمعة المخروطية في 25 x ز للحد الأدنى 3 بعناية نضح أعلى 25 مل من ربمي مع ماصة 25 مل ومكان هذه الوسائط التي تحتوي على الشخصيات في نظيفة 50 مل مخروطية على الجليد.
- إضافة 25 مل ربمي الطازجة إلى الأنبوب وريسوسبيند بيليه.
- كرر الخطوة 5، 3 ليغسل الثانية وتجمع المادة طافية. تجاهل 10 مل المتبقية لوسائل الإعلام وبيليه (بيليه يتكون في معظمه من خلايا الكبد قتيلا). الطرد المركزي المادة طافية المجمعة في 163 س ز لمدة 10 دقائق.
- أثناء الطرد المركزي، إعداد التدرجات حل حماية الأصناف النباتية في 50 مل مخروطية الشكل.
- إضافة 15 مل محلول 50% حماية الأصناف النباتية إلى 50 مل المخروطية تليها 20 مل من 25% بركل مضافين مع بيبيتور تعيين على أبطأ سرعة القذف. تأكد من مراقبة خط إنكسار عند علامة 15 مل فىالوقت الطبقتين، هذا هو حيث سيتم تجميع ثانية و KCs بعد الطرد المركزي.
- ريسوسبيند الخلايا القريبون مسبقاً في الخطوة 5، 5 في 10 مل من ربمي الباردة وتراكب لهم على التدرج حل حماية الأصناف النباتية. يجب التأكد من الحفاظ على خط فاصل واضح بين الطبقتين. الطرد المركزي التدرج في 805 س ز لمدة 20 دقيقة مع فرامل تعيين 50 في المائة.
- نضح من أعلى إلى أسفل الاتجاه إلى علامة 20 مل في الأنبوب وتجاهل هذه المواد. مع ماصة نقل 5 مل، جمع ثانية و KCs التي تقع في واجهة 25/50%. تجاهل أي من كتل الخلايا البنى أن هذه هي خلايا الكبد الميت.
- وضع الخلايا في 50 مل المخروطية وإضافة ربمي يصل إلى علامة 50 مل تمييع حل حماية الأصناف النباتية. الطرد المركزي في 200 غ س لمدة 10 دقائق، مع الفرامل 80%.
- نضح وتجاهل المادة طافية وريسوسبيند بيليه بينما غسل قبالة المخروط من المخروطية في 12 مل ربمي الحارة.
- فصل في ثوان من KCs بوضع المادة طافية في البوليسترين طبق بيتري واحتضان في حاضنة زراعة الأنسجة هوميديفيد لمدة 8 دقائق في درجة حرارة الغرفة.
- نضح وسائط الإعلام مع ماصة 25 مل وشطف اللوحة مع وسائط الإعلام نفسها، مع بيبيتور تعيين بأقل سرعة لجمع ثوان المتبقية في حين KCs التمسك باللوحة.
- الطرد المركزي ثانية في 200 x غ لمدة 10 دقائق، وريسوسبيند في ربمي + 5% FBS + القلم/بكتيريا. ثم عيار الخلايا، ومكان في أطباق الثقافة المغلفة بالكولاجين.
النتائج
أسلوب ديمونستراشونال، وصقل لنضح الكبد وتنقية/تخصيب خلايا الكبد وثانية يرد هنا يوفر نصائح مفصلة لتنقية/تخصيب خلية الأمثل مماثلة للتقارير المطبوعة الأخرى المترجمة في هذا المشار إليه استعراض 5. تحدث في الطريق والتفاصيل التقنية للإجراء نضح كولاجيناز الخطوات الحاسمة التي تحدد النجاح لتنقية الخلوية وهي المبينة في هذا البروتوكول. الإعداد للجهاز إلى حد ما بسيطة وفعالة من حيث التكلفة مع معدات المختبرات القياسية، على عكس الأنظمة الأخرى التي تم نشر11 (الشكل 1). في هذا التشكيل، يجلس علبة عقد الماوس في حوض ماء مع بعض الأنابيب الزائدة في حمام الماء للحفاظ على درجة حرارة السوائل بيرفوسينج في الكبد. يمكن استخدام الجهاز كما هو موضح هنا للفئران وكذلك الفئران، مع هندسة مختلفة قليلاً للفئران نضح الكبد12 (الشكل 2).
في هذا الإجراء، هو perfused في الكبد عن طريق الوريد البابي بدلاً من الأجوف فينا (وتوجيه آخر بشعبية نضح) نظراً لسهولة الوصول إلى داخل البطن والذي يغذي الوريد مباشرة في الكبد. ينبغي أن يكون المشاهد يدرك أن الوريد البابي عدة فروع صغيرة التي يمكن اختزال بيرفوساتي، وينبغي أن توضع القسطرة في الماضي هذه الفروع للنجاح الأمثل13 (الشكل 3). بمجرد التعرف على الوريد البابي، تستخدم الملقط منحنى لرسم خياطة جراحية أو خيط البوليستر تحت الوريد البابي بين الكبد والوريد البنكرياس الإثناعشرية متفوقة. وتستخدم أيضا الملقط تصويب الوريد البابي الذي تحت ضغط الدم الإيجابية (الشكل 4أ). ينبغي أن توضع الإبرة داخل القسطرة موازية بجوار الوريد (الشكل 4ب)، وينبغي إدراج الشطب برفق في التجويف الوريد (الشكل 4ج). وسترد التنسيب السليم بالدم التي تظهر على طول القسطرة. حالما يتم سحب الإبرة يجب أن تستقر القسطرة مع مؤشر ترابط مرتبطة به وسوف يجبر ضغط الدم الدم تصل عن طريق القسطرة. من المستحسن أن القسطرة تكون متصلة بأنابيب ضخ قبل انسكاب الدم بها (الشكل 4د). بمجرد توصيل أنابيب ضخ، فورا قطع الأوعية الدموية رئيسية مثل الوريد الأجوف أو أبدوميناليس الشريان الاورطي لتصريف الدم/السائل (الشكل 5ألف). من الضروري عادة قطع الجانب جدار البطن من الماوس لتصريف المياه الكافية، وتراكم الدم في البطن يجعل من الصعب تصور عملية التروية، والدم قد يرحل إلى تنقية الخلية (الشكل 5 ب). وحالما يبدأ برنامج تلفزيوني نتخلل في الكبد، الكبد سوف لانش مع غياب الدم (الشكل 5ج). إلا إذا كان عدد قليل من الفصوص لانش، ثم السبب المحتمل هو أن القسطرة قد وضعت بعيداً جداً داخل الكبد، وسوف تحتاج إلى أن تدعم بطء. حالما يتم التأكد من وضع القسطرة استخدام للماء إخفاء الشريط لتأمين الأنابيب في المكان. عادة ما تكون الشريط المختبرات العامة غير كافية. للتأكد من الموضع الصحيح للقسطرة، ضغط الأوعية الدموية قطع وقف تصريف المياه ومراقبة زيادة الضغط داخل الكبد. عند القيام بذلك سوف تساعد في مسح الدم من الكبد (الشكل 5د). أيضا وهذا ينبغي أن يتم عند حل كولاجيناز في البداية يذهب إلى الكبد التأكد من أن جميع الفصوص معرضون كولاجيناز. بعد كولاجيناز يعمل الحل، هضم كولاجيناز جيدة إرشادي بفصل الكبسولة جليسون عن حمة.
الإجراء العام لتنقية الخلوية ويرد في الشكل 6 و الرقم 7 فيه خلايا الكبد يتم حصادها في وقت مبكر في الإجراء أثناء سرعة منخفضة يدور وهي نقية جداً بعد 4 يغسل في المخازن المؤقتة التي تحتوي على جيش صرب البوسنة (الرقم 8 ). تنقية يشترك مع KCs على تدرج حماية الأصناف النباتية (الشكل 9ألف) ثانية ومفصولة ثم الالتصاق الانتقائي في البوليسترين المغلفة بالكولاجين طبق بيتري. 83-90 ٪ نقية نقاء ثانية استخدام هذا الأسلوب ويعتمد إلى حد كبير على الفعالية الشاملة لهضم كولاجيناز (الشكل 9ب). القياسات الكمية باستخدام ضوء الفحص المجهري (كخلايا الكبد وثانية لها سمات مميزة من الخلايا الأخرى) تظهر أنه في إعداد ممثل، خلايا الكبد ما يقرب من 100 ٪ نقية وثانية هي فقط ما يزيد على 89% النقي (الجدول 1). بدلاً من ذلك، يمكن الحصول تخصيب أعلى من ثوان قبل الفاصل المغناطيسي العمود بعد التدرج حماية الأصناف النباتية، على الرغم من أن هذا خارج نطاق هذا البروتوكول. يمكن الاطلاع على مزيد من المعلومات حول الفصل المغناطيسي لثوان و KCs في ماير et al. 9 وليو et al. 14 وينبغي أن نتذكر أن الجدوى من خلايا الكبد يقلل من سرعة في كبد هضم غير كاف، لكن هذه ليست الحقيقية اللازمة لكبد هضمها غير كاف أيضا إنتاج الحطام الخلوية أكثر، وهي ليست تماما الشخصيات. القضاء في خطوات استخدام الطرد المركزي.

الشكل 1 : التمثيل التخطيطي لجناح التروية. وتعقد في قوارير في مكان المشابك (غير معروضة)؛ أنابيب السوائل المحتوية على تبديل من قارورة 1 لتر إلى قارورة 125 مل أثناء الإجراء يمثل الخط المنقط أحمر. لا فقاعة علما، بأن تغذية الأكسجين مباشرة إلى الحلول قوارير. ينبغي أن يكون حقق الفلين أيضا للسماح بتدفق السوائل الدائرة المغلقة مع الأنبوب إدراجها داخل الشق. هذا أمر بالغ الأهمية خلال الاحماء الأنابيب وطرد جميع الهواء داخل الأنبوب. التسييل الهواء يتكون من موصل تي التي يتم توصيلها إلى أنابيب تيجون والمشابك قرصه لفتح سريع وإغلاق النظام. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : جناح التروية أثناء التروية الماوس الكبد. العلبة مع الماوس يوضع على زاوية حمام الماء. يتم قطع الأوكسجين الحل كولاجيناز كما أن الفعل كان اﻷوكسيجين أثناء الاحماء. موقع عناصر هي A) الأكسجين خطوط، ب) 1 لتر قارورة تحتوي على برنامج تلفزيوني، ج) 125 مل قارورة تحتوي على المخزن المؤقت 2 مع كولاجيناز، د) مضخة، ضوابط ه) مضخة، فخ و) فقاعة، ز) السائل خط يمتد من قارورة، عن طريق المضخة والماوس. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
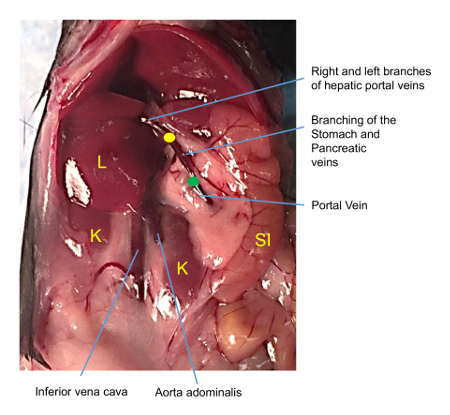
الشكل 3 : صورة المفرج البطن الماوس. ينبغي أن يكون الإدراج القسطرة أسفل الوصلات الوريد المعدة والبنكرياس نزوله الوريد البابي (النقطة الخضراء) وينبغي أن توضع نصيحة قرب الأوردة بوابة اليسار واليمين الكبدي (النقطة الصفراء) التي تشكل شوكة في الفصوص الرئيسية في الكبد. حالما يتحقق الموضع الصحيح، ينبغي أن تستقر القسطرة مع مؤشر الترابط باستخدام عقده تراكم بسيطة. K = الكلي، L = الكبد، سي = الأمعاء. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
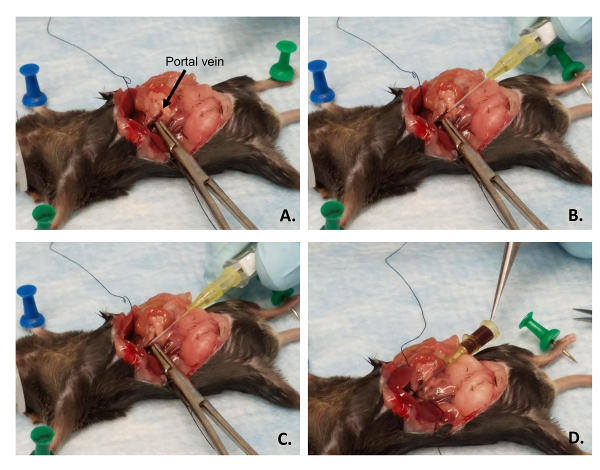
الشكل 4 : موضع قسطرة في الوريد البابي- (أ) تستخدم الملقط لضمان تحفل الدم من الوريد البابي وتصويب على المنوال لقسطرة التنسيب. (ب) القسطرة هو اصطف بالتوازي مع الوريد البابي مع المجسم مشطوف الحواف. (ج) الشطب الإبرة داخل القسطرة يتم إدراج على المنوال، ليس عن طريق الوريد. (د) إبرة القسطرة يتم سحبه والدم سوف الدفق من خلال القسطرة كما هو مبين بتلميح الملقط. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
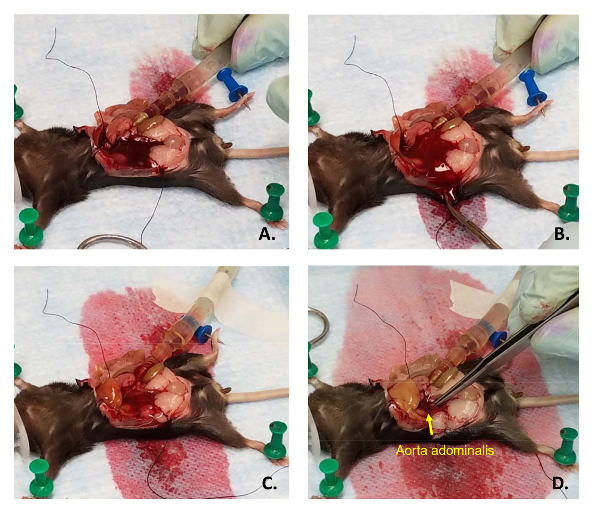
الشكل 5 : نضح الكبد السليم. (أ) بعد أن يتم الاتصال قسطرة التنسيب، نهاية القسطرة اللوير الإناث إلى نهاية نظام الذكور (قطع من حقنه 1 مل) من أنابيب الضخ. (ب) بعد أن قطع أحد الأوعية الدموية الرئيسية تنازلي، الدم وبرنامج تلفزيوني يتم استنزفت من البطن بتقطيع إلى جانب الماوس مع المقص. (ج) ينبغي أن لانش الكبد بينما يتم مسح الدم وسوف تضخم (د) عندما تكون تحت ضغط بإيقاف الضغط قطع الأوعية الدموية بالملقط. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 6 : ملخص تخطيطي تتمثل تنقية وعزل المجلس الوطني- وتهدف معظم الخطوات الطرد المركزي لإزالة خلايا الكبد الحية والميتة من الخلايا غير متني. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 7 : ملخص تخطيطي ثانية تخصيب وتنقية- يتم فصل الشخصيات بالتدرج حماية الأصناف النباتية يليه فصل ثانية بالتصاق قصيرة إلى لوحة البوليستيرين قياسية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 8 : تنقية خلايا الكبد. مطلي على لوحات زراعة أنسجة الكولاجين المغلفة مع دميم + 8% FBS + القلم/بكتيريا خلايا الكبد والمحتضنة ح 6 تليها مجموعة الصور مجهر في 400 X. شريط يساوي 20 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 9 : تنقية SEC. ثانية (A) و KCs جمعت من واجهة حماية الأصناف النباتية 25/50% (الأسهم الصفراء) وغسلها مع المتوسط خالية من المصل. ثانية (ب) كانت تفصل في KCs الالتصاق الانتقائي على أطباق بيتري القياسية وغسلها ومطلي على أطباق زراعة الأنسجة المغلفة بالكولاجين في ربمي + 5% FBS. وأخذ الصور مجهر المقلوب أفوس 400 X. شريط يساوي 20 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 10 : فحص المجهر الإلكتروني لتشريح الفأر الكبد. كان perfused كبد ماوس مع برنامج تلفزيوني تليها مثبت (كاكوديلاتي الصوديوم 100 مم، 12 مل 25 ٪ glutaraldehyde، بارافورمالدهيد 16% 15.6 مل، وكلوريد الكالسيوم مم 2.65، السكروز 180.2 مم، مختلطة في الحل 100 مل) بمعدل 1 مل/دقيقة للحد الأدنى 4 كانت شرائح الأنسجة و أعدت للمسح الضوئي المجهر الإلكتروني. جمعت الصور و "وزارة شؤون المرأة" ميدان الانبعاثات في 10، 000 X. تشير الأسهم الصفراء إلى زغيبات بين خلايا الكبد. شريط يساوي 5 ميكرومتر. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
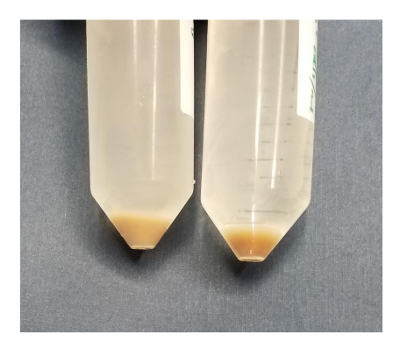
الرقم 11 : التصور للميت مقابل خلايا الكبد الحية- بعد أن يغسل 2 مع المخزن المؤقت 1، يمكن تقييم الأعلاف خلايا الكبد ليعيش الميت نسبة بالعين المجردة. بيليه أخف (يسار) تشير إلى أن على الأقل نصف خلايا الكبد الميت. بيليه قتامة على اليمين هو أكثر شدة القريبون إلى الجزء السفلي من الأنبوب وهو يعيش أكثر من 90 في المائة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
| الجدول 1: الخلية تنقية | ||
| نوع الخلية | الخلايا الهدف % | % خلايا أخرى |
| خلايا الكبد | 99 | 1 |
| خلايا بطانية سينسوسويدال | 89.1 | 10.9 |
الجدول 1: تقييم نقاء الخلية بالميكروسكوب الخفيفة.
Discussion
ويبرز هذا البروتوكول بالأدوات المتوفرة والتي ستتيح للمستخدم نسبة عالية من النجاح في هذا الإجراء. نضح ناجحة أمر أساسي لأي تطبيق المصب عند العمل مع الخلايا الأولية.
وهناك بضع خطوات حاسمة من الإجراءات التي تحدد النجاح. أولاً، يجب أن يكون وضع طرف قسطرة داخل الوريد البابي الصحيح. إذا وضعت بعيداً جداً داخل الكبد، وسوف perfused الفصوص طفيفة فقط. يجب أن تكون الحافة فقط أدناه فروع الوريد البابي الأيمن والأيسر. ميزة استخدام قسطرة مركب البوليمر عبر إبرة أن بارب الإبرة المسيل للدموع على المنوال خلال نضح من قسطرة على الأرجح. ثانيا، تحديد كمية ونوعية كولاجيناز كفاءة الهضم الكبد. في هذا الإجراء، واستخدمت كولاجيناز المؤهلين مسبقاً نوع 4 وأنه هو حراكه في 0.5 ملغ/مل في المخزن المؤقت 2 إذا كان النشاط كولاجيناز تكون جزيئي أكبر من 900 وحدة دولية.
في نهاية نضح كولاجيناز، ينبغي أن تحتفظ الكبد تان مظلمة إلى حد ما إلى اللون البنى. إذا كان لون تان ضوء، ثم خلايا الكبد معظم القتلى. الكبد وينبغي أن تكون تتهاوى عندما قطعت من الماوس. في أفضل الظروف، قد يكون حصد الكبد خارج تجويف الجسم للماوس مع ملعقة صغيرة. كبد في هذا الشرط دائماً إعطاء صلاحية خلية عالية جداً. إذا كان الأمر يستغرق الكثير من الجهد لاهتزاز الخلايا عن بعضها البعض، إذا ما زال راسخا الكبد أثناء استخراج، أو إذا كان هناك الكثير من القوة اللازمة للتحرك في خلايا الكبد من خلال المرشحات، ثم خلايا الكبد سيكون صلاحية أقل. خلايا الكبد مغطاة زغيبات، مما يسمح لهم بمساحة سطحية عالية جداً (الشكل 10). غير مكتملة الهضم يحتفظ خلية خلية الوصلات بين خلايا الكبد، والقص الميكانيكية سوف تمزق غشاء البلازما. نضح في الموقع مع كولاجيناز هو أفضل طريقة للتفكك من الخلايا والمحافظة على سلامة عالية. في الشكل 11، قورنت اثنين تتمثل الاستعدادات في الذي الكريات الخلية بعد قليل يغسل في المخزن المؤقت 1. بيليه على اليسار أخف ويحتوي على بقاء خلية حوالي 50%. بيليه على اليمين أغمق وجدوى من 92 في المائة. وبالمثل، عند سكب السائل من 50 مل المخروطية، ثابتة داخل الأنبوب، على عكس بيليه أخف، الذي سوف الشريحة في الأنبوب كما سكب السائل قبالة بيليه أكثر قتامة. بقاء الخلية السفلي أو بيرفوسيونس غير فعالة قد تحدث عندما الكبد يحتوي على مستويات عالية من التصلب.
منذ خلايا الكبد الحية لها كثافة أعلى من خلايا الكبد الميت، سيؤدي إلى إجراءات الطرد المركزي استعدادا نقية جداً في خلايا الكبد سليمة15. إذا لم يكن هناك كمية كبيرة من خلايا الكبد الميت (الذي غالباً ما يحدث عندما تكون الشروط الأمثل)، يعيش الخلايا قد تكون زيادة إثراء وفصلها عن الخلايا الميتة باستخدام التدرجات حماية الأصناف النباتية. منذ خلايا الكبد الحية بيليه أسرع من خلايا الكبد الميت، بالإضافة إلى ذلك، سوف أيضا زيادة نسبة مباشرة إلى الخلايا الميتة في بيليه التطلع للأعلى 3rd لبيليه. تكون هذه الإجراءات سريعة وطرق سهلة لفصل مباشر من خلايا الكبد الميت وخلية الحطام عند الحاجة10،16. وهذا مفيد بشكل خاص إذا كانت العينة الثمينة، وفقط عدد قليل من الخلايا مليون مطلوبة للتجربة.
وفي الختام، وهذا طريقة سهلة وفعالة لحصاد خلايا الكبد وثانية من الكبد. بالأسعار الحالية، هو تكلفة القيام بهذا الإجراء بما في ذلك جميع الكواشف ومرة واحدة تحت 75 دولاراً لكل إعداد. إذا هي رغبت في الفئران متعددة، فمن الأفضل المضي قدما في تنقية تتمثل وإبقاء الكسر نواب على الجليد حتى تم تجهيز جميع الفئران. الشخصيات مستقرة بصفة عامة على الجليد لمالا يقل عن 5 ح، ولكن لم يتم اختبارها لأوقات أطول في هذا المختبر.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
ويقدم التمويل في جزء من المعاهد الوطنية للصحة من المنحة R01HL130864.
Materials
| Name | Company | Catalog Number | Comments |
| 1 L Erlenmeyer flask | Fisher Scientific | S63274 | |
| 250 mL Erlenmeyer flask | Fisher Scientific | S63271 | |
| silicone tubing | Cole-Parmer | 96400-14 | This tubing runs from the flasks through the pump to the T connector and then to the 1.0 mL syringe that is connected to the catheter. |
| Tygon tubing | Fisher Scientific | R3603 | Used as an adaptor between 96400-14 and pipettes and T connector. This may also be used for the oxygen tubing. |
| T-connectors | Cole-Parmer | EW-06294-82 | |
| Quick dissconnects | Fisher Scientific | 6150-0010 | |
| Pinch Clamps | Fisher Scientific | 6165-0002 | |
| Masterflex L/S Variable speed Pump, model 7553-70 | Cole-Parmer | EW-07559-00 | Periplastic pump with variable speed |
| Pump head, model 7014-20 | Cole-Parmer | EW-07014-20 | |
| glass graduated 1.0 mL pipettes | Fisher Scientific | 13-678 | |
| curved non-serrated scissors | Fine Science Tools | 14069-12 | |
| Dumont forceps | Fine Science Tools | 11252-20 | |
| Curved forceps | Fine Science Tools | 13009-12 | |
| 10 mL syringe | Fisher Scientific | 03-377-23 | Only barrel of syringe will be needed |
| sterlized spoon | Home supply store | ||
| Cotton ball(s) | Home supply store | ||
| Polyester sewing thread | Home supply store | ||
| Masking tape | Home supply store | ||
| thumb tacks | Home supply store | ||
| styrofoam pad | 50 mL conical rack | ||
| cookie/baking sheet | Home supply store | ||
| Absorbant underpads | Fisher Scientific | 14-206-64 | |
| 19 L water bath | Fisher Scientific | TSCOL19 | |
| BD Insyte Autogaurd Shielded IV Catheter 24 guage | Becton Dickinson | 381412 | Plastic cathetar with retractable needle |
| Crystallizing dishes 100x50 | VWR | 89000-290 | |
| Polystyrene petri dishes | Sigma Aldrich | P5481-500EA | |
| 50 mL conical tubes | Fisher Scientific | 12-565-270 | |
| graduated pipettes (5 mL) | Fisher Scientific | 170355 | |
| graduated pipettes (25 mL) | Fisher Scientific | 170357 | |
| EasyStrainer 100 μM | Greiner bio-one | 542000 | 100 μm filter |
| EasyStrainer 40 μM | Greiner bio-one | 542040 | 40μm filter |
| Sterile transfer pipettes | Fisher Scientific | 13-711-20 | |
| Refrigerated swinging bucket centrifuge | Sorvall Legend XTR | 75-217-406 | Centrifuge with swinging bucket rotar |
| Galaxy 170R tissue culture incubator | Eppendorf | CO170R-120-0000 | Humidified tissue culture incubator |
| Reagents | |||
| Name | Compound | Grams (g/L) | Millimolar (mM) |
| Buffer 1, pH 7.4 | NaCl | 8.3 | 142 |
| KCl | 0.5 | 6.7 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| Buffer 2, pH 7.4 | NaCl | 3.9 | 66.74 |
| KCl | 0.5 | 6.71 | |
| CaCl2 | 0.7 | 6.31 | |
| HEPES | 24 | 100 | |
| BSA | 15 | 0.226 | |
| Phenol Red | 0.01 | 0.03 | |
| Buffer 3, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.35 | 4.7 | |
| MgSO4 | 0.08 | 0.66 | |
| CaCl2 | 0.18 | 1.62 | |
| HEPES | 2.4 | 10 | |
| BSA | 15 | 0.226 | |
| PBS, pH 7.4 | NaCl | 8 | 137 |
| KCl | 0.2 | 2.7 | |
| Na2HPO4-7H2O | 1.15 | 4.3 | |
| KH2PO4 | 0.2 | 1.4 | |
| Other reagents | |||
| Name | Company | Catalog Number | Comments |
| Percoll (PVP solution) | GE Healthcare | 288555 | |
| Collagenase Type IV | Sigma Aldrich | C5138 | |
| Isoflurane | Abcam | ab144581 | |
| Hepatocyte Growth Medium | |||
| DMEM | Gibco | 11965118 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Long-term Hepatocyte Growth Medium | |||
| DMEM | |||
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 | |
| Glucagon | Sigma | G3157-2mg | 14 ng/mL |
| Insulin | Sigma | I9278-5mL | 0.5 U/mL |
| Hydrocortisone | Sigma | H0888-1g | 7.5 mg/mL |
| Epidermal Growth Factor | BD Biosciences | 354001-100ug | 20 ng/mL |
| LSEC medium | |||
| RPMI | Gibco | 11875119 | |
| 10% by volume fetal bovine serum | Gibco | 10437010 | |
| Pen/Strep (2x) | Gibco | 15140148 |
References
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. J Cell Biol. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods Cell Biol. 13, 29-83 (1976).
- Miller, L. L., Bly, C. G., Watson, M. L., Bale, W. F. The dominant role of the liver in plasma protein synthesis; a direct study of the isolated perfused rat liver with the aid of lysine-epsilon-C14. J Exp Med. 94 (5), 431-453 (1951).
- Edstrom, S., Ekman, L., Ternell, M., Lundholm, K. Isolation of mouse liver cells: perfusion technique and metabolic evaluation. Eur Surg Res. 15 (2), 97-102 (1983).
- Meyer, J., Gonelle-Gispert, C., Morel, P., Buhler, L. Methods for Isolation and Purification of Murine Liver Sinusoidal Endothelial Cells: A Systematic Review. PLoS One. 11 (3), 0151945(2016).
- Sies, H. The use of perfusion of liver and other organs for the study of microsomal electron-transport and cytochrome P-450 systems. Methods Enzymol. 52, 48-59 (1978).
- Smedsrod, B. Protocol for preparation of mouse liver Kupffer cells and liver sinusoidal endothelial cells. Munin open research archive. , University of Tromsø. 1-10 (2012).
- Smedsrod, B., Pertoft, H., Eggertsen, G., Sundstrom, C. Functional and morphological characterization of cultures of Kupffer cells and liver endothelial cells prepared by means of density separation in Percoll, and selective substrate adherence. Cell Tissue Res. 241 (3), 639-649 (1985).
- Meyer, J., Lacotte, S., Morel, P., Gonelle-Gispert, C., Buhler, L. An optimized method for mouse liver sinusoidal endothelial cell isolation. Exp Cell Res. 349 (2), 291-301 (2016).
- Kreamer, B. L., et al. Use of a low-speed, iso-density percoll centrifugation method to increase the viability of isolated rat hepatocyte preparations. In Vitro Cell Dev Biol. 22 (4), 201-211 (1986).
- Meijer, D. K., Keulemans, K., Mulder, G. J. Isolated perfused rat liver technique. Methods Enzymol. 77, 81-94 (1981).
- Gopalakrishnan, S., Harris, E. N. In vivo liver endocytosis followed by purification of liver cells by liver perfusion. J Vis Exp. (57), e3138(2011).
- Cook, M. J. The Anatomy of the Laboratory Mouse. , Academic Press. 2008 edn (1965).
- Liu, J., et al. Advanced Method for Isolation of Mouse Hepatocytes Liver Sinusoidal Endothelial Cells, and Kupffer Cells. Methods Mol Biol. 1540, 249-258 (2017).
- Knobeloch, D. E., Ehnert, S., Schyschka, L., Buchler, P., Schoenberg, M., Kleeff, J., Thasler, W. E., Nussler, N. C., Godoy, P., Hengstler, J., Nussler, A. K. Human Hepatocytes: Isolation, Culture, and Quality Procedures. Methods in Molecular Biology. 806, 99-120 (2012).
- Clarke, B. L., Weigel, P. H. Recycling of the asialoglycoprotein receptor in isolated rat hepatocytes. ATP depletion blocks receptor recycling but not a single round of endocytosis. J Biol Chem. 260 (1), 128-133 (1985).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved