Method Article
تتبع الزمني للتقدم دورة الخلية باستخدام التدفق الخلوي دون الحاجة إلى مزامنة
In This Article
Summary
يصف هذا البروتوكول استخدام bromodeoxyuridine (BrdU) امتصاص للسماح تتبع الزمني للخلايا التي كانت في المرحلة S في نقطة محددة في الوقت المناسب. إضافة الأصباغ الحمض النووي ووضع العلامات الأجسام المضادة تسهل تحليل مفصل لمصير الخلايا مرحلة S في أوقات لاحقة.
Abstract
This protocol describes a method to permit the tracking of cells through the cell cycle without requiring the cells to be synchronized. Achieving cell synchronization can be difficult for many cell systems. Standard practice is to block cell cycle progression at a specific stage and then release the accumulated cells producing a wave of cells progressing through the cycle in unison. However, some cell types find this block toxic resulting in abnormal cell cycling, or even mass death. Bromodeoxyuridine (BrdU) uptake can be used to track the cell cycle stage of individual cells. Cells incorporate this synthetic thymidine analog, while synthesizing new DNA during S phase. By providing BrdU for a brief period it is possible to mark a pool of cells that were in S phase while the BrdU was present. These cells can then be tracked through the remainder of the cell cycle and into the next round of replication, permitting the duration of the cell cycle phases to be determined without the need to induce a potentially toxic cell cycle block. It is also possible to determine and correlate the expression of both internal and external proteins during subsequent stages of the cell cycle. These can be used to further refine the assignment of cell cycle stage or assess effects on other cellular functions such as checkpoint activation or cell death.
Introduction
تقييم ميزات دورة الخلية والتغيرات التي تحدث في الخلايا أثناء تقدم دورة الخلية هو أمر أساسي لفهم جوانب كثيرة من الأحياء، لا سيما بيولوجيا السرطان. العديد من وكلاء في التنمية لعلاج الأورام الخبيثة يكون لها آثار عميقة على تقدم دورة الخلية أو لحث على موت الخلايا عبر دورة الخلية الآليات التي تعتمد على. من أجل دراسة ديناميات دورة الخلية أو الخلايا في مرحلة معينة من مراحل دورة الخلية، ومن المعتاد لمزامنة الخلايا. ومع ذلك أساليب التزامن يمكن أن يكون لها آثار ضارة على خلايا التي تجري دراستها، يحتمل أن يفند النتائج التي تم الحصول عليها. 1 تحليل الآونة الأخيرة استخدام البروتينات الموسومة fluorescently التي تكون موجودة إلا في مراحل معينة من دورة الخلايا ويسمح للتقدم دورة الخلية في الخلايا واحد على مر الزمن 2، إلا أن الخلايا لدراستها الحاجة إلى معالجته وراثيا للتعبير عن هذه البروتينات الموسومة مما يحد من وإلى أنظمة حيث هذا يمكن قراءةحققت إيلي.
تتكون دورة الخلية من مرحلتين النشطة: مرحلة التوليف (S)، حيث يتم نسخ DNA والانقسام (M) حيث انقسام الخلية تأخذ مكان. يتم فصل هذه المراحل من خلال ثلاث مراحل الفجوة، G 0، G 1 و 2 G. G 0 أو السكون، هو مرحلة الراحة حيث ترك الخلية دورة، G 1 حيث تزيد من الخلايا في الحجم قبل تكرار الحمض النووي وG 2 حيث يستمر نمو الخلايا بين الانتهاء من تكرار الحمض النووي ولكن قبل انقسام الخلية. يتم التحكم في تطور من خلال دورة الخلية من قبل عدد من نقاط التفتيش. تنشيط G 1 نقطة تفتيش عندما تكون الظروف البيئية ليست داعمة لتخليق DNA ويمنع دخول مرحلة S. ويمكن أن تظهر نقطة تفتيش المرحلة داخل S أو تأخير من قبل الحمض النووي من التلف الذي قد يؤدي إلى تكرار الشوك المتوقفة. خلال G 2 تأكيد الإخلاص من الحمض النووي تتكرر وإذا تم الكشف عن الأضرار ثم G 2 نقطة تفتيش سمحت إصلاح الحمض النووي قبل انقسام الخلايا. A نقطة تفتيش النهائي خلال الانقسام يضمن أن الصبغيات تم محاذاة بشكل صحيح في لوحة الإنقسامية حتى يمكن الانتهاء من هذا الانقسام الخلوي بنجاح. يستخدم 3 تفعيل هذه الحواجز عادة لمزامنة السكان الخلية. نقاط التفتيش دورة الخلية يمكن تفعيلها من خلال عدد من العوامل ولكن في بيولوجيا السرطان الأكثر شيوعا هو الكشف عن الحمض النووي من التلف. تبدأ الاستجابة الحمض النووي من التلف من قبل مثل PI3 كيناز توسع الشعريات تحركات ترنح وRad3 ذات الصلة (ATR) وترنح توسع الشعيرات تحور (ATM) التي تنشط تحركات المستجيب المصب Chk1 وChk2، على التوالي. 3 وهناك مجموعة من الأحداث ينشط Chk1 بما المتوقفة تكرار الشوك، crosslinks DNA، وأضرار الأشعة فوق البنفسجية في حين يتم تنشيط Chk2 المقام الأول عن طريق الكسر مزدوج الحبل.
الطريقة المعتادة لدراسة تأثير الظروف المتغيرة على طول ط دورة الخليةالصورة لمزامنة الخلايا في مرحلة معينة من مراحل دورة الخلية. 1 وهذا لا يمكن أن يتحقق من خلال عدة طرق. الخلايا يمكن جسديا منعزلة على أساس الحجم والكثافة، مبعثر الجانب (التفاصيل)، وعلامات التعبير سطح الخلية. أكثر عمليا، قد تكون متزامنة الخلايا عن طريق الوسائل الكيميائية. عدة عوامل مثل الثيميدين، هيدروكسي يوريا والسيتوزين الأرابينوزيد يمكن أن تستخدم لتثبيط تخليق DNA في المرحلة S من دورة الخلية مما يؤدي إلى تراكم الخلايا في مرحلة S التي لا تزال ركوب الدراجات بعد إزالة العوامل. خلايا تعامل مع نوكودازول، الذي يمنع تشكيل المغزل الإنقسامية والاعتقال مع G 2 - أو M-مرحلة محتوى الحمض النووي. القضاء على المصل من نتائج مستنبت في تراكم الخلايا في G 0 المرحلة. إعادة بالإضافة للمغذيات داخل المصل ثقافة إعادة يبدأ ركوب الدراجات العادية للخلايا. ومع ذلك، كل من هذه الأساليب تزامن تتداخل مع ركوب الدراجات العادية ونمو الخلايا ويمكن بالنتيجهتي في موت الخلايا كبيرة.
تزامن خلايا سرطان الدم الليمفاوي الحاد هو تحديا من نوع خاص، وهذه الخلايا ليست قابلة للتلاعب الجيني. الطريقة الموصوفة هنا يسمح تقييم ديناميكيات دورة الخلية ودراسة الخلايا في مراحل معينة من دورة الخلية دون تزامن التقليدي أو التعديل الوراثي. هذه الطريقة قد تكون مفيدة لأنواع الخلايا الأخرى التي لم تتحقق التعديل الوراثي وتزامن الإجراءات التقليدية بسهولة أيضا. وتستند هذه الطريقة على استخدام عريقة من bromodeoxyuridine (BrdU) التأسيس، والذي له تأثير ضئيل جدا على النمو على المدى القصير وتكاثر الخلايا. 4 بروتوكولات BrdU تأسست الاستفادة من إدماج BrdU الى الحمض النووي مركبة جديدة خلال المرحلة S . هذا يمثل بشكل دائم الخلايا بأنها كانت في المرحلة S أثناء التعرض BrdU. يمكن التعرف على هذه الفئة من السكان في نقطة زمنية لاحقة من قبل تلطيخ لBrdU incorporأوجه، وبالتالي يكون بمثابة السكان متزامنة التي يمكن اتباعها وتقييمها على مر الزمن السماح دراسة آثار المخدرات على دورة الخلية العبور. يحتاج BrdU أن تتعرض قبل تلوين الأجسام المضادة، التي تحققت عادة بعد الدناز أو العلاج حامض. 6،7 عن طريق التدفق الخلوي للكشف BrdU أدرجت يمكن إدراج علامات إضافية. والأهم هو استخدام الأصباغ لقياس محتوى الحمض النووي، مما يتيح تقييم دورة الخلية توزيع المرحلة من الخلايا التي كانت في المرحلة S في بداية الدراسة. ويمكن أيضا 8 السطح أو داخل الخلايا المستضدات وعلاوة على ذلك إضافية دراستها. 9 هذه قد تتعلق بأحداث دورة الخلية مثل Ki67 أو ميزات الخلية لتبدو غير ذات صلة مثل علامات موت الخلايا المبرمج مثل المشقوق كاسباس 3. التطبيقات المحتملة محدودة من الخيال المحقق.
Protocol
بروتوكول الموصوفة هنا يستخدم الليمفاوي خط خلية سرطان الدم الحاد NALM6 لكن يمكن تطبيقها على أنواع الخلايا الأخرى.
1. حلول والكواشف
- كامل RPMI
- إضافة 56 مل مصل العجل الجنين (FCS) و 5.5 مل من 200 ملي L-الجلوتامين لزجاجة 500 مل من المتوسط RPMI-1640.
- BrdU محلول المخزون
- إعداد 32.5 ملي BrdU (10 ملغ / مل) في Dulbecco والفوسفات مخزنة المالحة (DPBS).
- BrdU كاملة RPMI
- إضافة 6.2 ميكرولتر من BrdU حل سهم إلى 10 مل من RPMI كاملة.
- الدناز الحل
- إعداد 1 ملغ الدناز / مل في DPBS.
- تلطيخ العازلة
- إعداد 3٪ الحرارة المعطل FCS و0.09٪ أزيد الصوديوم في DPBS.
- الرجوع إلى قائمة المواد اللازمة للتعريفات التثبيت العازلة، Permeabilization العازلة وغسل العازلة.
2. خلايا
لاوكانت الزنازين لا تربيتها لمدة تزيد عن 6 أشهر: الشركة المصرية للاتصالات. هذا الأسلوب هو قابل للتكيف مباشرة إلى أي خط الخلايا غير ملتصقة مع تعديلات لكثافة الخلايا وسائل الإعلام والثقافة. استخدام الخلايا التي تنمو باطراد في بدء التجربة.
- الحفاظ على خلايا NALM6 في قوارير ثقافة T-75 في استكمال RPMI. تنفيذ جميع الخطوات تحت ظروف معقمة باستخدام الدرجة الثانية للسلامة الأحيائية مجلس الوزراء.
- الحفاظ على خلايا NALM6 بين 1-2 × 10 6 خلايا لكل مل عن طريق تقسيم ثقافة ثلاث مرات أسبوعيا.
- احتضان عند 37 درجة مئوية في 5٪ CO 2 في الهواء.
3. نبض صفها من الخلايا مع BrdU
تنبيه: التعامل مع BrdU مع الرعاية كما هو المغير المحتملين ومشوه.
- خلايا الطرد المركزي في 150 x ج لمدة 5 دقائق. ملاحظة: نقل الخلايا إلى وسائل الإعلام الجديدة يحسن من استنساخ النتائج.
- إجراء تعداد خلايا والخلايا resuspend في كامل RPMI في 2 × 10 6 جملتعلمي اللغة اإلنكليزية / مل.
- تمييع الخلايا 1 في 2 مع BrdU كاملة RPMI إنتاج تركيز الخلية النهائي من 1 × 10 6 خلية / مل.
- احتضان عند 37 درجة مئوية مع CO 2 5٪ لمدة 45 دقيقة، ثم تمييع الخلايا 1 في 10 مع كامل RPMI. خلايا الطرد المركزي في 150 x ج لمدة 5 دقائق وبعناية تجاهل كل من طاف.
- Resuspend الخلايا في حجم صغير (~ 100 ميكرولتر) لاستكمال RPMI، بإجراء عدد خلايا والتكيف مع 1 × 10 6 خلية / مل.
- ماصة 1 مل من الخلايا في الآبار من 48 لوحة جيدا. ماصة 1 مل من DPBS إلى أية آبار غير مأهولة للحصول على نتائج أكثر استنساخه.
- احتضان عند 37 درجة مئوية في 5٪ CO 2 في الهواء لمدة timepoints المطلوب، هنا 1، 2، 3، 4، 5، 6، 7، 8، 9، 10، 11، 12، 13، 14، 15، 16، 17 ، 18، 19، 20، 21، 22، 23، و 24 ساعة. ملاحظة: إن طول الفترة الزمنية تعتمد على ما يهدف التصميم التجريبي لقياس.
- نقل جميع الخلايا في أنابيب FACS باستخدام ماصة. شطف بالتتابع جيدا مع 1 مل voluMES من برنامج تلفزيوني إلى الحجم الكلي النهائي من 5 مل.
- أجهزة الطرد المركزي في 150 x ج لمدة 5 دقائق وإزالة بعناية كل طاف. الخلايا جاهزة للتلوين، تؤدي هذه (القسم 4) على الفور.
تلطيخ 4. خلية
ملاحظة: إذا كان مطلوبا تلطيخ سطح الخلايا تنفيذ ذلك قبل التثبيت، وضمان أن الخلايا يتم الاحتفاظ في 4 ° C طوال الوقت.
- Resuspend الخلايا في 100 ميكرولتر من العازلة تلطيخ (لتلطيخ السطح اختياري، إضافة حجم الموصى بها من الأجسام المضادة على سطح المستضدات واحتضان لمدة 30 دقيقة في 4 درجة مئوية).
- إضافة 1 مل من العازلة تلطيخ، الطرد المركزي لمدة 5 دقائق في 150 x ج وتجاهل طاف.
ملاحظة: الأجسام المضادة النوعية والتركيز، وفترة حضانة وما إلى ذلك سوف يختلف وفقا لأهداف تجريبية محددة. - تثبيت وPermeabilization
- الخلايا resuspend في 100 ميكرولتر من العازلة التثبيت واحتضان لمدة 15 دقيقة في درجة حرارة الغرفة.
- إضافة 1 مل سو غسل العازلة، الطرد المركزي لمدة 5 دقائق في 150 x ج وتجاهل طاف.
- الخلايا resuspend في 100 ميكرولتر من العازلة permeabilization واحتضان الخلايا لمدة 10 دقيقة على الجليد.
- إضافة 1 مل من غسل العازلة، الطرد المركزي لمدة 5 دقائق في 150 x ج، وتجاهل طاف.
- الخلايا resuspend في 100 ميكرولتر من تثبيت العازلة في أنبوب واحتضان لمدة 5 دقائق في درجة حرارة الغرفة.
- إضافة 1 مل من غسل العازلة، الطرد المركزي لمدة 5 دقائق في 150 x ج، وتجاهل طاف.
ملاحظة: يمكن إيقافها مؤقتا بروتوكول هنا إذا لزم الأمر. خلايا ثابتة مستقرة لعدة أيام في 4 درجات مئوية إذا معلق في المخزن تلطيخ. إزالة المنطقة العازلة تلطيخ التالية الطرد المركزي قبل المتابعة.
- الدناز العلاج
- Resuspend الخلايا في 100 ميكرولتر من محلول الدناز (30 ميكروغرام من الدناز / 10 6 خلايا)، واحتضان الخلايا لمدة 1 ساعة على 37 درجة مئوية.
- إضافة 1 مل من غسل العازلة، الطرد المركزي في 150 x ج لمدة 5 دقائق وتجاهل طاف.
- تلوين الأجسام المضادة
ملاحظة: تلطيخ لعلامات داخل الخلايا الأخرى من BrdU لا يمكن أن يؤديها في وقت واحد مع تلطيخ BrdU.- هام: إعداد ضوابط التعويض يتألف من خلايا غير ملوثين والخلايا المسمى مع كل تألقي واحد. من الناحية المثالية، استخدام نفس الأجسام المضادة للضوابط التعويض عن تلك المستخدمة في أنابيب التجريبية. ومع ذلك، إذا لم يكن ذلك ممكنا، والأجسام المضادة بديلة لمستضدات أعرب غاية مترافق إلى نفس تألقي.
- resuspend الخلايا في 50 ميكرولتر من غسل العازلة وإضافة 1 ميكرولتر / 10 6 خلايا BrdU الأجسام المضادة. ملاحظة: يمكن أيضا الأجسام المضادة مترافق مباشرة إلى غيرها من مستضدات الخلايا المحددة تضاف.
ملاحظة: الأجسام المضادة للهيستون H3 فسفرته على Ser10 يمكن استخدامها للتمييز بين الخلايا في G2 وM، هيستون H3 هو مفسفر على Ser10 خلال الانقسام 10 أضداد cdc2 مفسفر على Tyr15 يمكن استخدامها للكشف عن الخلايا التي هفالبريد ملتزمون الانقسام. 11 - احتضان الخلايا لمدة 20 دقيقة في درجة حرارة الغرفة.
- إضافة 1 مل من غسل العازلة، والخلايا الطرد المركزي في 150 x ج لمدة 5 دقائق وتجاهل طاف.
- DNA وصمة عار لتحليل دورة الخلية
- تخفيف بيليه وإضافة 20 ميكرولتر من الحل 7-AAD (0.25 ميكروغرام). ملاحظة: فمن الأهمية بمكان أن استخدام كمية ثابتة من 7 AAD / خلية.
- resuspend الخلايا في 1 مل من العازلة تلطيخ.
5. جمع بيانات التدفق الخلوي
ملاحظة: الجهاز المطلوبة تعتمد على عدد وطبيعة fluorochromes المستخدمة.
- جمع المعلمات التالية: FSC-A، SSC-A، FSC-H (FSC-W يمكن أن تستخدم بدلا من FSC-H) و 7 AAD مضان على مقياس خطي. جمع القناة APC على نطاق السجل. جمع أي قنوات إضافية مطلوبة لتقييم السطحية أو الداخلية التسميات باستخدام مقياس السجل.
- أداء كومpensation تداخل الإشارات في أطياف الانبعاثات لوحظ بين fluorochromes مختلف قبل تحليل العينات. ملاحظة: معظم أجهزة قياس التدفق الخلوي تنفيذ هذا تلقائيا.
- جمع ما لا يقل عن 10000 الأحداث لكل عينة.
6. تحليل التدفق الخلوي البيانات
ملاحظة: تم استخدام FlowJo في هذه الدراسة لتحليل التدفق الخلوي البيانات ولكن حزم البرامج الأخرى يمكن أن تستخدم أيضا. ويتضح الاستراتيجية النابضة في الشكل 1.
- تحديد السكان خلية قابلة للحياة باستخدام FSC-A وSSC-A المعلمات.
- ضمن هذه الفئة من السكان استبعاد الحلل والركام باستخدام FSC-A وFSC-H (FSC-W يمكن أن تستخدم أيضا هنا).
- ضمن هذه الفئة من السكان تعيين مؤامرة نقطة باستخدام 7-AAD على محور س وBrdU-APC على المحور الصادي.

الشكل 1: استراتيجية المحاصرة اليسار سنويا.نيل: وتظهر الخلايا ungated على FCS-A مقابل SSC-A مؤامرة نقطة. يتم التعرف على السكان خلية قابلة للحياة بوابة مبين. وتظهر الخلايا المغلقة من لوحة اليسرى على FSC-A مقابل FSC-H مؤامرة نقطة (يمكن استخدامها بدلا من ارتفاع FSC-W): مركز اللوحة. يتم تحديد الحلل والركام، ويستثنى من الباب مبين. اللوحة اليمنى: وتظهر الخلايا المغلقة من تاريخ الاستبعاد صدرة في لوحة مركز على 7-AAD مقابل APC-A مؤامرة نقطة. هو المسمى الضد BrdU مع APC يتيح التعرف على الخلايا التي أدرجت BrdU خلال وضع العلامات النبض. تقدم 7-AAD معلومات عن محتوى الحمض النووي. وتعرف بوابة العليا خلايا إيجابية لBrdU وبالتالي في المرحلة S في وقت نبض BrdU، البوابة اليسرى السفلى، والخلايا في G 0/1 والبوابة اليمنى السفلى تلك الموجودة في G 2 / M. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
- دورة الخلية A nalysis
- فتح ملف البيانات الأولى وبوابة على الخلايا في البوابة صدرة الاستبعاد.
- تحليل هذه الفئة من السكان لتوزيع دورة الخلية (الموجود ضمن منصات في مجال البرمجيات FloJo) واستخدام نموذج دين-جيت-فوكس.
- الحصول على مواقف G 0/1 وG 2 / M قمم باستخدام إنشاء البوابات.
- بوابة على خلايا BrdU إيجابية وتخضع هذه الفئة من السكان لنفس التحليل دورة الخلية.
- توفير مواقف للG 0/1 وG 2 / M قمم من خلال تطبيق نفس البوابات من إنشاء البوابات ووضع القيود (باستخدام البوابات خلق) لمواقف G 0/1 وG 2 / M القمم. ويتضح ذلك في لوحات 2 الأولى من الشكل 2.
ملاحظة: يمكن أيضا برامج أخرى يمكن استخدامها لتحليل البيانات وان تعليمات تختلف وفقا لذلك.
840 / 52840fig2highres.jpg "العرض =" 700 "/>
وبوابات تقدم دورة الخلية الفريق الأول (جميع خلايا) على السكان الخلية التي حددها بوابة صدرة الاستبعاد: الرقم 2. تم عرض هذه الفئة من السكان في الرسم البياني مع 7-عاد على المحور X. يشار إلى ذروة G 0/1 الذروة التي كتبها السهم الموجود أسفل المحور. في لوحات لاحقة تم بوابات الخلايا إيجابية BrdU على النحو المبين في الشكل رقم 1. يتم تطبيق قيمة لل0/1 موقف G الحصول عليها عندما المعزولة من بوابة صدرة الإقصاء للخلايا BrdU إيجابية بوابات داخل FlowJo برنامج دورة الخلية. تم بوابات كل لوحة لاحقة على السكان إيجابي BrdU كما هو مبين في الشكل (1) وموقف G 0/1 الذروة على أساس القيمة التي تم الحصول عليها عند تحليل جميع السكان كما هو موضح في لوحات الأولين. باستخدام جزء سلبي BrdU لتحديد الموقع من السكان G 0/1 للخلايا إيجابية BrdU في نفس عصيدةلو تسيطر لأي الاختلافات الطفيفة في كثافة وصمة عار الحمض النووي بين العينات. الرقم الظاهر في كل لوحة يمثل الوقت منذ انتهاء نبض BrdU. وترد محسوبة مراحل دورة الخلية باللون الأخضر مظللة. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
النتائج
ويمكن استخدام هذه المنهجية للحصول على مجموعة من المعلومات. وترد عدد قليل من الطلبات هنا.
تقييم مدة دورة الخلية
لتحديد الوقت اللازم للخلايا إلى المرور عبر دورة الخلية، ويتم حصاد الخلايا في نقاط زمنية مختلفة بعد نبض BrdU. الفواصل بين التقييمات يمكن تكييفها لخلايا معينة يجري تحليلها. كانت خطوط الخلايا المكونة للدم تقييم كل ساعة على مدى فترة 24 ساعة في حالة عدم وجود أي العلاج الدوائي لتحديد طول مراحل دورة الخلية في ظل ظروف ثقافة القياسية. يبين الشكل 2 مجموعة مختارة من التحليل لقطة من خلايا NALM6 على مدى فترة 24 ساعة. الخلايا في S المرحلة في وقت نبض BrdU (أي داخل البوابة الأكيدة BrdU في الشكل 1) تقدم من خلال G 2 / M، وبلغت ذروتها من الخلايا في تلك المرحلة من مراحل دورة الخلية التي يجري الكشف عن 10 ساعة بعد BrdU صulse. بلغت نسبة الخلايا BrdU المسمى في المرحلة S في ساعة الحضيض بعد 14 نبض وكان جميع الخلايا تقريبا عادت إلى G 1 بعد 17 ساعة. قبل 24 ساعة من نسبة الخلايا BrdU المسمى قد دخلت مرة أخرى مرحلة S كجزء من دورة الخلية التالية التي تشير إلى أن الخلايا يمكن إكمال دورة الخلية في غضون 24 ساعة، ولكن معظم لم تدخل بعد جولة ثانية من تكرارها، بما يتفق مع معروف 36 ساعة مضاعفة الوقت لهذه الخلايا.
توزيع دورة الخلية يمكن مزيد من الصقل من خلال إدراج علامات إضافية. على سبيل المثال، بالإضافة إلى وجود الأجسام المضادة للهيستون H3 فسفرته على Ser10 (علامة من الخلايا في الانقسام) تسمح للتمييز الخلايا في الانقسام من تلك الموجودة في G 2 (من اليسار وحات من الشكل 3).

الرقم 3: التأكيدمن دورة الخلية المرحلة عن طريق علامات إضافية. وتظهر الألواح العلوية تحليل دورة حياة الخلايا من بوابة الإيجابية BrdU كما هو مبين في الشكل 1، وقد حضنت الخلايا في وجود أو عدم وجود 3 نانومتر فينكريستين لمدة 18 ساعة بعد نبض BrdU . أجري تحليل دورة الخلية كما هو موضح في الشكل (2). وتظهر الألواح أقل نفس الخلايا على 7-AAD مقابل هيستون H3 فسفرته على Ser10 مؤامرة نقطة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
تقييم آثار المخدرات على دورة الخلية
يمكن كلاء السامة للخلايا لديها آثار عميقة على التقدم دورة الخلية ويمكن أن تحدث موت الخلايا. تأثير المخدرات على تقدم دورة الخلية يمكن تقييمها عن طريق إضافة الأدوية من الفائدة في أعقاب نبض BrdU. وترد مثالين. كان أول الحالة التي تكون فيها تحريض سمرتبك موت الخلايا و تحليل البيانات دورة الخلية (لوحات اليمين في الشكل 3). تعرضت الخلايا NALM6 إلى 3 نانومتر فينكريستين لمدة 18 ساعة بعد نبض BrdU. كان من المتوقع أن اعتقال في الانقسام كأهداف فينكريستين الأنابيب الدقيقة الخلايا. ومع ذلك اقترح تحليل دورة الخلية أن الخلايا لم القبض لكن عبروا إلى G 0/1 (الشكل 3 اللوحة اليمنى العليا). وأظهرت إضافة أجسام مضادة لهيستون H3 فسفرته على Ser10 أن الخلايا لم خرجت الانقسام (الشكل 3 اللوحة السفلى اليمنى)، على الرغم من وجود محتوى الحمض النووي المنخفض. فمن المرجح أن المحتوى DNA وانخفض لأن الخلايا يخضعون لعملية موت الخلايا المبرمج وبدأت في التدهور الحمض النووي. منذ الخلايا بدأت الخلايا أثناء الانقسام (أي مع 4N DNA)، فإنها تبدو وكأنها S مرحلة أو G 0/1 الخلايا بدلا من نموذجية أفكارك الفرعية G 1 الذروة.
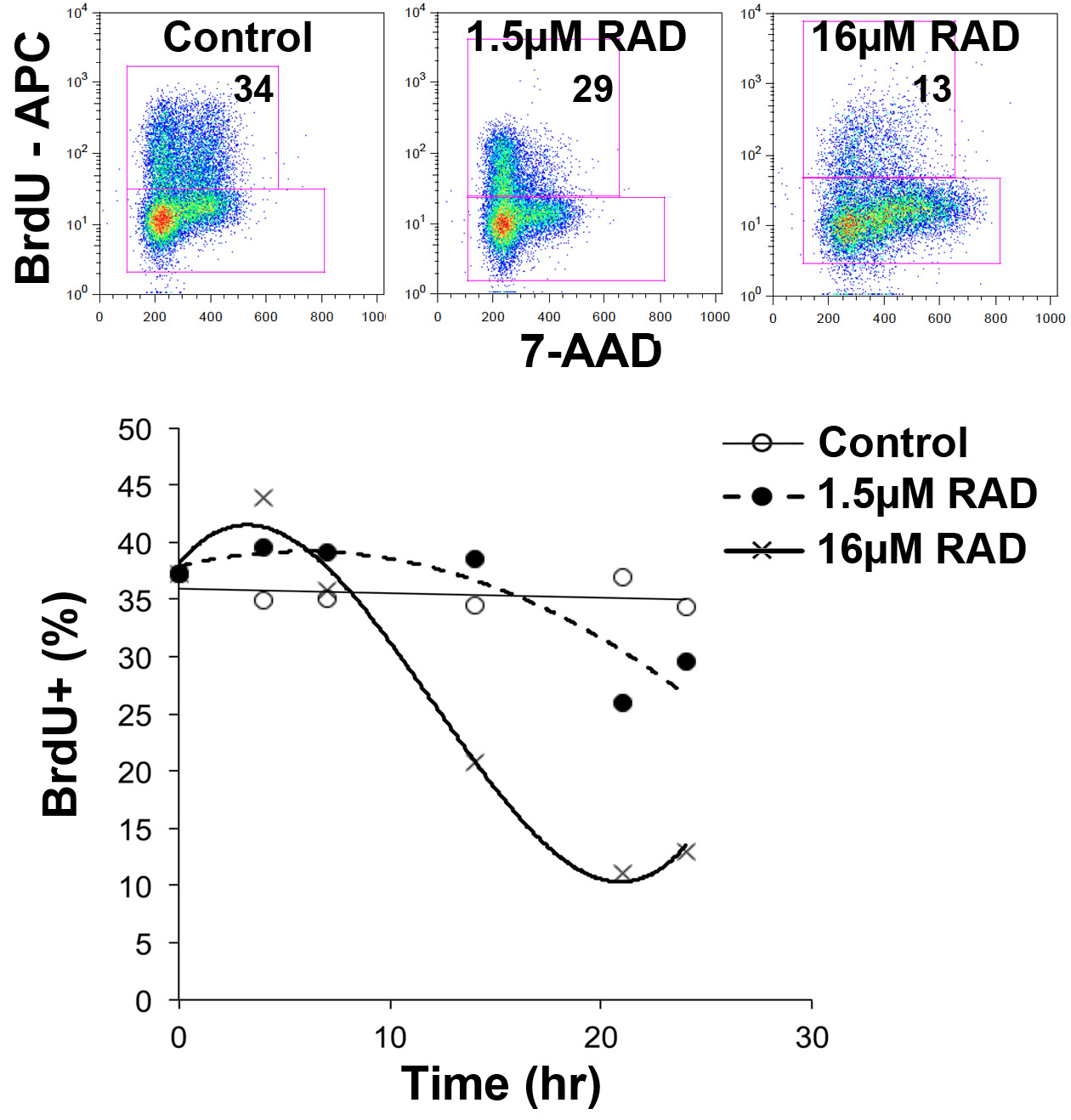
الرقم 4: الكشف عن دورة الخلية المرحلة القتل محددة تظهر المؤامرات نقطة النسبة المئوية للخلايا BrdU إيجابية المتبقية في ساعة الثقافة 24 بعد نبض BrdU. قد مثقف الخلايا في وجود أو عدم وجود سيارة وحده (التحكم)، 1.5 أو 16 ميكرومتر RAD001 منذ نهاية نبض BrdU. تظهر لوحة أقل نسبة الخلايا التي كانت BrdU إيجابية على حضانة 24 ساعة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
وفي مثال آخر، ويبين الشكل 4 كيف في وجود تركيز منخفض من RAD001 (مثبط mTOR س) خلايا تمكنوا من إتمام دورة الخلية ولكن بعد ذلك خضع لتأخير أو إلقاء القبض عليهم في G 0/1. A تركيز أعلى من RAD001 منعت إلى حد كبير الخلايا من هيئة تنظيم الاتصالاتnsiting من خلال لG 0/1. عرضت الخلايا الأهم في المرحلة S (أي BrdU إيجابي) لتختفي بشكل تفضيلي من الثقافة عندما أضيف RAD001. وهذا يشير إلى أن الخلايا التي تمر عبر G 2 / M كانوا أكثر عرضة للموت الخلايا بواسطة هذا العامل. 12
ومن الممكن أيضا لدراسة استجابات الخلايا في مراحل معينة من دورة الخلية باستخدام الأجسام المضادة لمستضدات معينة. في الشكل (5) تفعيل نقطة تفتيش دورة الخلية السيطرة على البروتينات Chk1 وChk2 في الاستجابة للعلاج فينكريستين هو مبين. يتم تنشيط Chk1 وChk2 من قبل الفسفرة على Ser345 وThr68 على التوالي. ويمكن رؤية تفعيل Chk1 وChk2 في الخلايا التي يبدو أن لها محتوى الحمض النووي 2N ولكن كما هو موضح في الشكل من المحتمل أن تكون الخلايا في الانقسام التي بدأت تدهور DNA نتيجة لموت الخلايا المبرمج 5.
فمن الممكن لإضافة المخدرات على مختلف نقاط وقت بعدBrdU نبض لدراسة تأثير عامل على الخلايا في مراحل مختلفة من دورة الخلية.
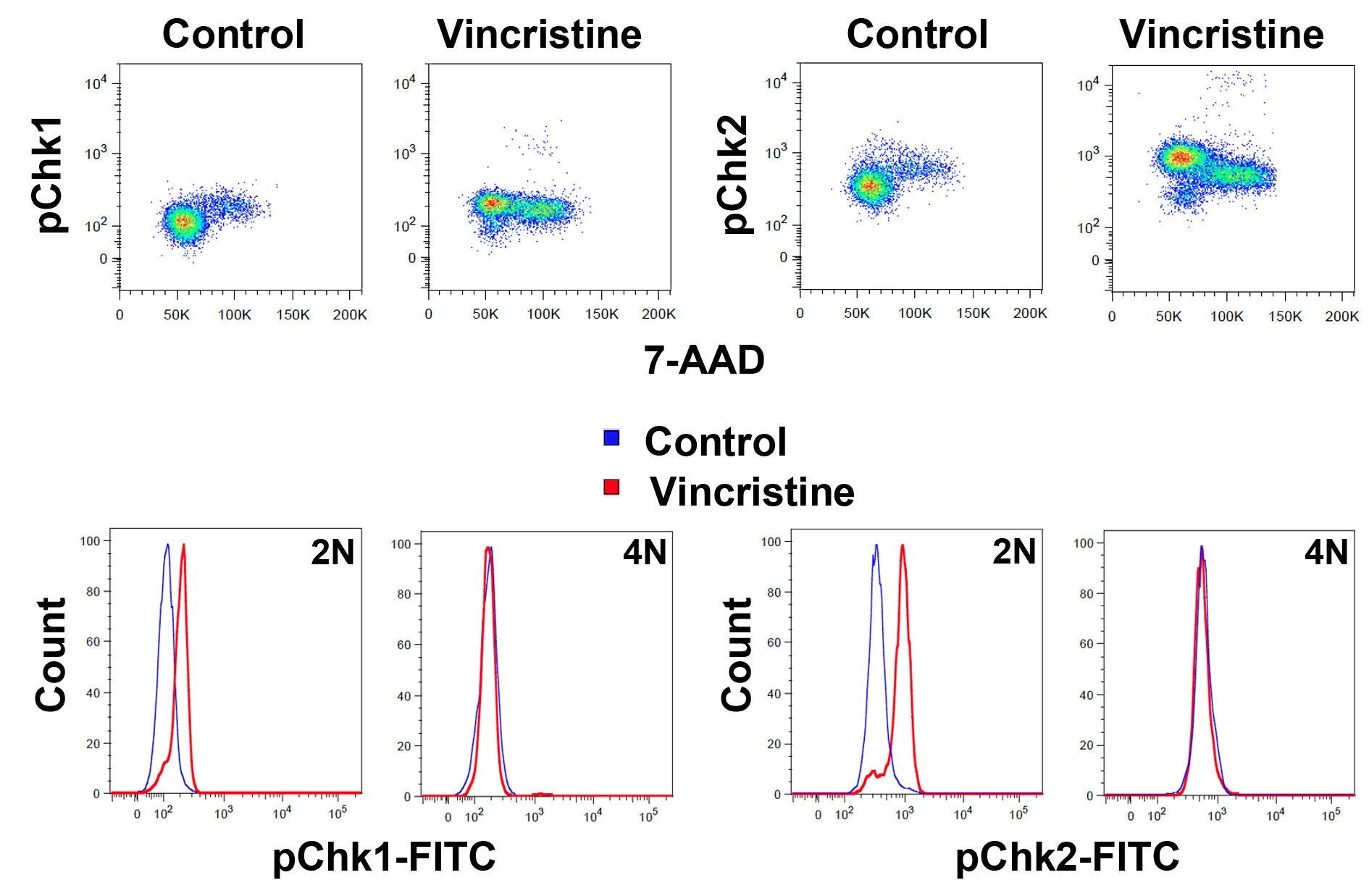
الرقم 5: الكشف عن التغييرات في الخلايا في مراحل معينة دورة الخلية وتظهر اللوحة العليا الخلايا المغلقة على الخلايا إيجابية BrdU كما في الشكل 1 في 7-AAD مقابل مفسفر Chk1 (يسار) أو Chk2 (يمين) نقطة المؤامرات. كانت الزنازين لمدة 18 ساعة الثقافة التالية نبض BrdU في وجود أو غياب 3 نانومتر فينكريستين أما الشكل (3). وتظهر الألواح أقل رسوم بيانية تراكب من نفس الخلايا المغلقة سواء على 2N 4N أو جزء كما هو مبين. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
القدرة على تحليل دورة الخلية هي مهمة لفهم بيولوجيا السرطان وآلية عمل كل من المخدرات والجينات التي تؤثر على تكاثر الخلايا والنمو. في حين أن هناك العديد من المقايسات التي يقال قياس تكاثر الخلايا، فإن الغالبية لا توفر سوى مقياس يشير إلى خلايا العدد الحالي. وتشمل هذه المقايسات التي تقيس عدد الخلايا التي تصور المباشر والعد، والنشاط الأيضي أو تركيز ATP. والميزة الرئيسية لكثير من هذه الأساليب هي أنها سهلة نسبيا لأداء وقابلة للصيغ صفيحة ميكروسكوبية والأتمتة، مما يجعلها مفيدة لفحص أعداد كبيرة من الشروط أو المركبات. وأحد أوجه القصور في العديد من هذه الأساليب هو أن فقدان الخلية الناجمة عن الوفاة لا يؤخذ بعين الاعتبار، مما قد يؤدي إلى التقليل من تكاثر الخلايا. أيضا هذه الأساليب تقيس السكان الأكبر، ولا تسمح دراسة الخلايا واحد أو عبور الخلايا من خلالدورة الخلية.
من المقايسات انتشار شائعة الاستخدام، وربما الأكثر موثوقية ودقة هي تلك التي تقيس توليف الحمض النووي. التقليدية فحوصات تكاثر الخلايا احتضان خلايا لساعات قليلة ليلة وضحاها مع 3 H-الثيميدين، والتي يتم تضمينها في الحمض النووي توليفها حديثا. 13 والمشكلة واضحة مع هذا الأسلوب هو استخدام المواد المشعة، ولكن الحد آخر هو أن التدابير نتيجة المتوسط انتشار مجموعة من الخلايا. BrdU يمكن استخدامها على نحو مماثل دون القضايا الإشعاع، على الرغم من حاجة إلى اتخاذ خطوات إضافية وBrdU هو المغير المحتملين. ومع ذلك، BrdU لديها ميزة كونها متوافقة مع التدفق الخلوي، مما يسمح تحليل الخلايا واحد. 14 التدفق الخلوي باقي الأساليب الملائمة لتقييم انتشار الخلايا على مستوى خلية واحدة تشمل عددا متزايدا من الأصباغ التي تسمية غشاء الخلية أو البروتينات الخلوية ( على سبيل المثال CFSE) التي تفرق بين daughtخلايا إيه، والأصباغ الإقحام الحمض النووي ودورة الخلية كشف مستضد معين عن طريق الأجسام المضادة. أفضل الأصباغ وضع العلامات خلية تسمح تتبع انقسام الخلايا على مدى عدد من الانقسامات الخلوية. 15 وهي توفر مقياسا مباشرا لانتشار الأسلحة النووية، على الرغم من أن ليس لديه معلومات عن مرحلة دورة الخلية أو التوزيع يتم الحصول. قياس محتوى الحمض النووي DNA باستخدام الأصباغ الإقحام مثل يوديد propidium أو 7-AAD تقديم القوي توزيع دورة الخلية 16، ولكن ليس الزمانية والبيانات. حتى مع وجود تقييم نقاط زمنية متعددة فإنه لا يزال من المستحيل تقدير طول دورة الخلية أو مراحل محددة دورة الخلية. مستضدات معينة دورة الخلية يمكن استخدامها لتقييم مرحلة دورة الخلية في خلية السكان غير المتزامنة. وتشمل مستضدات معينة دورة الخلية التي يشيع استخدامها مراحل M من دورة الخلية كي-67، 17 وهو ما يعبر عنه خلال S، G 2 ولكن ليس خلال G 0/1، PCNA (الخلايا المتكاثرة مستضد النووي) 18، والفسفرة من ساعةistone H3. 19 وبينما توفر هذه البيانات الجيدة بشأن مرحلة دورة الخلية، المعلومات المتعلقة ديناميات دورة الخلية ينقصنا.
وقد جرت العادة على فحص بالحصول على بيانات عن ديناميات دورة الخلية من خلال مزامنة الخلايا باستخدام عوامل أو شروط الثقافة التي تمنع تقدم دورة الخلية. هذا يؤدي إلى تراكم الخلايا وراء كتلة، الذي أطاح مرة واحدة، يؤدي إلى موجة من الخلايا تتقدم معا من خلال دورة الخلية. (1) حساب مدة دورة الخلية وطول مختلف مراحل دورة الخلية من الممكن بعد ذلك. الخلايا يمكن أن يتسبب في خروج الدراجات الخلية النشطة دخول G 0 بالحرمان المصل. وعند إعادة بالإضافة إلى ذلك، من المصل قد الخلايا ثم تتحرك معا في المراحل اللاحقة. 20 في حين أن هذا هو أسلوب موثوق بها لبعض أنواع الخلايا، والبعض الآخر، بما في ذلك العديد من أنواع الخلايا تحولت، تفشل في الخروج من دورة الخلية، وكثيرا ما تخضع لموت الخلايا باعتبارها نتيجة 21 في الواقع لدينا ستووفاة وجدت أن هذا الوضع لخلايا سرطان الدم الليمفاوي الحاد. وعلاوة على ذلك، فإن الخلايا غالبا ما تفشل في إعادة إدخال دورة الخلية بطريقة متزامنة بما فيه الكفاية. الطرق الكيميائية يمكن أن تستخدم للحث على اعتقال دورة الخلية في مراحل محددة من دورة الخلية. على سبيل المثال، العوامل التي تمنع تخليق الحمض النووي (على سبيل المثال يزيد الثيميدين) أو منع تشكيل المغزل الإنقسامية (على سبيل المثال نوكودازول) خلايا اعتقال في S وM مراحل على التوالي، ولكن هي مواد سامة ويمكن أن يؤدي إلى اضطرابات النمو وحتى الموت في نسبة كبيرة من الخلايا. 22 في جميع خلايا هذه الأساليب فشلت في إلقاء القبض على غالبية الخلايا من دون قتل جزء كبير. وبالنظر إلى أن الهدف هو تقييم الآثار المترتبة على مادة مضادة للابيضاض الدم المحتمل على المعلمات دورة الخلية، وكان موت الخلايا الناتجة عن تزامن غير مقبول. وعلى الرغم من وصف لعدد كبير من الطرق لمزامنة الخلايا، جميعا أوجه القصور. المشاكل الرئيسية هي: ليست كافيةتخصيب الخلايا في الجزء المطلوب من دورة الخلية، واضطرابات في علم وظائف الأعضاء العادي للدورة الخلية، أو كما لوحظ، سمية الزائدة.
الطريقة الموصوفة هنا هو امتداد بسيط لنظام النبض استخدمت لفترة طويلة، حيث يتم تحضين الخلايا لفترة وجيزة مع BrdU لتحديد الخلايا في مرحلة S. وجدنا النبض 45 دقيقة لتكون الأمثل في نظامنا ولكن يمكن استخدام فترات زمنية أقصر إذا تم الحصول على العلامات كافية. من خلال الاستمرار في خلايا الثقافة بعد إزالة BrdU أنه من الممكن أن تتبع تقدمهم خلال الفترة المتبقية من المرحلة S، G 2، الانقسام، G 1 والدخول في دورة الخلية التالية. قد يكون من الممكن لمتابعة خلايا أخرى. وميزة هذا النظام هو أنه لا يوجد أي دليل على سمية للخلايا في الإطار الزمني لهذه التجارب، وهناك أقل قدر من الاضطراب في نمو الخلايا، كما هو مطلوب فقط بضعة تغييرات وسائل الإعلام. تتم المحافظة على الخلايا على خلاف ذلك في كونتيثقافة nuous. والتدفق الخلوي طبيعة استنادا للأسلوب يعني أنه يمكن الجمع بين تحديد المجموعات السكانية الفرعية خلية سطح إضافية أو تلطيخ الخلايا. كنا APC الأجسام المضادة BrdU مترافق ولكن يمكن أن تكون بديلا تقارن أخرى لتسهيل وضع لوحات الأجسام المضادة. استخدمنا 7-AAD بدلا من يوديد propidium ل7-AAD تتفلور في قناة واحدة تعظيم خيارات متعدد الألوان تلطيخ. وبالمثل دابي أو هويشت يمكن أن تستخدم البقع DNA ولكنها تحتاج ليزر الأشعة فوق البنفسجية. السير الذاتية تشديد لتلطيخ DNA يمكن الحصول عليها باستخدام الإيثانول التثبيت ولكن هذا كثيرا ما يعرض للخطر تلوين الأجسام المضادة، مما يحد من الخيارات المتاحة لسطح إضافية أو البقع حشوية. أكبر العيب هو أنه لا يمكن ق المرحلة تستمر حوالي 8 ساعات، لذلك الخلايا المسمى قد دخلت للتو أو على وشك الخروج من المرحلة S خلال الفترة النبض. ونتيجة لذلك، وتزامن ليست ضيقة كما هو الحال في بعض الأنظمة الأخرى. ومع ذلك، من خلال الجمع بين العلامات BrdU مع الأصباغ تشير DNAالمحتوى والأجسام المضادة للبروتينات التي تعتمد دورة الخلية المحددة، ويمكن الحصول على البيانات القوية.
من أجل الحصول على بيانات متسقة من المهم للتأكد من أن الخلايا هي في التركيز الصحيح وأن تركيز الخلية هو ثابت في جميع الظروف التي تتم مقارنتها. خطيرة سطوع تلطيخ 7-AAD حساس جدا للتركيز الخلية. يمكن استخدام نظام العد الآلي خلية مساعدة على ضمان أن تركيزات الخلية متسقة في جميع العينات في كل خطوة في هذه العملية. نقطة مهمة أخرى هي طول الفترة الزمنية تتعرض الخلايا لBrdU. يمكن أن الاختلافات الصغيرة يترجم إلى اختلافات كبيرة، ولذلك فمن المهم أن جميع العينات يتم تحضين مع BrdU لبدقة نفس الوقت. وأخيرا، من المهم أن يعاير الأجسام المضادة للحصول على تلطيخ الأمثل وهذا يجب أن تتكرر كلما تغيرت دفعة واحدة. إذا تم اتباع جميع الخطوات باستمرار والحفاظ على تركيز خلية المستمر ثم وهذا methoد- تمكين موثوق تتبع الخلايا من خلال دورة الخلية دون الحاجة لإجراء التزامن. وهناك أيضا مجالا كبيرا لتعديل هذا الأسلوب ليناسب أنواع الخلايا معينة، ومعالجة مسائل محددة.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The work was funded by the Leukemia and Lymphoma Society of the USA (6105-08), a Cancer Council NSW grant (13-02), an NHMRC Senior Research Fellowship (LJB) (1042305) and project grant (1041614).
Materials
| Name | Company | Catalog Number | Comments |
| APC BrdU Flow Kit | BD Biosciences | 552598 | Contains BrdU antibody, 7-AAD and BD Cytofix/Cytoperm Buffer (referred to as Fixation Buffer) |
| BD Cytoperm Permeabilization Buffer Plus | BD Biosciences | 561651 | Referred to as Permeabilization buffer |
| BD Perm/Wash Buffer | BD Biosciences | 554723 | Referred to as Wash buffer |
| DNase | Sigma | D-4513 | |
| BD Falcon 12 x 75 mm FACS tubes | BD Biosciences | 352008 | |
| BD Pharmingen Stain Buffer | BD Biosciences | 554656 | |
| BD LSR FORTESSA flow cytometer | BD Biosciences | FORTESSA | |
| Pipetman | Gilson | P2, P20, P100, P1000 | |
| RPMI 1,640 w/o L-Gln 500 ml | Lonza | 12-167F | |
| DPBS | Lonza | 17-512F | |
| Fetal Bovine Serum | FisherBiotec | FBS-7100113 | |
| L-Glutamine | Sigma | G7513-100ML | |
| 5-Bromo-2′-deoxyuridine | Sigma | B5002-1G | |
| Falcon TC 150 cm2 vented Flasks | BD Biosciences | 355001 | |
| Pipettes 25 ml | Greiner | 760180 | |
| Aersol Pipettes 200 µl | Interpath | 24700 | |
| Aersol Pipettes 1 ml | Interpath | 24800 | |
| Centrifuge | Spintron | GT-175R | |
| CO2 incubator | Binder | C 150 | |
| AF488 anti-Histone H3 Phospho (Ser10) Antibody | Cell Signalling | 9708S | |
| Phospho-Chk2 (Thr68) (C13C1) Rabbit mAb | Cell Signalling | 2197S | |
| Phospho-Chk1 (Ser345) (133D3) Rabbit mAb | Cell Signalling | 2348S | |
| NALM6 | DSMZ | ACC-128 |
References
- Banfalvi, G., Banfalvi, G. . Methods Mol Biol. 761, 1-23 (2011).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132, 487-498 (2008).
- Harper, J. W., Elledge, S. J. The DNA damage response: ten years after. Molecular Cell. 28, 739-745 (2007).
- Latt, S. A., George, Y. S., Gray, J. W. Flow cytometric analysis of bromodeoxyuridine-substituted cells stained with 33258 Hoechst. The Journal of Histochemistry and Cytochemistry. 25, 927-934 (1977).
- Gratzner, H. G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science. 218, 474-475 (1982).
- Carayon, P., Bord, A. Identification of DNA-replicating lymphocyte subsets using a new method to label the bromo-deoxyuridine incorporated into the DNA. Journal of Immunological Methods. 147, 225-230 (1992).
- Gonchoroff, N. J., et al. S-phase detection with an antibody to bromodeoxyuridine. Role of DNase pretreatment. Journal of Immunological Methods. 93, 97-101 (1986).
- Rabinovitch, P. S., Torres, R. M., Engel, D. Simultaneous cell cycle analysis and two-color surface immunofluorescence using 7-amino-actinomycin D and single laser excitation: applications to study of cell activation and the cell cycle of murine Ly-1 B cells. Journal of Immunology. 136, 2769-2775 (1986).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. 32, 4789-4797 (2013).
- Hendzel, M. J., et al. Mitosis-specific phosphorylation of histone H3 initiates primarily within pericentromeric heterochromatin during G2 and spreads in an ordered fashion coincident with mitotic chromosome condensation. Chromosoma. 106, 348-360 (1997).
- Draetta, G., Beach, D. Activation of cdc2 protein kinase during mitosis in human cells: cell cycle-dependent phosphorylation and subunit rearrangement. Cell. 54, 17-26 (1988).
- Saunders, P. O., et al. RAD001 (everolimus) induces dose-dependent changes to cell cycle regulation and modifies the cell cycle response to vincristine. Oncogene. , (2012).
- Knudsen, R. C., Ahmed, A. A., Sell, K. W. An in vitro microassay for lymphotoxin using microculture plates and the multiple automated sample harvester. Journal of Immunological Methods. 5, 55-63 (1974).
- Beck, H. P. Proliferation kinetics of perturbed cell populations determined by the bromodeoxyuridine-33258 technique: radiotoxic effects of incorporated [3H]thymidine. Cytometry. 2, 170-174 (1981).
- Miller, M. J., Wei, S. H., Parker, I., Cahalan, M. D. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science. 296, 1869-1873 (2002).
- Collins, J. M., Berry, D. E., Bagwell, C. B. Different rates of DNA synthesis during the S phase of log phase HeLa S3, WI-38, and 2RA cells. Journal of Biological Chemistry. 255, 3585-3590 (1980).
- Schwarting, R., Gerdes, J., Niehus, J., Jaeschke, L., Stein, H. Determination of the growth fraction in cell suspensions by flow cytometry using the monoclonal antibody Ki-67. Journal of Immunological Methods. 90, 65-70 (1986).
- Danova, M., et al. Cell cycle-related proteins: a flow cytofluorometric study in human tumors. Biology of the Cell. 64, 23-28 (1988).
- Juan, G., et al. Histone H3 phosphorylation and expression of cyclins A and B1 measured in individual cells during their progression through G2 and mitosis. Cytometry. 32, 71-77 (1998).
- Langan, T. J., Chou, R. C. Synchronization of mammalian cell cultures by serum deprivation. Methods in Molecular Biology. 761, 75-83 (2011).
- Kues, W. A., et al. Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors. Biology of Reproduction. 62, 412-419 (2000).
- Urbani, L., Sherwood, S. W., Schimke, R. T. Dissociation of nuclear and cytoplasmic cell cycle progression by drugs employed in cell synchronization. Experimental Cell Research. 219, 159-168 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved