Method Article
Submillisecond بتكوين جزئي التغييرات في البروتينات حلها بواسطة شعاع ضوحراري الإمالة
In This Article
Summary
نحن هنا الإبلاغ عن تطبيق تقنية انحراف شعاع حراري ضوئي؛ بالاشتراك مع مركب الكالسيوم في قفص، DM-nitrophen، لرصد ميكروثانية وميلي ثانية واحدة ديناميكية و طاقة من التغييرات الهيكلية المرتبطة ارتباط الكالسيوم إلى الخلايا العصبية جهاز استشعار الكالسيوم، العنصر التنظيمي المصب خصم المغير .
Abstract
ضوحراري شعاع انحراف معا مع الصورة الصوتية الكالوري وصريف الحرارية ينتمي إلى عائلة من أساليب حراري ضوئي؛ التي ترصد حجم والمحتوى الحراري تغييرات التوقيت الشخصى الضوء الناجم عن التغيرات متعلق بتكوين جزئي في البروتينات على ميكروثانية إلى ميلي ثانية واحدة وقت القشور التي لا يمكن الوصول إليها باستخدام محطة التقليدية أدوات التدفق. بالإضافة إلى ذلك، منذ يتم بحثها التغييرات الشاملة في حجم و / أو المحتوى الحراري، وهذه التقنيات يمكن تطبيقها على البروتينات والجزيئات الكبيرة الحيوية الأخرى التي تفتقر إلى fluorophore وأو تسمية حامل اللون. لرصد ديناميات وعلم الطاقة من التغييرات الهيكلية المرتبطة كا 2 + ملزمة لمحولات الكالسيوم، مثل أجهزة الاستشعار الكالسيوم العصبية، وهو مركب الكالسيوم في قفص، DM-nitrophen، ويعمل على الصورة الزناد زيادة سريعة (τ <20 μsec) في الكالسيوم الحرة يتم بحثها تركيز وحجم والمحتوى الحراري المرتبطة التغييرات باستخدام شعاع حراري ضوئي؛ تقنية انحراف.
Introduction
أساليب الصورة الحرارية مثل الكالوري الضوئي، شعاع حراري ضوئي؛ انحراف (PDB)، وصريف عابرة إلى جانب الإثارة الليزر النانوسيكند تمثل بديلا قويا لعابرة spectroscopies البصرية للدراسات وقت حل وسيطة قصيرة الأجل 1،2. وعلى النقيض من التقنيات البصرية، مثل امتصاص الأشعة تحت الحمراء الطيفي وعابرة، التي ترصد الشخصى الوقت من التغييرات في امتصاص حامل اللون المحيطة بها؛ تقنيات حراري ضوئي؛ كشف عن الاعتماد وقت التغييرات الحرارة / حجم، وبالتالي هي أدوات قيمة للتحقيق في وقت لمحات بصريا عمليات "الصامتة". حتى الآن، وقد تم تطبيق الكالوري الضوئي وصريف عابرة بنجاح لدراسة ديناميكية بتكوين جزئي للعمليات التي يسببها الصورة بما في ذلك الهجرة ثنائي الذرة يجند في globins 3،4، تفاعلات البروتين يجند مع مستشعر الاوكسجين FixL 5، والإلكترون والبروتون النقل في الهيم والنحاس oxidases 6 والثانية الضوئي الثاني وكذلك الصور المماكبة في رودوبسين 7 وديناميكية بتكوين جزئي في cryptochrome 8.
إلى التوسع في تطبيق التقنيات حراري ضوئي؛ لالنظم البيولوجية التي تفتقر لحامل اللون الداخلي و / أو fluorophore، تم الجمع بين تقنية PBD مع استخدام مركب قفص على الصورة الزناد زيادة في تركيز يجند / الركيزة في غضون بضع ميكروثانية أو أسرع، وهذا يتوقف على مجمع في قفص. يسمح هذا النهج رصد ديناميات وعلم الطاقة من التغييرات الهيكلية المرتبطة يجند / الركيزة ملزمة للبروتينات التي تفتقر إلى fluorophore الداخلية أو حامل اللون وعلى الوقت النطاق التي لا يمكن الوصول إليها عن طريق الأدوات توقف تدفق التجارية. هنا طلب من PBD لرصد الديناميكا الحرارية للمجمع القفص، كا 2 + DM-nitrophen، الصور الانقسام وكذلك حركية لكا 2 + الجمعيات إلى المجال C-محطة للاستشعار الكالسيوم العصبية داونوتقدم تيار التنظيمية العنصر خصم المغير (DREAM). كا 2 + هو من كا اطلاق سراحهم الصورة 2 + DM-nitrophen في غضون 10 μsec وrebinds إلى قفص unphotolysed مع ثابت وقت ~ 300 μsec. من ناحية أخرى، في حضور apoDREAM لوحظ حدوث الحركية الإضافية التي تحدث على نطاق وميلي ثانية واحدة وقت ويعكس يجند ملزمة للبروتين. وقد تم تطبيق PBD للتحقيق التحولات متعلق بتكوين جزئي في النظم البيولوجية محدودة نوعا ما بسبب الصعوبات فعال؛ المحاذاة مثل شاقة لجنة التحقيق ومضخة شعاع لتحقيق PBD إشارة قوية وقابلة للتكرار. ومع ذلك، فإن تصميم دقيق من الأجهزة انشاء، ومراقبة دقيقة لدرجة الحرارة، والمحاذاة حذرا من لجنة التحقيق ومضخة شعاع توفير إشارة متسقة وقوية PBD التي تسمح رصد حجم الوقت حل والتغيرات في المحتوى الحراري على نطاق واسع المقياس الزمني من 10 μsec إلى ما يقرب من 200 ميللي ثانية. بالإضافة إلى ذلك، modifications من إجراء التجارب لضمان الكشف عن العينة ومرجعية آثار تحت درجة حرارة متطابقة، وتكوين العازلة، والتوجه الخلايا البصرية، وقوة الليزر، الخ يخفف كثيرا من الخطأ التجريبي في حجم رد الفعل قياس والمحتوى الحراري.
Protocol
1. عينة الاستعدادات
- تنفيذ إعداد العينات وجميع التلاعب العينة في غرفة مظلمة لمنع حدوث uncaging غير المرغوب فيها.
- ذوبان DM-nitrophen ((1 - (2-4-نيترو ،5-ديميثوكسي فنيل) - N، N، N '، N' tetrakis [(أوكسي كربونيل) الميثيل] -1،2-ethanediamine) في 50 ملي HEPES العازلة، 100 ملي بوكل، ودرجة الحموضة 7.0 إلى تركيز النهائي من 400 ميكرومتر (ε = 350nm 4330 M -1 سم -1 9).
- إضافة و CaCl 2 من محلول المخزون 0.1 M إلى تحقيق نسبة مرغوب فيه من [كا 2 +]: [DM-nitrophen]. لبروتينات مع د K لكا 2 + جمعية أكبر من 10 ميكرومتر، نسبة [كا 2 +]: [DM-nitrophen] 1:1 هو الأفضل لمنع ملزم من الكالسيوم اطلاق سراحهم الصورة 2 + لuncaged DM-nitrophen . في الواقع، بالنظر إلى قيمة K د للDM-nitrophen أن يكون 10 نانومتر والتركيز الكلي للDM-nitrophen وكا 2 + لتكون 400 ملم، ~ 90٪ من الكالسيوم بروتين ملزمةمع د K = 10 ميكرومتر سوف تكون في apoform. من ناحية أخرى، لدراسة كا 2 + ملزمة للبروتينات مع K د <10 ميكرومتر، فمن الأفضل أن تقلل من [كا 2 +]: [DM-nitrophen] النسبة إلى 0.95 لمنع كا 2 + complexation مع الاشتقاق البروتين قبل القفص الصور التفكك.
- ذوبان مجمع المرجعية، K 3 [الحديد (III) (CN) 6] أو نا 2 CRO 4، في نفس المخزن المؤقت بالنسبة للعينة.
2. إعداد التجربة
- ويظهر التكوين التجريبية الأساسية في الشكل 2.
- استخدام ثقب دبوس (P 2) لضبط قطر شعاع التحقيق (632 نانومتر خرج من قال ني الليزر، ~ 5 ميغاواط قوة الليزر) إلى 1 مم ونشر شعاع التحقيق من خلال مركز خلية وضعها في درجة حرارة تسيطر حامل الخلية باستخدام M 1 المرآة.
- استخدام المرآة (م 2) وراء العينة إلى مركز شعاع التحقيقعلى مركزا للكشف عن موقف حساس.
- تركيز شعاع التحقيق على مركز للكشف في مثل هذه الطريقة أن الفرق في الجهد بين أعلى اثنين من الثنائيات وأسفل اثنين من الثنائيات وكذلك الفرق في الجهد بين الثنائيات اثنين على الجانب الأيسر والأيمن من كاشف هو صفر.
- في وقت لاحق، تشكيل قطر شعاع مضخة، وإخراج 355 نانومتر من Q-تحول الثانية: YAG الليزر، FWHM 5 NSEC) باستخدام 3 مم الثقب (P 1) وضعت بين اثنين من المرايا ليزر 355 نانومتر.
- Copropagate شعاع مضخة من خلال مركز كفيت كما هو موضح في الشكل 2. من المهم أن يتم نشر كل من أشعة الليزر من خلال مركز الخلية الضوئية بطريقة colinear تقريبا للحصول على زاوية انحراف قابلة للقياس، وبالتالي السعة العالية للإشارة PBD. تحت ظروف تجريبية، زاوية تقاطع التحقيق ومضخة الحزم هو أقل من 15 درجة.
- استخدام مركب إشارة إلى محاذاة التحقيق ومضخةشعاع لتحقيق إشارة PBD مرضية، أي نسبة S / N جيدة ومستقرة PBD السعة على نطاقات زمنية أطول (~ 100 مللي ثانية).
- ضبط الموقف من شعاع مضخة فيما يتعلق شعاع التحقيق قبل التعديل الإضافية من 355 نانومتر ليزر المرايا.
- قياس السعة للإشارة المرجعية PBD باعتبارها الفرق بين اثنين من أعلى وأسفل فوتوديوديس على كاشف الحساسة الموقف. إشارة PBD ينبغي أن يحمل على الزيادة السريعة في السعة على النطاق وقت سريع (<10 μsec) وتظل مستقرة على 100 ميللي ثانية الزمني كما هو موضح في الشكل 3. لقطة لتقلب النار من السعة PDB هو في حدود 5٪ من السعة إشارة ويتأثر أساسا استنساخ إشارة من الاهتزازات.
- تحقق الخطي في إشارة السعة PBD فيما يتعلق الطاقة الحرارية الصادرة عن قياس الاعتماد الخطي للإشارة PBD على قوة الإثارة ليزر وعلى عدد من آينشتاين استيعابها، E و= (1-10-A)، حيث A يتوافق مع الامتصاصية المرجعية في الطول الموجي الإثارة.
- الحفاظ على قوة الليزر أدناه حوالي 1،000 μJ والامتصاصية للمجمع عينة / المرجع في الطول الموجي الإثارة أقل من 0.5 لمنع امتصاص multiphoton وانخفاض القوة مضخة شعاع، على التوالي، وضمان الخطي للإشارة PBD.
3. PBD القياسات
- تبدأ مع قياس آثار PBD للمرجعية. وضع حل للمجمع الإشارة في 1.0 سم × 1.0 سم أو 1.0 سم خلية الكوارتز × 0.5 سم ووضع الخلايا في درجة حرارة حامل للرقابة. تقديم كل من أطوال مسار مشابه PBD السعة.
- الكشف عن إشارة PBD المرجعية بوصفها وظيفة من درجة الحرارة في نطاق درجة حرارة 16-35 درجة مئوية مع الزيادة في درجة الحرارة 3 درجات مئوية.
- عند كل تغير في درجة الحرارة، والتحقق من موقف شعاع التحقيق على كشف الحساسة الموقف وإعادةضبط الموقف إلى مركز للكشف إذا لزم الأمر.
- تحقق الخطي للإشارة PBD بوصفها وظيفة من [(DN / دينارا) / C ع ρ] المدى وفقا للمعادلة 2.
- وضع محلول العينة في الخلية الضوئية نفسها بالنسبة للمجمع المرجعية الحفاظ على نفس التوجه للخلية الضوئية حيث لقياس مرجعية.
- الكشف عن آثار PBD العينة في نطاق درجات الحرارة لنفس المرجع والتحقق من الخطي من السعة عينة PBD فيما يتعلق [(DN / دينارا) / C ع ρ] المدى.
4. تحليل البيانات
حجم الانحراف يتناسب طرديا مع حجم التغيير بسبب التدفئة العينة (ΔV عشر) وتغير حجم nonthermal (ΔV nonth) وفقا للمعادلة 1: 
اتساع العينة (A Sيمكن وصفها) والمرجع (A ص) إشارة PBD باستخدام معادلات 2 و 3، على التوالي. 

إشارة PBD يتناسب طرديا مع المعلمة استجابة الصك (K) وعدد آينشتاين استيعابها (E أ). الفصل الدراسي الأول في المعادلة 2، (DN / ت) (1/ρC ع) س، يتوافق مع تغير إشارة بسبب الحرارة المنبعثة إلى المذيبات. يمثل DN / دينارا المدى التغيير التي تعتمد على درجة الحرارة في معامل الانكسار، ρ هي كثافة المذيب، C p هو قدرة الحرارة. ومن المعروف أن جميع المعلمات من أجل الماء المقطر ويمكن تحديد لحل العازلة بمقارنة إشارة PBD لمجمع الإشارة في الماء المقطر وجود مخزن مؤقت المناسبة. س هو مقدار رجع الحرارةد للمذيب. وρ (DN / د ρ) المدى هو ثابت وحدة أقل وهذا هو درجات الحرارة مستقلة في نطاق درجة حرارة 10-40 درجة مئوية 10. يقابل مصطلح القيمة المطلقة Δn إلى تغيير في معامل الانكسار بسبب وجود امتصاص الأنواع في الحل وانها لا تذكر إذا ما تحولت الطول الموجي للشعاع التحقيق بالنسبة إلى أطياف امتصاص أي نوع من الأنواع في الحل. وأعرب عن إشارة الناشئة عن مجمع المرجعية (ص) من خلال المعادلة 3 حيث E ح ν هو طاقة الفوتون على طول موجة الإثارة، E ح ν = 80.5 كيلو كالوري / مول ل355 نانومتر الإثارة.
- اتخاذ اتساع إشارة مرجعية PBD بالفرق بين pretrigger وآخر إشارة الزناد PBD كما هو موضح في الشكل 3. بطريقة مماثلة، وتحديد السعة من الصيام (A و سريع) ومرحلة بطيئة (A ق بطيئة) للإشارة عينة PBD.
- للقضاء على المعلمة استجابة الصك، K، قياس السعة للإشارة عينة PBD من السعة للإشارة PBD للمرجعية. نسبة الإشارة إلى عينة إشارة مرجعية يعطي المعادلة 4 ويمكن كتابة على النحو التالي:

- باستخدام هذه المعادلة، وتحديد حرارة الافراج الحل (س) وnonthermal تغيير حجم (ΔV nonth) المرتبطة رد فعل بمبادرة صورة من المنحدر واعتراض، على التوالي، من مؤامرة من [(A ق / م ص) E ح ν] المدى مقابل درجة الحرارة على المدى تعتمد [(DN / ت) (1/ρCp)].
- لتحديد حجم رد الفعل والتغيير في المحتوى الحراري لعملية سريعة وبطيئة، وقياس حجم وحظ وتغير المحتوى الحراري للعائد الكم المناسب وفقا لمعادلات 5-7.


لعملية متعددة الخطوات مع حركية تحدث على مقياس الوقت بين 10 ~ 200 ميللي ثانية μsec، يمكن تحديد حجم والتغيرات في المحتوى الحراري المرتبطة الخطوات الفردية للتفاعل. يتم تحليل سعة وأعمار للخطوات الفردية عن طريق تركيب البيانات إلى الدالة F (ر) الذي يصف الشخصى الوقت من حجم والتغيرات في المحتوى الحراري.
حيث α 0 يناظر A سريع وα ط يناظر A و بطيئة لكل عملية فردية وτ ط هي عمر خطوات التفاعل الفردية. من درجة الحرارة اعتماد معدل ثابت للص العمليات الفردية (ك ط = 1 / τ ط) المحتوى الحراري تفعيل والمعلمات الكون يمكن تحديده بسهولة باستخدام المؤامرات Eyring.
النتائج
وهناك مثال ممثل PBD يتتبع لكا 2 + الصور الإفراج عن كا 2 + DM-nitrophen هو مبين في الشكل (3). المرحلة سريع يتوافق مع الصور الانقسام من كا 2 + DM-nitrophen وكا 2 + التحرر، في حين أن المرحلة بطيئة يعكس كا 2 + ملزمة إلى القفص nonphotolysed. مؤامرة من PBD السعة العينة للمرحلة السريعة والبطيئة تدرج إلى اتساع مجمع المرجعية بوصفها وظيفة عامل تعتمد درجة حرارة [C ع ρ / (DN / دينارا)] عامل وفقا للمعادلة (4) ورفع كمية وحظ من الحرارة المنبعثة إلى حل وتغيير حجم nonthermal إلى العائد الكمي للDM-nitrophen الصور تفارق (Φ = 0.18) 11 وفقا لمعادلات 5-7 تقديم قيم المحتوى الحراري وحجم رد فعل للمرحلة سريع (ΔV السريع = - 12 ± 5 مل / مول وΔH السريع = -50 ± 20 كيلو كالوري / مول) وللمرحلة بطيئة (ΔV بطيئة = 9 ± 5 مل / مول وΔH = -23 بطيئة ± 12 كيلو كالوري / مول). وترد التتبع PBD لكا 2 + الجمعيات إلى المجال-C محطة من الخلايا العصبية استشعار الكالسيوم المصب التنظيمية العنصر خصم منظم (DREAM) (بقايا الأحماض الأمينية 161-256) في الشكل 4. على كا 2 + الصور التفكك، اطلاق سراحهم الصورة الزميلة يجند إلى المجال C-محطة من DREAM مع ثابت وقت 1.3 ± 0.3 ميللي ثانية في 20 درجة مئوية. من الاعتماد على درجة الحرارة لوحظ معدل ثابت، حاجز التنشيط لكا 2 + ملزمة إلى المجال C-محطة من حلم كان مصمما ليكون 9.2 ± 0.4 كيلو كالوري / مول.

الشكل 1. نظام رد فعل لكا 2 + DM أحمقrohen uncaging وكا 2 + ملزمة لكا 2 + الاستشعار. عرض تخطيطي من الصور الشروع في كا 2 + اثار التحول متعلق بتكوين جزئي في كا 2 + محولات الطاقة. الصور الانقسام من كا 2 + DM-nitrophen يؤدي إلى زيادة في حر كا 2 + تركيز (بروتوكول 1)، كا 2 + الجمعيات إلى كا 2 + محول والتحول الهيكلي يصاحب ذلك (بروتوكول 2). اضغط هنا لمشاهدة أكبر الصورة .
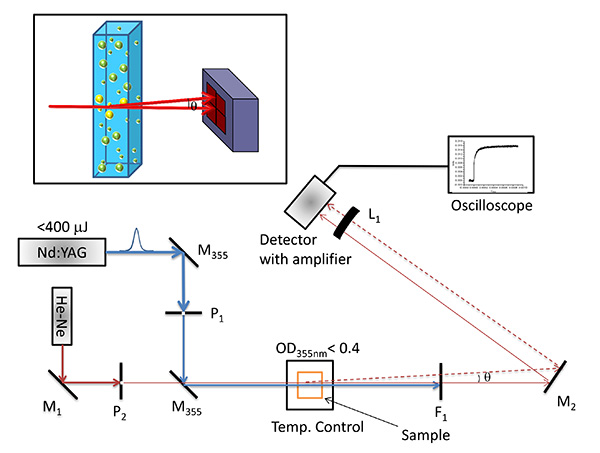
الشكل 2. انشاء ضوحراري شعاع انحراف انشاء. التجريبية لقياسات الصورة الحرارية شعاع انحراف في تكوين خط واحد. M 1 و M 2 تمثل المرايا المسطحة تستخدم لتركيز شعاع التحقيق على مركز للكشف عن حساسية الموقف، M 355 تمثل عالية الطاقة بدون تاريخ: YAG الليزر المرايا، L 1 يمثل عدسة محدبة وضعه أمام كاشف، P 1 و P 2 تمثل الثقوب لتشكيل المضخة والتحقيق شعاع قطره، على التوالي، وDM هو مرآة مزدوج اللون. F 1 يمثل 500 نانومتر تمريرة طويلة التصفية. أقحم: شعاع انحراف بسبب تأثير حراري ضوئي؛. ينحرف شعاع التحقيق التي تنتقل عن طريق التدرج معامل الانكسار إنشاؤها بسبب التدرج في درجة الحرارة في المتوسط قبل θ زاوية ويتم قياس زاوية انحراف باستخدام كاشف الحساسة الموقف. اضغط هنا لمشاهدة صورة بشكل اكبر .
الرقم 3. ممثل PBD يتتبع لكا 2 + DM-nitrophen uncaging. PBD تتبع لكا 2 + الإفراج الصور الإفراج عن كا 2 + DM-nitrophen (كما هو موضح باللون الأحمر) ومجمع المرجعية (كما هو موضح باللون الأزرق). الشروط: 1 ملم DM-nitrophen في 20 ملي HEPES العازلة، 100 ملي بوكل درجة الحموضة 7.0 و 0.8 ملي كا 2 +. K 3 [الحديد (CN) 6] كان يستخدم كمركب مرجعي. امتصاص العينة في 355 نانومتر المتطابقة أن المجمع مرجعية (A = 0.4 355nm). يتم تحديد الكثافة البصرية من 0.4 لأنه في نطاق الخطي للإشارة PBD بوصفها وظيفة من عدد استيعابها آينشتاين . تمثل آثار PBD بمعدل 20 آثار. اضغط هنا لمشاهدة صورة بشكل اكبر .
محتوى العرض = "5IN" FO: SRC = "/ files/ftp_upload/50969/50969fig4highres.jpg" سرك = "/ files/ftp_upload/50969/50969fig4.jpg" العرض = "600px ل" />
الشكل 4. ممثل PBD يتتبع لكا 2 + uncaging DM-nitrophen في وجود نطاق C-محطة من حلم. تتبع PBD لكا 2 + الصور الإفراج عن كا 2 + DM-nitrophen في وجود نطاق C-محطة من البروتين DREAM ( هو مبين في الحمراء)، ومجمع للإشارة (كما هو موضح باللون الأسود). أقحم: مؤامرة Eyring باستخدام حركية تعافى من الاضمحلال الأسي لPBD تتبع عينة عند درجات حرارة مختلفة. الشروط 400 ميكرومتر DM-nitrophen، 390 ميكرومتر و CaCl 2، 100 ميكرومتر-C محطة DREAM في 20 ملي HEPES العازلة ودرجة الحموضة 7.4، 100 ملي بوكل و 500 ميكرومتر TCEP وتتبع للمرجعية في ظل نفس الظروف. تتبع PBD للمرجعية تمثل في المتوسط 20 آثار وذلك لتكون العينة بمتوسط ثلاثة آثار.hres.jpg "الهدف =" _blank "> اضغط هنا لمشاهدة صورة أكبر.
Discussion
مبدأ المادية وراء أساليب حراري ضوئي؛ هو أن جزيء الصورة متحمس تبدد الطاقة الزائدة عن طريق الاسترخاء الذبذبات الى ارض الدولة، مما أدى إلى التسخين الحراري من 1،12 المذيب المحيطة بها. للمذيبات مثل الماء، وهذا ينتج توسع حجم السريع (ΔV عشر). جزيئات الحالة المثارة قد يخضع أيضا العمليات الكيميائية الضوئية التي ينتج عنها تغيرات الحجم nonthermal (ΔV nonth) بسبب الانقسام السندات / تشكيل و / أو تغييرات في التركيب الجزيئي التي يمكن أن تغير أبعاد الجزيئية للجزيء (ق) (أي تغييرات في فان دير حجم فال)، وكذلك في تغيير التوزيع المسؤول عن جزيء (ق) مما أدى إلى electrostriction الآثار. هذه النتائج في التوسع السريع في حجم مضيئة التي تولد التغيير معامل الانكسار التي يمكن بحثها من خلال مجموعة متنوعة من الأساليب البصرية. PBD يستفيد من حقيقة أن مؤشر الانحدار الانكسار أنشئت في العينة درق إلى نبضة ليزر على شكل التمويه، يسبب انحراف شعاع التحقيق نشر من خلال العينة كما هو موضح في الشكل 2.
تقنية شعاع انحراف الضوئية الحرارية يمكن تحديد الحجم حلها الوقت والتغيرات في المحتوى الحراري لمجموعة واسعة من العمليات التي بدأها الصورة بما في ذلك آلية رد فعل من الصور الانقسام المجمعات يجند هيم 13 والإفراج عن جزيء النشطة بيولوجيا من القفص مركب معقد 14 وكذلك التحقيق في عمر الدولة fluorophore الثلاثي. هذا النهج يوفر مزايا عدة بالمقارنة مع التقنيات التقليدية التي يشيع استخدامها لرصد التغيرات الهيكلية في الجزيئات الكبيرة الحيوية، مثل التحليل الطيفي امتصاص عابرة ومضان. ليس هناك حاجة لحامل اللون الجوهرية / fluorophore أو وضع العلامات إضافية من البروتين حيث يتم بحثها التحولات الهيكلية التي كتبها رصد التغيرات في حجم و / أو في المحتوى الحراري، على الرغم من وجود حامل اللون في العينة بحيثlution هو ضروري لتوليد إشارة PBD. بالإضافة إلى ذلك، المعلمات الحركية (ثوابت المعدل، المحتوى الحراري تفعيل والكون) لالعمليات التي تحدث على مقياس الوقت submicrosecond، والتي لم يتم حلها في تجارب توقف التدفق، ويمكن الوصول إليها بسهولة في القياسات PBD. في الآونة الأخيرة، وغيرها من أنظمة الكشف المجاني التسمية التي بدراسة التغير في الرقم القياسي للانكسار أو تحولا الطول الموجي مثل سطح صدى مأكل وbiolayer التداخل، على التوالي، تم وضعها وتطبيقها لدراسة يجند / البروتين وتفاعلات البروتين / البروتينات. ولكن، خلافا PBD، هذه النهج تنطوي تجميد الجزيئات المستهدفة البيولوجية على سطح وبالتالي مطلوب تعديلات الحيوية جزيء إضافية التي قد تتداخل مع عملية الملاحظة.
وقد اعتمدنا العديد من التعديلات لدينا الأجهزة انشاء التي أسفرت أفضل استنساخ البيانات والأخطاء الصغيرة في المعلمات الحرارية استردادها. على وجه التحديد، وتطبيقرباعية الصورة الثنائي مثل كاشف PBD يسمح للمحاذاة دقيقة من شعاع التحقيق على كشف الموقف، وبالتالي أفضل استنساخ إشارة في حين أن العزلة الذبذبات إضافية من كل من شعاع التحقيق وكشف PBD باستخدام ثبط المشاركات تصاعد انخفض الضجيج من إشارة PBD و وسعت في الوقت المقاييس الوصول إليها في قياسات PBD. ونود أن نؤكد أن حساسية هذه التجربة يعتمد على الجدول الزمني لهذا الحدث (ق) ورصد العمليات أبطأ (τ> 10 ميللي ثانية) حساس للغاية لإعداد الأجهزة والظروف التجريبية. أيضا، وضع مرآة مزدوج اللون أمام الخلية عينة يبسط محاذاة خط واحد من لجنة التحقيق ومضخة شعاع، وزيادة نسبة S / N للإشارة PBD.
وتشمل الخطوات الحاسمة لبروتوكول التحقق العادية للالخطي للإشارة PBD بوصفها وظيفة من ط) عامل درجة الحرارة تعتمد، [(DN / دينارا) / C ع ρ]، والثاني) بو ليزرور، والثالث) الامتصاصية عينة / المرجع في الطول الموجي الإثارة. بالإضافة إلى ذلك، مراقبة دقيقة لدرجة الحرارة والظروف التجريبية متطابقة لقياسات العينات والمرجع هو أمر حاسم لقياسات PBD قوية والحصول على البيانات بنجاح.
القيد الرئيسي للتقنية PBD تذكر شرط أن درس الحيوية جزيء يحمل مجموعة الصور التسمية. هذا العائق يمكن التغلب عليها عن طريق استخدام مركبات قفص المختلفة. في الواقع، والتنمية مؤخرا استراتيجيات جديدة بما في ذلك حبس في قفص الببتيدات والبروتينات والحمض النووي في قفص قفص يسمح لتطبيق واسع النطاق من PBD لمراقبة النظم والعمليات البيولوجية المعقدة بما في ذلك البروتين - الببتيد، والبروتين - تفاعلات البروتين وكذلك حركية السريعة المرتبطة الحمض النووي للطي على نطاقات زمنية ذات الصلة من الناحية الفسيولوجية. الاستراتيجية المعروضة هنا يدل بوضوح على أن في تركيبة مع نظام مجمع قفص المناسبة، والتقنيات PBD يمكن استخدامها بسهولة لتميز ميكروثانية إلى ميلي ثانية واحدة التحولات الهيكلية المرتبطة كا 2 + ملزمة لأجهزة الاستشعار الكالسيوم وكذلك لرصد التفاعلات بروابط صغيرة مع محولات البروتين أو ربط جزيئات الركيزة لأنزيمات الخ
Disclosures
والكتاب ليس لديهم ما يكشف.
Acknowledgements
وأيد هذا العمل من قبل مؤسسة العلوم الوطنية (MCB 1021831، JM) وJ. & E. برنامج البحوث الطبية الحيوية (فلوريدا، قسم الصحة، JM).
Materials
| Name | Company | Catalog Number | Comments |
| 1-(4,5-Dimethoxy-2-Nitrophenyl)-1,2-Diaminoethane-N,N,N',N'-Tetraacetic Acid | Life Technologies | D-6814 | DM-nitrophen, cage calcium compound, keep stock solutions in dark to prevent photodissociation |
| 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid, N-(2-Hydroxyethyl)piperazine-N′-(2-ethanesulfonic acid) | Sigma Adrich | 0909C | HEPES buffer |
| Potassium ferricyanide (III) | Sigma Aldrich | 702587 | reference compound for PBD measurements |
| Sodium chromate | Sigma Aldrich | 307831 | reference compound for PBD measurements |
| He-Ne Laser Diode 5 mW 635 nm | Edmund Optics | 54-179 | use as a probe beam for PBD measurements |
| Oscilloscope, | LeCroy | Wave Surfer 42Xs | 400 MHz bandwith |
| Nd:YAG laser | Continuum | ML II | pump beam for PBD measurements |
| M355; Nd:YAG laser mirror | Edmund Optics | 47-324 | laser mirror for 355 nm laser line |
| M1 and M2; Laser diode mirror | Edmund Optics | 43-532 | visilbe laser flat mirror, wavelength range 300-700 nm |
| P1 and P2; Iris Diaphragm | Edmund Optics | 62-649 | pin hole to shape the probe and pum beams |
| L1; bi-convex lens | Thorlabs | LB1844 | a lens to focus the probe beam at the detector, EFL 50 mm, wavelength range 350-2,000 nm |
| DM, dichroic mirror | Thorlabs | DMLP505 | a longpass dichroic mirror with a cutoff wavelength of 505 nm |
| F1; Edge filter | Andower | 500FH90-25 | a long pass filter with a cutoff wavelength of 500 nm |
| Temperature-controlled cuvette holder | Quantum Northwest | FLASH 300 |
References
- Gensch, T., Viappiani, C. Time-resolved photothermal methods: accessing time-resolved thermodynamics of photoinduced processes in chemistry and biology. Photochem. Photobiol. Sci. 2, 699-721 (2003).
- Larsen, R. W., Mikšovská, J. Time resolved thermodynamics of ligand binding to heme proteins. Coord. Chem. Rev. 251 (9-10), 1101-1127 (2007).
- Westrick, J. A., Peters, K. S. A photoacoustic calorimetric study of horse myoglobin. Bioph. Chem. 37 (1-3), 73-79 (1990).
- Belogortseva, N., Rubio, M., Terrell, W., Miksovska, J. The contribution of heme propionate groups to the conformational dynamics associated with CO photodissociation from horse heart myoglobin. J. Inorg. Biochem. 101 (7), 977-986 (2007).
- Mikšovská, J., Suquet, C., Satterlee, J. D., Larsen, R. W. Characterization of Conformational Changes Coupled to Ligand Photodissociation from the Heme Binding Domain of FixL. Biochemistry. 44 (30), 10028-10036 (2005).
- Miksovska, J., Gennis, R. B., Larsen, R. W. Photothermal studies of CO photodissociation from mixed valence Escherichia coli cytochrome bo3. FEBS Lett. 579 (14), 3014-3018 (2005).
- Losi, A., Michler, I., Gärtner, W., Braslavsky, S. E. Time-resolved Thermodynamic Changes Photoinduced in 5,12-trans-locked Bacteriorhodopsin. Evidence that Retinal Isomerization is Required for Protein Activation. Photochem. Photobiol. 72, 590-597 (2000).
- Kondoh, M., et al. Light-Induced Conformational Changes in Full-Length Arabidopsis thaliana Cryptochrome. J. Mol. Biol. 413 (1), 128-137 (2011).
- Kaplan, J. H., Ellis-Davies, G. C. Photolabile chelators for the rapid photorelease of divalent cations. Proc. Natl. Acad. Sci. U.S.A. 85 (17), 6571-6575 (1988).
- Eisenberg, H. Equation for the Refractive Index of Water. J. Chem. Phys. 43 (11), 3887-3892 (1965).
- Ellis-Davies, G. C., Kaplan, J. H., Barsotti, R. J. Laser photolysis of caged calcium: rates of calcium release by nitrophenyl-EGTA and DM-nitrophen. Biophys. J. 70, 1006-1016 (1996).
- Miksovska, J., Larsen, R. W. Structure-function relationships in metalloproteins. Methods Enzymol. 360, 302-329 (2003).
- Miksovska, J., Norstrom, J., Larsen, R. W. Thermodynamic profiles for CO photodissociation from heme model compounds: effect of proximal ligands. Inorg. Chem. 44 (4), 1006-1014 (2005).
- Dhulipala, G., Rubio, M., Michael, K., Miksovska, J. Thermodynamic profile for urea photo-release from a N-(2-nitrobenzyl) caged urea compound. Photochem. Photobiol. Sci. 8, 1157-1163 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved