Method Article
تحديد وتوصيف ارتباط بالغليكوزيل باستخدام بروتين معين إندو وexoglycosidases
In This Article
Summary
باستخدام glycosidases محددة لإزالة السكر من جليكوبروتينات تليها SDS - PAGE هي طريقة للكشف عن قيمة غليكان تعديلات على عينات البروتين و هو اختيار جيد للدراسات غليكوبيولوغي الأولي. ويمكن الكشف عن التغييرات التالية deglycosylation والتحولات في التنقل هلام أو تلطيخ مع الكواشف الحساسة غليكان.
Abstract
ارتباط بالغليكوزيل ، إضافة السكريات مرتبطة تساهميا ، هي كبرى بعد التعديل متعدية من البروتينات التي يمكن أن تؤثر تأثيرا كبيرا على عمليات مثل خلية التصاق ، والاتجار الجزيئية ، وإزالة الألغام ، ونقل الإشارة 1-4. في حقيقيات النوى ، والتعديلات ارتباط بالغليكوزيل الأكثر شيوعا في مسار إفرازية والاضافات في البقايا الأسباراجين الآراء (N - مرتبط) ، أو على بقايا أو السيرين ثريونين (O - مرتبط) (الشكل 1). يتم حفظها للغاية بدء N - غليكان التوليف في حقيقيات النوى ، في حين أن المنتجات النهائية يمكن أن تختلف اختلافا كبيرا بين الأنواع المختلفة ، والأنسجة ، أو البروتينات. تبقى بعض glycans معدلة ("عالية مانوز N - glycans") أو يتم معالجتها مرة أخرى في غولجي ("معقدة N - glycans"). تم العثور على تنوع أكبر لO - glycans ، والتي تبدأ مع بقايا المشتركة (GalNAc) N - Acetylgalactosamine في الخلايا الحيوانية ولكنها تختلف في أقل الكائنات الحية 1. الأنف والحنجرة "> تحليل مفصل للارتباط بالغليكوزيل من البروتينات هو حقل في حد ذاته ويتطلب موارد واسعة وخبرة لتنفيذ بشكل صحيح ، ولكن مجموعة متنوعة من الانزيمات التي تعمل على إزالة السكريات المتوفرة (glycosidases) يجعل من الممكن أن يكون فكرة عامة عن حالة من ارتباط بالغليكوزيل . بروتين في إعداد مختبر القياسية ونحن هنا توضيح استخدام glycosidases لتحليل بروتين سكري طراز : المشيمي البشري المؤتلف جونادوتروبين بيتا (hCGβ) ، الذي يحمل N - two glycans وأربعة O - 5 glycans تقنية بسيطة تتطلب فقط يمكن أن تكون الأجهزة والمواد الاستهلاكية العادية ، وأنها تتكيف بسهولة لتحليل عينات من بروتين سكري متعددة.
ويمكن استخدام العديد من الانزيمات في دراسة موازية لبروتين سكري. PNGase F قادرة على إزالة ما يقرب من جميع أنواع N - مرتبطة glycans 6،7. لO - glycans ، لا يوجد أي انزيم المتاحة التي يمكن أن يلتصق an oligosaccharide سليمة من اله البروتين العمود الفقري. بدلا من ذلك ، يتم قطع O - glycans بواسطة exoglycosidases إلى نواة قصيرة ، وهو ثم إزالتها بسهولة عن طريق O - غليكوزيداز. ويحتوي على مزيج من البروتين Deglycosylation PNGase F ، O - غليكوزيداز ، النورامينيداز (سياليداز) ، غالاكتوزيداز β1 - 4 و β - N - Acetylglucosaminidase. يتم استخدامها لإزالة في وقت واحد N - glycans وبعض glycans O - 8. أخيرا ، تم استكمال ميكس Deglycosylation بمزيج من exoglycosidases الأخرى (α - N - Acetylgalactosaminidase ، α1 فوكوزيداز - 2 ، α1 - 3 ، 6 غالاكتوزيداز وغالاكتوزيداز β1 - 3) ، والتي تساعد على إزالة السكريات الأحادية التي يمكن أن تقاوم إلا أن تكون موجودة في O - glycans معينة.
يستخدم SDS-PAGE/Coomasie الزرقاء لتصور الاختلافات في بروتين الهجرة قبل وبعد العلاج غليكوزيداز. بالإضافة الى ذلك ، السكر التلوين بطريقة محددة ، ProQ الزمرد - 300 ، كما يظهر إشارة تقلص glycans هي succeإزالة ssively. ويهدف هذا البروتوكول لتحليل كميات صغيرة من بروتين سكري (0،5-2 ميكروغرام) ، رغم أنه يمكن تحجيمها deglycosylation الأنزيمية لاستيعاب كميات أكبر من البروتين حسب الحاجة.
Protocol
1. الأنزيمية deglycosylation
- استخدام أنابيب PCR لتقليل فاقد المياه بسبب التبخر. تسمية مجموعة واحدة من أنابيب 1-7.
- ذوبان الجليد في 10X G7 العازلة ، وتغيير طبيعة 10X العازلة بروتين سكري ، ونسبة 10 ٪ NP - 40 واضغط بلطف أنابيب لخلط محتوياتها. تبقي في درجة حرارة الغرفة.
- ضع قارورة تحتوي على انزيم على الجليد. في محاولة للحد من ذوبان الجليد / تجميد دورات.
- حل محتويات القارورة hCGβ (150 ميكروغرام) في 600 درهم ميكرولتر من 2 O والحفاظ على الجليد.
- 1 مل من إعداد 1X العازلة التي G7 تمييع المخزون 10X درهم في 2 O.
- مخفف 0.5 ميكرولتر من F PNGase العازلة في 25 ميكرولتر G7 1X والحفاظ على الجليد.
- تحضير مزيج exoglycosidase (EG مزيج) من خلال الجمع بين كل من 2 ميكروليتر α - Acetylgalactosaminidase - N ، فوكوزيداز α1 - 2 ، غالاكتوزيداز β1 - 3 ، وα1 3 ، 6 غالاكتوزيداز.
- انشاء أنابيب PCR على النحو المبين :
| أنبوب / عينة # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| hCGβ (0.25mg/ml) | 9μl | 9μl | 9μl | 9μl | -- | -- | -- |
| جلايكوبروتين 10X تغيير طبيعة العازلة | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl | 1μl |
| DH 2 O | -- | -- | -- | -- | 9μl | 9μl | 9μl |
- غطاء الأنابيب ، مزيج بلطف ومكانته فيthermocycler ، إغلاق الغطاء وتفسد البروتينات التي يحتضنها 10 دقائق في 94 درجة مئوية ، ويعقبها عقد 4 درجات مئوية (PCR باستخدام أنابيب في thermocycler يمنع التبخر بشكل كبير في عينات صغيرة الحجم).
- إزالة الأنابيب من thermocycler والطرد المركزي لإزالة أي تكثف مرئية.
- إضافة الكواشف التالية على النحو المبين :
| عينة # | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 10 ٪ NP - 40 | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl |
| G7 الاحتياطي 10X | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5μl | 2.5 و مو؛ ل | 2.5μl |
| PNGase F 01:50 ديل. | -- | 2μl | -- | -- | 2μl | -- | -- |
| Deglycosylation ميكس | -- | -- | 2μl | 2μl | -- | 2μl | 2μl |
| مزيج EG | -- | -- | -- | 2μl | -- | -- | 2μl |
| DH 2 O | 10μl | 8μl | 8μl | 6μl | 8μl | 8μl | 6μl |
| مجموع ردود الفعل المجلد. | μ ل 25 | μ ل 25 | μ ل 25 | 25 μ ل | μ ل 25 | μ ل 25 | μ ل 25 |
- إغلاق أنابيب PCR باستخدام قبعات جديدة (تجاهل تلك المستخدمة لأنها لا تناسب بشكل صحيح بعد دورة الحضانة واحد).
- مزيج الأنابيب بالنقر برفق 4 مرات ثم تدور محتويات أسفل.
- مكان الأنابيب في thermocycler واحتضان عند 37 درجة مئوية لمدة 4 ساعات ثم تبرد العينات الى 4 درجة مئوية.
2. SDS - PAGE عينات deglycosylated
- إعداد 130 الطازجة 3X ميكرولتر تحميل SDS خفض العازلة بإضافة 4 ميكرولتر من DTT 1.25M.
- إضافة 12.5 ميكرولتر من إعداد 3X خفض العازلة تحميل SDS على كل عينة.
- إغلاق أنابيب مع قبعات جديدة والاستفادة برفق لمزج الأنابيب.
- احتضان الأنابيب في thermocycler في 94 درجة مئوية لمدة 5 دقائق ثم تبرد إلى 4 درجة مئوية.
- تحميل 30 ميكرولتر من كل عينة و 10 ميكرولتر من البروتين علامة على هلام تريس - جليكاين 10-20 ٪. إنقاذ ما تبقى من عينة لجزء 3.1. تحميل 10μl من البروتين Prestained ColorPlus ماركر.
- Electrophorese الجل ب 130 فولت في درجة حرارة الغرفة حتى صبغ الجبهة بالقرب من الجزء السفلي من هلام.
- عند انتهاء تشغيل هلام ، إزالة هلام من المدلى بها ووضعها في علبة بلاستيكية صغيرة زرقاء مع بقع Coomasie يكفي لتغطية هلام.
- وصمة عار في هلام لمدة 1 ساعة مع الإثارة لطيف.
- اغسل الجل ثلاث مرات لمدة 30 دقيقة في 50 مل من محلول يزيل اللون.
- تسجيل الصور باستخدام transilluminator الضوء الأبيض أو الماسح الضوئي. بدلا من ذلك ، يمكن المجففة هلام بين ورقة من السيلوفان في إطار.
3. س الموالية للالزمرد 300 للكشف عن البروتينات في الغليكوزيلاتي SDS - PAGE المواد الهلامية
- بالتوازي مع هلام في 2.1) ، وتحميل ما تبقى من العينات على هلام تريس - جليكاين 10-20 ٪. تحميل 10 و مو؛ لتر من ماركر ColorPlus Prestained البروتين.
- في حين أن جل يشغل حل كاشف الزمرد الموالية للسؤال مع DMF وإعداد المخزون فيكس ، اغسل والمؤكسدة حلول للالزمرد برو - Q 300 وصمة عار في أعقاب دليل المنتج المتوفرة مع الطقم.
- عند اكتمال الكهربائي ، إزالة هلام من المدلى بها ووضعها في صندوق من البلاستيك.
- إصلاح هلام بإضافة 100 مل من الحل إصلاح بين عشية وضحاها ، وتركها في درجة حرارة الغرفة مع الإثارة لطيف.
- غسل هلام مع 100 مل من محلول الغسيل لمدة 10 إلى 20 دقيقة في درجة حرارة الغرفة مع الانفعالات غير اليهود. تكرار غسل بمحلول غسيل الطازجة.
- أكسدة الكربوهيدرات التي يحتضنها الجل مع الإثارة لطيف لمدة 30 دقيقة في 25 مل من محلول المؤكسدة.
- اغسل الجل كما هو موضح في الخطوة 3.5.
- في حين أن جل هو غسل إعداد الطازجة برو - Q 300 الزمرد وصمة عار وذلك بإضافة 500 ميكروليتر من محلول الزمرد برو - Q 300 كاشف الذائبة في خطوة 3،2-25 ملتلطيخ العازلة المنصوص عليها في الطقم.
- وصمة عار الجل وذلك بإضافة 25 مل من وصمة عار على استعداد في الخطوة 3.8 و تفرخ في الظلام لطيف مع الانفعالات لمدة 90 إلى 120 دقيقة.
- كرر الخطوات غسل المذكورين في الخطوة 3.5.
- تسجيل صور الأشعة فوق البنفسجية مع transilluminator في 300nm. استخدام علامة كيلو دالتون 80 ، وهو المسمى مع الأخضر الزمردي الموالية للسؤال ، لتداخل صورة إلى صورة الأشعة فوق البنفسجية الضوء الأبيض من هلام تبين prestained سلم.
- قارن بين الصور من هلام ملون على Coomasie 2.10 في الخطوة مع هلام الزمرد الموالية للسؤال الملون من الخطوة 3.11.
4. ممثل النتائج
وتظهر التغييرات في الهجرة بعد deglycosylation البروتين الأنزيمي في الشكل 2. مقارنة بين عينة التحكم (لوحة A ، حارة 1) مع العلاج F PNGase (إزالة N - glycans ، لين 2) ، وميكس Deglycosylation (F PNGase ؛ زائد إندو وexoglycosidases لإزالة O - glycans ، حارة 3). لا مزيد من الانخفاضفي الحجم يعتبر بعد هضم مع glycosidases إضافية (حارة 4). بالإضافة إلى تغيير في الكتلة ، والعصابات أصبحت أكثر وضوحا حيث ستزال glycans. فرقة تعمل تحت علامة 17 كيلو دالتون (النجمة) ويمثل (MW : 16 كيلو دالتون) deglycosylated تماما hCGβ ببتيد. قد فرق أخرى مستمدة من deglycosylation ناقصة أو من البروتينات مجهولة متعددة موجودة في عينة hCGβ (انظر حارة 1). الممرات 5-7 (الضوابط) إظهار الفرق المقابلة لglycosidases.
يظهر تلطيخ بروتين سكري بواسطة الزمرد الأخضر في هذه اللوحة ب كاشف يتأكسد والبقع جميع glycans موجودة في جزيء البروتين. ولشدة إشارة النقصان كما هو deglycosylated إنزيمي hCGβ (حارة حارة من 1 إلى 4). إشارة المتبقية في الحارات 3 و 4 تشير إلى وجود زخارف غليكان ، والتي هي مقاومة للالانزيمات المستخدمة. وglycosidases إضافية تستخدم في حارة 4 إزالة مخلفات السكر في عدد قليل اضافي : هجرة البروتين هو نفسه ، ولكنويمكن ملاحظة انخفاض طفيف في كثافة في تلطيخ. والأنصاف السكر المقاومة غير موجودة في جميع أنواع البروتين : لم يتم الكشف عن بعض الفرق التي كتبها الزمرد الأخضر (تغيب في صورة الأشعة فوق البنفسجية ، بين قوسين) ، مما يدل على نطاق واسع أنها كانت deglycosylated. بيانات إضافية تدعم الاستنتاج القائل الغليكوزيلاتي heterogeneously hCGβ. انخفاض الفرقة في حارة 2 (السهم) وخافت على الصورة الأخضر الزمردي ، في حين أن الشريط العلوي في حارة 2 هو مشرق ، مشيرا إلى أن العديد من الجماعات glycans لا تزال موجودة. هذه البيانات تدعم الاستنتاج بأن hCGβ المؤتلف وأعرب في خلايا الفأر يحتوي glycoforms متعددة 9. وتمتد هذه glycoforms مختلفة نظرا لعدم التجانس المتأصل في بعض البروتينية ارتباط بالغليكوزيل حيث لا تتلقى غليكان الآراء في كل موقع و / أو بعض glycans حين أن البعض الآخر حتى على البروتين نفسه ليسوا كذلك.
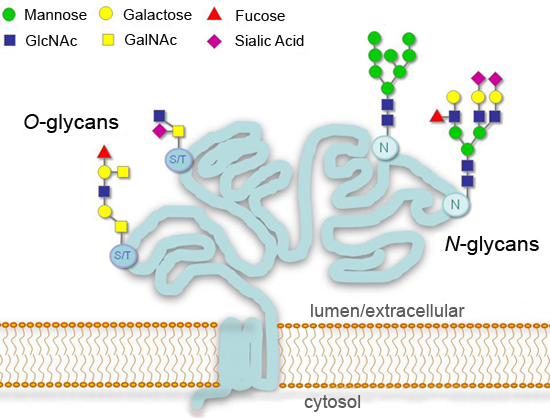
الشكل 1.ارتباط بالغليكوزيل أنماط نموذجية ليفرز أو جليكوبروتينات سطح الخلية.
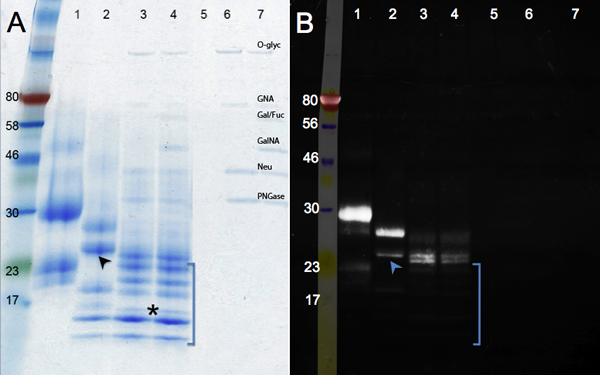
الشكل 2. SDS - PAGE الهلام يظهر deglycosylation الأنزيمية من hCGβ. وتظهر لوحة تلوين Coomasie زرقاء بينما الفريق B يظهر نتائج الموالية للسؤال عن التصور الزمرد 300 من البروتينات الغليكوزيلاتي. عينة رقم : 1 ، ومراقبة hCGβ ؛ 2 ، F PNGase الهضم ؛ 3 ، Deglycosylation الهضم ميكس ، 4 ، ميكس Deglycosylation زائد exoglycosidases الهضم ، وعينات 5-7 هي الضوابط كاشف (O - Glyc ، O - غليكوزيداز ؛ GNA ، β - N - Acetylglucosaminidase ؛ غال / الجبهة ، β1 - 3 غالاكتوزيداز ، α1 - 3 ، 6 غالاكتوزيداز وα1 2 - فوكوزيداز ؛ GalNA ، α - N - Acetylglalactosaminidase ؛ نوي ، النورامينيداز ؛ PNGase ؛ PNGase F)
Discussion
وصف الأسلوب هنا باستخدام deglycosylation الأنزيمية وSDS PAGE ، يمكن أن توفر معلومات قيمة حول حالة ارتباط بالغليكوزيل من البروتين من الفائدة ، بينما غليكان محددة الكواشف تسهيل تفسير البيانات. ويهدف هذا البروتوكول للدراسات الأولية للارتباط بالغليكوزيل البروتين وخصوصا انه يناسب لإفرازية وجليكوبروتينات الغشاء من خلايا الثدييات : الانزيمات المختار في هذه الحالة على وجه التحديد سوف يزيل جميع N - glycans وأو N - glycans زائد والسكريات الأكثر شيوعا توسيع وتشكيل نواة O - glycans. Glycosidases لديها ميزة إضافية كونها معتدلة ، مقارنة مع أساليب deglycosylation الكيميائية ، والحفاظ على سلامة كل من السكريات والبروتين العمود الفقري.
لتوضيح معدل الإشغال (التي هي الغليكوزيلاتي الأحماض الأمينية) ، ومدى ارتباط بالغليكوزيل ، أو لتحديد هيكل غرامة glycans ، وتقنيات أكثر تطورا مثل ممطلوبة الطيف الحمار ، واللوني السائل أو الرنين المغناطيسي النووي.
بسبب بساطتها ، يمكن تعديلها عدة خطوات في هذا البروتوكول ، واستبداله ، و / أو مجتمعة لتلبية احتياجات مختلف التجريبية. ومع ذلك ، من أجل الحصول على النتائج التي يمكن أن تفسر بشكل واضح أنه من المهم أن نفهم نقاط قوتها والقيود. أولا ، لخصوصية ونقاء glycosidases حاسمة : يجب ان تستخدم فقط الانزيمات جيدا اتسم اختبارها لتكون خالية من البروتياز وغيرها من الأنشطة الملوثة. للأسف ، لا توجد وحدة انزيم تعريف موحد للglycosidases ؛ يجب على المستخدم تحديد بدائل مناسبة وفقا لمواصفات الشركة المصنعة. الثاني ، وهو اختيار دقيق للكشف ضروري : أ تلطيخ بروتين) الكواشف مفيدة فقط إذا deglycosylation في النتائج تحولا كبيرا في الكتلة الجزيئية. ليست هذه نتيجة واضحة كما هو موضح هنا تم الحصول عليها دائما. في حالات أخرى ، شهدنا ميل طبيعيغريشن بعد deglycosylation (بعيدا عن الوزن الجزيئي وتوقع ، أو حتى الهجرة أبطأ). ليست هذه الظاهرة مفهومة جيدا ، ولكن يمكن القول أن أي تغيير في الهجرة هي الأدلة التي تم deglycosylated البروتين. ب) الكشف عن الأجسام المضادة للسكر مع تحديات فريدة الحد من تطبيقها. فقد كان من الصعب للغاية لتوليد العامة لمكافحة غليكان الأضداد ؛ تثار عادة ضد هدف غليكان المعقدة ، الأمر الذي يحد من استخدامها. وعلاوة على ذلك ، وعدة وحيدة النسيلة المضادة للأضداد غليكان عرض تفاعلية عبر 10 غير مرغوب فيها. ج) Lectins (البروتينات مع تقارب السكر الذاتية) هي مناسبة تماما للكشف عن السكر ، بالإضافة إلى أنها تعطي فكرة عن هيكل غليكان. ومع ذلك ، ليس كل منهم يملك خصوصية ضيقة ، وتتميز العديد جزئيا فقط (بمعنى أنها يمكن أن تكون الصلات غير معروف). باعتباره نتيجة تلطيخ lectin مؤشرا إيجابيا ، وليس دليلا ، من وجود غيفين السكر. د وضع العلامات الكيميائية) مجموعات (على أساس الأكسدة بريودات من السكريات) هي الطريقة المفضلة لصبغ جميع جليكوبروتينات ، وبالتالي تتناسب بشكل جيد لمتابعة deglycosylation.
عند معالجة عينة مجهولة ، وهو ممارسة جيدة لتشمل الضوابط بروتين سكري. فتوين هي متاحة بسهولة N -- O وبروتين سكري ؛ موجهة الغدد التناسلية المشيمية (سواء مفارز) هو أيضا خيارا جيدا. ألبومين المصل البقري يمكن (BSA) أن يستخدم كعنصر تحكم سلبية. ومع ذلك ، تجدر الإشارة إلى أن بعض البروتينات غير الغليكوزيلاتي يتفاعل بشكل طفيف مع الزمرد الموالية للس 300 ، وخاصة عندما تستخدم في تركيزات عالية. غير الغليكوزيلاتي معايير الوزن الجزيئي ، مثل علامة البروتين prestained المستخدمة في هذا البروتوكول ، لديها ميزة عرض شرائح حادة. فقط عن طريق الصدفة هي واحدة من هذه البروتينات (80 كيلو دالتون) رد الفعل المؤيدة للالزمرد س 300. لذا ، قد يكون للمستخدم تريد تشغيل سلم القياسية بدلا من بروتين سكري ، مثل حلوى قصب من Invitrogeن.
أخيرا ، بسيطة في جل كشف جليكوبروتينات nucleocytosolic (والتي يتم تعديلها مع GlcNAc - O واحد) هو ممكن مع استخدام الأجسام المضادة وحيدة النسيلة ، جنبا إلى جنب β - N - Acetylglucosaminidase من أجل السيطرة النوعية 11. وصف هذا الأسلوب هو ما وراء وتجدر الإشارة نطاق هذه المقالة ، ولكنه كما glycosidases هي أدوات مفيدة لدراسة جليكوبروتينات أخرى كثيرة ، وglycoconjugates موجودة في الخلايا. يمكن العثور على العلاج الشامل لجميع أشكال معروفة من ارتباط بالغليكوزيل في الطبعة الثانية من "أساسيات غليكوبيولوغي" ؛ عبر الإنترنت الحرة المتوفرة على رف الكتب NCBI (ID BOOKSHELF : NBK1908 ؛ PMID : 20301239) 12.
Disclosures
ويعمل في كتاب من قبل نيو انغلاند Biolabs ، والتي تنتج العديد من الكواشف المستخدمة في هذه المقالة.
Acknowledgements
دون مشط
Materials
| Name | Company | Catalog Number | Comments |
| اسم الكاشف | شركة | فهرس العدد | تعليقات |
| β الإنسان موجهة الغدد التناسلية المشيمية | سيغما الدريتش | C6572 | |
| PCR أنابيب | VWR | 20170-004 | |
| PCR Thermocycler | تطبيق النظم البيولوجية | 4359659 | |
| PNGase F | نيو انغلاند Biolabs | P0704 | الموردة مع مخازن |
| البروتين Deglycosylation ميكس | نيو انغلاند Biolabs | P6039 | الموردة مع مخازن |
| α - N - Acetylglalactosaminidase | نيو انغلاند Biolabs | P0734 | مزودة العازلة |
| α1 - 2 فوكوزيداز | نيو انغلاند Biolabs | P0724 | مزودة العازلة |
| α1 - 3 ، 6 غالاكتوزيداز | نيو انغلاند Biolabs | P0731 | مزودة العازلة |
| β1 - 3 غالاكتوزيداز | نيو انغلاند Biolabs | P0726 | مزودة العازلة |
| 10X الاحتياطي G7 (500 ملي فوسفات الصوديوم) | نيو انغلاند Biolabs | --- | مزودة PNGaseF أو مزيج Degl |
| 10X الاحتياطي جلايكوبروتين تغيير طبيعة (5 ٪ SDS ، 400 مم DTT) | نيو انغلاند Biolabs | --- | مزودة PNGaseF أو مزيج Degl |
| 10 ٪ NP - 40 | نيو انغلاند Biolabs | --- | مزودة PNGaseF أو مزيج Degl |
| 3X SDS تحميل العازلة (187.5 ملي تريس ، حمض الهيدروكلوريك درجة الحموضة 6.8 ، 6 ٪ SDS ، الجلسرين 30 ٪ ، 0.03 ٪ بروميتش البيونophenol الأزرق) | نيو انغلاند Biolabs | B7703 | مزودة DTT 1.25M |
| Prestained ColorPlus ماركر البروتين | نيو انغلاند Biolabs | P7709 | |
| 10-20 ٪ تريس - جليكاين Multigel | شركة كوزمو بيو | DCB - 414893 | |
| الكاسيت الكهربائي وحدة | شركة كوزمو بيو | DCB - 303111 | |
| EPS الكهربائي التيار الكهربائي 301 | جنرال إلكتريك للرعاية الصحية | 18-1130-01 | |
| س الموالية للالزمرد كيت جلايكوبروتين 300 اللطخة | Invitrogen | P - 21857 | |
| الأزرق اللامع R | سيغما الدريتش | B0149 | |
| AlphaImager نظام HP | خلية العلوم البيولوجية | 92-13823-00 |
References
- Spiro, R. G. Protein glycosylation: nature, distribution, enzymatic formation, and disease implications of glycopeptide bonds. Glycobiology. 12 (4), 43-56 (2002).
- Ohtsubo, K., Marth, J. D. Glycosylation in Cellular Mechanisms of Health and Disease. Cell. 126, 855-867 (2006).
- Arnold, J. N., Wormald, M. R., Sim, R. B., Rudd, P. M., Dwek, R. A. The impact of glycosylation on the biological function and structure of human immunoglobulins. Annual Review of Immunology. 25, 21-50 (2007).
- Mitra, N., Sinha, S., Ramya, T. N. C., Surolia, A. N-linked oligosaccharides as outfitters for glycoprotein folding, form and function. Trends in Biochemical Sciences. 31, 156-163 (2006).
- Carlsen, R. B., Bahl, O. P., Swaminathan, N. Human chorionic gonadotropin. Linear amino acid sequence of the beta subunit. Journal of Biological Chemistry. 248 (19), 6810-6812 (1973).
- Tarentino, A. L., Plummer, T. H. Deglycosylation of Asparagine-linked Glycans by PNGaseF. Trends in Glycoscience and Glycotechnology. 5 (23), 163-170 (1993).
- Tretter, V., Altmann, F., Marz, L. Peptide-N4-(N-acetyl-β-glucosaminyl)asparagine amidase F cannot release glycans with fucose attached α1-3 to the asparagine-linked N-acetylglucosamine residue. European Journal of Biochemistry. 199, 647-652 (1991).
- Koutsioulis, D., Landry, D., Guthrie, E. P. Novel endo-α-N-acetylgalactosaminidases with broader substrate specificity. Glycobiology. 18 (10), 799-805 (2008).
- Thakur, D. Profiling the glycoforms of the intact alpha subunit of recombinant human chorionic gonadotropin by high-resolution capillary electrophoresis-mass spectrometry. Analytical Chemistry. 81 (2), 8900-8907 (2009).
- Park, S., Lee, M. R., Shin, I. Carbohydrate microarrays as powerful tools in studies of carbohydrate-mediated biological processes. Chemical Communications. 37, 4389-4399 (2008).
- Zachara, N. E., Vosseller, K., Hart, G. W. Detection and analysis of proteins modified by O-linked N-acetylglucosamine. Current Protocols in Molecular Biology. 95, 17-17 (2011).
- Varki, A. Essentials of Glycobiology. , 2nd Ed, Clod Spring Harbor Laboratory Press. (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved