12.12 : الاليكتروليت: عامل فانت هوف
الخصائص المجمعة للإلكتروليتات
تعتمد الخصائص الترابطية للمحلول فقط على عدد الأنواع المذابة الذائبة وليس على الهوية. شروط التركيز في معادلات الخصائص التجميعية المختلفة (انخفاض نقطة التجمد، ارتفاع نقطة الغليان، الضغط الاسموزي) تتعلق بجميع الأنواع المذابة الموجودة في المحلول. تذوب اللا إلكتروليتات فيزيائياً دون تفكك أو أي عملية أخرى مصاحبة. كل جزيء يذوب ينتج جزيئاً ذائباً واحد. ومع ذلك، فإن انحلال الإلكتروليت ليس بهذه البساطة، كما هو موضح في المثالين الشائعين أدناه:

بالنظر إلى أول هذه الأمثلة، وبافتراض التفكك الكامل، يحتوي محلول مائي 1.0 m من كلوريد الصوديوم على 2.0 مول من الأيونات (1.0 مول Na +Na+ و 1.0 مول Cl−) لكل كيلوغرام من الماء، ومن المتوقع أن يكون انخفاض نقطة التجمد
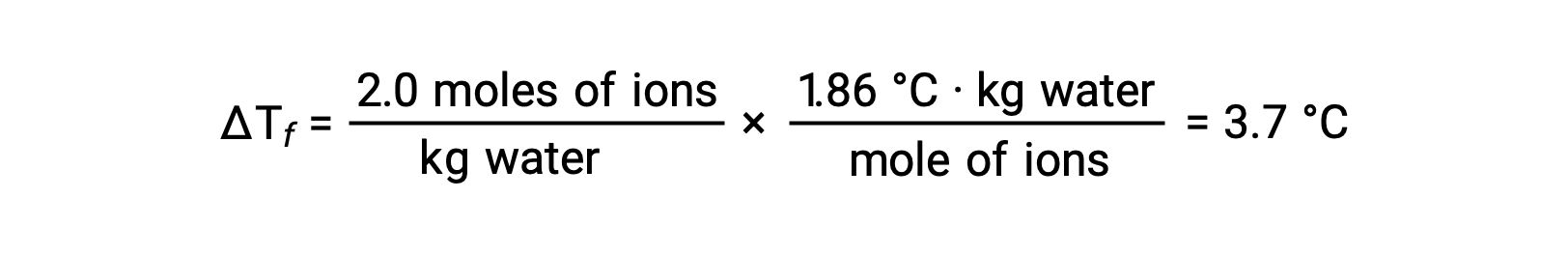
ومع ذلك، عندما يتم تحضير هذا المحلول بالفعل وقياس انخفاض درجة التجمد، يتم الحصول على قيمة 3.4 °C. لوحظت تباينات مماثلة للمركبات الأيونية الأخرى، وعادة ما تصبح الاختلافات بين قيم الخصائص التجميعية المقاسة والمتوقعة أكثر أهمية مع زيادة تركيزات الذائبة. تشير هذه الملاحظات إلى أن أيونات كلوريد الصوديوم (وغيرها من الإلكتروليتات القوية الأخرى) لا تنفصل تماماً في المحلول.
لتفسير ذلك وتجنب الأخطاء المصاحبة لافتراض التفكك التام، يتم استخدام معلمة تم قياسها تجريبياً تم تسميتها تكريماً للكيميائي الألماني الحائز على جائزة نوبل هيتريكوس فانت’ هوف. يتم تعريف عامل فانت’ هوف (i) على أنه نسبة الجسيمات المذابة في المحلول إلى عدد وحدات الصيغة المذابة:

في عام 1923، اقترح الكيميائيان بيتر ديبي و ايريك üهيكيل نظرية لشرح التأين الواضح غير المكتمل للإلكتروليتات القوية. اقترحوا أنه على الرغم من أن التجاذب بين الأيونات في محلول مائي يتم تقليله بشكل كبير عن طريق إذابة الأيونات والعمل العازل للمذيب القطبي ، إلا أنه لا يتم إلغاؤه تمامًا. تمنع عوامل الجذب المتبقية الأيونات من التصرف كجزيئات مستقلة تمامًا. في بعض الحالات، قد يتلامس أيون موجب وسالب بالفعل ، مما يعطي وحدة مذابة تسمى زوج أيون. وبالتالي ، فإن النشاط— أو التركيز— الفعال لأي نوع معين من الأيونات أقل مما يشير إليه التركيز الفعلي. يتم فصل الأيونات على نطاق واسع أكثر فأكثر حيث يصبح المحلول أكثر تمييعاً وتصبح عوامل الجذب البينية المتبقية أقل وأقل. وبالتالي، في المحاليل المخففة للغاية، تكون التركيزات الفعالة للأيونات (أنشطتها) مساوية أساساً للتركيزات الفعلية. بالنسبة إلى حلول 0.05 m، تكون قيمة i لـ NaCl هي 1.9 ، مقابل القيمة المثالية التي تبلغ 2.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Tags
From Chapter 12:

Now Playing
12.12 : الاليكتروليت: عامل فانت هوف
Solutions and Colloids
32.6K Views

12.1 : تشكيل المحاليل
Solutions and Colloids
31.0K Views

12.2 : القوى بين الجزيئات في المحاليل
Solutions and Colloids
32.8K Views

12.3 : المحتوى الحراري للمحلول
Solutions and Colloids
24.6K Views

12.4 : المحاليل المائية ودرجات حرارة الماء
Solutions and Colloids
14.2K Views

12.5 : توازن المحلول والتشبّع
Solutions and Colloids
18.3K Views

12.6 : الخصائص الفيزيائية التي تؤثّر على الذوبان
Solutions and Colloids
22.3K Views

12.7 : التعبير عن تركيز المحلول
Solutions and Colloids
58.1K Views

12.8 : تخفيض ضغط البخار
Solutions and Colloids
25.8K Views

12.9 : المحاليل المثالية
Solutions and Colloids
18.9K Views

12.10 : انحدار نقطة التجمّد وارتفاع نقطة الغليان
Solutions and Colloids
33.9K Views

12.11 : الأسموزية والضغط الأسموزي للمحاليل
Solutions and Colloids
38.8K Views

12.13 : الغرويات
Solutions and Colloids
17.2K Views
Copyright © 2025 MyJoVE Corporation. All rights reserved