Porosimétrie d'une poudre de silice et d'alumine
Vue d'ensemble
Source : Kerry M. Dooley et Michael g. Benton, département de génie chimique, Louisiana State University, Baton Rouge, Louisiane
Distribution granulométrique surface zone et les pores sont les attributs utilisés par adsorbant et catalyseur des fabricants et des utilisateurs pour assurer le contrôle de la qualité et déterminer quand les produits sont à la fin de leur durée de vie utile. La surface d’un solide poreux est directement liée à sa capacité d’adsorption ou l’activité catalytique. La répartition porométrique d’un adsorbant ou le catalyseur est contrôlée de façon que les pores sont suffisamment grands pour admettre facilement les molécules d’intérêt, mais assez petit pour fournir une surface importante par masse.
Distribution granulométrique surface zone et pore peut être mesurée par la technique de l’adsorption et la désorption azote isotherme. Dans cette expérience, un porosimètre azote servira à mesurer la surface et la granulométrie de la poudre de silice/alumine des pores.
Principles
Domaines des micro de surface (< 2 pores nm) et de solides mésoporeux (2-50 nm pores) peuvent être plus grandes que plusieurs centaines de m2/g. mesure précise nécessite une équation concernant superficie volume adsorbé (Vannonces) et de pression à température constante température (l' isotherme). On régresse alors l’équation isotherme pour déterminer les paramètres d’ajustement. La méthode normale de la déclaration de la superficie est de diviser la zone échantillon m2 par le massif en grammes pour produire ce qu’on appelle souvent la surface spécifique, A.
Toutes les isothermes d’adsorption peuvent être divisées en cinq classes (Figure 1). 1 pour l’adsorption physique, seuls les types II et IV sont pertinentes ; les autres décrivent isothermes de liaison (« adsorption chimique »). De type I est de Langmuir et types III et V sont « gonflement » isothermes souvent trouvées adsorbants polymériques. Annonces de la points V = Vm dans les types II et IV représentent (environ) l’emplacement d’un adsorbé monocouche. Le reste de la courbe représente l’adsorption multicouche et la condensation capillaire puis.

Figure 1. Classification de Brunauer des isothermes d’adsorption.
Les équations de trois isotherme plus fréquemment utilisées sont celles qui résultent de Langmuir ; Freundlich ; et de Brunauer, Emmett et Teller (BET). Seulement l’équation BET peut concerner Vm et les paramètres d’énergie adsorption d’un vapeur à quantité adsorbée.
Un adsorbant est un composé en phase gazeuse ou liquide qui s’attache à la surface de l’adsorbant solide à l’étude. L’adsorption physique dépend uniquement des forces intermoléculaires faibles. La ΔH de cette adsorption est < 3 fois la chaleur de vaporisation. Il est seulement important aux basses températures près et en dessous de la température de saturation de l’adsorbat. La N2 adsorption/désorption dans le porosimètre a lieu au point d’ébullition normal du liquide N2 (77 K). Le processus est rapide et réversible. Une monocouche est une seule couche de molécules recouvrant complètement les surfaces des pores d’un matériau poreux.
L’intérieur d’un porosimètre contient deux chambres avec un transducteur de pression sensibles, un régulateur de débit à la chambre 1 et une pompe à vide. Chambre 1 contient le transducteur et est tenue à la température ambiante. Chambre 2 contient l’échantillon et s’assoit dans un bain de liquide N2 . Pour faire fonctionner un porosimètre azote, tout d’abord les deux chambres sont évacués. Puis une petite quantité d’azote est ajoutée dans la chambre 1. La quantité de gaz admis (ΔN1) peut être calculée à partir V1, le capteur de pression et la Loi des gaz parfaits.
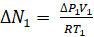 (1)
(1)
où ΔP1 est l’augmentation de la pression lue par le transducteur. Une fois la vanne entre les deux chambres, ~ 5 min s’écoule pendant laquelle adsorption se produire dans la chambre 2 et éventuellement fournis par le système à l’équilibre. L’adsorption à la surface supprime N2 de la phase gazeuse, en abaissant la pression lue par le transducteur. La quantité adsorbée au cours de cette étape est :
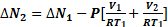 (2)
(2)
Étapes (2-3) sont répétées jusqu'à atteindre une pression proche de la saturation P0 . Cette procédure constitue la « branche d’adsorption » du cycle. Pour la désorption, le processus est inversé. Est plus impliqué dans ce processus qu’est présentée ici (p. ex., le volume de l’échantillon doit également être pris en compte, la température du bain liquide N2 doit être connue avec précision et une correction de la non-idéalité est généralement appliquée). Pour chaque cycle d’étapes (2-3) un système géodésique de quantité adsorbée (habituellement exprimée comme gaz volume Vannonces, à l’aide de la Loi des gaz parfaits) vs la pression (exprimée en P/P,0) sont recueillis. Toutes les données recueillies à une température fixe est appelée une isotherme d’adsorption (lorsque P2 est augmenté progressivement) ou une isotherme de désorption (lorsque P2 est abaissée).
L’isotherme de pari fait suite à deux hypothèses. La première hypothèse est que chaque molécule dans la première couche adsorbée (la monocouche) ne prévoit qu’un seul site pour le deuxième et ultérieures (multi-) couches. Adsorption au départ se déroule couche par couche. La deuxième hypothèse est que la chaleur d’adsorption, ΔH1, s’applique à la première couche, tandis que la chaleur de la liquéfaction de la vapeur, ΔHL, s’applique à l’adsorption dans les couches 2, 3, etc.. Brunauer et coll. simplifié l’estimation de Vm et les paramètres d’énergie de l’équation isotherme suivante :2
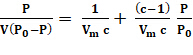 (3)
(3)
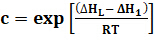 (4)
(4)
où P0 est la pression de saturation à une température donnée, T. Cette expression représente une isotherme de type II ou IV de l’ordre de 0,05 < P/P0 < 0,35. Il y a une progression de multicouche adsorption (P/P de0 à ~0.3-0.35) à condensation capillaire (P/P supérieur0) à qui les pores plus petits deviennent complètement remplis. Cela se produit car la fugacité (pression de vapeur) dans un petit pore est réduite, conformément à l’équation de Kelvin (équation 5), de la tension superficielle (σ). 1
 (5)
(5)
Le côté gauche indique le P/P de0 au cours de laquelle la condensation capillaire se déroule dans un cylindrique des pores avec adsorbat angle de contact θ et pores de diamètre D. L’effet capillaire est significatif uniquement dans les pores < ~ 200 nm de diamètre. Pores plus grands que cela sont rares dans la plupart des adsorbants poreux et catalyseurs.
Procédure
1. démarrer le porosimètre
- Démarrer le porosimètre et laissez-le se stabiliser.
- Peser le porte-tube plastique, tube à essais, insert en verre et le plastique des soupapes qui se visse dans la partie supérieure du tube.
- Charger l’échantillon dans le tube, puis peser. Lors du chargement, essayez d’obtenir au moins 20 m2 de surface totale dans le tube. Recherchez une gamme de superficie typique pour le type de solide que vous utilisez. Toutefois, n’utilisez jamais inférieur à 50 mg d’échantillon.
- En utilisant le logiciel pour le porosimètre, initialisez un nouvel échantillon en cliquant sur « Fichier » puis « Nouvel échantillon » et sélectionnez la méthode appropriée. Entrer les deux poids (appareil et appareil + échantillon) dans le programme et renommez l’échantillon.
- Charger l’échantillon et le joint torique dans le port de degas et ajuster les conditions de degas, tel que requis. Le programme suivant doit être suivi : l’échantillon doit tout d’abord être chauffé et ont été évacué à 12 μm de mercure à basse température (90 ° C) pendant la « Phase d’évacuation ». Puis, rampe à la température finale souhaitée (généralement de 300 ° C pour les atomes de carbone et des matières inorganiques) et la maintenir pour la durée souhaitée (la « Phase de chauffage »).
- Charger le tube échantillon et le joint torique dans le port de l’échantillon. Pousser vers le haut sur le tube légèrement avant de tourner l’écrou pour engager la goupille qui ouvre la valve en plastique peut s’engager. Assurez-vous de tenir le tube en position verticale.
- Placer un chauffe-ballon sous l’ampoule en tenant le tube à essais et soutenir le chauffe-ballon avec un cric de laboratoire. Ne pas agiter l’ampoule - maintenir le manteau fermement.
- Montrer les degas schématique en cliquant sous « Degas » et sélectionner « Afficher le schéma degas ». Sélectionnez « unité 1 », puis « Démarrer Degas ». Cliquez sur « Parcourir » pour sélectionner votre fichier d’échantillon (s), puis « Start ». La phase de degas supprime toutes les traces d’eau et de CO2 dans l’échantillon avant l’expérience de l’adsorption. N2 ne peut supplanter l’eau et le CO2! Une fois que la pression désirée et la température ont été atteintes, dégazer étape peut être omise.
- Lorsque la phase de degas atteint l’étape de « refroidissement », abaissez le chauffe-ballon et laisser refroidir de tube de l’échantillon à la température ambiante.
- Remblayez l’échantillon avec de l’hélium. Si la pression ne s’approche pas 800 mm Hg, puis le tube échantillon peut ont sauté hors de l’installation. Si nécessaire, maintenez en place avec vos mains.
- Une fois que le dégazage est terminée, peser l’échantillon et l’appareil et modifier la masse dans le fichier d’exemple.
2. mesure porosimétrie
- Remplir fiole Dewar du porosimètre avec liquide N2.
- Mettre la gaine en plastique sur le tube à essais et charger l’échantillon et le joint torique dans le port au-dessus de la fiole de Dewar. Fixer le plastique isolant de couverture sur le Dewar près du port de l’échantillon.
- Cliquez sur « unité 1', puis « Analyse de l’échantillon ». Recherchez le fichier échantillon dégazé, puis cliquez sur « Start » pour commencer à prendre des mesures.
- Vérifier que l’évacuation initiale est terminée avec succès. Si cela échoue, essayez de re-régler le tube dans le port (vérifier le joint torique et resserrer l’écrou). Des mesures seront recueillies automatiquement sur plusieurs heures. Résultats peuvent être téléchargés dans un tableur Excel.
Résultats
Dans la région de condensation capillaire, l’isotherme montre généralement hystérésis afin que la pression d’équilibre apparent observé dans l’adsorption et la désorption des expériences sont différentes (Figure 2). La branche de désorption est toujours à basse pression et la fugacité. L’hystérésis commence à P/P0 = ~ 0,6, où la condensation capillaire commence à dominer le processus d’adsorption, bien que l’algorithme de distribution de taille de pore utilise l’ensemble isotherme. Le total calculé pore volume, à l’aide de la Loi des gaz parfaits et le volume molaire de liquide N2, est de 0,63 cm3/g.
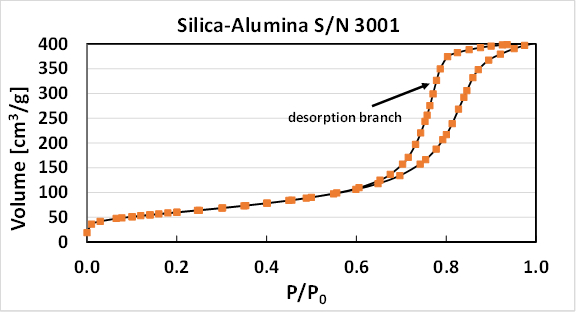
Figure 2 . Volume adsorbé (phase de gaz base) par rapport à la pression relative (l’isotherme) pour N2 adsorption sur silice-alumine 3001 de S/N.
Deux explications à cet effet ont été proposées. 1 durant l’adsorption, multicouches accumulent sur les parois des pores, mais un ménisque complète n’est pas formé, jusqu'à ce que la saturation est atteinte. Par conséquent, la surface d’adsorption (les surfaces de mur) dépasse celle de désorption (ménisque uniquement) dans la région de condensation capillaire. La branche de l’adsorption de l’isotherme est donc régie par une isotherme multicouche analogue à l’équation de pari, mais la désorption dans la région de condensation capillaire est régie par l’équation de Kelvin (équation 5). Les différences dans les branches pourraient aussi découler d’une différence dans la forme du ménisque. Au cours de l’adsorption du pore remplit radialement et un ménisque cylindrique est formé. Au cours de la désorption, le ménisque est hémisphérique et l’équation de Kelvin s’applique. Par des arguments, seulement l’isotherme de désorption doit servir à calculer la répartition porométrique dans la région d’hystérésis, même si aucun argument n’est tout à fait correcte. De la théorie de désaccords de déviations dans la forme des pores de géométrie cylindrique simple et du fait qu’en microscopie électronique et autres techniques suggèrent que les deux explications sont en partie raison. En particulier, la physique d’adsorption dicte qu’il doit y avoir un certain matériel adsorbé dans les pores, s’accrochant aux parois même en dessous de la Kelvin Pv/p0 = P/P0. L’espace occupé par ce matériau multicouche adsorbé doit être corrigé pour dans le calcul de taille de pore de Kelvin - cela s’appelle une « correction de t-terrain » dans la littérature. Diverses équations théoriques peuvent servir à calculer cette épaisseur de la couche adsorbée (= t), en fonction de P/P0. Pour notre système, la correction de Halsey-Faas pour obtenir t est utilisée automatiquement dans le logiciel de la machine, et la répartition porométrique pour les deux branches calculée automatiquement.
L’équation BET donne une ligne droite lorsque tracées de façon linéaire (voir équation 3), pour donner Vm et c de la pente et l’intersection. La surface spécifique, un, se trouve en supposant que la surface moyenne occupée par une molécule d’adsorbat (unm) est connue (pour N2, 0.1620 nm2) :1
 (6)
(6)
où Vm [=] cm3/g, [=] m2/g et L = nombre d’Avogadro.
Un typique montrant de terrain (Figure 3) pari données et la régression s’est illustré ci-dessous. On rapporte la valeur de R2 (coefficient de corrélation) et l’écart relatif moyen de l’ajustement. Les limites de confiance sur la pente et l’ordonnée à l’origine de la régression linéaire peut être utilisés pour estimer la limite de confiance A, de la propagation de la théorie de l’erreur. Sont les valeurs régressées (prévues) : c = 139, Vm = 49,3 cm3/g STP, A = 214 m2/g, R2 = 0,9998, ARD = 0,59 %.

Figure 3 : Terrain de pari à échantillon silice-alumine 3001 S/N.
Une répartition porométrique typique pour le même échantillon est illustrée à la Figure 4. Pour cet exemple, le pore moyens D, de la distribution a été calculé comme 8,6 nm, alors que l’estimation de pore cylindrique (4 PV / A) a été de 8,0 nm (PV est pore masse/volume). Il s’agit d’assez bon accord, ce qui suggère que ces pores sont à peu près cylindriques. En utilisant les deux l’adsorption et la désorption dV/JJ, le diamètre moyen de pore peut être déterminé à partir des propriétés d’une distribution de probabilité. Notez que x (dV/dD) (dD) est la probabilité de volume adsorbé, exprimé comme un volume de la phase gaz, chez D. La moyenne de désorption, D, est toujours inférieure à la moyenne de l’adsorption, tel que prédit par l’équation 5. C’est parce que, comme illustré à la Figure 2, sa fugacités (P,v, Pv = P) v donné lesannonces sont plus petits.

Figure 4 . Calculé la porosimétrie des données dans la Figure 2, Direction générale de la désorption.
Applications et Résumé
La méthode de mesure et de calcul présenté ici est l’étalon-or en porosimétrie. La technique de porosimétrie au mercure est une alternative, mais ses pressions élevées et la possibilité d’exposition au mercure sont des inconvénients. Mieux les transducteurs de pression, pompes à vide et les logiciels ont considérablement étendu l’utilité de la porosimétrie2 N et la méthode donne toutes les clés adsorbant 3 ou mesures morphologiques de catalyseur (distribution de taille des poresA, volume de pore,) dans un Faites des essais. Il fournit également des informations sur la forme des pores.
Adsorbants et catalyseurs commerciaux sont souvent fabriqués conformément aux spécifications de taille de pores serrés. Le moyen le plus rapide pour déterminer si la morphologie correcte est présente est de mesurer la distribution de taille de pore. Par exemple, contrôle de la température inégale dans l’étape de calcination (traitement thermique) lors de la fabrication peut considérablement modifier la répartition. Pour beaucoup de catalyseurs, durée est grandement réduite si grands pores ne sont pas présentes, même si la surface est encore élevée, car ces grands pores servent souvent de passerelles pour l’élimination des résidus de carbone oligomériques (« coke ») qui autrement serait le poison beaucoup sites actifs.
Pour les pores cylindriques le diamètre moyen de pore, D, est aussi égal à 4PV/A (PV est pore masse/volume). Le logiciel indique les estimations cylindriques pour l’adsorption et la désorption des branches, et l’ampleur de leurs différences avec les diamètres moyens calculés à partir des distributions donne une idée de la déviation de la matière poreuse du pores parfaitement cylindriques. Certains solides ont des pores qui sont analogues à fente, avec une dimension courte critique (h) analogue au diamètre de 2 PV / A pour fente très longue et large pores. Trouver les deux estimations l’adsorption et la désorption de la moyenne et déterminer ensuite si le solide poreux est plus semblable à fente, en comparant la branche différente estimations pour des valeurs plus exactes générés par les distributions de probabilité. Si les estimations cylindriques et fendez sont significativement dans l’erreur, que cela signifierait ? Des calculs semblables pourraient se faire pour vérifier pour les autres formes de pore.
Porosimètres peut être facilement adapté pour mesurer les surfaces aussi petites que 0,01 m2/g (par exemple, dans les bétons, bien que Kr ou Xe sont utilisés au lieu de N2) et les tailles de pores moins de 1 nm (par exemple, dans les zéolites, même si l’Ar est utilisé et spécial procédures nécessaires). S’il est vrai que les zéolites sont importants catalyseurs et adsorbants commerciales, leur utilisation principale est dans les détergents, où ils peuvent lier presque toute la crasse retirée de blanchisserie.
En outre, il est également important de connaître les propriétés morphologiques de tableting matériaux, tels que les excipients (lubrifiants) et de liants, de contrôler la pilule tableting processus et la dissolution et la dégradation des coquilles extérieures pour assurer la libération contrôlée de l' ingrédient de pharma active in vivo.
References
- Gregg and K.S.W. Sing, Adsorption, Surface Area, & Porosity, 2nd Ed., Academic, 1982 , and D. Ruthven, Principles of Adsorption and Adsorption Processes, Wiley, New York, 1984.
- J. Amer. Chem. Soc., 60, 309-319 (1938).
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Porosimétrie d'une poudre de silice et d'alumine
Chemical Engineering
9.6K Vues

Test de l'efficacité du transfert de chaleur d'un échangeur de chaleur à ailettes et à tubes
Chemical Engineering
17.9K Vues

Utilisation d'une étuve à plateaux pour étudier le transfert de chaleur par convection et par conduction
Chemical Engineering
44.0K Vues

Viscosité des solutions de propylène glycol
Chemical Engineering
32.9K Vues

Démonstration de la loi de puissance grâce à l'extrusion
Chemical Engineering
10.2K Vues

Absorbeur de gaz
Chemical Engineering
36.8K Vues

Équilibre vapeur-liquide
Chemical Engineering
89.3K Vues

L'effet du taux de reflux sur l'efficacité de la distillation en plateaux
Chemical Engineering
77.8K Vues

Efficacité de l'extraction liquide-liquide
Chemical Engineering
48.5K Vues

Réacteur à phase liquide : Inversion du saccharose
Chemical Engineering
9.7K Vues

Cristallisation de l'acide salicylique par modification chimique
Chemical Engineering
24.3K Vues

Écoulement monophasique et diphasique dans une colonne à garnissage
Chemical Engineering
19.0K Vues

Cinétique de la polymérisation par addition
Chemical Engineering
16.1K Vues

Réacteur catalytique : Hydrogénation de l'éthylène
Chemical Engineering
30.5K Vues

Évaluation du transfert de chaleur d'un Spin-and-Chill
Chemical Engineering
7.4K Vues