理想气体定律
Overview
资料来源: 实验室的博士 Andreas Züttel-瑞士联邦实验室材料科学与技术
理想气体定律描述最常见气体在附近环境条件下的行为和所有化学物质在稀释极限下的趋势。它在系统中,是三个可衡量宏观系统变量 (压力、 温度和体积) 与气体分子的数目之间的基本关系,因此是微观和宏观的宇宙之间必不可少的环节。
理想气体定律的历史可以追溯到17 世纪中叶时候的压力和体积的空气之间的关系被发现是成反比,证实了由罗伯特 · 波义耳和我们现在称之为 · 博伊尔的法律 (方程 1) 的表达式。
P  V-1 (方程 1)
V-1 (方程 1)
发表的作品,由雅克 · 查尔斯在 1780 年代,并被给予大量的气体和蒸气的约瑟夫 · 路易斯 · 吕报道于 1802 年,成立的绝对温度和气体体积的正比关系。这种关系称为查尔斯的法律 (方程 2)。
V  T (方程 2)
T (方程 2)
纪尧姆 · Amontons 通常归功于18 世纪初第一次发现固定体积内空气的压力与温度的关系。这项法律还向许多其他气体由约瑟夫 · 路易斯 · 吕19 世纪初,因此也被称为 Amontons 的法律或同性恋者 Lussac 法,指出方程 3中所示。
P  T (方程 3)
T (方程 3)
在一起,可以结合这三组关系给关系方程 4中。
V  T (方程 4)
T (方程 4)
最后,在 1811 年,它提出了阿米阿佛加德罗任何两种气体,在相同的体积和在相同的温度和压力,举行包含相同数目的分子。这导致所有气体可以通过一个共同的常数,理想气体常数 R,即独立的气体的性质进行都描述的结论。这就是所谓的理想气体定律 (方程 5)。1,2
PV T (方程 5)
T (方程 5)
Principles
理想气体定律,因此其特性的不断研发,可也雄辩地从第一原理理论在许多方面,分子有没有固有的卷和不进行交互的重要的简化假设在哪里。这些假设有有效稀释物质限制,在什么地方空每个分子 (例如~ 10-23 L 在环境条件下) 所占用的空间量远大于分子本身 (~ 10-26 L),哪里的相互作用是不大可能。它因此可以很容易在通过各种方式使用普通实验室设备在室温,证明,可准确地测量各种气体在压力甚至 10 条 (图 1)。然而,理想气体定律不能准确地考虑和在附近环境条件下 (例如,丙烷) 密度气体的性质或冷凝,因分子间相互作用而产生的现象。为此,许多更详细的状态方程的年以来它的发现,通常降低到理想气体定律在稀事极限成功理想气体定律。1,2

图 1。理想气体法密度对各种其他常见气体在 25 ° C 和 0-100 之间的比较栏。
在本教程中,我们仔细地将测量氢气在增加的压力和温度固定体积内的密度由称重的已知体积的悬浮固体样品: 精确加工的铝块。在样品重量的变化是直接关系到改变流体的密度,在其中它浮动的由阿基米德定律。我们还将演示在高压下使用较少的理想气体 (如二氧化碳) 的缺点。最后,我们将直观地演示,并定性地通过执行一个简单的台式实验,由于氢释放的贮氢材料,系统体积的变化测量确认理想气体定律。使用任意一种的这些实验,我们可以确定描述压力、 温度和气体 — — 理想气体常数,R.给定数量的卷之间的关系的通用的常数
Procedure
1.测量体积的样品
- 仔细清洁样品和干燥它。
- 一个高分辨率的量筒装满足够蒸馏水覆盖样品。请注意初始音量
- 掉进了水的样本,并注意体积的变化。这是样本体积,V。
- 删除示例然后擦干。注意: 或者,测量样品的侧 length(s),并计算其体积使用几何。
2.负载平衡中的示例
- 挂在磁悬浮平衡样品。
- 安装压力/温度室围绕样品。
- 撤离的示例环境和加氢气,到 1 栏。
- 测量样品重量在 1 酒吧和室温下,w00。
3.测量样品重量为常温压力的函数
- 增加或减少在 Pi0样品环境压力。
- 允许样品环境平衡。
- 测量样本,wi0的重量。
- 3.1-3.3 重复无数次。
4.测量样品重量作为压力在不同温度下的函数
- 设定的温度为 Tj并允许它保持平衡。
- 设置的氢气压力为 1 个酒吧。
- 测量样品重量在 1 酒吧和 Tj,w0j。
- 增加或减少的压力 Pij ,允许它平衡。
- 测量的样本,wij重量。
- 4.4-4.5 重复无数次。
- 重复 4.1-4.6 作为所需。
5.计算理想气体常数
- 统计测量的值 {Tj、 Pij和 wij} P0j总是 1 栏,T0是实测的室温。
- 计算并制成表格的差异 Δwij和 δ Pij在每个温度 Tj使用6 方程和方程 7。
Δwij = wij - w0j (方程 6)
Δwij = Pij - P0j = Pij -1 酒吧 (方程 7) - 计算 Rij为每个度量值和平均以上所有的值来确定理想气体常数,R.或者,情节 δ Pij与 V 的乘积作为 Δwij (除以分子量 MW) 产品的功能和 Tj,和氢为执行线性回归分析,以确定边坡,R.(方程 8和9)MW = 2.016 g/mol。
ΔP V = Δn RT (方程 8)
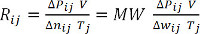 (方程 9)
(方程 9)
Results
理想气体定律是有效的描述实际气体性质的许多常见气体在附近环境 (图 1插图) 条件的因此在很多应用程序的上下文中很有用。理想气体定律描述高压力或温度低的条件下系统的局限性可以解释由分子间的相互作用的日益重要性和/或有限大小的气体分子系统的性能作出贡献。因此,与强、 有吸引力的分子间相互作用 (如偶极-偶极相互作用,包括氢键、 离子-偶极相互作用或范德瓦尔斯相互作用所引起) 的气体会表现出更高的密度比理想气体。所有气体都亦会令人厌恶的组件在密度高,多个分子不能占用相同的位置,放款超过理想气体的密度减少。气体,如氢和氦所示的更大的贡献,从排斥力有限的分子尺寸,由于,因此在高压力下稍低密度。甲烷和二氧化碳给更多贡献他们的属性从相互的吸引作用,贷款他们更高的密度比理想气体直到非常高的压力,在那里令人厌恶的词占主导地位 (在很多高于 100 栏在 25 ° C)。

图 2。平衡吸附吸收等温线的 CO2对高比表面积,椰壳碳 MSC-30,在 25 ° c。
Application and Summary
理想气体定律是化学的科学,它具有大量的使用在日常实验室活动以及计算和建模的甚至高度复杂的系统,至少第一近似的基本方程。其适用性有限只能由逼近固有的法律本身;在附近环境的压力和温度,在理想气体定律哪里好有效的许多共同的气体,它广泛采用气体为基础的系统和过程的解释。两个例子的经营原则,这可以通过调和的设备使用的理想气体定律,气体温度计和斯特林发动机。
一个特定的应用程序是在测量气体吸附 (吸附) 的数量在固体材料的表面上。吸附是固体与气体之间的吸引力分子间相互作用 (色散力) 的物理现象,藉以气体分子离开气相和进入致密表面附近的固体 (或也许是一种液体) 阶段。吸附作用对于许多散装材料 (如玻璃和不锈钢) 钢在环境条件下,可以忽略,但变得非常重要,为多孔材料与访问表面积大,尤其是在低温。3容积弗法和重量法量化物理吸附的依靠知道系统的气体状态方程。在低压力和环境温度,理想气体定律对许多气体,有效和可以用来准确地确定的气体的吸附的量以类似的方式确定 R 上述协议中所述。例如,在重力测量的高比表面积,理想气体法事实上有效,Δw实际之间的差异的测量的条件下脱硫剂和 Δw理想浮力的计算使用理想的状态方程可以归因于重量的吸附相的变化。(方程 10)平衡气体吸附等温线因而可测定制表此偏差、 Δw广告,作为在一个固定的温度压力的函数 (见图 2),在多孔材料表征的标准程序。
Δw广告= Δw实际-Δw理想(方程 10)
Tags
跳至...
此集合中的视频:

Now Playing
理想气体定律
General Chemistry
79.5K Views

常见的实验室玻璃器皿和用途
General Chemistry
659.6K Views

溶液和浓度
General Chemistry
275.6K Views

固体和液体的密度测定
General Chemistry
557.2K Views

确定在水溶液中的质量百分组成
General Chemistry
383.9K Views

确定经验公式
General Chemistry
183.9K Views

确定离子化合物的溶度积的规则
General Chemistry
141.6K Views

使用 pH 计
General Chemistry
347.1K Views

滴定法简介
General Chemistry
425.8K Views

平衡常数的分光光度法测定
General Chemistry
158.9K Views

Le Châtelier 原则
General Chemistry
266.0K Views

凝固点降低,以确定一种未知的化合物
General Chemistry
160.9K Views

确定率法律和秩序的反应
General Chemistry
196.5K Views

用焓差扫描量热法测量的变化
General Chemistry
44.8K Views

配合化学物
General Chemistry
91.8K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。